黄花菜多糖的提取、结构性质及抑菌活性
2015-12-29周纪东李余
周纪东,李余 动
黄花菜多糖的提取、结构性质及抑菌活性
周纪东1,李余 动2
(1.浙江育英职业技术学院生物技术系,浙江 杭州 310018;2.浙江工商大学食品与生物工程学院,浙江 杭州 310018)
采用水提醇沉法,通过单因素试验和正交试验研究黄花菜粗多糖(crude polysaccharides from Hemerocallis citrina Baroni,CPH)的提取工艺,并利用Sevag法和H2O2氧化法提纯制备黄花菜精制多糖(deproteinized polysaccharides from Hemerocallis citrina Baroni,DPH),通过理化检验和紫外光谱、红外光谱、高效液相色谱分析,考察DPH的性质与结构,同时还研究DPH对铜绿假单胞菌、大肠杆菌、金黄色葡萄球菌、白假丝酵母、黑曲霉的抑制作用。正交试验结果表明,CPH最优提取条件为浸提温度75 ℃、浸提时间3 h、液固比20∶1(mL/g)、浸提2 次。在此条件下,CPH提取率为28.36%。理化性质、光谱与色谱特征表明,DPH是一种具有α-型吡喃糖苷结构的水溶性杂多糖,是由L-鼠李糖、D-木糖、L-阿拉伯糖、D-甘露糖、D-葡萄糖和D-半乳糖组成,且可能是一种与蛋白质或多肽以共价键结合的糖复合物。抑菌实验结果表明,DPH对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌具有明显的抑制作用,相应的最小抑菌质量浓度分别为10、10、25 mg/mL。
黄花菜;多糖;提取工艺;性质;抑菌活性
黄花菜属百合科萱草属多年生草本植物,又名金针菜、忘忧草,其花可食用,为我国特产蔬菜,是一种营养价值高、具有多种保健功能的花卉珍品蔬菜,还是一味良药,其花、叶、根晒干后均可入药用[1-2]。《本草纲目》中称其有安神醒脑、增智宽胸、美容养血、解热消毒、除烦通乳之功效[3]。黄花菜富含胡萝卜素、氨基酸和多糖等[4-5]。大量研究表明,植物多糖具有免疫调节[6-7]、抗肿瘤[7-8]、抗炎[9]、抗病毒[10]、抗氧化[11-12]、抗辐射[13]、降血糖[14]、保湿[11]、保肝[12]等多种功能,由于其毒副作用小、安全性强、功能多等特点而被越来越多的人所关注,其相关研究也日益受到重视。
近年来,已有学者深入研究开发了黄花菜的栽培技术,有关黄花菜中化学成分及其生物活性的研究也已展开,其中关于黄酮、多酚等化合物的报道较多[15-19],但有关黄花菜中多糖的研究报道甚少。本实验就黄花菜多糖的提取条件、含量测定、结构性质及抑菌活性等进行了研究,以期为深度开发利用黄花菜这一丰富资源提供科学依据。
1 材料与方法
1.1 材料、菌种与试剂
黄花菜样品采自浙江省桐庐县分水镇,经杭州市植物园卢毅军高级工程师鉴定为百合科萱草属黄花菜(Hemerocallis citrina Baroni)。
铜绿假单胞菌(Pseudomonas aeruginosa)(CGMCC 1.2387)、大肠杆菌(Escherichia coli)(CGMCC 1.3373)、金黄色葡萄球菌(Staphylococcus aureus)(CGMCC 1.2155)、白假丝酵母(Candida albicans)(CGMCC 2.4090)、黑曲霉(Aspergillus niger)(CGMCC 3.6327) 中国普通微生物菌种保藏管理中心。
D-葡萄糖、D-半乳糖、D-甘露糖、D-木糖、L-阿拉伯糖、D-果糖、L-岩藻糖、L-鼠李糖、D-山梨糖 上海试剂二厂;葡萄糖醛酸 美国Sigma公司;木瓜蛋白酶美国Merck公司。
胰酪胨大豆肉汤培养基、胰酪胨大豆琼脂培养基、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基配制见《中国药典》附录[20]。
1.2 仪器与设备
HH-2数显恒温水浴锅 常州国华电器有限公司;752W紫外-可见分光光度计 上海朗伯仪器有限公司;Anke TDL-40B离心机 上海安亭科学仪器厂;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;DZF-6021真空干燥箱 上海一恒科学仪器有限公司;Wzz-2A数字式自动旋光仪 上海浦东物理光学仪器厂;THZ-82B气浴恒温振荡器 金坛国旺实验仪器厂;DHP-25电热恒温培养箱 常州迈科诺仪器有限公司;Nicolet nexus 470红外光谱仪 美国Thermo公司;2695高效液相色谱仪(配有2414差示折光检测器、2487双λ波长检测器)美国Waters公司。
1.3 方法
1.3.1 多糖提取工艺流程
黄花菜样品→预处理→浸提→过滤→浓缩→醇析沉淀→离心分离→黄花菜粗多糖(crude polysaccharides from Hemerocallis citrina Baroni,CPH)→复溶→除蛋白→脱色→纯化→黄花菜精制多糖(deproteinized polysaccharides from Hemerocallis citrina Baroni,DPH)
预处理:黄花菜样品于60 ℃干燥至质量恒定,用粉碎机磨成粉末,过400 目筛备用。取适量黄花菜粉末用滤纸包好,放入索氏提取器,用石油醚60~90 ℃回流脱脂3 h。将脱脂后的滤纸包风干,用80%乙醇溶液85 ℃回流6 h,以除去样品中单糖、寡糖等,最后自然风干滤渣。
浓缩:热水浸提液用3 层纱布过滤,滤液用旋转蒸发仪浓缩至约100 mL。
醇析:向浓缩液中缓慢加入4 倍体积的无水乙醇,用玻璃棒缓慢搅拌,使乙醇体积分数达到80%,4 ℃静置24 h,4000 r/min离心10 min,收集沉淀即为CPH。
除蛋白与脱色:将CPH复溶于水,采用中性酶-Sevag法[21]除去蛋白质和H2O2氧化法[22]脱色。
纯化:将多糖水溶液透析36 h后减压浓缩,再次醇析沉淀,离心,所得沉淀分别用95%乙醇、无水乙醇、丙酮溶液各洗3 次,60 ℃真空干燥得DPH。
1.3.2 热水浸提工艺优化单因素试验
以CPH提取率为考察指标,通过单因素试验分别研究浸提温度、浸提液pH值、浸提时间、液固比、浸提次数对CPH提取率的影响,提取率计算见式(1)。

1.3.2.1 浸提温度对CPH提取率的影响
准确称取5 份各10 g黄花菜样品,经过预处理后,以液固比25∶1(mL/g)、浸提液pH 7.0、浸提2 h、浸提1 次为不变条件,研究不同浸提温度(60、70、80、90、100 ℃)对CPH提取率的影响。
1.3.2.2 浸提液pH值对CPH提取率的影响
准确称取5 份各10 g黄花菜样品,经过预处理后,以液固比25∶1(mL/g)、浸提温度80 ℃、浸提2 h、浸提2 次为不变条件,研究不同pH值(5、6、7、8、9)的浸提液对CPH提取率的影响。
1.3.2.3 浸提时间对CPH提取率的影响
准确称取6 份各10 g黄花菜样品,经过预处理后,以液固比25∶1(mL/g)、浸提温度80 ℃、浸提液pH7.0、浸提1 次为不变条件,研究不同浸提时间(1、2、3、4、5、6 h)对CPH提取率的影响。
1.3.2.4 液固比对CPH提取率的影响
准确称取6 份各10 g黄花菜样品,经过预处理后,以浸提温度80 ℃、浸提液pH7.0、浸提2 h、浸提1 次为不变条件,研究不同液固比(15∶1、20∶1、25∶1、30∶1、35∶1、40∶1(mL/g))对CPH提取率的影响。
1.3.2.5 浸提次数对CPH提取率的影响
准确称取4 份各10 g黄花菜样品,经过预处理后,以液固比25∶1(mL/g)、浸提温度80 ℃、浸提液pH 7.0、浸提3 h为不变条件,研究不同浸提次数(1、2、3、4)对CPH提取率的影响。
1.3.3 正交试验优化工艺参数
根据单因素试验的结果,确定正交试验的因素水平,采用L9(34)正交表进行正交试验,以CPH提取率为考察指标,研究CPH浸提工艺参数的最佳组合。
1.3.4 多糖含量测定
1.3.4.1 标准曲线的建立
葡萄糖溶液标准曲线建立采用苯酚-硫酸法[23],所得回归方程为A=0.008 7ρ(R=0.999 7,n=6),式中A为490 nm波长处吸光度,ρ为葡萄糖溶液质量浓度/(μg/mL)。该标准曲线在葡萄糖溶液质量浓度5.00~80.00 μg/mL范围内呈良好的线性关系。
1.3.4.2 换算因子的计算
准确称取3 份各20 mg DPH,分别用蒸馏水溶解,定容到100 mL。准确移取0.3 mL按照1.3.4.1节中所述方法测定吸光度,由回归方程计算供试液中葡萄糖质量浓度,根据式(2)计算换算因子。

式中:f为换算因子;m为DPH含量/(μg/mL);ρ为DPH供试液中葡萄糖质量浓度/(μg/mL);d为多糖的稀释倍数。计算求得DPH相对于葡萄糖的换算因子f=1.518(相对标准偏差(relative standard deviation,RSD)为1.13%,n=3)。
1.3.4.3 样品中多糖含量测定
准确称取6 份各10 g黄花菜样品,按照1.3.1节中多糖提取工艺(优化后)分别制备出CPH和DPH各3份,分别用蒸馏水溶解,定容到500 mL,稀释100 倍后准确移取1 mL按照1.3.4.1节中所述方法测定吸光度,由回归方程计算供试液中葡萄糖质量浓度,根据式(3)计算黄花菜样品中多糖含量。

式中:w为多糖含量/%;ρ为供试液中葡萄糖质量浓度/(μg/mL);d为样液的稀释倍数;f为换算因子;M为样品含量/(μg/mL)。
1.3.5 多糖的理化性质及成分含量测定
物理性质参考文献[23],测定DPH在水及几种主要有机溶剂中的溶解性及比旋光度。化学性质参考文献[23],测定进行包括碘-碘酸钾反应、硫酸-咔唑反应、费林试剂反应、Molish反应。
中性多糖含量测定采用苯酚-硫酸法[23],蛋白质含量测定采用微量凯氏定氮法,糖醛酸含量测定采用硫酸-咔唑法,灰分含量测定采用总灰分测定法[24]。
1.3.6 多糖的紫外光谱性质
配制2 mg/mL DPH溶液,在200~600 nm波长范围内进行扫描,以蒸馏水作为空白。
1.3.7 多糖的红外光谱性质
将2 mg DPH与100 mg溴化钾纯品混合,研细均匀,压成透明薄片,在500~4 000 cm-1区间内进行扫描。
1.3.8 多糖的单糖组分分析
将1 mg DPH用2 mol/L硫酸于100 ℃封管水解8h,水解产物经碳酸钡中和,得到单糖供试液进行高效液相色谱测定,以单糖标准品作为对照。色谱柱为NUCLEOGEL SUGARPb色谱柱(300 mm×7.7 mm),洗脱剂为超纯水,流速为0.6 mL/min,柱温为80 ℃,进样量为20 μL。
1.3.9 DPH的抑菌实验
1.3.9.1 菌悬液制备
将铜绿假单胞菌、大肠杆菌、金黄色葡萄球菌、白假丝酵母、黑曲霉5 种供试菌株活化后分别制备原始菌液(或孢子液),采用比浊法以无菌生理盐水分别稀释成107~108CFU/mL菌悬液(或孢子悬液)[20]。
1.3.9.2 抑菌效果评价
每个平皿中,先将纯琼脂培养基溶化后倒入10 mL,冷却,作为平板底层。溶化各供试菌培养基,待冷却至50~55 ℃,分别将5 种供试菌稀释菌悬液(或孢子悬液)加入对应的培养基中充分混匀至105~106CFU/mL,再向各自平皿中琼脂底层上倒入10 mL,冷却。每种供试菌株做3 个重复。
每个平板表面上,等间距均匀放置3 个牛津杯,每个牛津杯中均准确加入200 μL 500 mg/mL DPH溶液。每个平板先放置于4 ℃冰箱中扩散10 h,然后细菌所在平板置于37 ℃恒温培养箱中倒置培养24 h,霉菌及酵母所在平板置于28 ℃恒温培养箱中培养48 h。按时取出后,测量每个牛津杯周围所产生的透明抑菌圈直径,结果取平均值,比较抑菌效果。
1.3.9.3 最小抑菌浓度(minimum inhibitory concentration,MIC)测定
将DPH溶液稀释成250、100、50、25、10、5 mg/mL的质量浓度梯度,分别研究不同质量浓度DPH溶液对5 种供试菌株的MIC,实验过程与1.3.9.2节中相同,以出现抑菌圈的最低质量浓度为MIC。
2 结果与分析
2.1 单因素试验结果
2.1.1 浸提温度对CPH提取率的影响
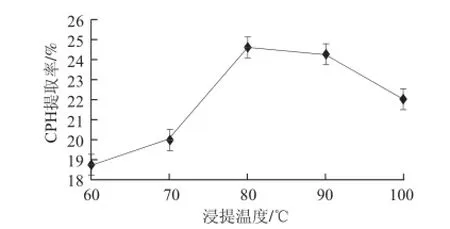
图 1 浸提温度对CPH提取率的影响Fig.1 Effect of extraction temperature on CPH yield
如图1所示,随着浸提温度升高,CPH提取率不断增大,80 ℃时达到最大值,温度继续升高提取率反而逐渐下降。由此推测,高温对CPH的结构与稳定性有一定影响,所以80 ℃是CPH浸提的合适温度。
2.1.2 浸提液pH值对CPH提取率的影响
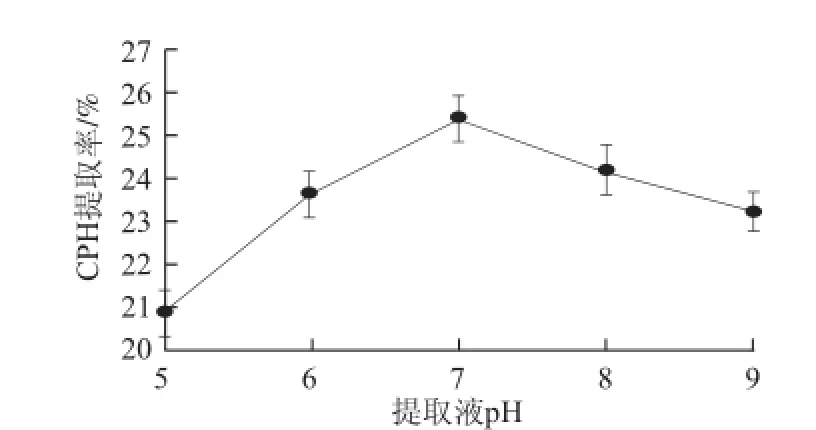
图 2 浸提液pH值对CPH提取率的影响Fig.2 Effect of extraction solvent pH on CPH yield
如图2所示,随着浸提液pH值升高,CPH提取率有所提高,pH 7时达到最大值,pH值大于7后呈下降趋势。由此推测,浸提时间较长,浸提液过酸或过碱均会破坏CPH的立体结构及稳定性。因此,浸提时不必调节浸提液pH值。
2.1.3 浸提时间对CPH提取率的影响
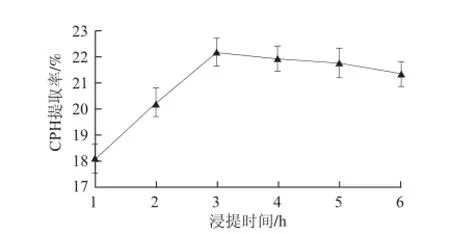
图 3 浸提时间对CPH提取率的影响Fig.3 Effect of extraction time on CPH yield
如图3所示,随着浸提时间延长,CPH提取率有所增大,3 h后逐渐回落并趋于稳定。为了提高效率,减少能耗,浸提时间以3 h为宜。
2.1.4 液固比对CPH提取率的影响
如图4所示,随着液固比增加,CPH提取率逐渐增大,当液固比达到25∶1(mL/g)后,不再增大并趋于稳定。鉴于后续的浓缩工艺,所以选择液固比为25∶1(mL/g)为宜。
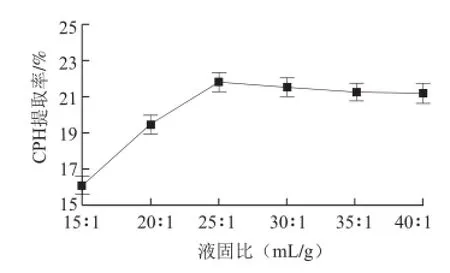
图 4 液固比对CPH提取率的影响Fig.4 Effect of solvent-to-solid ratio on CPH yield
2.1.5 浸提次数对CPH提取率的影响
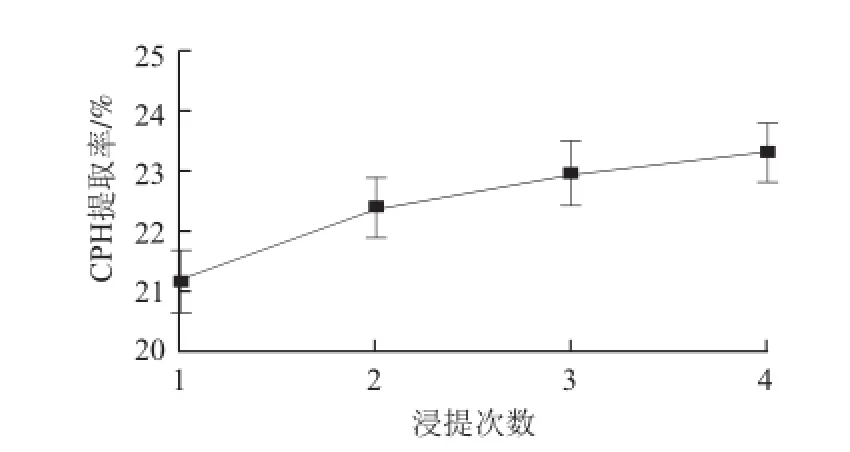
图 5 浸提次数对CPH提取率的影响Fig.5 Effect of repeated extraction number on CPH yield
如图5所示,第1次浸提得到的多糖最多,随着浸提次数的增加,每次浸提到的CPH质量越来越少,至第4次浸提到的多糖质量仅增加了0.35%。由此推测,持续高温条件下浸提可能会造成CPH降解。从经济角度考虑,浸提次数应不超过3 次。
2.2 热水浸提工艺的正交试验结果
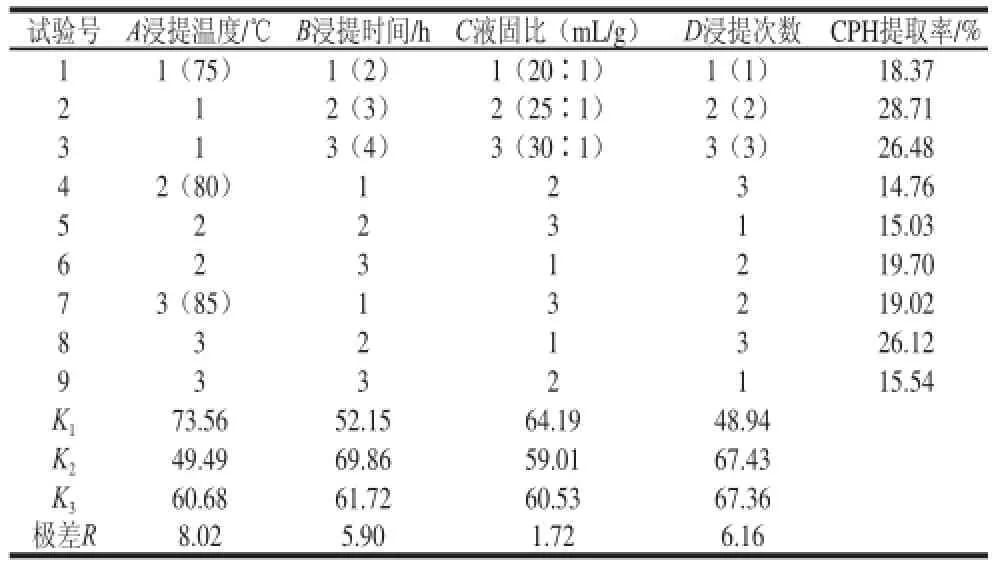
表 1 正交试验因素水平、方案及结果Table 1 Factors and their coded levels, design scheme, results and range analysis of orthogonal array
由表1可知,根据极差分析结果,4 个因素对多糖提取率影响的主次顺序是:浸提温度(A)>浸提次数(D)>浸提时间(B)>液固比(C),最佳组合为A1B2C1D2,即浸提工艺参数为浸提温度75 ℃、浸提时间3 h、液固比20∶1(mL/g)、浸提2 次。按照此最佳组合条件进行浸提工艺的验证实验,结果显示CPH提取率为28.36%(RSD为2.04%,n=3)。
2.3 样品中多糖的含量
1.3.4 节中所得CPH和DPH的供试液分别测得吸光度,代入公式计算得CPH和DPH多糖占样品含量分别为20.71%(RSD为2.36%,n=3)、14.92%(RSD为2.85%,n=3)。由此表明,在经过除蛋白、脱色等纯化工艺过程中,样品多糖含量有所损失。
2.4 多糖的理化性质及成分含量
DPH为白色粉末,可溶于冷水,易溶于热水、稀酸、稀碱,不溶于乙醇、乙醚、石油醚、丙酮等有机试剂,比旋光度[α]D20=+112.75°(RSD为1.08%,n=3)。
DPH的碘-碘酸钾反应呈阴性,表明不含淀粉;硫酸-咔唑反应呈阳性,表明其含有糖醛酸;费林试剂反应呈阴性,表明不含还原糖;Molish反应呈阴性,表明不含单糖和二糖。综上所得,DPH是一种水溶性、非淀粉、非果胶、不含单糖和二糖的多糖。
DPH中蛋白质含量为1.67%(RSD为2.80%,n=3),中性多糖含量为68.31%(RSD为1.12%,n=3),糖醛酸含量为20.98%(RSD为1.34%,n=3),灰分含量为0.43%(RSD为10.75%,n=3)。
2.5 DPH的紫外光谱分析
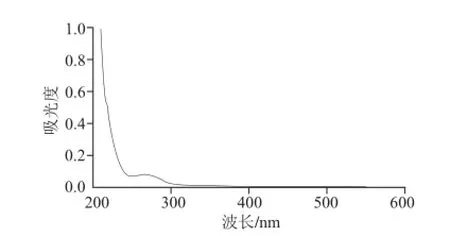
图 6 DPH的紫外吸收光谱图Fig.6 UV spectrum of DPH
由图6所示,DPH在200 nm波长处存在显著的多糖特征吸收峰,至260 nm波长处未见核酸的特征吸收峰,表明已除去核酸,至280 nm波长处有一个弱肩峰,表明仍含有蛋白质。该结果与2.4节中DPH含有少量蛋白质相一致。据此推测,DPH可能是一种与蛋白质或多肽以共价键结合的糖复合物[25]。
2.6 DPH的红外光谱分析
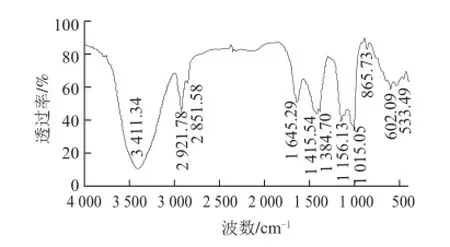
图 7 DPH的红外吸收光谱图Fig.7 IR spectrum of DPH
由图7所示,DPH具有一般多糖物质的特征吸收峰(3 411、2 921、1 645、1 415、1 384、1 156、1 015、865、602、533 cm-1)。3 411 cm-1处强且宽的吸收峰是O—H、C—H和N—H伸缩振动引起,且含有明显的分子间氢键;2 921 cm-1吸收峰是—CH2中C—H伸缩振动产生;1 645 cm-1吸收峰是O—H弯曲振动引起;1 415 cm-1吸收峰是C—H变角振动引起;1 384 cm-1是C—N伸缩振动与N—H弯曲振动的混合吸收峰;1 156 cm-1是吡喃糖环的C—O吸收峰;1 015 cm-1吸收峰是O—H变角振动引起;865 cm-1是α-型糖苷键吸收峰;602 cm-1吸收峰是N—H弯曲振动引起;533 cm-1吸收峰是C—CO变形振动引起[26]。其中,3 411、1 384、602 cm-13处吸收峰分析结果表明DPH中含有较多的酰胺键,且为仲酰胺,由此推测其含有蛋白质,这与DPH的紫外吸收光谱分析结果相一致。综上所得,DPH为典型的多糖类物质,具有α-型吡喃糖苷结构,且含有与其以共价键结合的蛋白质或多肽。
2.7 DPH的单糖组分分析
通过高效液相色谱分析,对照组中单糖标准品与DPH水解产物的单糖组分比对结果见表2。
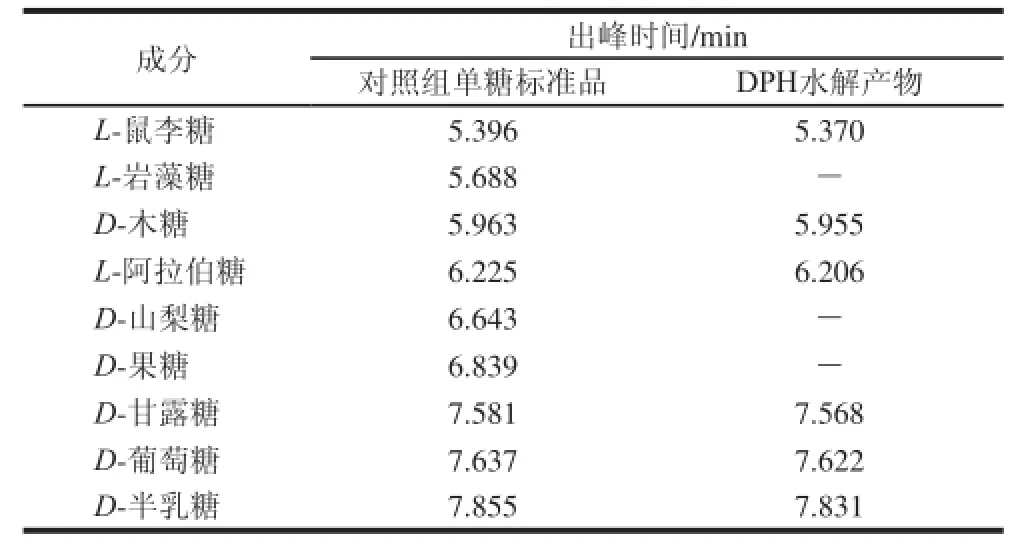
表 2 DPH水解产物的高效液相色谱分析Table 2 HPLC analysis of hydrolyzed DPH
由表2可知,参照对照组中单糖标准品的出峰时间,可判断DPH水解产物中含有L-鼠李糖、D-木糖、L-阿拉伯糖、D-甘露糖、D-葡萄糖和D-半乳糖,未检测出L-岩藻糖、D-山梨糖和D-果糖。上述6 种检出单糖均为吡喃型单糖,与红外光谱分析结果相吻合。由此推测,DPH是一种由上述6 种单糖组成的杂多糖。
2.8 DPH的抑菌效果
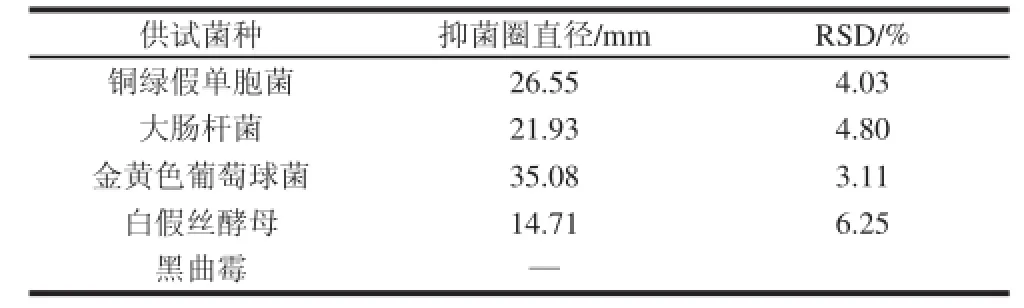
表 3 DPH对不同菌株的抑菌效果Table 3 Inhibitory effects of DPH against different microorganismsTable 3 Inhibitory effects of DPH against different microorganisms
由表3可知,500 mg/mL DPH溶液对4 种供试菌株产生较为显著的抑菌效果,其抑菌效果强弱顺序为金黄色葡萄球菌>铜绿假单胞菌>大肠杆菌>白假丝酵母,而对黑曲霉无抑菌效果。由于牛津杯外径为7.8 mm,据此可知DPH对白假丝酵母的抑菌效果偏弱,而对其他3 种细菌表现出很强的抑菌效果,尤其是对金黄色葡萄球菌。
2.9 DPH的MIC值测定结果
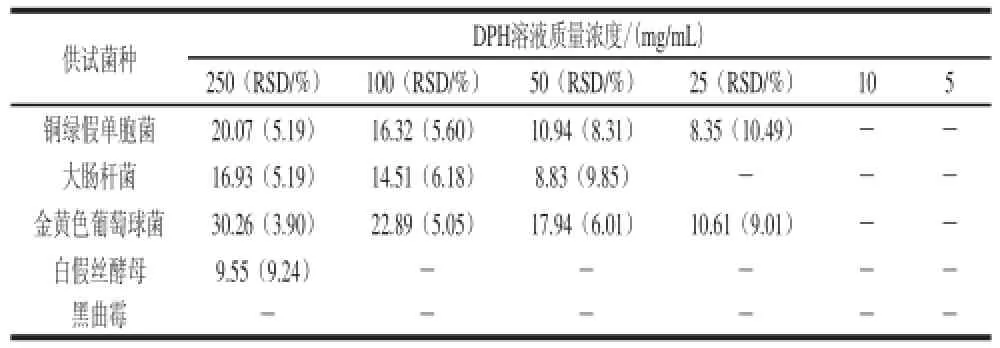
表 4 DPH的MIC值Table 4 MICs of DPH mm
由表4可知,DPH溶液质量浓度的变化与其对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌3 种细菌的抑菌效果存在正相关,相应的MIC值分别为10、10、25 mg/mL。相比而言,DPH溶液对白假丝酵母抑菌效果很弱,对黑曲霉无抑菌效果。综上表明,DPH的抑菌作用具有一定的选择性。
3 结 论
通过单因素试验和正交试验优化黄花菜中提取多糖的工艺条件,结果表明提取CPH最适宜的工艺条件为:黄花菜干粉末先后使用石油醚、乙醇进行脱脂、除去单糖和寡糖,然后以水为提取溶剂,采用提取条件为液固比20∶1(mL/g)、75 ℃浸提3 h、浸提次数2 次。按此浸提,多糖提取率为28.36%。进一步利用中性酶-Sevag法和H2O2氧化法对CPH分别除去蛋白质和脱色,提纯制备出DPH。通过理化检验和紫外光谱、红外光谱、高效液相色谱分析,考察DPH的性质与结构,同时还研究DPH对铜绿假单胞菌、大肠杆菌、金黄色葡萄球菌、白假丝酵母、黑曲霉的抑制作用。实验结果表明,DPH是一种水溶性、非淀粉、非果胶、不含单糖和二糖的杂多糖,具有α-型吡喃糖苷结构,主要是由L-鼠李糖、D-木糖、L-阿拉伯糖、D-甘露糖、D-葡萄糖和D-半乳糖组成。紫外光谱分析和含量分析结果均显示DPH中含有少量蛋白质,至于其是否为与蛋白质或多肽以共价键结合的糖复合物还需进一步纯化后再深入研究。此外,抑菌实验结果表明,DPH对细菌具有特异性的抑制作用,当其溶液质量浓度大于25 mg/mL,对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌均有一定的抑制作用,尤以对金黄色葡萄球菌的抑制作用最佳。因此,DPH是一种潜在的天然抑菌剂,具有一定的开发应用前景。
[1] UEZU E. A philological and experimental investigation of the effects of Hemerocallis as food in man and ddY mice[J]. Bulletin of College of Education University of the Ryukyus, 1997, 51: 231-238.
[2] 张西露, 粟建文, 叶英林. 祁东县黄花菜产业发展现状及对策分析[J].湖南农业科学, 2013(15): 148-151.
[3] 南京中医药大学. 中药大辞典[M]. 上海: 上海科学技术出版社, 2006: 1947-1948.
[4] 邓放明, 尹华, 李精华, 等. 黄花菜应用研究现状与产业化开发对策[J].湖南农业大学学报: 自然科学版, 2003, 296: 529-532.
[5] 韩志平, 张春业, 张海, 等. 黄花菜和3种食用菌营养价值的研究[J].山西大同大学学报: 自然科学版, 2013, 29(5): 63-65.
[6] DING Xia, ZHU Fangshi, GAO Siguo. Purification, antitumour and immunomodulatory activity of water-extractable and alkaliextractable polysaccharides from Solanum nigrum L.[J]. Food Chemistry, 2011, 131(2): 677-684.
[7] LIU Lei, JIA Jun, ZENG Guang, et al. Studies on immunoregulatory and anti-tumor activities of a polysaccharide from Salvia miltiorrhiza Bunge[J]. Carbohydrate Polymers, 2013, 92(1): 479-483.
[8] SILVA D C, FREITAS A L P, BARROS F C N, et al. Polysaccharide isolated from Passiflora edulis: characterization and antitumor properties[J]. Carbohydrate Polymers, 2012, 87(1): 139-145.
[9] de PEREIRA L P, da SILVA R O, BRINGEL P H, et al. Polysaccharide fractions of Caesalpinia ferreapods: potential antiinflammatory usage[J]. Journal of Ethnopharmacology, 2012, 139(2): 642-648.
[10] GODOI A M, FACCIN-GALHARDI L C, LOPES N, et al. Antiviral activity of sulfated polysaccharide of Adenanthera pavonina against poliovirus in HEp-2 cells[C]//Evidence-Based Complementary and Alternative Medicine, 2014: 1-6.
[11] ZHANG Zhongshan, WANG Xiaomei, HAN Zhiping, et al. Purification, antioxidant and moisture-preserving activities of polysaccharides from papaya[J]. Carbohydrate Polymers, 2012, 87(3): 2332-2337.
[12] ZHAO Wei, LI Juejie, YUE Shuqiang, et al. Antioxidant activity and hepatoprotective effect of a polysaccharide from Beichaihu (Bupleurum chinense DC)[J]. Carbohydrate Polymers, 2012, 89(2): 448-452.
[13] JIN Mingliang, HUANG Qingsheng, ZHAO Ke, et al. Biological activities and potential health benefit effects of polysaccharides isolated from Lycium barbarum L.[J]. International Journal of Biological Macromolecules, 2013, 54(1): 16-23.
[14] NIU Jun, PI Zifeng, YUE Hao, et al. Effect of ginseng polysaccharide on the urinary excretion of type 2 diabetic rats studied by liquid chromatography-mass spectrometry[J]. Journal of Chromatography B, 2012, 907: 7-12.
[15] 周秀梅, 王秀兰, 沈楠. 黄花菜粗黄酮提取工艺优化[J]. 中国医药科学, 2013, 3(15): 59-62.
[16] 白雪松, 杜鹃, 刘新迪. 黄花菜根中总黄酮的超声提取工艺研究[J].安徽农业科学, 2012, 40(12): 7108-7109.
[17] 周向军, 高义霞, 张继. 黄花菜多酚提取工艺及抗氧化作用的研究[J].作物杂志, 2012(1): 68-72.
[18] 彭玲. 超声波辅助萃取黄花菜卵磷脂的工艺研究[J]. 食品工业, 2013, 34(2): 1-3.
[19] 虎玉森, 杨继涛, 杨鹏. 黄花菜挥发油成分分析[J]. 食品科学, 2010, 31(12): 223-225.
[20] 国家药典委员会. 中国药典: 一部, 附录: 抑菌剂效力检查法指导原则[S]. 北京: 中国医药科技出版社, 2010.
[21] 胡喜兰, 许瑞波, 陈宇. 牛蒡叶多糖的提取及生物活性研究[J]. 食品科学, 2013, 34(2): 78-82.
[22] 王辰龙, 张子奇, 王曼, 等. 黑木耳多糖的提取分离及体外抗凝血作用研究[J]. 食品工业科技, 2013, 34(9): 238-241.
[23] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 2006: 11-12.
[24] 大连轻工业学院. 食品分析[M]. 北京: 中国轻工业出版社, 2007: 99-103.
[25] 许瑞波, 高颖颖, 万蓓蓓, 等. 北五味子叶多糖的提取及抑菌活性[J].食品科学, 2012, 33(20): 33-37.
[26] 邓芹英, 刘岚, 邓慧敏. 波谱分析教程[M]. 北京: 科学出版社, 2003: 60-63.
Extraction, Structural Characterization and Antimicrobial Activity of Polysaccharides from Hemerocallis citrina Baroni
ZHOU Jidong1, LI Yudong2
(1. Department of Biotechnology, Zhejiang Yuying Vocational Technology College, Hangzhou 310018, China;2. College of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China)
The extraction of crude polysaccharides from Hemerocallis citrina Baroni (CPH) by water extraction and alcohol precipitation was optimized using one-factor-at-a-time and orthogonal array methods. After CPH was deproteinized by Sevag method and decolorized by H2O2oxidation method, the physicochemical properties and structure of the deproteinized polysaccharides from (DPH) were analyzed and characterized by UV spectrometry, infrared (IR) spectrometry and high performance liquid chromatography (HPLC). Meanwhile, the inhibitory activities of DPH against Pseudomonas aeruginosa, Escherichia coli, Staphylococcus aureus, Candida albicans and Aspergillus niger were investigated. The results showed that the optimal conditions for CPH extraction were determined as two extraction cycles with distilled water at a solvent/solid ratio of 20:1 (mL/g) at 75 ℃ for 3 h. Under these conditions, the extraction yield of CPH was 28.36%. Meanwhile, DPH was water-soluble heteropolysaccharides which possessed the structure of α-pyranosides and consisted of L-rhamnose, D-xylose, L-arabinose, D-mannose, D-glucose and D-galactose. DPH was probably formed by conjugation of polysaccharides with proteins or polypeptides through peptide bonds. Furthermore, DPH had strong inhibitory activities against Staphylococcus aureus, Pseudomonas aeruginosa, and Escherichia coli, their corresponding minimum inhibitory concentrations (MICs) were 10, 10, and 25 mg/mL, respectively.
Hemerocallis citrina Baroni; polysaccharides; extraction process; characterization; antimicrobial activity
R284.2
A
1002-6630(2015)08-0061-06
10.7506/spkx1002-6630-201508011
2014-09-14
浙江省教育科学规划研究课题(SCG348);国家自然科学基金青年科学基金项目(31101339)
周纪东(1976—),男,讲师,硕士,研究方向为生物大分子制备与应用。E-mail:tristanzhou1976@sina.com
