基于DNA电化学发光传感器研究金纳米颗粒对量子点的电化学发光影响
2015-12-29鲁理平康天放程水源
鲁理平 李 娇 武 静 康天放 程水源
(北京工业大学环境与能源工程学院,区域大气复合污染防治北京市重点实验室,北京100124)
基于DNA电化学发光传感器研究金纳米颗粒对量子点的电化学发光影响
鲁理平*李 娇 武 静 康天放 程水源
(北京工业大学环境与能源工程学院,区域大气复合污染防治北京市重点实验室,北京100124)
纳米金颗粒具有高的消光系数和良好的表面等离子体共振特性,其等离子体共振特性受纳米金颗粒的尺寸和周围环境等因素的影响.本文基于半导体纳米晶电化学发光信号对金纳米颗粒的距离依赖性制备了DNA电化学发光传感器.首先利用循环伏安法(CV)在玻碳电极(GCE)表面原位沉积金纳米颗粒(AuNPs),巯基丙酸包裹的CdS量子点(QDs)与氨基修饰的双链DNA(dsDNA)通过酰胺键缩合,形成量子点修饰的双链DNA (QDs-dsDNA).最后将QDs-dsDNA通过dsDNA另一端的巯基组装到纳米金表面,得到CdS QDs-DNA/ AuNPs/GCE电化学发光传感器.在优化电极表面QDs-dsDNA密度、金纳米颗粒沉积方法等实验条件的基础上,对不同传感器的表面性质进行了表征,如形貌和电化学阻抗等.进一步通过控制纳米金和CdS QDs之间的DNA研究了纳米金对CdS QDs发光信号的影响作用.结果显示DNA链的长度和类型对发光信号有着重要的影响.最后将此传感器用于环境污染物的DNA损伤检测,显示出很好的灵敏响应.
量子点;电化学发光;金纳米颗粒;DNA;全氟辛酸
1 引言
贵金属纳米颗粒是纳米材料的一个重要分支.随着纳米科学的发展,金纳米颗粒(AuNPs)以其优良的稳定性、良好的生物亲和性以及易于制备等优点,使其在传感器研制、电催化等领域都得到了广泛的关注.1-5近年来,半导体纳米晶-量子点(QDs)与纳米贵金属表面的相互作用特性引起了人们的研究兴趣,该体系即金属表面的等离子体对半导体纳米晶发光特性的影响作用.研究表明,金、银等纳米金属表面等离子体能显著影响与之临近的半导体纳米晶的发光强度,等离子体共振诱导的发光增强或福斯特共振能量转移导致的发光淬灭.6-9
电化学发光方法是电化学和化学发光的结合,它不仅具有化学发光分析灵敏度高、线性范围宽和仪器简单等优点,而且还具有电化学分析控制性强、选择性好等优点.10-12在电化学发光的研究中,通过化学修饰的方法直接或间接将参与化学发光反应的试剂固定在电极上,对电化学发光位点的控制容易实现,从而有利于提高灵敏度,增强选择性,且便于多元分析物测定及成像分析.13自2002年Bard课题组14首次于Science杂志上报道了硅量子点(Si QDs)在有机溶液中的电化学发光特性以来,量子点作为新兴的电化学发光体引起了研究者的极大兴趣.15,16
为了更好地理解金属表面等离子体对半导体纳米晶的电化学发光作用及其应用,我们构建了QDs-DNA/AuNPs/GCE(玻碳电极)电化学发光传感界面,分别选用了不同链长DNA和不同类型DNA来实现对QDs与纳米金体系的调控,探讨了纳米金对QDs发光信号的影响,并基于此测定了环境污染物导致的DNA损伤.
2 实验部分
2.1 实验仪器
CHI 660e型电化学工作站(上海辰华仪器有限公司);光电倍增管(H9306-03,日本滨松),电阻值调节为1000 Ω;漩涡振荡器(北京鼎国昌盛有限公司); KQ218超声波清洗器(昆山市超声仪器有限公司); Pico Scan-MI型原子力显微镜(AFM,美国);JEOL JSM 6500F型扫描电子显微镜(SEM,日本).电化学方法采用三电极系统:修饰的玻碳电极(d=3 mm)为工作电极,饱和甘汞电极为参比电极,铂丝为对电极.
2.2 实验试剂
全氟辛酸(PFOA,≥96%)、巯基丙酸(MPA,≥99%)、氯金酸(HAuCl4,≥49%)、乙基-(3-二甲基丙基)碳二亚胺盐酸盐(EDC,≥99%)和6-巯基己-1-醇(MCH,≥97%),购自Sigma公司(USA);柠檬酸三钠(≥99%)、五水合氯化镉(CdCl2·5H2O,≥99%)和过硫酸钾(K2S2O8,≥99.5%),购于北京化学试剂有限公司;N-羟基琥珀酰亚胺(NHS,≥99%)和硫代乙酰胺(≥99%),购于国药集团化学试剂有限公司;氯化镁(MgCl2,≥99%)购于上海生工生物有限公司;所有试剂均为分析纯,实验用水为超纯水.DNA溶液的储备液用5 mmol·L-1磷酸缓冲溶液PBS(NaH2PO4, Na2HPO4,KCl,pH 7.0)配制.
所有DNA均由北京赛百盛生物技术有限公司合成纯化.杂交双链DNA所需的单链DNA(ssDNA)序列(5'to 3')如下:

实验中所需的单链ssDNA的序列(5'to 3')如下:
ssDNA-7:5'-SH GAG GTT GTG AGG CGC TGC CCC CAC CAT GAG NH2-3'
由ssDNA-1和ssDNA-2杂交而成的互补双链DNA记为dsDNA;由ssDNA-1和ssDNA-3杂交而成的单碱基误配双链DNA记为MMdsDNA-1;由ssDNA-1和ssDNA-4杂交而成的双碱基误配双链DNA记为MMdsDNA-2(误配碱基对均为AC误配);由15个碱基的短链ssDNA-5和ssDNA-6杂交而成的短链互补双链DNA记为dsDNA-15.
2.3 实验步骤
2.3.1 CdS QDs的制备
CdS QDs的合成方法参考文献,17可简单描述为:将20 mL 20 mmol·L-1CdCl2溶液和86µL巯基丙酸混合,用1 mol·L-1NaOH溶液调节pH至10,将溶液转移到三口烧瓶中,在通氮气、磁力搅拌的条件下加入20 mL 20 mmol·L-1硫代乙酰胺溶液,80°C冷凝回流4 h,自然冷却至室温后,置于离心机中4000 r·min-1离心10 min,弃去沉淀物,保留上清液, 4°C冰箱保存.其形貌通过透射电镜和紫外光谱表征(图略),得到粒径大小为2-3 nm的样品.
2.3.2 QDs-dsDNA复合物的制备
取一定量CdS QDs溶液,加入适量的0.1 mol· L-1的EDC和0.1 mol·L-1的NHS(体积比为2:1),震荡5 min,再加入适量的dsDNA溶液,震荡反应30 min,并用NAP-5柱纯化,得到量子点修饰的双链DNA(QDs-dsDNA).
2.3.3 DNA电化学发光传感器的制备
玻碳电极(GCE)使用前,在抛光机上用粒径为0.05µm Al2O3粉浊液抛光至镜面,依次用无水乙醇、超纯水超声清洗5 min,用氩气吹干备用.将表面清洗干净的玻碳电极浸入含0.5 mol·L-1H2SO4的5 mmol·L-1HAuCl4溶液中沉积纳米金,电位范围为0-1.0 V,速率为50 mV·s-1,沉积圈数为5圈,此电极记为AuNPs/GCE,用超纯水冲洗干净,氩气吹干.取适量QDs-dsDNA溶液滴加至AuNPs/GCE表面,湿润环境下自组装16-24 h.将MCH溶液滴加至电极表面,室温组装1 h,封闭电极表面,并用0.1 mol·L-1PBS充分清洗,此电极记为QDs-dsDNA/AuNPs/ GCE,制备过程如图1所示.

图1 量子点-dsDNA/AuNPs/GCE电化学发光(QDsdsDNA/AuNPs/GCE ECL)传感器的制备及全氟辛酸(PFOA)损伤示意图Fig.1 Schematic diagram of quantum dots-dsDNA/AuNPs/ GCE electrochemiluminescence(QDs-dsDNA/AuNPs/GCE ECL)sensor preparation and perfluorooctanoic acid (PFOA)damage
2.3.4 PFOA损伤
将QDs-dsDNA/AuNPs/GCE浸泡在一定浓度的PFOA溶液中,37°C条件下温浴30 min,用0.1 mol· L-1的PBS(pH=7.4)充分冲洗.
2.3.5 电化学发光检测
将电极置于0.1 mol·L-1PBS(pH=7.4)+0.1 mol· L-1K2S2O8溶液中,以铂丝为对电极,以饱和甘汞电极(SCE)为参比电极进行循环伏安扫描,并用光电倍增管(PMT)收集光信号,PMT的电阻设置为1000 Ω,电位扫描范围为0--2.0 V,扫描速率为100 mV·s-1.
3 结果与讨论
3.1 修饰电极的界面表征
3.1.1 扫描电子显微镜和原子力显微镜表征
图2(左)为玻碳电极沉积纳米金的扫描电子显微镜(SEM)图,从图中可以看出,金纳米颗粒均匀地分布在玻碳电极表面.QDs-dsDNA/AuNPs/GCE的原子力显微镜(AFM)(图2(右))表征了QDs-dsDNA在电极表面的状态.从图中可以看出,QDs-dsDNA呈颗粒状态,紧密、均匀地分布在表面.量子点修饰的dsDNA被组装到电极表面的原理是dsDNA的两端分别修饰巯基(—SH)和氨基(—NH2),修饰—NH2的一端与QDs以酰胺键连接,修饰—SH的一端通过Au—S键共价键合在AuNPs表面.
3.1.2 电化学阻抗表征
电化学阻抗谱(EIS)是表征修饰电极表面特征的有效手段.18一般情况下,电极的阻抗图是由受扩散控制的低频段和受动力学控制的高频段两部分组成的,高频部分的半圆形曲线的直径等于电子转移阻抗.图3为不同修饰电极在5 mmol·L-1K3Fe(CN)6/K4Fe(CN)6(1:1)+0.1 mol·L-1KCl溶液中的电化学阻抗谱图.由图可知,当玻碳电极修饰上纳米金后,高频段没有显示电子转移阻抗的半圆形曲线,只观察到受扩散控制的低频段曲线,这是因为纳米金颗粒优良的电子传递性能.19而量子点修饰的双链DNA(QDs-dsDNA)组装到纳米金颗粒表面后,电子转移电阻明显增大了,这是由于DNA的磷酸骨架带负电荷,排斥[Fe(CN)6]3-/[Fe(CN)6]4-到达电极表面,而且QDs为半导体,20从而增大了电子在电极表面转移的阻力,21同时也证明QDs-dsDNA组装到金的表面.最后经PFOA损伤后的传感器(QDsdsDNA/AuNPs/GCE)电化学阻抗明显增大,其原因可推测为PFOA与DNA发生作用,导致了DNA碱基完美堆积结构的破坏,22消弱了DNA的电荷传递,增大了界面阻抗.

图2 AuNPs/GCE扫描电镜图(左)和QDs-dsDNA/AuNPs/GCE原子力显微镜图像(右)Fig.2 Scanning electron microscope(SEM)image ofAuNPs/GCE(left)and atomic force microscopy (AFM)image of QDs-dsDNA/AuNPs/GCE(right)

图3 GCE在不同修饰条件下的电化学阻抗谱图Fig.3 Eletrochemical impedance spectra(EIS)of GCE in different modified conditions
3.2 电极表面QDs-dsDNA密度的影响
将DNA组装到界面时,通常会加入MgCl2来中和DNA磷酸骨架的负电荷,减小DNA之间的相互排斥作用,从而使DNA能均匀、紧密地连接在电极表面,提高DNA固载量,增大信号强度.为了确定QDs-dsDNA组装在AuNPs/GCE表面的密度大小对组装效果的影响,我们比较了dsDNA溶液中是否加入MgCl2对电化学发光强度的影响.实验结果如图4所示,dsDNA溶液中不加MgCl2时,QDs-dsDNA/ AuNPs/GCE的电化学发光强度要明显大于加入MgCl2的情况.这是由于在本体系中,QDs-dsDNA是连接在近似球形的金纳米颗粒上,连接在金纳米颗粒顶端的QDs-dsDNA可以直立在金表面,而对于固载在球形边缘的QDs-dsDNA将无法直立于电极表面,23所以会导致部分QDs与金纳米颗粒接触,从而发生能量转移使得发光淬灭.因此本实验所用DNA溶液中不加MgCl2.

图4 MgCl2对QDs-dsDNA/AuNPs/GCE电化学发光强度(ECL)的影响Fig.4 Effect of MgCl2on QDs-dsDNA/AuNPs/GCE ECLintensity
3.3 纳米金对量子点电化学发光作用的影响
3.3.1 纳米金对发光信号的增强作用
图5为不同修饰电极在0.1 mol·L-1PBS(pH= 7.4)+0.1 mol·L-1K2S2O8溶液中的电化学发光图.其中曲线a为QDs-dsDNA/AuNPs/GCE的电化学发光图,曲线b为QDs-dsDNA/Au电极(即直接将QDsdsDNA组装在金盘电极上)的电化学发光图.由图可以看出,QDs-dsDNA/AuNPs/GCE的发光强度明显大于QDs-dsDNA/Au电极.这是由于在电化学发光的激发下,纳米金颗粒表面发生表面等离子体共振(SPR),从而增强了量子点的电化学发光强度.

图5 不同修饰电极的ECL图Fig.5 ECLimage of different modified electrodes
3.3.2 纳米金与QDs之间的距离对电化学发光强度的影响
利用DNA链的长短来控制纳米金与QDs之间的距离,研究传感器发光强度对距离的依赖性.双螺旋结构的dsDNA的三个碱基长度大约为1 nm,24因此,30个碱基对的dsDNA长度大约为10 nm;15个碱基对的dsDNA长度大约为5 nm.如图6所示,修饰含30个碱基对的dsDNA时,电极的电化学发光强度明显大于修饰含15个碱基对的dsDNA电极.这是由于,在电化学发光的激发下,金纳米颗粒表面会发生表面等离子体共振(SPR),从而导致电化学发光强度的增大.而当金纳米颗粒与量子点的间距较小时,二者之间发生福斯特共振能量转移(FRET),从而导致电化学发光的淬灭.25
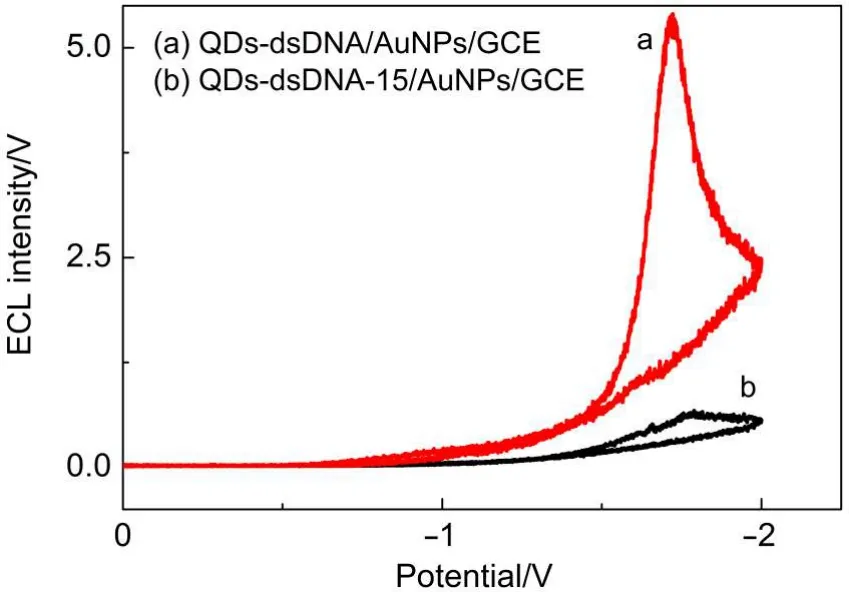
图6 不同DNA链长度修饰电极的ECL图Fig.6 ECLimage of modified electrodes with different DNAchain lengths
3.3.3 DNA类型对电化学发光强度的影响
考察了分别组装单链DNA(ssDNA-7)、单碱基误配(MMdsDNA-1)及双碱基误配(MMdsDNA-2)时产生的电化学发光强度变化.图7分别表示QDsdsDNA/AuNPs/GCE、QDs-MMdsDNA-1/AuNPs/GCE、QDs-MMdsDNA-2/AuNPs/GCE、QDs-ssDNA-7/AuNPs/ AuNPs/GCE的电化学发光曲线.由图中可以看出, QDs-ssDNA-7/AuNPs/GCE(d)的电化学发光强度远小于QDs-dsDNA/AuNPs/GCE(a).其原因是单链DNA无法直立于纳米金表面,倾倒的DNA链将导致QDs与纳米金临近或接触,从而发生能量转移,发光淬灭.碱基误配MMdsDNA修饰电极的发光强度明显小于完全互补dsDNA电极的电化学发光强度,其中双碱基误配MMdsDNA-2修饰电极的发光信号要稍小于单碱基误配MMdsDNA-1,误配碱基对均为C-A.其原因是碱基误配DNA的碱基堆集刚性结构受到破坏,DNA以一定的倾斜度直立于金表面,使QDs与纳米金的距离缩短,部分导致发光淬灭;另一原因是碱基误配削弱了DNA的电荷传递使QDs电化学发光强度减弱.
3.4 PFOA对DNA的损伤测定
图8为QDs-dsDNA/AuNPs/GCE在PFOA中浸泡前后的电化学发光图,曲线a为QDs-dsDNA/ AuNPs/GCE的电化学发光图,曲线b为PFOA损伤后PFOA/QDs-dsDNA/AuNPs/GCE的电化学发光图.由实验结果可知,经PFOA损伤后,电极的电化学发光强度较未损伤的有显著的减小,其原因可以推测是由于PFOA与dsDNA结合,破坏了DNA碱基紧密堆集的刚性结构,导致QDs与纳米金的距离缩短,从而发生了能量转移,使得电极的发光强度显著减小.

图8 QDs-dsDNA/AuNPs/GCE经PFOA损伤前(a)后(b)的ECL图Fig.8 ECLimage of QDs-dsDNA/AuNPs/GCE before
4 结论
在构建QDs-DNA/AuNPs/GCE电化学发光传感界面的基础上探讨了金纳米颗粒对量子点电化学发光强度的影响.通过DNA链的长短实现对QDs与纳米金之间距离的控制,测定了二者之间的距离对发光强度的影响.同时采用SEM、AFM对修饰电极进行了表征,通过电化学及组装不同类型DNA进行了讨论.结果表明,纳米金对QD是的发光强度的作用依赖于其与QDs之间的距离,且发现该体系可用来测定PFOA对DNA的损伤.
(1)Dulkeith,E.;Morteani,A.C.;Niedereichholz,T.;Klar,T.A.; Feldmann,J.;Levi,S.A.;Reinhoudt,D.N.;Moller,M.;Gittins, D.I.Phys.Rev.Lett.2002,89(20),203002.doi:10.1103/ PhysRevLett.89.203002
(2)Du,H.;Disney,M.D.;Miller,B.L.;Krauss,T.D.J.Am.Chem. Soc.2003,125(14),4012.doi:10.1021/ja0290781
(3)Han,R.C.;Yu,M.;Sha,Y.L.Acta Phys.-Chim.Sin.2011,27 (1),255.[韩荣成,喻 敏,沙印林.物理化学学报,2011,27 (1),255.]doi:10.3866/PKU.WHXB20110135
(4)Lu,L.P.;Wang,S.Q.;Lin,X.Q.Anal.Chim.Acta2004,519 (2),161.doi:10.1016/j.aca.2004.05.062
(5)Lu,L.P.;Xu,L.H.;Kang,T.F.;Cheng,S.Y.Appl.Surf.Sci.2013,284(1),258.doi:10.1016/j.apsusc.2013.07.091
(6)Liebermann,T.;Knoll,W.Colloid Surf.A-Physicochem.Eng. Asp.2000,171(1-3),115.doi:10.1016/S0927-7757(99)00550-6
(7)Matsuda,K.;Kanemitsu,Y.Appl.Phys.Lett.2008,92(21), 211911.doi:10.1063/1.2937142
(8)Sen,T.;Patra,A.J.Phys.Chem.2012,116(33),17307.doi: 10.1021/jp302615d
(9)Yang,F.;Wang,L.L.;Guo,Z.H.Acta Chim.Sin.2012,70(11), 1283. [杨 帆,王伶俐,郭志慧.化学学报,2012,70(11), 1283.]doi:10.6023/A1201124
(10)Li,H.J.;Han,S.;Hu,L.Z.;Xu,G.B.Chin.J.Anal.Chem.2009,37(11),1557.[李海娟,韩 双,胡连哲,徐国宝.分析化学,2009,37(11),1557.]doi:10.1016/S1872-2040(08)60139-5
(11)Guo,Z.H.;Tang,L.J.;Zhang,Z.J.Chin.J.Anal.Chem.2009,37(1),13. [郭志慧,唐隆键,章竹君.分析化学,2009,37(1), 13.]doi:10.1016/S1872-2040(08)60078-X
(12)Gao,W.H.;Zhang,A.;Chen,Y.S.;Chen,Z.X.;Chen,Y.W.; Lu,F.S.;Chen,Z.G.Biosens.Bioelectron.2013,49,139.doi: 10.1016/j.bios.2013.05.013
(13)Jiang,H.;Wang,X.M.Electrochem.Commun.2009,11(6), 1207.doi:10.1016/j.Elecom.2009.04.004
(14)Ding,Z.F.;Quinn,B.M.;Haram,S.K.;Pell,L.E.;Korgel,B. A.;Bard,A.J.Science2002,296(5571),1293.doi:10.1126/ science.1069336
(15)Lu,L.P.;Xu,L.H.;Kang,T.F.;Cheng,S.Y.Chin.J.Anal. Chem.2013,41(6),805.[鲁理平,许来慧,康天放,程水源.分析化学,2013,41(6),805.]doi:10.1016/S1872-2040(13) 60659-3
(16)Wu,J.;Lu,L.P.;Kang,T.F.;Cheng,S.Y.Journal of Instrumental Analysis2014,33(4),367.
(17)Wang,H.Y.;Zhang,X.L.;Tan,Z.A.;Yao,W.;Wang,L. Electrochem.Commun.2008,10(1),170.doi:10.1016/j. elecom.2007.11.015
(18)Ren,X.M.;Pickup,P.G.J.Electroanal.Chem.1997,420(1-2),251.doi:10.1016/S0022-0728(96)04784-5
(19)Wang,J.;Han,H.Y.;Jiang,X.C.;Huang,L.;Chen,L.N.;Li, N.Anal.Chem.2012,84(11),4893.doi:10.1021/ac300498v
(20)Morteza,H.;Mohammad,R.G.;Zahra,V.;Farnoush,F.; Batool,A.;Mohammad,H.S.Spectrochim.Acta A2014,121, 116.doi:10.1016/j.saa.2013.10.074
(21)Lu,L.P.;Xu,L.H.;Kang,T.F.;Cheng,S.Y.Biosens. Bioelectron.2012,35(1),180.doi:10.1016/j.bios.2012.02.043
(22)Lu,L.P.;Xu,L.H.;Kang,T.F.;Cheng,S.Y.Applied Surface Science2013,284,258.doi:10.1016/j.apsusc.2013.07.091
(23)Kelley,S.O.;Barton,J.K.Science1999,283(5400),375.doi: 10.1126/science.283.5400.375
(24)Wang,J.;Shan,Y.;Zhao,W.W.;Xu,J.J.;Chen,H.Y.Anal. Chem.2011,83(11),4004.doi:10.1021/ac200616g
(25)Amouyal,E.;Homsi,A.;Chambron,J.C.;Sauvage,J.P. J.Chem.Soc.Dalton Trans.1990,6(6),1841.doi:10.1039/ dt9900001841
Effects of Gold Nanoparticles on Quantum Dot Electrochemiluminescence Obtained Using a DNA Electrochemiluminescence Sensor
LU Li-Ping*LI Jiao WU Jing KANG Tian-Fang CHENG Shui-Yuan
(Key Laboratory of Beijing on Regional Air Pollution Control,College of Environmental and Energy Engineering, Beijing University of Technology,Beijing 100124,P.R.China)
Gold nanoparticles(AuNPs)have a high extinction coefficient and a strong surface plasmon resonance,the latter of which is influenced by the size ofAuNPs and the surrounding environment.In this article, a DNA electrochemiluminescence(ECL)sensor was fabricated based on the distance-dependence of semiconductor nanocrystals'ECL signal toAuNPs.AuNPs were first deposited on the surface of glassy carbon electrode(GCE)by cyclic voltammetry(CV).The mercaptopropionic acid-capped CdS quantum dots(QDs)used in this study can covalently bind with amino-terminated double-stranded DNA(dsDNA),via the—CO—NH bond to obtain a QDs-dsDNAcompound.The QDs-dsDNAcompounds were assembled on the surface ofAuNPs via anAu—S bond,using the other distal of dsDNAthat is labeled with thiol,to create the CdS QDs-DNA/AuNPs/ GCE ECL sensor.Experimental conditions,such as the QDs-dsDNA density on the surface of electrode and the deposition method of AuNPs,were then optimized.The surface properties of different modified electrodes were characterized by scanning electron microscopy(SEM),atomic force microscopy(AFM),and electrochemical impedance spectroscopy(EIS).The effect of AuNPs on the ECL intensity of CdS QDs wasinvestigated by controlling the DNA which lies between the AuNPs and the CdS QDs.The ECL signal was affected significantly by the length and type of DNAstrands.The sensor was used to detect DNAdamage from environmental pollutants and exhibited a highly sensitive response.©Editorial office ofActa Physico-Chimica Sinica
Quantum dot;Electrochemiluminescence;Au nanoparticle;DNA; Perfluorooctanoic acid
O646
10.3866/PKU.WHXB201501151www.whxb.pku.edu.cn
Received:December 30,2014;Revised:January 13,2015;Published on Web:January 15,2015.
∗Corresponding author.Email:lipinglu@bjut.edu.cn;Tel:+86-10-67391659.
The project was supported by the National Natural Science Foundation of China(21005005,21375005,21475006)and Beijing Nova Program,China (2010B009).
国家自然科学基金(21005005,21375005,21475006)和北京市科技新星项目(2010B009)资助
