不同内膜准备方案对激素替代冻胚移植患者临床结局的影响
2015-12-29陈朝军,何峻
不同内膜准备方案对激素替代冻胚移植患者临床结局的影响
陈朝军何峻
(贵州省人民医院生殖中心,贵州贵阳550002)
摘要〔〕目的探讨不同激素替代(HRT)内膜准备方案冻融胚胎移植(FET)中患者的临床结局。方法按照所使用药物方案的不同,将行HRT内膜准备FET周期的486例患者,分为HRT 1组(362例,给予戊酸雌二醇治疗)和HRT 2组(124例,给予戊酸雌二醇联合17β-雌二醇治疗)。比较这两种内膜准备方法患者的基本情况与临床结局。结果HRT 1组原取卵周期人绒毛膜促性腺激素(HCG)日的内膜厚度及HRT周期内膜厚度、HRT1组药物周期加用黄体酮日的内膜厚度均显著高于HRT 2组(P<0.05)。HRT 1组的雌二醇低于HRT 2组(P<0.05)。两组的胚胎种植率、临床妊娠率均无显著差异(P>0.05)。两组因子宫内膜厚度<7 mm发育不良而取消周期的周期取消率分别为18.51%,16.94%。随着内膜厚度的增加,所有患者的临床妊娠率、胚胎种植率逐渐升高。两组患者不同E2水平的临床妊娠率、胚胎种植率均无明显差异(P>0.05)。结论对于子宫内膜薄,单纯使用戊酸E2治疗内膜厚度不理想的患者,加用17β-雌二醇后,内膜厚度增加,临床结局较理想。
关键词〔〕激素替代;冻融胚胎移植;内膜厚度
中图分类号〔〕R392.45〔文献标识码〕A〔
第一作者:陈朝军(1968-),男,副主任医师,主要从事生殖医学研究。
近年来,体外受精和胚胎移植技术(IVF-ET)得到广泛应用,尤其是冻融胚胎移植(FET),是IVF-ET技术的重要补充。优质的胚胎、胚胎与内膜发育的同步性、同步发育的高容受性的子宫内膜是FET成功率的主要影响因素〔1〕。因此,内膜准备在FET中起着重要作用,主要方法有自然周期、微刺激周期、激素替代(HRT)周期这三种内膜准备方案。HRT主要用于治疗绝经期综合征〔2〕,目前在FET中也使用HRT治疗,指导患者口服雌激素,为胚胎移植做子宫内膜准备,在临床妊娠确立后持续用药至胎盘形成。HRT治疗的常用雌激素有戊酸雌二醇、17β-雌二醇。本研究比较分析了单纯戊酸雌二醇、17β-雌二醇联合戊酸雌二醇在HRT内膜准备FET中患者的临床结局。
1资料与方法
1.1一般情况回顾性选取2012年4月至2013年5月我院生殖医学中心收治的用HRT周期准备内膜行FET的患者,共486个周期。用HRT周期行内膜准备所具备的指征主要包含:(1)年龄≥35岁;(2)月经周期不规则的患者;(3)自然周期卵泡发育欠佳的患者,或内膜厚度<7 mm的患者,或者因随诊不便而行HRT周期内膜准备的患者。所有初次胚胎移植失败及取卵周期内膜发育不良的患者均先行宫腔镜检查及治疗,排除内膜病变。
1.2HRT内膜准备的方法
1.2.1HRT内膜准备治疗方案(1) HRT 1组:共362例,在月经周期的第3天,采用基本衡量法指导患者口服戊酸雌二醇(6~8 mg/d),持续用药2~3 w。(2) HRT 2组:共124例,在月经周期的第3天,采用基本衡量法指导患者口服戊酸雌二醇(6~8 mg/d),月经周期第10天开始,加用17β-雌二醇2 mg/d口服,持续至用药2~3 w。
两组患者在用药期间B超监测子宫内膜生长情况及形态,定期监测血清雌二醇、黄体酮、孕酮水平。当用药时间超过14 d,内膜厚度≥8 mm时加用黄体酮60~80 mg/d,第4天行解冻胚胎移植。若持续用药21 d,内膜厚度仍不能达8 mm或出现内膜形态不良、宫腔积液、P值升高(>2 ng/ml)等建议取消移植,部分患者反复多次治疗内膜仍不能达到理想厚度时,在知情同意的条件下仍行移植术。
1.2.2FET技术采用玻璃化胚胎冷冻技术进行胚胎冷冻,解冻后6 h内进行胚胎移植。冷冻胚胎的标准:D3胚胎≥5细胞,胚胎评分为1~2级。解冻后重新对胚胎进行评级。每周期移植胚胎数≤3个,胚胎移植于距宫底1~1.5 cm处宫腔内。存活胚胎指的是复苏胚胎中保持完整的细胞超过一半〔3〕。优质胚胎指的是D3胚胎细胞数在6~12个之间、碎片<20%、胚胎评分为1~2级。
1.2.3妊娠判断标准与监测两组患者移植后原方案持续用药,黄体支持至胚胎移植后第14天,检测血人绒毛膜促性腺激素(HCG),用于判定是否妊娠;移植后第35天经B超检测见孕囊,则为临床妊娠,孕囊个数则是着床个数。
1.3统计学方法应用SPSS17.0软件进行t检验、χ2检验。
2结果
2.1两组HRT患者相关情况的构成比HRT 2组为子宫内膜薄、反复胚胎种植失败、卵泡发育不良的患者。见表1。
2.2两组HRT患者的临床指标分析HRT 1组的原取卵周期HCG日的内膜厚度、药物周期加用黄体酮日的内膜厚度均显著高于HRT 2组(P<0.05)。两组患者的年龄、优质胚胎率、胚胎种植率、移植胚胎数、临床妊娠率、早期流产率均无显著差异(P>0.05)。见表2。
2.3两组患者不同内膜厚度的临床结局分析两组患者在不同内膜厚度下的临床妊娠率、胚胎种植率均无明显差异(P>0.05)。随着内膜厚度的增加,所有患者的临床妊娠率、胚胎种
植率逐渐上升,7~10 mm 、10~12 mm、≥12 mm组的临床妊娠率显著高于<7 mm组(P<0.05),10~12 mm、≥12 mm组的临床妊娠率显著高于7~10 mm组(P<0.05)。10~12 mm、≥12 mm组的胚胎种植率显著高于<7 mm组 (P<0.05)。见表3。
2.4两组患者不同雌二醇水平的临床结局两组患者不同雌二醇水平的临床妊娠率、胚胎种植率均无明显差异(P>0.05)。所有患者雌二醇水平均>250 ng/L。见表4。

表1 两组HRT患者相关情况的构成比〔 n(%)〕

表2 两组临床指标分析
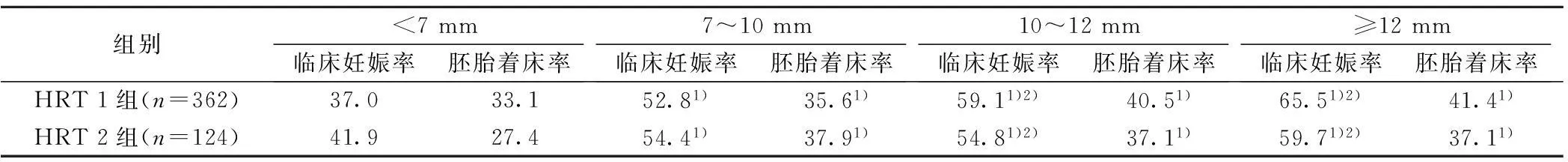
表3 两组患者不同内膜厚度的临床结局(%)
与临床妊娠率<7 mm组比较:1)P<0.05;与7~10 mm组比较:2)P<0.05
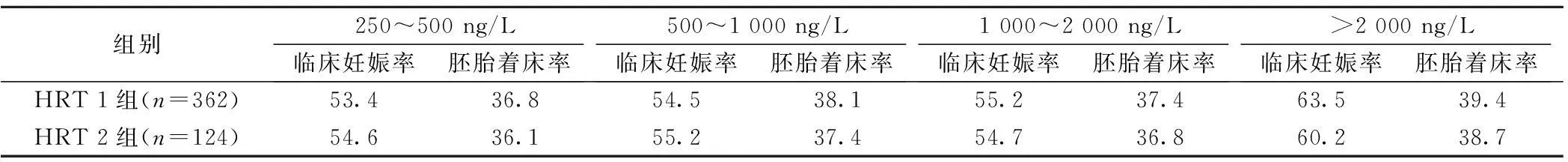
表4 两组患者不同雌二醇水平的临床结局(%)
3讨论
影响FET 成功的关键因素优质的胚胎、胚胎与内膜的同步性、同步发育的高容受性的子宫内膜中,子宫内膜的准备对冻融胚胎临床治疗起着重要作用。在冻融胚胎移植的内膜准备方案中HRT周期应用较广泛〔4〕,可使患者的子宫内膜厚度增加,达到生理要求。已有研究〔5〕证明,HRT周期的使用可达到与自然周期相同的妊娠结局。
临床上虽然戊酸雌二醇已使用较大剂量,但仍有部分患者内膜不能达到理想厚度,或雌激素浓度达不到理想水平。目前,已有研究〔6〕发现17β-雌二醇应用于FET内膜准备,口服或经阴道用药,全身吸收后血药浓度升高,这可能会促进子宫内膜的生长、内膜血液供应的增加,从而改善子宫内膜容受状态。本研究表明17β-雌二醇不仅可以促进内膜的生长,而且可以间接调控囊胚种植于内膜的能力〔7〕,能够提高患者的胚胎种植率。原因可能是雌激素水平有利于血管内皮生长,或者提高了内皮通透性因子的表达,从而使子宫内膜血供量的增加〔8〕。研究表明雌激素浓度对FET的临床结局无明显的影响。这与以往研究〔9〕的结论一致,在HRT周期准备内膜行冻融胚胎移植时监测雌二醇浓度对移植的临床结局无明显的预测作用。 目前,一般认为正常的子宫内膜增殖晚期厚度约8~14 mm,已有研究〔10〕发现子宫内膜厚度<7或8 mm时其妊娠率明显下降。本研究结果表明戊酸雌二醇联合17β-雌二醇治疗的临床疗效可能优于戊酸雌二醇治疗。
综上所述,HRT内膜准备周期在冻融胚胎移植中的应用能够获得较理想的临床结局。对于使用戊酸雌二醇后内膜仍较薄,或使用戊酸雌二醇后雌二醇浓度仍<300 ng/L,或反复冻胚移植失败的患者,在持续服用戊酸雌二醇期间可以加用17β-雌二醇,治疗后可以改善子宫内膜的容受性。
4参考文献
1刘芳,李丽,王兴玲,等.HCG 日血清激素水平对供精体外受精妊娠结局的影响〔J〕.中国妇幼保健,2013;28(1):94-8.
2张惠珍.低剂量雌孕激素联合治疗对绝经后妇女绝经相关指标及生活质量的影响〔J〕.中国妇幼保健,2012;27(24):3758-60.
3闻国芬,金晓莹,王紫莲,等.不同年龄阶段移植 1 和 2 枚新鲜或冻融胚胎时的妊娠结局〔J〕.中华医学杂志,2013;93(33):2646-9.
4Roque M,Lattes K,Serra S,etal.Fresh embryo transfer versus frozen embryo transfer in vitro fertilization cycles:a systematic review and meta-analysis〔J〕.Fertility Steri,2013;99(1):156-62.
5Xiao Z,Zhou X,Xu W,etal.Natural cycle is superior to hormone replacement therapy cycle for vitrificated-preserved frozen-thawed embryo transfer〔J〕.Syst Biol Reprod Med,2012;58(2):107-12.
6Simon JA,Maamari RV.Ultra-low-dose vaginal estrogen tablets for the treatment of postmenopausal vaginal atrophy〔J〕.Climacteric,2013;16(S1):37-43.
7Kobayashi H,Uekuri C,Shigetomi H.Towards an understanding of the molecular mechanism of endometriosis:unbalancing epithelial-stromal genetic conflict〔J〕.Gynecol Endocrinol,2013;30(1):7-15.
8Li B,Chen M,Liu X,etal.Constitutive and tumor necrosis factor-α-induced activation of nuclear factor-κB in adenomyosis and its inhibition by andrographolide〔J〕.Fertil Steri,2013;100(2):568-77.
9邵小光,史艳彬,佟玉.在冻融胚胎移植当日即时评估血清孕酮的价值〔J〕.生殖医学杂志,2013;22(4):270-2.
10Ashrafi M,Jahangiri N,Hassani F,etal.The factors affecting the outcome of frozen-thawed embryo transfer cycle〔J〕.Taiwan J Obstet Gynecol,2011;50(2):159-64.
〔2014-10-20修回〕
(编辑袁左鸣/滕欣航)
