鸭坦布苏病毒SC2013株的分离鉴定
2015-12-28周念戴怡雪丁玲玲胡书月李继祥
周念,戴怡雪,丁玲玲,胡书月,李继祥
(西南大学荣昌校区,重庆荣昌 402460)
鸭坦布苏病毒SC2013株的分离鉴定
周念,戴怡雪,丁玲玲,胡书月,李继祥*
(西南大学荣昌校区,重庆荣昌 402460)
利用RT-PCR从疑似鸭坦布苏病毒感染的致死产蛋鸭的肝、脾和卵泡膜等组织中扩增出鸭坦布苏病毒E基因,并利用10日龄鸭胚分离出病毒SC2013株。该毒株对氯仿和胰蛋白酶敏感,不凝集鸡红细胞;E基因核苷酸序列与坦布苏病毒GX2013G(GenBank:KM275941.1)的相似性在99%以上;对10日龄鸭胚的半数致死量为10-4.59/0.2mL,人工接种能引起2日龄雏鸭发病死亡并呈现典型的临床症状与病理变化。以上结果表明,分离病毒SC2013株为致病性的鸭坦布苏病毒,在今后养鸭业中除注重鸭坦布苏病毒对产蛋鸭的危害外,也应加强防止幼龄鸭感染。
坦布苏病毒;RT-PCR检测;病毒分离
坦布苏病毒(Tembusu virus,TMUV)属于黄病毒科(Flavivirus)的成员,是经蜱、蚊等媒介传播的虫媒病毒,最先于1955年从马来西亚吉隆坡地区的伊蚊体内分离得到,后来在其它地区的库蚊中也分离到该病毒(Platt et al,1975)。自2010年以来,我国东南主要养鸭地区,包括浙江、福建、广东、江苏和山东等,出现一种以产蛋鸭产蛋急剧下降,食欲骤减,卵巢出血、变性和坏死为主要特征的传染病。通过流行病学调查、病原分离、动物回归试验、病理学研究和病毒全基因组测序,确诊该病由一种新的黄病毒引起,并参照病毒分离地将其命名为BYD病毒,疾病命名为鸭产蛋下降综合征[1]。在我国水禽业,该病主要发生于种鸭的产蛋期,但抗体检测结果显示各个日龄鸭均可感染,在临床上出现4周龄樱桃谷鸭和40日龄金定麻鸭感染发病的报道。2011年中国畜牧兽医学会第一届水禽疫病防控研讨会正式将该病名统一为“鸭坦布苏病毒病”,该病病原为一种新型黄病毒即鸭坦布苏病毒(Duck Tembusu virus,DTMUV)。2013年11月,四川北部地区某蛋鸭养殖场的160日龄产蛋麻鸭,疑似感染了鸭坦布苏病毒,本文就该病毒的分离鉴定及特性测定的结果报道如下。
1 材料与方法
1.1 病料采集与处理
2013年11月四川某养鸭场160日龄产蛋麻鸭发病;临床表现为采食量和产蛋量急剧下降,在发病3d内采食量下降90%、产蛋率从92%降至10%左右、发病率几乎100%、死亡率10%左右;病死鸭的主要病变为肝肿大、质脆,卵泡充血、出血、变性和坏死,脾肿大。无菌采集病死鸭的脑、肝、脾及卵泡膜,混合匀浆后按1∶5(W/V)加入0.01M pH7.2 PBS,反复冻融3次,14 000rpm离心5min,上清液用于病毒检测与分离。
1.2 鸭坦布苏病毒的RT-PCR检测
病毒RNA的提取按试剂盒(病毒DNA/RNA提取试剂盒,购自大连TaKaRa公司)说明书进行。按文献[2]报道的序列由上海生工合成引物Fla-1(GCCACGGAATTAGCGGTTGT)和Fla-2(TAATCCTCCATCTCAGCGGTGTAG)以扩增鸭坦布苏病毒E基因约400bp片段。反转录(RT)以6个碱基随机引物按反转录试剂盒(Reverse Trancriptase M-MLV,购自大连TaKaRa公司)的说明书进行。PCR体系为(25.0μL):10×PCR buffer 2.5 μL、25 mM MgCL22.0 μL、2.5mM dNTP 2.0μL、1.25U rTaq酶0.25μL、10 pM上、下游引物各1.0μL、cDNA模板2.0μL,补充灭菌去离子水至25.0μL;反应条件为:94℃5min,94℃30s、57℃30s、72℃30s、40个循环后,72℃延伸10min。取PCR产物5.0μL用琼脂糖凝胶(1.0%琼脂糖、含荧光染料Glodview)电泳、凝胶成像系统观察。
1.3 病毒的分离
病料处理上清液经微孔滤膜(0.22um)除菌并加入双抗,37℃作用30 min后尿囊腔接种10日龄鸭胚(0.2mL/枚);接种鸭胚37℃孵育,每天照胚2次,连续观察7d。收集24h后死亡鸭胚的尿囊液用于鸭胚的连续传代至接种鸭胚规律性死亡,若没有鸭胚死亡,则在接种后120h随机收集3个鸭胚尿囊液用于连续传代。规律死亡鸭胚尿囊液按1.2检测鸭坦布苏病毒,并按文献[3~7]的方法检测鸭甲肝病毒、禽流感病毒、副粘病毒、鸭瘟病毒、鸭星状病毒。
1.4 病毒理化特性测定
用1.0%公鸡红细胞悬液按文献[8]方法测定分离病毒感染鸭胚尿囊液的血凝性;同时,按文献[8]的方法测定了病毒对有机溶剂氯仿、胰蛋白酶的敏感性。
1.5 坦布苏病毒E基因克隆及序列分析
参照GenBank已发表的鸭坦布苏病毒基因序列(登录号JF270480),设计一对特异性引物Fe-1 (GTTGAGGGAGTGAATG)和Fe-2(TTCTTTCCTAGCCAAGT)用于扩增坦布苏病毒的E基因。分离病毒的鸭胚尿囊液按试剂盒说明书提取病毒RNA并反转录合成cDNA。PCR的体系(25.0μL)如1.2。PCR产物经1.0%琼脂糖电泳、切胶回收DNA并利用T载体克隆,上海生工测序。利用MAGE6.0生物学软件的Neighbor-Joining构建方法与BYD-1株(JF312912.1)、FS株(JN811558.1)等11株黄病毒E基因核苷酸序列进行比对分析。
1.6 对雏鸭的致病性及病理学观察
2日龄四川麻鸭(重庆永健生物技术有限公司实验动物基地提供)用于分离病毒的致病性测定。分离病毒第7代鸭胚尿囊液经10倍递进稀释后腿部肌肉接种,0.2mL/只,每个稀释度接种11只;每组动物隔离饲养,饲喂全价雏鸭饲料;连续观察14d并记录发病及死亡情况。濒临死亡动物解剖,观察大体病变及采集肝、心、脾等用于组织病理学观察和病毒检测。
2 结果
2.1 发病鸭大体病变及鸭坦布苏病毒检测
将5只送检病鸭放血致死后解剖,心肌苍白、质地坚硬,脾脏肿大,卵泡变性坏死、卵性腹膜炎,肝脏肿大、质脆,脑膜充血。利用鲜血营养琼脂平板没有从心血、脑、肝、脾和卵泡中分离出致病性细菌。以鸭坦布苏病毒E基因设计的特异性引物(Fla-1和Fla-2)进行RT-PCR检测,所有送检鸭病料均检出400 bp的单一DNA条带(图1)。
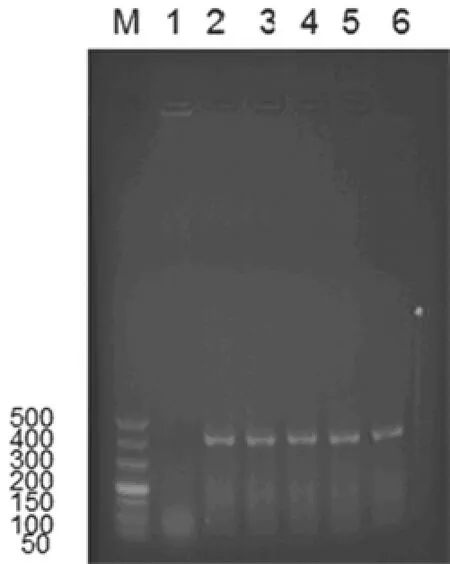
图1 病料中鸭坦布苏病毒RT-PCR产物琼脂糖电泳M:DL500 DNA Marker,1:空白对照,2~6:分别为5个检测样品
2.2 病毒的分离、鉴定
病料处理液接种10日龄鸭胚,接种后40h开始死亡,在120h内死亡率76.9%(10/13);将96h死亡胚的尿囊液10倍稀释后接种,在60~96h鸭胚100% (10/10)死亡;此后死亡胚尿囊液连续传代,都能60~108h内100%(10/10)致死10日龄鸭胚。第7次接种鸭胚尿囊液(F7)对10日龄鸭胚的半数致死量为10-4.59/0.2mL,不凝集鸡红细胞,经5%氯仿和1%胰蛋白酶处理后均不致死10日龄鸭胚,用RT-PCR或PCR检测鸭甲肝病毒、禽流感病毒、副粘病毒、鸭瘟病毒、鸭星状病毒均阴性,RT-PCR检测鸭坦布苏病毒为阳性。
2.3 坦布苏病毒E基因的克隆与分析
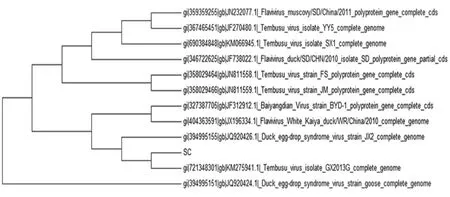
图2 E基因核苷酸序列进化树分析
以第7次接种鸭胚尿囊液(F7)提取的病毒基因组为模板进行反转录、鸭坦布苏病毒E基因特异性引物(Fe-1、Fe-2)进行PCR,其产物经琼脂糖电泳、切胶回收DNA、克隆及测序,获得1 506bp的核苷酸序列。在NCBI中,利用Blast软件分析,该核苷酸序列与黄病毒属的坦布苏病毒GX2013G(GenBank: KM275941.1)E基因的同源性最高,相似性在99%以上;在氨基酸水平上与CQW1株(GenBank: AIU44176.1)的相似性最高,达99%以上。以核苷酸序列绘制进化树(见图2)。
2.4 SC2013株病毒对雏鸭的致病性
分离病毒鸭胚尿囊液(F7)、10倍稀释及100稀释后经颈部皮下接种2日龄四川麻鸭,死亡率分别为100%、80%和60%;在接种后70h左右发病,死亡发生于120h左右。发病鸭排黄绿色稀粪、行动迟缓,后期出现瘫痪、头颈抽搐等神经症状。病死鸭肾脏出血及输卵管尿酸盐沉积、心脏泛白像水煮样、脾脏肿大及坏死、脑膜呈树枝样出血;肝细胞颗粒变性及空泡变性,心肌纤维肿胀断裂、嗜中性白细胞增多,脾脏淋巴细胞坏死,肠黏膜上皮细胞坏死、脱落。死亡鸭脑、肝、心和脾经RT-PCR或PCR检测为鸭坦布苏病毒阳性,鸭瘟、鸭甲肝病毒、禽流感病毒副粘病毒和鸭星状病毒阴性。
3 讨论
本试验从临床疑似鸭坦布苏病毒感染的产蛋鸭组织中分离出无血凝性、对氯仿和胰蛋白酶敏感的病毒,鸭坦布苏病毒E基因特性引物进行RT-PCR检测阳性,而鸭甲肝病毒、流感病毒、副粘病毒和鸭星状病毒等检测阴性,由此表明本试验分离出的病毒SC2013株为鸭坦布苏病毒。
自2010年以来,该病毒的感染给我国的蛋鸭养殖造成了巨大的经济损失。我们将分离的SC2013株病毒人工感染2日龄雏鸭,能引起发病死亡,并表现出典型的临床症状和病例变化。因此,鸭坦布苏病毒感染除能引起蛋鸭产蛋下降及死亡以外,在今后的工作中要关注幼龄鸭的感染。
[1]Su J,Li S,Hu X,et al.Duck egg-drop syndrome caused by BYD virus,a new tembusu related flavivirus[J].PLoS One, 2011,6(3):1~10.
[2]胡旭东,路浩,刘培培,等.我国发现的一种引起鸭产蛋下降综合征的新型黄病毒[J].中国兽医杂志,2011,47(7):43~47
[3]Gan YJ,Huang CH,Wang XZ,et.al.Epidemiological Investigation of Duck Hepatitis A Virus(DHAV)Isolated from Sichuan Basin by RT-PCR Disclose the Existence of Mixed Infection and the Feasibility of DHAV-A Evolved from C80 Strain[J].Pak Vet J,2014,34(3):356~360.
[4]王秀荣,孙明,刘明,等.禽流感病毒RT-PCR试验方法.中华人民共和国农业行业标准NY/T 772-2004.
[5]Liu HL,Wang ZL,Wu YG,et al.Molecular epidemiological analysis of Newcastle disease virus isolated in China in 2005[J]. Journal of Virological Methods,2007(140):206~211.
[6]郭霄峰,廖明,洪洁心.鸭病毒性肠炎诊断技术.中华人民共和国国家标准GB/T 22332-2008.
[7]Todd D,Smyth V J,Ball N W,et al.Identification of chicken enterovirus-like viruses,duck hepatitis virus type 2 and duck hepatitis virus type 3 as astroviruses[J].Avian Pathol.2009,38 (1):21~30.
[8]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997.
1004-2342(2015)02-0017-03
S852.65+9.6
B
2015-03-17)
