动物源性食品中赭曲霉毒素A毒性和检测方法研究进展
2015-12-28夏骏李勇徐国茂于学红陈玲珍
夏骏,李勇,徐国茂,于学红,陈玲珍
(1.江西省兽药饲料监察所,江西南昌 330029;2.南昌市农产品检验测试中心)
动物源性食品中赭曲霉毒素A毒性和检测方法研究进展
夏骏1,李勇1,徐国茂1,于学红1,陈玲珍2
(1.江西省兽药饲料监察所,江西南昌 330029;2.南昌市农产品检验测试中心)
赭曲霉素主要为赭曲霉、疣孢青霉和碳黑曲霉等三种霉菌的二级代谢产物。赭曲霉毒素A具有很强的肝脏毒性和肾脏毒性,并有致畸、致突变和致癌作用,且对于不同动物种属的毒副作用具有差异。赭曲霉毒素A广泛存在于谷物及谷物产品、草料及饲料产品中,一旦被动物食用后,容易在肌肉、组织中蓄积,进而严重危害人体健康。目前国内仅对部分饲料和农产品的进行了限量,对于动物源性食品的限量值和检测方尚未规定,因此有必要建立快速、灵敏、简便,适合我国具体国情的赭曲霉毒素A检测方法,并尽快开展研究,制定动物源性食品的赭曲霉毒素A的限量标准。
赭曲霉毒素A;毒性;检测方法
赭曲霉素主要为赭曲霉(Aspergillus Ochraceus)、疣孢青霉(Penicillium verrucosum)和碳黑曲霉(Aspergillus carbonarius)等三种霉菌的二级代谢产物。赭曲霉素共7种形式,其化学结构极其相似,其中毒性最大、与人类健康关系最密切、对农作物的污染最重、分布最广的是赭曲霉素A(OTA)。饲料中OTA的污染严重,动物进食被OTA污染的饲料后会导致体内OTA的蓄积,而且代谢缓慢。因此在动物性食品,尤其是猪组织、禽蛋及牛奶中常被检出。OTA主要危及人和动物肾脏,还对免疫系统有毒性,并有致畸、致癌、致突变作用。1993年IARC评估后将赭曲霉毒素A归为二类可能对人类致癌物。
1 OTA的理化性质
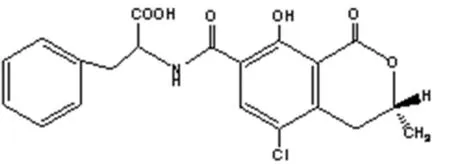
图1 赭曲霉素A化学结构
OTA是异香豆素与苯丙氨酸结合体的衍生物,分子量为403.08,外观性状为无色结晶,弱酸性,溶于极性溶剂和碳酸氢钠溶液,微溶于水,在紫外线照射下呈绿色荧光;在苯溶液中,OTA最大吸收波长为333nm,在纯乙醇溶液中,最大发射波长为467 nm[1]。化学性质稳定,其甲醇溶液可在低温状态下保存一年。赭曲霉素耐热,焙烤只能使其毒性减少20%,蒸煮对其毒性不具有破坏作用。
2 OTA的毒性
大多数研究结果表明,OTA具有肾毒性、致癌性和遗传毒性,在多数动物体内有较长的半衰期。但需要指出的是OTA的药物吸收、代谢以及毒性对于不同种属动物有较大差异。
2.1 反刍动物
一般而言,由于反刍动物的瘤胃微生物可代谢转化部分霉菌毒素,所以比单胃动物更能抑制霉菌毒素的危害。研究结果表明,奶牛摄入OTA后,瘤胃微生物会很快将其转化为低毒性的赭曲霉素-α,只有小部分的OTA吸收到奶牛体内[2]。健康奶牛每摄入1kg饲料可代谢12mg的OTA[3]。当奶牛摄入的OTA达到1.66mg/kg体重,可检测到OTA及其代谢产物赭曲霉素-α[4]。同时也有文献报道,在奶牛体内,OTA还可转化为赭曲霉素C,以及羟基-赭曲霉素A[5~6]。由于反刍动物对OTA的代谢主要是由于瘤胃微生物,因此瘤胃中微生物的生理环境对于OTA的代谢具有重要影响,Pattono的研究表明,由于不同的饲料会改变瘤胃pH,从而影响瘤胃微生物数量,最终影响OTA的代谢。该研究同时指出,基于此原因,有机牛奶受到OTA污染的风险更大[7]。
2.2 非反刍哺乳动物
OTA对于非反刍动物的危害主要体现在肾毒性、神经毒性和免疫毒性。猪食用霉变饲料后,约66%的OTA会被猪肠上皮细胞吸收进入体循环,吸收后在绝大部分OTA与血清白蛋白结合,结合率达99.98%[8]。Herbert的动力学实验表明,以0.5mg/kg剂量对大鼠灌胃,24~48h血药浓度达峰约为4.6~6.0μmol/L,96h后可在尿液和粪便中检出OTA,完全清除需要230h。对于大部分哺乳动物,OTA主要通过肾脏代谢,对于啮齿类,主要通过胆汁代谢[9]。
OTA具有强烈肾脏毒性,会抑制肾脏细胞的增殖,严重减少蛋白的合成,是造成人体巴尔干肾病和泌尿道肿瘤的主要致病因之一。RachedE,Hard GC等对雄性F344大鼠进行攻毒后发现,动物肾近端小管直部出现核增大和单细胞死亡,并且在肾细胞增殖上显示出明显的剂量和时间依赖性[10]。匈牙利的一项研究表明,长期饲喂OTA浓度为800μg/ kg的饲料就会导致育肥猪肾脏病变。
OTA同时还具有神经毒性和免疫毒性。实验表明OTA可显著降低小鼠纹状体纤维细胞酪氨酸羟化酶免疫反应强度[11]。连续35d对后备母猪饲喂2.5mg/kg OTA,会导致猪细胞介导的免疫反应受到抑制。另外OTA会减少猪的白细胞和淋巴细胞数量且升高嗜中性粒细胞总数,减弱嗜中性粒细胞吞噬作用[12]。
国际肿瘤组织已将赭曲毒素A定为可能致癌物质之一。研究确认OTA是神经管缺陷(NTD)的致畸因子,用2mg/kg OTA攻毒7.5d,鼠胎中的NTP的发病率明显上升。Fischer实验结果表明,雄性大鼠的肾癌发病率与OTA剂量呈正比,高剂量组(0.21mg/kg)肾癌发病率高达60%,肾小管腺瘤和肾癌合并发病率分别为39.2%和72.0%[13]。
2.3 禽类
禽类相对于哺乳动物对OTA更加敏感。除了出现类似哺乳动物的肾脏损伤、神经毒性、免疫毒性外,还会出现其种属特有的病变。低剂量的OTA能延长蛋鸡的性成熟、降低产蛋量和孵化率。Huff等在肉鸡日粮中添加6种不同浓度的OTA,饲喂4周后证实,OTA对肉鸡生长性能产生抑制作用,且抑制程度与毒素含量呈正相关[14];原维的实验结果表明,OTA对肉雏鸡肝脏具有毒性,会导致谷草转氨酶(AST)、谷丙转氨酶(ALT)、血清碱性磷酸酶(ALP)数值升高,会加速肝脏的脂质过氧化作用,诱导肝细胞凋亡,使其发生形态学的变化,而导致肝脏的氧化代谢功能障碍[15]。鸭食用OTA会导致肝脏呈脂肪空泡组织增加引起的肝变性、线粒体间质发生变化、肝细胞内质网组织发生破坏[16]。
3 检测方法
目前OTA的检测方法较为成熟,主要包括薄层色谱法、液相色谱法、毛细管电泳-二极管阵列检测法、液相色谱串联质谱法、酶联免疫吸附法和胶体金免疫层析技术。其中液相色谱法和液相色谱串联质谱法是目前应用较广的仪器确证方法,酶联免疫吸附法和胶体金免疫层析技术主要用于大批量样品的快速筛选。
3.1 薄层色谱法
薄层色谱法(TLC)是较早用于OTA检测的一种方法,其优点是方法简单,使用的试剂价格便宜,但是操作繁锁、灵敏度低,一般无法达到痕量检测的要求。其检测原理为:使用三氯甲烷-0.1mol/L磷酸或石油醚-甲醇-水将样品中的OTA提取出来,样品提取液跑板后,通过在365nm紫外光灯照射产生的黄绿色荧光与标准的荧光进行比较得到测定含量(GB/TB111-2003)。Dragan R等建立了猪肾脏及肝脏中OTA的残留量TLC检测方法,检测限和定量限分别为0.5μg/kg和1.0μg/kg,回收率为83%[17]。
3.2 高效液相色谱法(HPLC)
由于赭曲霉素A拥有良好的荧光特性,因此使用配置FLD检测器的高效液相色谱法是目前检测OTA的常用方法。Bascaran等用HPLC-FLD检测牛奶中OTA,将牛奶浓缩后直接通过免疫亲和柱洗脱,上机,该方法操作简单,准确性好,灵敏度较高。陈大义等建立的HPLC-FLD检测植物性产品的方法,准确性高,灵敏度好。该方法用1%的磷酸提取后经PSA固相萃取小柱净化,浓缩后用40%乙腈复溶,上机测定。该方法对大米、玉米、小麦、大麦等样品的回收率均在90%以上,最低检测限为0.05μg/kg[18]。
3.3 毛细管电泳-二极管阵列检测法(CE-DAD)
毛细管电泳是以高压电场为驱动力,以毛细管为分离通道,依据样品中各组分之间淌度和分配行为上的差异而实现分离分析的液相分离方法。曾红燕等人建立了液-超声波提取、C18柱净化和胶束电动毛细管电泳(MEKC)同时测定粮食样品中的玉米赤霉烯酮和赭曲霉毒素A等真菌毒素的方法。该方法回收率为77.9%~103.1%,变异系数小于2%[19]。
3.4 高效液相串联质谱法(LC-MS)
近年来,LC-MS检测方法也被广泛的运用到OTA的检测中,主要是因为该方法检测霉菌毒素时拥有一致的分离和检测条件[20]。Michael等用LCMS的方法对农产品中的OTA进行测定,将样品进行溶剂提取后,提取液再通过免疫亲和柱净化后进行检测分析,该方法的检测限为15μg/kg,加标回收率达到90%。史娜等建立了多种食品中OTA的LC-MS方法。该方法用甲醇-2%碳酸氢钠溶液(60∶40,V/V)或甲醇-水(80∶20,V/V)提取样品中的OTA,经OchraTest亲和柱净化,以甲醇-5mmol/L(含0.1%甲酸)乙酸铵为流动相,采用正离子模式对赭曲霉毒素A进行检测,结果回收率在82.3%~98.5%之间,检出限为0.1μg/kg[21]。Losit等建立了检测猪肉组织中OTA的高效液相串联质谱法,检测限为0.61μg/ kg[22]。
3.5 酶联免疫吸附法(ELISA)
ELISA法是将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原-抗体结合专一性进行免疫反应的定性和定量检测方法。该方法准确度好、灵敏度高、操作简单,适用于大批量样本的检测。但检测结果的重现性差,而且由于存在交叉反应而易造成假阳性,因此需要用其它的方法来验证。江涛等建立了OTA的ELISA检测方法,在2~500ng/L线性范围内,回收率达79%~119.7%,检测限为0.5ng/L[23]。
3.6 胶体金免疫层析技术
免疫胶体金技术是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。该方法精密度好,操作非常简单,基本上不需要有机试剂和精密设备,分析时间短,非常适用于大批量样品的现场快速检测。赖卫华等建立了牛奶中OTA快速检测胶体金试纸条,检测限达10ng/ml,整个过程只有加样一个步骤,10min即可判定结果[24]。
3.7 其它检测方法
除了上述检测方法外,OTA的检测方法还包括时间分辨荧光免疫分析[25]、蛋白质芯片技术[26]和噬菌体随机肽库技术[27]等。
4 结语
赭曲霉毒素A对家禽、哺乳动物均有严重的毒副作用,会对人类健康、食品安全和国际贸易产生严重的影响。世界各国纷纷制定了赭曲霉毒素A的检测标准和在食品、饲料等中的限量标准。我国在赭曲霉毒素A方面的研究相对落后,仅对饲料、谷物、豆类及其制品制订了国家限量标准、对于动物源性食品中赭曲霉毒素A的限量和检测标准尚未建立。因此,在今后的研究工作中,有必要建立快速、灵敏、简便,适合我国具体国情的赭曲霉毒素A检测方法,并尽快开展研究,制定动物源性食品的赭曲霉毒素A的限量标准。
[1]Kuiper-Goodman.T,P.M.Scott.Risk assessment of the mycotoxin ochratoxin.A[J].Biomed.Environ.Sci.,1989,(2): 179~248.
[2]郑楠,王加启,韩荣伟,等.牛奶质量安全主要风险因子分析[J].中国畜牧兽医,2012,3:1~8.
[3]Hult K,Teiling A,Gatenbeck S.Degradation of ochratoxin A by a ruminant[M].Applied and environmental Microbiology, 1976,32:443~444.
[4]Prelusky D B,Veria D M,Trenholm H L,et al.Metabolic fate and elimination in milk,urine and bile of deoxynivalenol following administration to lactating sheep[J].Journal of Environmental Science and Health B,1987,22:125~148.
[5]Galtier P,Alvinerie M.In vitro transformation of ochratoxin A by animal mirobaial floras[M].Ann Rech Vet,1976,7:97~98.
[6]Chu F S.Studies in ochratoxin[M].CRC Crit Rev Toxicol, 1974,2:499.
[7]Pattono D,Gallo P F,Civera T.Detection and quantification of ochratoxin A in milk produced in organic farms[J].Food Chemistry,2011,127:374~377.
[8]李发生,徐霞,郭乐,等.赭曲霉素A的毒性研究进展[J].山东畜牧兽医,2009,30:58~60.
[9]Herbert Zepnika,Wolfgang,et a1.Toxicokinetics of the mycotoxin ochratoxin A in F 344 rats after oral administration[J]. Toxicology and Applied Pharmacology 2003,1:36~44.
[10]Rached E,Hard GC.Effect of ochratoxin A on redox-regulated transcription factors,antioxidant enzymes and glutathione-S-transferase in cultured kidney tubulus cells[J].Food Chem-Toxicol.2008,46(8):65~71.
[11]Sava V,Velasquez A,Song S,et a1.Adult hippocampal neural stem/progenitor cells in vitro are vulnerable to the mycotoxin ochratoxin-A.Toxicology and Applied Pharmacology 2003,192(1):36~44.
[12]Muller G,Kielstein P,Rosner H,et al.Studies of the influence of ochratoxing A on immune and defence reactions in weaners[J].Mycoses,1999,42(7~8):495.
[13]Fischer W,Hillebrand E,Creepy E,et al.Sister chromatid exchange frequency in cultured isolated porcine urinary bladder epithelial cells treated with ochratoxin A and alpha.arch[J]. Toxicol,1995,69:280.
[14]Huff W E,Wystt R Ds,et al.Ochratoxicosis in broiler chicken[J]Poultry Science,1974,(53):1585~1591.
[15]原维.赭曲霉毒素A对肉雏鸡肝脏氧化损伤的研究[D].郑州:河南农业大学,2009:7.
[16]Hussein S H,Jeffrey M B.Toxicity,metabolism,and impact of mycotoxins on humans and animals[J].Toxicol,200l, 167(2):101~134.
[17]Dragan R Milicevic,Verica B Juric,Srdan M Stefanovic,et al.Analysis of ochratoxin in pig tissues using high pressure liquid chromatography(HPLC)and liquid chromatography tandem mass spectrometry(LC/MS/MS)as confirmative methods[J].Proceeding of the National Science,2009,117:51~61.
[18]陈大义,余蓉.HPLC法快速检测咖啡及粮食中赭曲霉毒素A[J].卫生研究,1999,27(增刊):143~145.
[19]曾红燕,黎源倩,晋军,等.毛细管电泳法测定玉米赤霉烯酮及其代谢物[J].四川大学学报(医学版),2003,34(2):333~336.
[20]王帅,陈贺,张继军,等.牛奶中赭曲霉毒素检测方法研究进展[J].中国畜牧兽医,2013,40:78~80.
[21]史娜,路勇,吴颖,等.高效液相色谱-串联质谱法测食品中的赭曲霉毒素A[J].食品科学,2011,32:260~263.
[22]Losito I,MonaciI L,Palimisano F,el al.Determination of ochratoxin A in mest products by high-performance liquid chromatography coupled to eleclrospray ionization sequential mass spectrometry[J].Rapid Communications in Mass Spectrometry,2004,18(17):1965~1971.
[23]江涛,李凤琴,王玉环,等.赭曲霉毒素A免疫学检测的研究[J].中国公共卫生,2004,50(5):556~558.
[24]赖卫华,熊勇华,陈高明,等.应用胶体金试纸条快速检测赭曲霉毒素A的研究[J].食品科学,2005,26(5):204~207.
[25]黄飚,陶文沂,张莲芬,等.赭曲霉毒素A的高灵敏时间分辨荧光免疫分析[J].生物化学与生物物理进展,2005,07: 662~666.
[26]王希春.农产品中两种真菌毒素蛋白质芯片检测技术的研究[D].南京:南京农业大学,2010.
[27]庄浩瀚.噬菌体展示技术筛选与褐飞虱中肠刷状缘膜囊泡结合短肽[D].福州:福建农林大学,2010.
1004-2342(2015)02-0004-04
S859.81
A
2015-02-12)
