磷钾伴生矿酸浸液除氯过程的研究
2015-12-28王为国贺方杰吕仁亮陈苏芳汪铁林王存文
王为国,贺方杰,吕仁亮,陈苏芳,汪铁林,王存文
(1.绿色化工过程教育部重点实验室,湖北武汉430073;2.武汉工程大学化工与制药学院,湖北武汉430073)
氮、磷、钾是农作物必须的三种元素,对农作物的生长有不可替代的作用[1]。我国肥料元素比例严重失调,多氮少磷缺钾现象十分严重。我国可溶性钾资源严重短缺,已探明储量不足世界总量的0.2%[2],但以钾长石为主的难溶性钾资源十分丰富且分布广泛,利用难溶性钾资源制取钾肥具有广阔的工业前景[3]。
湖北宜昌地区拥有储量丰富的磷钾伴生矿资源,其主要成分为石英、钾长石和胶磷矿[4]。合理开发、综合利用该地区磷钾伴生矿资源,对于提升磷资源综合利用率以及减少钾资源对外依存度意义重大[5]。
本课题组前期研究了宜昌地区磷钾伴生矿的反应特性和发泡特性[5],并用磷酸分解磷钾伴生矿[6]。采用磷酸和硫酸分解磷钾伴生矿,Ca2+易生成不溶或微溶钙盐包裹在固体表面阻碍反应。目前,以萤石为助剂在90 ℃下用盐酸与磷钾伴生矿反应4h,钾浸出率达到90%以上,磷可按化学计量浸出。由磷钾伴生矿的盐酸浸出液(酸浸液)制备氮磷钾复合肥,可以实现磷钾伴生矿的有效利用,但长期施用含氯化肥会使土壤中氯含量显著增加,影响农作物对微量元素的吸收[7]。因此,有效降低磷钾伴生矿酸浸液中的氯含量具有重要意义,但目前尚未见到相关报道。磷钾伴生矿的酸浸液中含有Ca2+、Mg2+、Al3+、K+等金属离子,这些金属离子会对盐酸的气液平衡造成影响[8-9]。作者以磷钾伴生矿的酸浸液为研究对象,分别研究了不同种类盐酸盐和硫酸对盐酸蒸馏的影响,拟为以磷钾伴生矿的酸浸液为原料制备低氯的氮磷钾复合肥提供一定参考。
1 实验
1.1 材料与试剂
磷钾伴生矿,湖北宜昌。矿样的化学组成见表1。
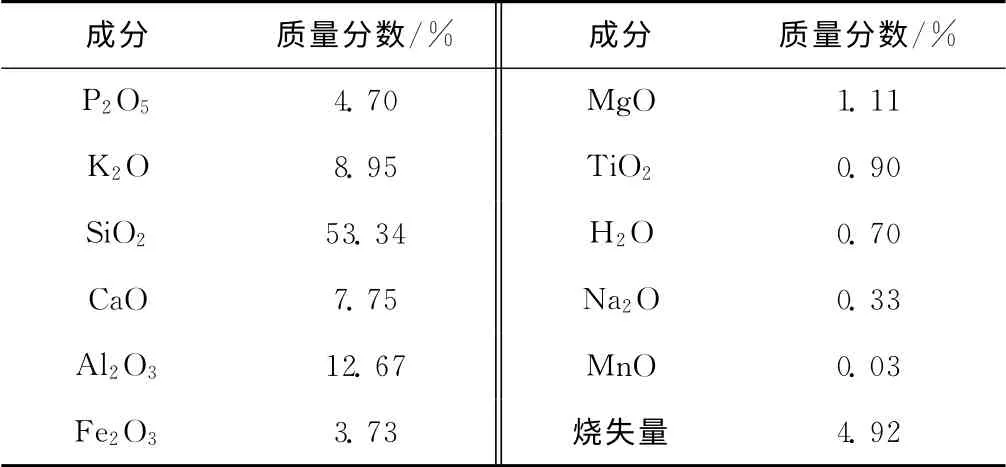
表1 磷钾伴生矿的化学组成Tab.1 C hemical composition of phosphate-potassium ores
磷钾伴生矿酸浸液中盐酸浓度约为2.7 mol·L-1,酸浸液中含有Ca2+、Mg2+、Al3+、K+等金属离子,其中Ca2+的含量最高(浓度为0.87mol·L-1)。
无水氯化钙、结晶氯化铝、六水合氯化镁、氢氧化钠、氯化钾、浓硫酸、浓盐酸等均为分析纯。
1.2 方法
1.2.1 不同种类盐酸盐和硫酸对盐酸蒸馏的影响
配制100mL 浓度为2.7mol·L-1的盐酸,分别加入相同氯离子量的不同种类盐酸盐(以浸出液中与Ca2+对应的Cl-为基准)和硫酸,在搅拌速度300r·min-1条件下进行蒸馏,分批收集沸程为109.2~124.4 ℃的馏出液(每次10mL 左右),采用酸碱滴定法测定馏出液中HCl含量。当馏出液的累计体积为样品总体积的80% 左右时停止加热。同时配制100 mL浓度为4.4mol·L-1盐酸(其氯离子浓度与2.7 mol·L-1盐酸中加入盐酸盐后相同)进行对照实验。
1.2.2 磷钾伴生矿酸浸液除氯的研究
向100mL磷钾伴生矿酸浸液中加入硫酸,搅拌,过滤。沉淀为二水硫酸钙,滤液按1.2.1的条件蒸馏,收集馏出液,并测定其中HCl含量。
2 结果与讨论
2.1 不同种类盐酸盐对盐酸蒸馏的影响
向100mL盐酸(2.7mol·L-1)中加入相同氯离子量的不同种类盐酸盐,不同种类盐酸盐对盐酸蒸馏的影响如图1所示。
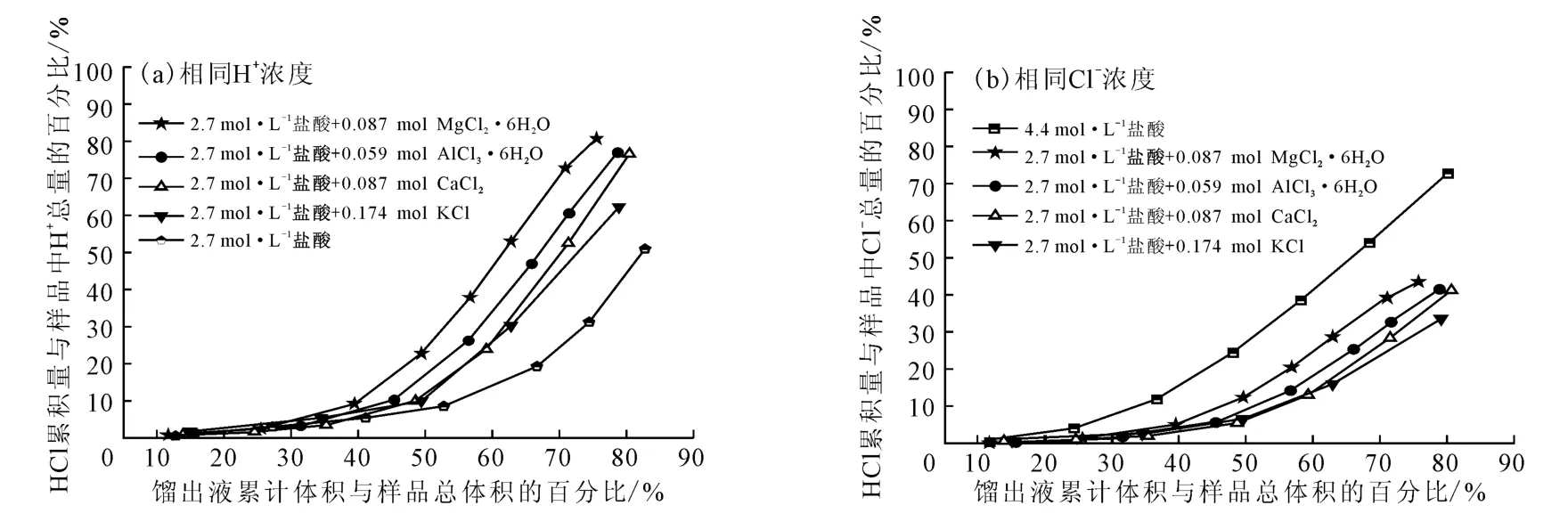
图1 不同种类盐酸盐对盐酸蒸馏的影响Fig.1 Effect of different kinds of hydrochlorides on distillation of hydrochloric acid
由图1a可知:相同H+浓度下,向体系中加入盐酸盐,馏出液中HCl含量增加。这是由于体系中存在着下列平衡关系[10]:

加入盐酸盐后Cl-浓度增大,平衡(1)将向左移动,体系中游离的HCl含量增加,有利于HCl逸出。此外,电解质在水中离解为离子,根据Stokes-Robinson离子水合理论,水溶液中,大多数离子都不是孤立存在的,而是以水合离子的形式存在[11]。水分子被束缚在离子水化层,“自由水”的浓度降低,从而水的活度系数降低[12]。根据热力学一致性,离子活度系数随溶剂活度系数降低而增大。由于离子的水化作用而产生的盐效应增大了盐酸对水的相对挥发度[13],促进了HCl的逸出。
添加等量的Cl-,金属离子对盐酸蒸馏有一定的影响,馏出液中HCl含量不同,相同H+浓度下,馏出液中HCl含量的大小顺序依次为:MgCl2>AlCl3>CaCl2>KCl。对于典型的离子型化合物,根据离子水合理论,“电荷密度”越大的金属正离子,水合作用越显著[13],而这几种金属离子的电荷密度大小顺序依次为Al3+>Mg2+>Ca2+>K+。根据这一原理:加入AlCl3,馏出液中HCl含量理应最多。但上述原理只对典型的离子型化合物适用,AlCl3是共价型化合物,表现出一定的特殊性[10]。因此,馏出液中HCl含量的大小顺序依次为:MgCl2>AlCl3>CaCl2>KCl。
由图1b可知:相同Cl-浓度下,4.4 mol·L-1盐酸比含盐酸盐的盐酸馏出液中HCl含量更高。这是由于4.4mol·L-1盐酸中H+浓度较高,有利于HCl的逸出。与相同H+浓度类似,相同Cl-浓度下,馏出液中HCl含量的大小顺序依次为:MgCl2>AlCl3>CaCl2>KCl。
2.2 硫酸对盐酸蒸馏的影响
2.2.1 硫酸用量对盐酸蒸馏的影响
向磷钾伴生矿酸浸液中加入硫酸,可去除大部分Ca2+,同时增加体系中H+浓度。向100 mL 盐酸(2.7mol·L-1)中加入硫酸,硫酸用量对盐酸蒸馏的影响如图2所示。
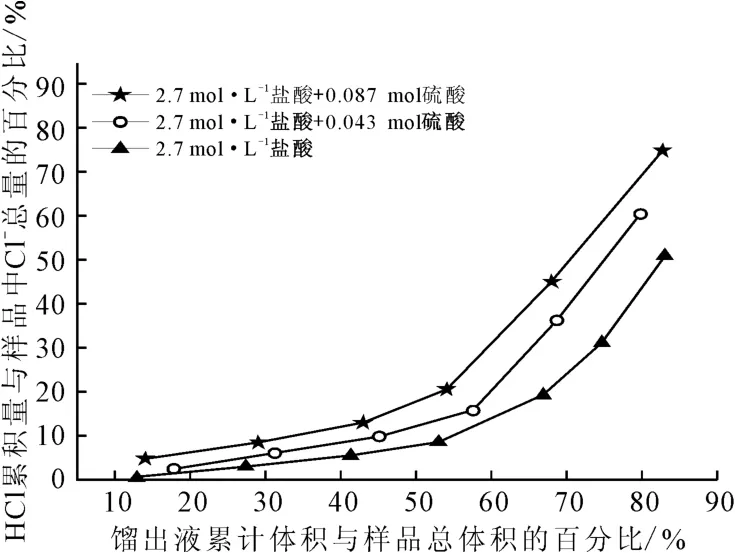
图2 硫酸用量对盐酸蒸馏的影响Fig.2 Effect of dosage of sulfuric acid on distillation of hydrochloric acid
由图2 可以看出:随着硫酸用量的增加,馏出液中HCl的含量逐渐增加。这是由于,加入硫酸后,H+浓度增加,平衡(1)将向左移动,导致体系中游离的HCl含量增加,有利于HCl的逸出。
2.2.2 硫酸对含氯化钙的盐酸蒸馏的影响
向100 mL 盐酸(2.7 mol·L-1)中加入0.087 mol(9.655g)氯化钙,再向其中加入0.087 mol(4.7 mL)硫酸,硫酸对含氯化钙的盐酸蒸馏的影响如图3所示。
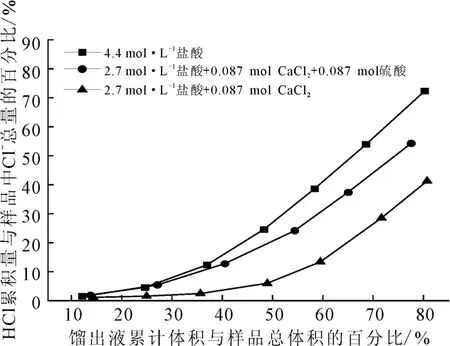
图3 硫酸对含氯化钙的盐酸蒸馏的影响Fig.3 Effect of sulfuric acid on distillation of hydrochloric acid containing calcium chloride
由图3可以看出:加入硫酸后,馏出液中HCl的含量增加。这是由于,加入硫酸后体系中的氯化钙与硫酸发生了复分解反应生成HCl,导致体系中有更多的HCl逸出。4.4mol·L-1盐酸比加酸后含氯化钙的盐酸的馏出液中HCl含量更多。这是由于,硫酸钙是微溶物,体系中的Ca2+与Cl-之间存在缔合作用形成了CaCl-[14-15],导致体系中Cl-浓度降低,不利于HCl逸出。
2.2.3 硫酸对含不同种类盐酸盐的盐酸蒸馏的影响
向100mL盐酸(2.7mol·L-1)中加入相同氯离子量的不同种类盐酸盐,再向其中加入0.087 mol硫酸,硫酸对含不同种类盐酸盐的盐酸蒸馏的影响如图4所示。
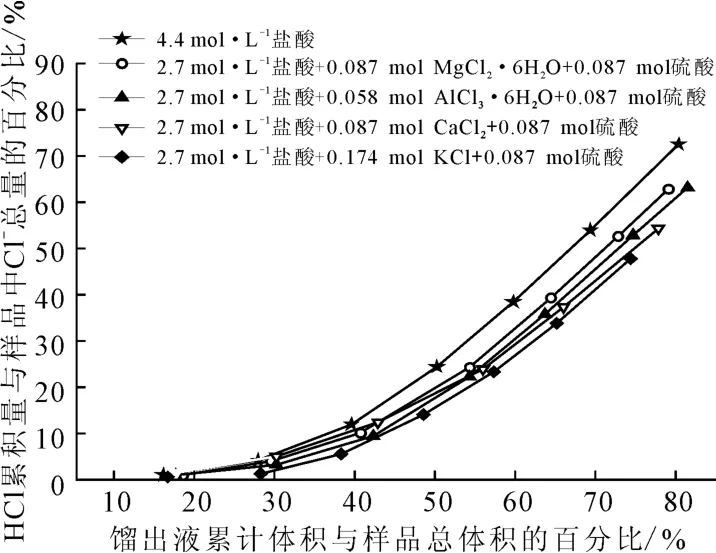
图4 硫酸对含不同种类盐酸盐的盐酸蒸馏的影响Fig.4 Effect of sulfuric acid on distillation of hydrochloric acid containing different kinds of hydrochlorides
由图4可以看出:相同Cl-浓度下,在含不同种类盐酸盐的盐酸中加入硫酸后,馏出液中HCl含量增加;馏出液中HCl含量的大小顺序依次为:MgCl2>AlCl3>CaCl2>KCl,与未加硫酸时一致(图1b)。比较图1b与图4可以看出:加入硫酸后,不同种类盐酸盐对盐酸蒸馏的影响差异变小。这是由于,加入硫酸后,体系中H+浓度大大增加,导致体系中游离的HCl含量增加,掩盖了金属离子的水化效应对盐酸蒸馏的影响。由图4还可以看出:4.4mol·L-1盐酸比加硫酸后含不同种类盐酸盐的盐酸的馏出液中HCl含量更多。这是由于,在盐酸盐溶液中Ca2+、K+等金属离子与Cl-存在着缔合作用[16],这使体系中Cl-浓度降低,不利于HCl逸出。此外,加入硫酸后,体系中H+和Cl-物质的量比为1∶1,盐酸盐中的氯还不能完全以HCl气体形式释放出来,为使反应进行完全,还需提高反应温度以及增大硫酸与盐酸盐的物质的量比[17-18]。因此,4.4mol·L-1盐酸比加硫酸后含盐酸盐的盐酸的馏出液中HCl含量更多。
2.3 磷钾伴生矿酸浸液除氯的研究
磷钾伴生矿酸浸液中含有0.087mol Ca2+,加入硫酸后有沉淀生成。沉淀的主要成分为CaSO4·2H2O,脱水后以CaSO4含量计,纯度为92%,这部分沉淀用于制备硫酸钙晶须。磷钾伴生矿浸出液中含0.27mol H+和0.46 mol Cl-,当分别加入5.5 mL(0.101mol)和11 mL(0.202 mol)硫酸后,体系中分别含有0.47mol H+和0.67mol H+,硫酸对酸浸液中盐酸蒸馏的影响如图5所示。
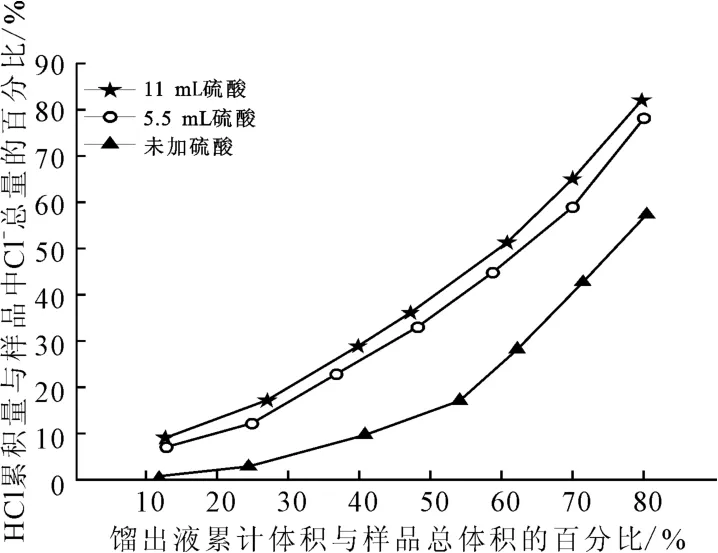
图5 硫酸对酸浸液中盐酸蒸馏的影响Fig.5 Effect of sulfuric acid on distillation of hydrochloric acid in acid-leaching solution
由图5可知:向磷钾伴生矿的酸浸液中加入硫酸有利于除氯。加入5.5mL 硫酸,当有80%的液体被蒸出时(沸程为109.2~124.4 ℃),体系中78%的氯离子被脱除。与加入5.5 mL 硫酸相比,加入11 mL硫酸馏出液中HCl含量有一定增加。这是由于,分别加入5.5mL和11mL硫酸后,体系中H+与Cl-的物质的量比约为1∶1与1.45∶1,H+与Cl-的物质的量比的增大促进了HCl逸出。在磷钾伴生矿的酸浸液中加入过量的硫酸有利于氯的去除,但会引入新的杂质,降低化肥中氮、磷、钾含量。因此,应根据对化肥中氯以及氮、磷、钾含量要求来确定适宜的硫酸用量。
3 结论
分别研究了不同种类盐酸盐以及硫酸对盐酸蒸馏的影响,采用加硫酸蒸馏去除磷钾伴生矿酸浸液中的盐酸。结果表明:(1)其它条件相同时,含不同种类盐酸盐的盐酸馏出液中HCl含量的大小顺序依次为:MgCl2>AlCl3>CaCl2>KCl;(2)在含不同种类盐酸盐的盐酸中加入硫酸后,馏出液中HCl含量增加,大小顺序与未加硫酸时一致,但不同种类盐酸盐对盐酸蒸馏的影响差异变小;(3)在磷钾伴生矿的酸浸液中加入过量的硫酸有利于氯的去除,但会引入新的杂质,降低化肥中氮、磷、钾含量。因此,应根据对化肥中氯以及氮、磷、钾含量要求来确定适宜的硫酸用量。
[1]李寿生,牛波.关于我国化肥工业当前发展的几个问题[J].现代化工,1998,(5):3-6.
[2]李金生,王石军.国产钾肥现状及发展前景[J].化工矿物与加工,2000,(1):1-5.
[3]田改仓.论钾长石制钾肥的开发前景[J].化肥工业,1997,24(2):18-20.
[4]刘艺玮,覃远航,王存文,等.宜昌中间坪磷钾矿矿物学研究[J].矿产综合利用,2014,(1):69-71.
[5]段欢,王存文,覃远航,等.宜昌磷钾矿反应特性和发泡特性研究[J].化工矿物与加工,2013,(9):9-11.
[6]孙雪飞,王为国,王存文.低品位磷钾矿与磷酸共浸提取磷和钾工艺研究[J].化工矿物与加工,2011,(1):6-10.
[7]邹长明,高菊生.长期施用含氯化肥对稻田土壤氯积累及养分平衡的影响[J].生态学报,2004,24(11):2557-2563.
[8]陆春宏.加盐精馏和加盐解吸回收稀盐酸的研究[D].天津:天津大学,2009.
[9]ZHANG Y,ZHOU R Q.Vapor-liquid equilibria for water+hydrochloric acid+magnesium chloride and water+hydrochloric acid+calcium chloride systems at atmospheric pressure[J].Journal of Chemical Engineering,2006,14(2):276-280.
[10]宋南勋.盐酸的盐析蒸馏实验原理与应用[J].重庆大学学报(自然科学版),1988,(1):32-36.
[11]龚海丹.碘离子和碱金属离子水合作用的理论研究[D].大连:辽宁师范大学,2011.
[12]FURTER W F.Salt effect in distillation:A literature reviewⅡ[J].The Canadian Journal of Chemical Engineering,2009,55(3):229-239.
[13]张颖,周荣琪.盐对盐酸-水体系气液平衡的影响[J].精细化工,2006,23(12):1227-1229.
[14]PHUTELA R C,PITZER K S.Thermodynamics of aqueous calcium chloride[J].Journal of Solution Chemistry,1983,12(3):201-207.
[15]RARD J A,CLEGG S L.Critical evaluation of the thermodynamic properties of aqueous calcium chloride.1.Osmotic and activity coefficients of 0~10.77 mol/kg aqueous calcium chloride solutions at 298.15Kand correlation with extended Pitzer ion-interaction models[J].Journal of Chemical and Engineering Data,1997,42(5):819-849.
[16]周权宝.用于强水化和缔合相互作用电解质溶液的化学反应热力学模型的开发及应用[D].长沙:湖南大学,2012.
[17]章永洁.氯化钾与硫酸转化制取硫酸钾的研究[D].天津:河北工业大学,2002.
[18]牛洁.水氯镁石与废硫酸反应制备盐酸的实验研究[J].化工矿物与加工,2013,(7):12-13,27.
