地塞米松对大鼠W alker 256乳腺癌骨转移癌痛的作用
2015-12-28张海林
张 凡,李 毅,丁 杰,张海林
(河北医科大学基础医学院药理学教研室,河北石家庄050017)
地塞米松对大鼠W alker 256乳腺癌骨转移癌痛的作用
张 凡,李 毅,丁 杰,张海林*
(河北医科大学基础医学院药理学教研室,河北石家庄050017)
目的 建立大鼠Walker 256乳腺癌骨转移癌痛模型,观察地塞米松对骨转移癌疼痛痛阈的影响。方法 制备Walker 256乳腺癌细胞的大鼠腹腔积液瘤细胞,将其注射入大鼠胫骨,测量术前及术后机械刺痛阈和辐射热痛阈。结果 接种Walker 256乳腺癌大鼠术侧机械刺激痛觉和辐射热痛觉阈值显著降低,且病理学结果显示骨质受到肿瘤破坏,提示Walker 256大鼠乳腺癌骨转移癌疼痛模型成功建立。地塞米松(5 mg/kg)能够显著提高骨转移癌疼痛模型刺痛痛阈。结论 地塞米松能够缓解大鼠骨转移癌疼痛。
肿瘤;地塞米松;疼痛测定
骨转移是癌症的常见并发症之一,骨转移瘤疼痛是癌症转移患者最常见的疼痛类型,约2/3骨转移患者经历重度疼痛[1]。随着肿瘤治疗的进步,带瘤生存的患者越来越多,生存时间也越来越长,骨转移瘤造成的并发症日渐增多,骨转移瘤疼痛已成为影响其生活质量的一个严重问题,已成为当前恶性肿瘤治疗的一个难点[2]。不同于了解较为深入的神经病理性疼痛和炎性疼痛,骨转移瘤疼痛并未得到广泛研究。直到近几年,合并疼痛研究和肿瘤研究的良好的骨转移瘤疼痛动物模型才得以建立,提供了对骨转移瘤疼痛实验研究的平台[3]。到目前为止,人们对骨转移瘤疼痛的分子机制仍缺乏系统而深入的认识,临床上有效治疗骨转移瘤疼痛的药物十分有限,故对骨转移瘤疼痛治疗的研究显得尤为重要[4]。地塞米松是一种肾上腺皮质激素类药。具有抗炎、抗过敏、抗风湿、免疫抑制作用,临床使用较广泛[5]。有报道地塞米松治疗对晚期肿瘤患者生活质量取得一定的效果,可明显缓解晚期肿瘤患者食欲不振、恶心呕吐、焦虑、疲倦乏力、心悸自汗等症状[6]。此外,应用地塞米松或联合其他镇痛药物,能够有效改善癌性疼痛[7]。本研究成功建立大鼠Walker 256乳腺癌骨转移癌痛模型,观察地塞米松对骨转移瘤疼痛痛阈的影响。报告如下。
1 材料与方法
1.1 动物与试剂 Walker 256乳腺癌细胞株,购自北纳创联生物技术研究院。Wistar雌性大鼠48只(体质量180~200 g),Wistar幼年雌性大鼠2只(体质量80 g)。均由河北省实验动物中心提供。地塞米松购自Sigma公司。
1.2 制备Walker256乳腺癌细胞的大鼠腹腔积液瘤细胞[8]将Walker 256大鼠乳腺癌细胞置于离心管中,1 500 r/min离心5 min,弃去上清液,加汉克斯平衡盐(Hank balance salt solution,HBSS)缓冲液重复漂洗1次。用细胞计数板进行计数,加适量HBSS缓冲液,调整细胞密度为2×107个/mL。选体质量80 g左右的Wistar幼年雌性大鼠,抽取0.2~0.3 m L肿瘤细胞接种幼鼠腹腔中。6~7 d后,待幼鼠出现腹腔积液症状,腹部明显膨大时,抽取含肿瘤细胞的腹腔积液。1 500 r/min离心5 min,弃去上清液,用HBSS缓冲液将细胞重悬,再以1 500 r/min离心5 min。然后用HBSS缓冲液调整细胞浓度为4× 107/mL,以备肿瘤接种时使用。
1.3 大鼠Walker256乳腺癌骨转移癌痛模型[8]
1.3.1 动物分组 结果2.1部分实验动物分组:将24只雌性Wistar大鼠(体质量180~200 g)随机分成3组各8只,分别为空白对照组(该组大鼠不做任何手术处理)、假手术组(该组大鼠在胫骨处注入5μL HBSS缓冲液)、手术组(该组大鼠在胫骨处植入5μL Walker 256细胞),造模时间持续28 d。结果2.2部分实验动物分组:将24只雌性Wistar大鼠(体质量180~200 g)随机分成3组各8只,分别为假手术组(该组大鼠在胫骨处注入5μL HBSS缓冲液)、手术组(该组大鼠在胫骨处植入5μL Walker 256细胞)、手术+地塞米松组(该组大鼠在胫骨处植入5μLWalker 256细胞),大鼠出现疼痛行为预示造模成功,第17天开始每天腹腔注射地塞米松5 mg/kg至第26天。
1.3.2 制备大鼠胫骨癌痛模型 参照文献报道[8]的方法并加以改进,制作大鼠胫骨癌痛模型。用1.0%戊巴比妥钠麻醉大鼠,手术组、假手术组动物采用仰卧位,用75%酒精对右侧后肢进行消毒,去毛。在胫骨上段切开皮肤约1 cm,用镊子钝性分离肌肉,小心暴露胫骨骨面,用电动钻孔器垂直于骨面钻孔,至有明显落空感后停止钻孔,用10μL微量注射器抽取Walker 256细胞悬浮液5μL,缓慢植入至骨髓腔中,拔出微量注射器,然后迅速用无菌骨蜡封住钻孔。如果有细胞悬浮液溢出,用75%酒精进行消毒,杀死溢出的癌细胞。逐层缝合切口,然后涂抹适量碘酒,以防切口感染。假手术组动物注射等体积HBSS溶液,其余操作同手术组。对照组大鼠不进行任何手术操作。
1.4 机械刺痛阈值测量 应用标准尼龙丝(美国North Coat Medical公司)刺激大鼠右后爪拓面。尼龙丝测试从最细柔开始逐渐顺序增大标号,直到引发大鼠右后腿抬起所使用尼龙丝的标号即为机械痛阈值。阈值标准以g为计量单位。结果2.1部分实验测量手术前和手术后第1、3、5、7、9、13、16、19、22、25、28天大鼠机械痛阈值。结果2.2部分实验测量手术前和手术后第1、3、6、9、12、15、20、23、26天大鼠机械痛阈值。
1.5 热痛阈值测量 应用激光热源灯(PL-200热痛仪,成都泰盟科技有限公司)照射大鼠右后爪拓面测量热痛阈值。激光热源强度为(25.0±0.1)℃。引发大鼠右后腿抬起所照射时间即为热痛阈值。阈值标准以s为计量单位。结果2.1部分实验测量手术前和手术后第1、3、5、7、9、13、16、19、22、25、28天大鼠热痛阈值。
1.6 病理组织学观察 于肿瘤细胞接种后28 d,断颈法处死大鼠,直接取大鼠新鲜胫骨,尽量除去肌肉组织,立即放入4%多聚甲醛中固定3 d,然后置于甲酸多聚甲醛溶液(甲酸与4%多聚甲醛比例为3∶7)中脱钙12~24 h,经脱水、透明、透蜡、包埋、切片后制成石蜡切片,然后进行HE染色。在显微镜下观察肿瘤细胞生长及骨组织的破坏情况。
1.7 统计学方法 应用Origin 7.5软件进行分析,计量资料以±s表示,分别采用单因素方差分析、q检验和t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠胫骨植入Walker 256乳腺癌细胞诱发骨转移疼痛的变化
2.1.1 胫骨植入Walker 256乳腺癌细胞的大鼠机械刺激和辐射热痛觉阈值 空白对照组和假手术组机械刺激痛觉阈值在手术后各时间点差异无统计学意义(P>0.05);手术组的大鼠于术后第7天,机械刺痛阈值开始逐渐降低,至第16天时机械刺痛阈值达到较低值(P<0.05)(图1A)。在相同时间点,空白对照组和假手术组的辐射热痛觉阈值差异无统计学意义(P>0.05);而植入Walker 256细胞组大鼠,于术后第7天开始其辐射热痛觉阈值逐渐降低,持续至第28天时达到最低值(P<0.05)(图1B)。
2.1.2 植入肿瘤细胞所致胫骨组织病理学变化于造模28 d,取各组大鼠胫骨,制备组织切片。在空白对照组(图2A)和假手术组(图2B),可见正常骨髓组织,未见其他骨结构改变。而手术组(图2C)的胫骨切片展示,在原有宿主骨周围出现多量新生骨,有的在一侧,有的包绕;髓腔内可见肿瘤细胞,大部分伴有坏死,符合肿瘤表现。大鼠Walker 256乳腺癌骨转移疼痛模型成功建立。
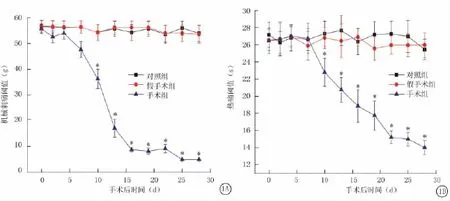
图1 Walker256乳腺癌骨转移瘤痛模型大鼠机械刺痛A.机械刺痛阈值;B.热痛阈值*P<0.05与对照组、假手术组比较(q检验)Figure 1 The withdrawal threshold to mechanical stimulus and withdrawal time in response to radiant thermal stimulus were reduced in rat model of bone cancer pain induced by Walker 256 mammary gland carcinoma cell
2.2 地塞米松对大鼠乳腺癌骨转移疼痛模型机械刺痛痛阈的影响 乳腺癌骨转移模型大鼠于术后机械刺痛阈值逐渐降低。于术后第17天起,连续腹腔注射给予5 mg/kg地塞米松;第20天后即显著提高大鼠机械刺痛痛阈,持续至第26天(图3)。

图3 地塞米松提高大鼠Walker 256乳腺癌骨转移疼痛模型机械刺痛阈值*P<0.05与手术组比较(t检验)Figure 3 Dexamethasone elevated withdrawal threshold to mechanical stimulus in rat model of bone metastasis pain induced by Walker 256mammary gland carcinoma cells
3 讨 论
骨转移瘤疼痛是癌症患者最常见的一种疼痛,也是肿瘤发生骨转移时最常见的症状之一,利用合适的动物模型研究骨转移癌疼痛的发生机制对其治疗具有重要意义[9]。目前认为,胫骨癌痛动物模型的疼痛表现与临床上所见的骨转移症状相似,可视为骨转移癌疼痛模型。Walker256大鼠乳腺癌细胞来源于大鼠原发性乳腺癌组织,具有较好的骨侵袭能力,应用该瘤细胞建立的乳腺癌骨转移模型,具有重要的科研价值[10]。
本研究结果显示,假手术组的机械痛阈和热痛痛阈与对照组比较差异无统计学意义(P>0.05);手术组大鼠术后手术侧后足机械痛阈和热痛痛阈值在造模6~7 d开始下降,与假手术组大鼠比较差异有统计学意义(P<0.05),且造模后28 d,组织学结果显示有肿瘤破坏骨质的证据。表明本研究成功建立Walker256大鼠乳腺癌骨转移癌疼痛模型,且本研究细胞造模的成模时间以及痛觉行为与文献报道基本一致,并表现出许多与人类骨转移癌痛相似的特征[10]。
本研究发现地塞米松能够有效缓解大鼠Walker 256乳腺癌骨转移疼痛模型机械刺痛。地塞米松对骨转移疼痛模型热痛的影响本研究未测试。地塞米松是一种人工合成的糖皮质激素,是抗炎、抗过敏药物,主要作为危重疾病的急救用药和各类炎症的治疗。阿片类药物是晚期癌症镇痛的基本用药,但其存在耐受性、成瘾性以及严重并发症等严重缺点[11]。单独增加阿片类药物的剂量并不能达到理想的镇痛效果。地塞米松适用于此类并发症及对其敏感的恶性肿瘤。有研究发现,单独使用地塞米松或联合其他镇痛药物对中、重度癌痛患者可达到完全或明显缓解的效果。其可能的止痛机制包括:通过减轻肿瘤周围组织水肿,缓解疼痛敏感结构的受压状态;或促使对类固醇有反应的恶性肿瘤萎缩;或通过减少某些炎性介质,如前列腺素和白三烯的组织浓度以降低伤害性感受器的活性[12-13]。
[1] Mantyh P.Bone cancer pain:causes,consequences,and therapeutic opportunities[J].Pain,2013,154(Suppl 1):S54-62.
[2] Kaasa S.Interview:Cancer pain management:the last decade and looking forward[J].Pain Manag,2014,3(6):431-434.
[3] Lozano-Ondoua AN,Symons-liguori AM,Vanderah TW.Cancerinduced bone pain:mechanisms and models[J].Neurosci Lett,2013,557(Pt A):52-59.
[4] Montiel-Ruiz RM,Acosta-Gonzaleza RI,Jimenez Andrade JM.Bone cancer pain:from preclinical pharmacology to clinical trials[J].Gac Med Mex,2013,149(2):204-211.
[5] Ahmad S,De Oliveira GS,Fitzgeraldf PC,et al.The effect of intravenous dexamethasone and lidocaine on propofol-induced vascular pain:a randomized double-blinded placebo-controlled trial[J].Pain Res Treat,2013,2013:734531.
[6] Rinehartr J,Amolda S,Kloeckerk G,et al.PhaseⅡ randomized trial of carboplatin and gemcitabine with or without dexamethasone pre-treatment in patients with StageⅣnon-small cell lung cancer[J].Cancer Chemother Pharmacol,2013,71 (5):1375-1383.
[7] Lauretti GR,Rizzo CC,Mattos AL,et al.Epidural methadone results in dose-dependent analgesia in cancer pain,further enhanced by epidural dexamethasone[J].Br JCancer,2013,108 (2):259-264.
[8] Zheng Q,Fang D,Liu M,et al.Suppression of KCNQ/M(Kv7) potassium channels in dorsal root ganglion neurons contributes to the development of bone cancer pain in a rat model[J].Pain,2013,154(3):434-448.
[9] Zhang R,Lao L.A new rat model of bone cancer pain[J].Methods Mol Biol,2012,851:261-273.
[10] Xia H,Zhang D,Yang S,et al.Role of ATP-sensitive potassium channels in modulating nociception in rat model of bone cancer pain[J].Brain Res,2014,1554:29-35.
[11] Chen L,Sein M,Vo T,et al.Clinical interpretation of opioid tolerance versus opioid-induced hyperalgesia[J].J Opioid Manag,2014,10(6):383-393.
[12] RoghaiR RD,Volk KA,Lamb FS,et al.Impact of maternal dexamethasone on coronary PGE (2) production and prostaglandin-dependent coronary reactivity[J].Am J Physiol Regul Integr Comp Physiol,2012,303(5):R513-519.
[13] Gong J,Ren D,Luo Y,et al.Effects of dexamethasone on expressions of IL-21 and its receptor in lungs of experimental asthmamice[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2013,29(6):561-564.
(本文编辑:刘斯静)
Effect of dexamethasone on rat bonemetastasis pain induced by Walker 256 mammary gland carcinoma cells
ZHANG Fan,LIYi,DING Jie,ZHANG Hai-lin*
( Department of Pharmcology,the Basic Medical College of Hebei Medical University,Shijiazhuang 050017,China)
Objective To establish a ratmodel of bone metastasis pain induced by Walker 256 mammary gland carcinoma cells and observe the effect of dexamethasone on bone cancer pain.MethodsAscitic tumour cells were made from Walker256mammary gland carcinoma cells injected to tibia of rats.Then,the withdrawal threshold to mechanical stimulus and withdrawal time in response to radiant thermal stimulus were tested before and after operation.ResultsThe withdrawal threshold to mechanical stimulus and withdrawal time in response to radiant thermal stimulus were significantly reduced in the tibia bone inoculated with Walker 256 cells.The pathology results showed the evidence of tibia bone structure was destructed by tumor.It is suggested that the model of bone metastasis pain induced by Walker 256 mammary gland carcinoma cell was successfully established.Dexamethasone(5 mg/kg) elevated withdrawal threshold to mechanical stimulus in rat model of bone metastasis pain induced by Walker256 mammary gland carcinoma cell.ConclusionDexamethasone could alleviate bone cancer pain.
neoplasms;dexamethasone;pain measurement
R965.1
A
1007-3205(2015)03-0249-04
2015-01-07;
2015-01-20
国家自然科学基金(31401199);河北省自然科学基金(H2015206427);河北省教育厅优秀青年基金(YQ2014030);中国博士后科学基金第56批面上资助(2014M560194)
张凡(1986-),女,河北邢台人,河北医科大学基础医学院讲师,理学博士,从事离子通道功能调节的研究。
*通讯作者。E-mail:z.hailin@yahoo.com
10.3969/j.issn.1007-3205.2015.03.001
