野生型p53-诱导的蛋白磷酸酶1过表达与胶质瘤患者预后的关系
2015-12-28梁朝辉胡福广王立群焦保华
梁朝辉,胡福广,赵 林,王立群,焦保华
(河北医科大学第二医院神经外科,河北石家庄050000)
野生型p53-诱导的蛋白磷酸酶1过表达与胶质瘤患者预后的关系
梁朝辉,胡福广,赵 林,王立群,焦保华*
(河北医科大学第二医院神经外科,河北石家庄050000)
目的 探讨野生型p53-诱导的蛋白磷酸酶1(wild-type p53-induced phosphatase1,Wip1)与脑胶质瘤患者预后相关性。方法 通过免疫组织化学方法检测81例不同级别和类型胶质瘤组织与15例正常脑组织中Wip1表达阳性与患者不同临床病理类型的关系,包括性别、年龄、胶质瘤的病理分级、肿瘤大小、肿瘤位置、KPS评分、病理分级、PCNA表达p53表达。应用Kaplan-Meier生存曲线法分析Wip1表达与患者预后的相关性。结果 Wip1在脑胶质瘤组织的阳性表达率为55.6%(45/81),明显高于正常脑组织的0.0%(0/15)(χ2=15.686,P<0.01),Wip1阳性表达的胶质瘤患者生存率低于Wip1阴性表达患者。Wip1的表达与PCNA表达呈正相关,低KPS评分、高Wip1表达和高病理分级是胶质瘤患者预后差的危险因素。结论 Wip1在人脑胶质瘤组织中呈高表达,与患者预后差有关。
神经胶质瘤;蛋白磷酸酶1;预后
[Key words]glioma;protein phosphatase 1;prognosis
野生型p53-诱导的蛋白磷酸酶1(the wild-type p53-induced phosphatase1,Wip1)是一种新发现的原癌基因,属于丝氨酸/苏氨酸蛋白磷酸酶 PP2C (PP2C type protein phosphatase)家族中的一员,位于人染色体17q23/q24区域。Wip1在正常小鼠细胞生长发育过程中,起重要调控作用[1]。Wip1过表达与肿瘤的发生发展密切相关。近年来,人们相继发现Wip1在神经母细胞瘤[2]、乳腺癌[3]、卵巢癌[4]、髓母细胞瘤[5]等肿瘤中高表达,并且高表达的Wip1与乳腺癌、胃癌及胰腺癌患者的预后差密切相关[6-8]。目前,国外学者针对Wip1在人脑胶质瘤中的研究仅限于高级别胶质瘤表达高于低级别胶质瘤的报道[9],而Wip1表达与胶质瘤患者预后的相关性尚未见报道。本研究采用免疫组织化学方法分析Wip1在胶质瘤组织和正常脑组织中的表达及其与临床病理特征之间的关系,以探讨Wip1在胶质瘤发生发展过程中的作用,旨在为胶质瘤的临床治疗和预后判断提供新的线索。
1 资料与方法
1.1 一般资料 选择2003年12月—2005年12月于河北医科大学第二医院神经外科收治的经手术、放化疗治疗的脑胶质瘤患者95例,术后6~12个月通过电话或信件进行随访,记录患者生存期;12例患者失随访,2例非胶质瘤原因死亡患者排除入组,将剩余81例病历资料完整的患者作为研究对象,男性48例,女性33例,年龄6~76岁,中位年龄36.9岁;依据2007年世界卫生组织中枢神经系统肿瘤分类方法,包括Ⅱ级38例(其中星形细胞瘤21例,少突胶质细胞瘤17例),Ⅲ级23例(其中间变型星形细胞瘤12例,少突胶质细胞瘤11例),Ⅳ级20例(均为多形性胶质母细胞瘤)。15例正常脑组织标本来自于胶质瘤患者术中皮层造瘘或脑外伤患者行内减压的脑组织,男性6例 ,女性9例,年龄9~69岁,中位年龄34.3岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 材料和试剂 Wip1兔抗人多克隆抗体(美国Santa Cruz公司),PCNA鼠抗人多克隆抗体,免疫组织化学试剂盒(北京中杉金桥生物技术公司),二氨基联苯胺(Diaminobenzidine,DAB)显色剂(北京中杉金桥生物技术公司),
1.3 实验方法
1.3.1 免疫组织化学染色 组织常规包埋、切片,行链霉菌抗生素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP)免疫组织化学染色,Wip1一抗(1∶200),增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(1∶200),PBS作阴性对照,Wip1染色以人正常胃组织作阳性对照。
1.3.2 评分方法 由2名及2名以上神经病理科医师在不知道患者临床数据的情况下,采取双盲法对结果进行计数。在高倍显微镜(×400)下,对阳性细胞进行计数,各自计数3张切片,每张切片上随机选取5个视野。Wip1/PCNA表达按照阳性细胞百分率与阳性细胞染色强度得分之和进行计数。阳性细胞百分率分4个级别:≤5%计0分,>5%~25%计1分,>25%~50%计2分,>50%计3分。细胞染色强度分数标准:无染色计0分,弱染色(浅黄色)计1分,中等染色(棕黄色)计2分,强染色(黄褐色)计3分。2项标准相和评分:0分为阴性(-),1~2分为弱阳性(+),3~4分为中等阳性(++),5~6分为强阳性(+++)。
1.4 统计学方法 应用SPSS 13.0统计软件进行数据分析。计数资料比较采用χ2检验;相关性采用Spearman秩相关;使用Kaplan-Meier法绘制生存曲线并计算生存率;多因素分析使用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结 果
2.1 Wip1在人脑胶质瘤组织及正常脑组织中表达Wip1阳性表达为胞浆和细胞核染成浅黄色、棕黄色或黄褐色,Wip1在脑胶质瘤组织的阳性表达率为55.6%(45/81),明显高于正常脑组织的0.0%(0/ 15),差异有统计学意义(χ2=15.686,P<0.01),见图1。
2.2 Wip1在脑胶质瘤各变量中的表达 在男女性别、肿瘤位置之间Wip1阳性率差异均无统计学意义;年龄≥50岁较 <50岁 Wip1阳性率高(P<0.01);肿瘤≥3 cm3较<3 cm3Wip1阳性率高(P<0.01);卡氏功能状态(Karnofsky performance status,KPS)评分<80分较≥80分Wip1阳性率高(P<0.05);病理分级Ⅲ~Ⅳ级较Ⅱ级Wip1阳性率高(P<0.01);PCNA表达阳性较 PCNA表达阴性Wip1阳性率高(P<0.05);p53表达阴性较p53表达阳性Wip1阳性率高(P<0.05)。见表1,图2。
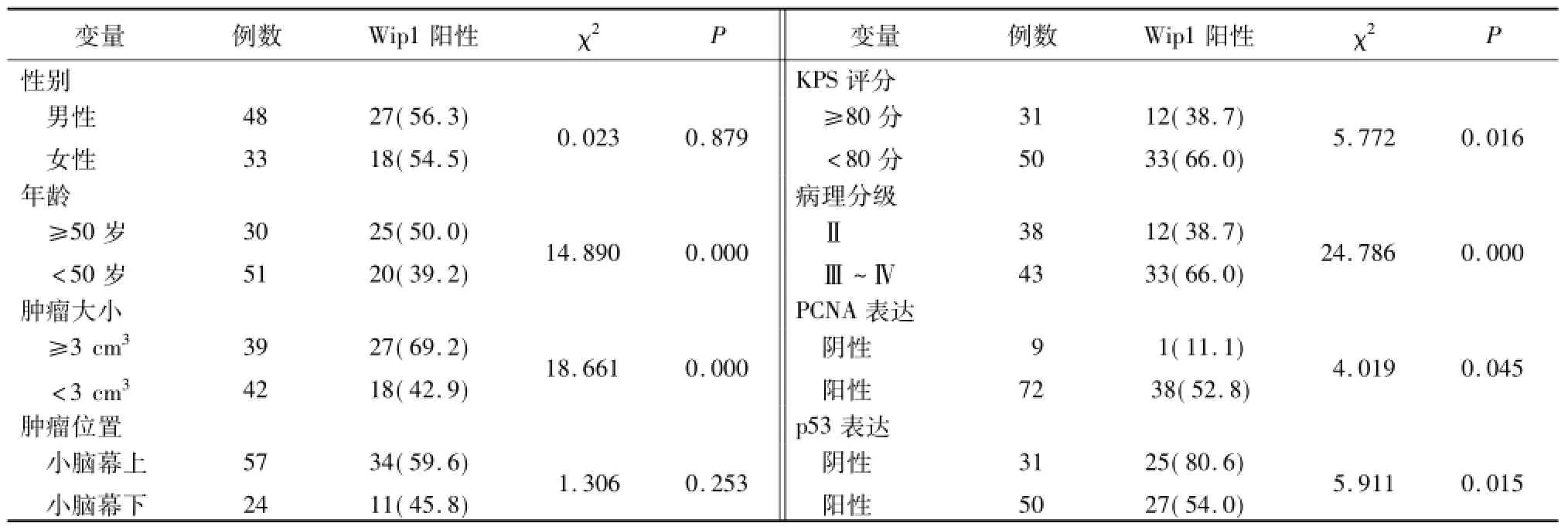
表1 W ip1在人脑胶质瘤各变量中的表达Table 1 Relationship of Wip1 and clinicopathological characteristics in glioma patients (例数,%)
2.3 相关性分析 非参数Spearman等级相关性分析检验显示Wip1与PCNA表达存在相关性(rs= 0.639,P<0.01)。
2.4 Cox回归模型分析 对入组的胶质瘤患者自术后6~12个月开始进行随访,应用 Kaplan-Meier生存曲线分析得出:在低级别脑胶质细胞瘤中Wip1阳性表达组生存率低于 Wip1阴性表达组(χ2= 4.260,P<0.05);在高级别脑胶质瘤中Wip1阳性表达组生存率也低于 Wip1阴性表达组(χ2= 14.640,P<0.01)。进一步行Cox回归模型分析显示低KPS评分、高Wip1表达、高病理分级是患者预后差的危险因素(均P<0.05),见表2,3。

表2 Cox回归赋值Table 2 Cox regression assignment
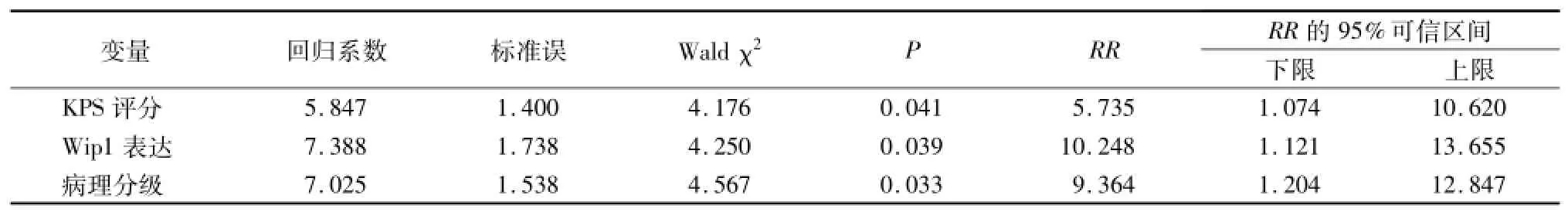
表3 Cox回归模型分析Tab le 3 Cox regression model
3 讨 论
Wip1存在于细胞核内,是一种均一核内蛋白,由PPM1D基因编码,位于人染色体17q23,蛋白质相对分子质量为61 000。Wip1在正常小鼠细胞生长发育过程中,起重要调控作用,通过半定量反转录聚合酶链反应方法和蛋白印迹技术检测到小鼠胚胎及成体鼠体内任何组织都有Wip1 mRNA的表达,尤其在睾丸中表达最高,并证实Wip1 mRNA在小鼠胚胎期组织内表达量较成体明显增高,这提示Wip1基因在细胞减数分裂和胚芽分化过程中具有重要作用。Wip1基因缺失对各种鼠肿瘤模型的形成均有抑制作用,其中包括肠息肉和B细胞淋巴瘤在内的自发性肿瘤[10]。然而,高表达的Wip1能促使成纤维细胞转化和加速转基因小鼠肿瘤生长[11]。
本研究结果表明,Wip1在人脑胶质瘤组织中的表达高于正常脑组织中的表达,并且随胶质瘤病理级别的增高Wip1表达呈高表达。然而,同级别但不同类型的脑胶质细胞瘤之间Wip1阳性表达却未发现差异,推测Wip1表达与胶质瘤肿瘤细胞分化、发生发展密切相关。此外,我们发现Wip1高表达患者平均生存期短于Wip1阴性表达患者,Cox回归分析显示Wip1高表达是导致胶质瘤患者平均生存期缩短的高危风险因素。
抑制肿瘤细胞增殖调控蛋白、活化肿瘤抑制蛋白和诱导肿瘤细胞凋亡是当前肿瘤生物治疗的基本策略。Wip1在促进肿瘤细胞增殖方面,与其他原癌基因存在相互协同作用,能促使成纤维细胞转化和加速转基因小鼠肿瘤生长[12-13]。相反,Wip1基因敲除的小鼠能够对肿瘤产生抵抗,甚至在Wip1基因敲除的荷瘤小鼠体内肿瘤生长速度明显减缓[14]。尽管目前对Wip1促进肿瘤生长的原因尚不明确,我们推测它可能通过某些通路促进肿瘤细胞增殖,依据实验研究结果能够得出,Wip1阳性表达组肿瘤组织体积大于Wip1阴性表达组,这种现象存在于高级别和低级别胶质细胞瘤组织中;PCNA在正常脑组织中不表达,可作为细胞周期内源性组织标记物,反映肿瘤细胞增殖活性指标,对分析判断胶质瘤增殖、分化及预后具有重要意义[15]。因此,我们选取PCNA作为研究对象,对Wip1促进肿瘤细胞增殖的可能机制进行了初步研究,结果显示Wip1高表达的胶质细胞瘤组织中PCNA表达明显增高,据此,我们可以推测Wip1对脑胶质细胞瘤的促进作用可能是通过促进肿瘤细胞增殖作用实现的。然而,Wip1在胶质细胞瘤生长、增殖中最终所扮演的角色仅仅依靠组织学数据并不能够说明问题,而是需要进一步通过细胞功能试验或动物体内实验验证Wip1对胶质瘤细胞增殖及侵袭的作用。(本文图见封二)
[1] Lu X,Nannenga B,Donehower LA,et al.PPM1D dephosphorylates Chk1 and p53 and abrogates cell cycle check points[J].Genes Dev,2005,19(10):1162-1174.
[2] Saito-Ohara F,Imoto I,Inoue J,et al.PPM1D is a potential target for17q gain in neuroblastoma[J].Cancer Res,2003,63(8): 1876-1883.
[3] Li J,Yang Y,Peng Y,et al.Oncogenic properties of PPM1D located within a breast cancer amplification epiccenter at 17q23[J].Nat Genet,2002,31(2):133-134.
[4] Hirasawa A,Saito-Ohara F,Inoue J,et al.Association of 17q21-q24 gain in ovarian clear cell adenocarcinomas with poor prognosis and identification of PPM1D and APPBP2 as likely amplification targets[J].Clin Cancer Res,2003,9(6):1995-2004.
[5] Mendrzyk F,Radlwimmer B,Joos S,et al.Genomic and protein expression profiling identifies CDK6 as novel independent prognostic marker in medulloblastoma[J].J Clin Oncol,2005,23 (34):8853-8862.
[6] Rauta J,Alarmo EL,Kauraniemi P,et al.The serine-threonine protein phosphatease PPM1D is frequently activated through amplification in aggressive primary breast tumours[J].Breast Cancer Res Treat,2006,95(3):257-263.
[7] Fuku T,Semba S,Yutori H,et al.Increased wild-type p53-induced phosphatase 1(Wip1 or PPM1D)expression correlated with downregulation of checkpoint kinase 2 in human gastric carcinoma[J].Pathology International,2007,57(9):566-571.
[8] Hu W,Feng Z,Modical I,et al.Gene amplifications in welldifferentiated Pancreatic Neuroendocrine Tumors Inactivate the p53 Pathway[J].Genes Cancer,2010,1(4):360-368.
[9] Seoane M,Iglesias P,Gonzalez T,et al.Retinoblastoma loss modulates DNA damage response favoring tumor progression[J].Plos One,2008,3(11):e3632.
[10] Demidov ON,Timofeev O,Lwin HN,et al.W ip1 phosphatase regulates p53-dependent apoptosis of stem cells and tumorigenesis in the mouse intestine[J].Cell Stem Cell,2007,1(2):180-190.
[11] Demidov ON,Kek C,Shreeram S,et al.The role of the MKK6/ p38 MAPK pathway in Wip1-dependent regulation of ErbB2-driven mammary gland tumorigenesis[J].Oncogene,2007,26 (17):2502-2506.
[12] Bulavin DV,Demidov ON,Saito S,et al.Amplification of PPM1D in human tumors abrogates p53 tumor-suppressor activity[J].Nat Genet,2002,31(2):210-215.
[13] Hirasawa A,Saito-Ohara F,Inoue J,et al.Association of 17q21-q24 gain in ovarian clear cell adenocarcinomas with poor prognosis and identification of PPM1D and APPBP2 as likely amplification targets[J].Clin Cancer Res,2003,9(6):1995-2004.
[14] Castellino RC,De Bortoli M,Lu X,et al.Medulloblastomas overexpress the p53-inactivating oncogene WIP1/PPM1D[J].J Neurooncol,2008,86(3):245-256.
[15] Marinovic J,Ljubkovic M,Stadnicka A,et al.Role of sarcolemmal ATP-sensitive potassium channel in oxidative stress induced apoptosis:mitochondrial connection[J].Am JPhysiol Heart Circ Physiol,2008,294(3):1317-1325.
(本文编辑:许卓文)
Overexpression of wild-type p53-induced phosphatase 1 relates poor prognosis of glioma patients
LIANG Chao-hui,HU Fu-guang,ZHAO Lin,WANG Li-qun,JIAO Bao-hua*
( Department of Neurosurgery,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China)
Objective To explore whether wild-type p53-induced phosphatase 1(Wip1)relates with poor prognosis of patients with glioma.MethodsThe expression of Wip 1 in the brain tissue was examined using immunohistochemistry method in different grades of primary glioma(81 cases)and normal brain tissues(15 cases).Analysis was made on the relationships between Wip1-positive patients and various clinicopathological characteristics including the gender,age,glioma pathological grade,tumor size,location,PCNA expression,p53 expression and Karnofsky performance status(KPS)score at the time of surgery.For survival analysis,we used the Kaplan-Meier method.ResultsThe expression of Wip1 in glioma samples was higher than that of normal brain tissues 55.6%(45/81)vs0.0%(0/15)(χ2=15.686,P<0.01).The survival rate of the glioma patients with positive Wip1 expression was significantly lower than that of the glioma patients with negative Wip1 expression.Wip1 was associated with the glioma pathological grade.The Wip1 expression was positive correlated with PCNA expression,Lower KPS score,Wip1 positive expression and higher pathology classification were risks for poor prognosis of glioma patients.ConclusionWip1 overexpression in brain glioma tissues was significantly associated with poor survival of glioma patients.
R739.4
A
1007-3205(2015)03-0273-04
2014-09-05;
2014-11-10
河北省医学科学研究重点课题(20120065)
梁朝辉(1979-),男,河北平乡人,河北医科大学第二医院副主任医师,医学博士,从事脑胶质瘤诊治研究。
*通讯作者。E-mail:jiaobh2000@163.com
10.3969/j.issn.1007-3205.2015.03.008
