葛根素影响雌激素受体α启动子甲基化调控成骨细胞增殖分化的研究
2015-12-28吕海宏汤旭磊傅松波
吕海宏,汤旭磊,傅松波
(兰州大学第一医院内分泌科,甘肃 兰州 730000)
·论著·
葛根素影响雌激素受体α启动子甲基化调控成骨细胞增殖分化的研究
吕海宏,汤旭磊,傅松波
(兰州大学第一医院内分泌科,甘肃 兰州 730000)
[摘要]目的探究葛根素对大鼠成骨细胞代谢调控的途径,为绝经后骨质疏松治疗提供理论依据。方法取新生SD大鼠的颅骨,胶原酶法培养成骨细胞,分别加入不同浓度(5、10、25、50、100 μmol/L)葛根素分组培养,应用巢式甲基敏感性聚合酶链反应方法观察雌激素受体α(estrogen receptor α,ERα)启动子A区甲基化,反转录-聚合酶链反应方法观察ERα mRNA表达,MTT法和对硝基苯磷酸酯方法观察体外培养成骨细胞的增殖及碱性磷酸酶活性。结果随着葛根素浓度增加,ERα 基因启动子甲基化程度逐渐减弱;同时发现细胞中ERα mRNA表达逐渐增强,25 μmol/L葛根素浓度时表达最强(P<0.01)。葛根素能刺激成骨细胞增殖,提高碱性磷酸酶活性(P<0.01)。结论葛根素抑制ERα启动子甲基化及增加ERα mRNA表达,可能通过此途径促进成骨细胞增殖分化。
[关键词]成骨细胞;葛根素;DNA甲基化;雌激素受体α
doi:10.3969/j.issn.1007-3205.2015.04.005
绝经后骨质疏松是临床常见的流行病,具有很高的患病率和骨折导致的致残率。研究认为骨质疏松的发病机制主要是由于骨重建失衡导致此病发生,绝经后妇女骨吸收能力明显大于骨形成,造成骨重建失衡,因此主导骨重建的成骨细胞和破骨细胞的调控受到更多重视。体内外骨质疏松模型相关研究表明雌激素受体α(estrogen receptor α,ERα)与成骨细胞的增殖分化有关[1]。葛根素是结构及生物活性均类似于雌激素的非甾体类化合物,为杂环多酚类化合物,可以与雌激素受体结合,具有弱雌激素活性,但葛根素对成骨细胞代谢调控的具体机制目前并不十分清楚。本研究旨在探讨葛根素与ERα甲基化的关系以及对成骨细胞增殖分化的调控,报告如下。
1资料与方法
1.1原代成骨细胞培养及处理取新生(<24 h)SD大鼠,清洗,乙醇浸泡10 min,取颅盖骨,PBS冲洗3遍,剪碎头盖骨。移入10 mL0.25%胰蛋白酶溶液,5 mLⅡ型胶原酶溶液,依次振荡消化,弃上清液。沉淀细胞团块用DMEM/F12液冲洗并悬浮于培养液中。细胞悬液混匀以1×106/mL密度接种于50 mL培养瓶培养、换液,传代培养备用。实验前PBS冲洗,接种细胞于培养板上,然后加入无血清的DMEM/F12,分别加入0、5、10、25、50、100 μmol/L不同浓度葛根素分组培养。
1.2实验仪器及试剂CO2恒温培养箱和低温离心机(德国Heraeus);SPECORD 40紫外分光光度仪(英国analyticjena公司);倒置相差显微镜(日本OLYMPUS公司);PCR仪(Eppendorf公司生产);紫外凝胶成像仪(美国Thermo Forma公司生产)。Puerarin、Biozol及TRIZOL试剂(Sigma-Aldrich);ZR Genomic DNA 成套试剂盒、DNA 片段恢复成套试剂盒及RT-PCR试剂盒(Tiangen Biotech Company);PNPP、亚硫酸氢钠、Triton X-100、Tris-HCl、1%茜素红及2%碱性磷酸酶等试剂(Sino-American Biotechnology Company)。
1.3方法
1.3.1培养细胞染色鉴定①茜素红染色法: PBS冲洗成骨细胞2遍,然后用95%酒精固定10 min,1%茜素红(pH 4.2)染色,PBS冲洗观察。②碱性磷酸酶染色法: PBS冲洗成骨细胞2遍,95%酒精固定10 min,2%碱性磷酸酶(pH 8.2)染色,PBS冲洗观察。
1.3.2DNA提取培养传代细胞中加入不同浓度葛根素进行培养,按照DNA提取试剂盒说明书常规操作进行成骨细胞基因组DNA的提取。
1.3.3亚硫酸盐修饰和DNA恢复①将DNA浓度稀释为20 μg/μL,取10 μL DNA加入50 mL双脱水,5.5 mL3 mmol/L氢氧化钠,混匀后孵育42 ℃30 min,使DNA充分溶解变性。②每个试管分别依次加入对苯二酚、3 mmol/L亚硫酸氢钠(NaHSO3)(pH 5.0),混匀,低温离心,按照说明书指示将经过上述处理的DNA脱盐,异丙醇冲洗样品,加入50 mL37 ℃热水恒温箱进行温育,低速离心1 min。③再将10 mol/L NaAc(pH 5.2)和无水乙醇加入试管混匀,离心,弃溶液,留白色沉淀。DNA沉淀用-20 ℃预冷的70%酒精反复冲洗后过夜,真空干燥,用20 mL水溶解沉淀。洗脱的DNA样品立即储存在-20 ℃备用。
1.3.4体外培养细胞ERα启动子甲基化测定①巢式甲基化特异性PCR(nested methylation-specific polymerase chain reaction,nMS-PCR)引物设计:根据Genebank中查询到的登录号为AY425004的ERα基因DNA序列,设计nMS-PCR的内外引物。nMS-PCR法包括两步PCR反应,第一步PCR使用的是不含任何CG序列的外侧引物,第二步PCR使用的内侧引物,其中ERα的内侧引物位于ERα基因序列的启动子区,共包含有8个CG序列,引物由上海生物工程公司合成,见表1。②nMS-PCR方法:应用Touchdown(TD) PCR方法扩增,按照试剂盒第一轮25 μL PCR反应体系加入试剂,ER-pN 20 μmol/L 0.3 μL,DNA 2 μL,2×Taq PCR Mastermix 6.3 μL,15 mmol/L的Tris-HCl(pH 8.0),25 mmol/L KCl,2.5 mmol/L MgCl2,250 μmol/L 4种dNTP,1 μL上、下游引物,3 μL DNA模板,加入25 μL蒸馏水。第二轮PCR反应DNA模板应用第一轮PCR扩增产物。随着热启动,样品应用Touchdown(TD) PCR方法进行20轮的扩增。

表1 ERα 的nMS-PCR引物Table 1 nMS-PCR primer of ER-α
1.3.5RT-PCR法检测ERα mRNA表达(1)RNA提取:培养传代细胞加入不同浓度葛根素进行培养,取生长状态良好的细胞,PBS冲洗2遍,加入1 mL TRIZOL,采用氯仿提取、异丙醇沉淀、75%乙醇洗涤、DEPC溶解RNA。详细过程按照TRIZOL说明进行,紫外分光光度计测量总RNA浓度,以保证cDNA合成时模板量一致。按Invitrogen公司RNA分离试剂盒说明书进行操作,提取RNA备用。(2)cDNA制备:总RNA经鉴定纯度和浓度符合要求后,用于制备cDNA。①加入1~2 μg总RNA和1 μL50 pmol/L Oligo(dT)18 primer至经过焦炭酸二乙酯(diethypyrocarbonate,DEPC)处理后的EP管中,再加入DEPC水,使体积总量至12 μL。②依次加入下列试剂混合离心,4 μL5×RT Buffer,1 μL RNase Inhibitor(10 U/mL),2 μL dNTP Mixture(10 mmol/L),1 μL ReverTra Ace。所得产物用于PCR扩增或置于-20 ℃保存。(3)PCR扩增目标cDNA:① 引物设计 根据Genebank中查询到的登录号NM000125的ERα基因mRNA序列,使用primer 5.0软件设计引物序列如下,GADPH管家基因用做内参照,引物由上海生物工程技术公司合成。ERα引物序列为5′-CCCTTG-CTATGTTACTAAGCGTGAGTGCC ATAGGA-ATACAAGAGGGTGCT-3′;ERα forward:5′-AG-CACCCTGAAGTCTCTGGA-3′;ERα reverse:5′-GATGTGGGAGAGGATGAGGA-3′。②PCR反应体系组分25 μL PCR反应体系包括Taq Polymerase,4种dNTP,Tris-HCl(pH8.3),50 mmol/L KC1,1.5 mmol/L MgCl2,1 μL上下游引物,3 μL cDNA模板。③ PCR反应 预变性94 ℃3 min后;变性94 ℃,退火61 ℃,延伸72 ℃各进行45 s 30个循环;最后终延伸72 ℃5 min结束。④反应产物的琼脂糖凝胶电泳分析 取出5 μL PCR反应产物,混合1 μL 6×琼脂糖凝胶电泳加样缓冲液,上样于0.5 ×TBE缓冲液配制的l%琼脂糖凝胶中,在0.5×TBE缓冲液中90V电泳45 min,紫外分析仪下观察结果,凝胶成像分析系统中分析PCR结果。
1.3.6MTT法培养成骨细胞0.25%胰蛋白酶消化后传代,相同细胞密度(2×103/孔)接种于96孔培养板,常规培养48 h,细胞汇合90%,加入无血清DMEM/F12,依次加入5、10、25、50、100 μmol/L葛根素作用72 h。PBS冲洗,每孔加入10 μL0.5%MTT,孵育3 h,加100 μL 10%SDS,酶标仪上波长570 nm处,测定吸光度值(A)。细胞量与MTT吸光度值正相关。成骨细胞增殖促进率=(A干预组-A对照组)/A对照组×100%。
1.3.7碱性磷酸酶(alkaline phosphatase,ALP)活性测定用0.25%胰蛋白酶溶液消化半汇合成骨细胞,相同细胞密度(2×103/孔)接种于96孔培养板,常规培养48 h,细胞汇合90%,加入无血清DMEM/F12溶液,然后分别依次加入5、10、25、50、100 μmol/L葛根素作用72 h后p-NPP法测定。取培养液10 μL于96孔板,加p-NPP-DEA溶液90 μL,37 ℃水浴20 min,终止反应。酶标仪上波长405 nm处,测定吸光度值(A)。通过样品A值在ALP标准曲线上读取酶活性值(U/L)。成骨细胞分化促进率=(Z干预组ALP-Z对照组ALP)/Z对照组ALP×100%。
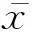
2结果
2.1培养细胞的鉴定
2.1.1活体细胞观察倒置相差显微镜下,刚接种细胞呈球形,24 h后存活细胞基本贴壁,展开后细胞形态不规则,多呈三角形、多角形,有较多突起,单核呈卵圆形,含1~3个核仁,胞浆丰富。传代培养,生长期细胞分裂相多见,突起互相连接,细胞重叠生长,呈铺路石状。细胞形态呈现梭形、多角形等多种形态(图1)。
2.1.2ALP染色ALP为成骨细胞系合成分泌的标志性功能酶。分化成熟、功能活跃的成骨细胞质中ALP组织化学染色呈阳性反应。应用偶氮偶联法染色,酶活性部位与偶氮染料形成不溶性蓝色沉淀(图2)。
2.1.3矿化结节茜素红染色成骨细胞具有体外矿化的功能特征,细胞传代培养,出现重叠生长,其间可见白色不透光圆形的矿化结节。茜素红染色法矿化结节染色呈红色,显示成骨细胞的矿化结节(图3)。

图1 汇合状OB(×100)Figure 1 Confluence of OB(×100)

图2 OB ALP染色(×100)Figure 2 ALP dyeing of OB(×100)

图3 OB矿化结节染色(×40)Figure 3 Mineral nodules dyeing of OB(×40)
2.2葛根素对细胞ERα启动子A区甲基化的影响不同浓度葛根素处理传代成骨细胞8 d后,ERα启动子甲基化状态的结果显示,随着剂量增加,基因启动子A 区甲基化程度逐渐减弱,25 μmol/L葛根素浓度时表达最弱,此后增加浓度无明显减弱。随着葛根素浓度逐渐增加(5、10、25、50、100 μmol/L),甲基化条带变得越来越弱,25 μmol/L葛根素浓度时表达最弱;未甲基化条带变得越来越强,成骨细胞25 μmol/L葛根素浓度培养时表达最强(图4)。

图4 葛根素干预成骨细胞后ERα启动子A区甲基化状态U:引物ER-pU的DNA序列中,经NaHSO3处理后未甲基化胞嘧啶被修饰为胸腺嘧啶的未甲基化PCR 条带;M: 甲基化胞嘧啶经NaHSO3处理后未被修饰,DNA序列仍是胞嘧啶的甲基化PCR条带
Figure 4The methylation status of ERa in cells treated by different concentrations of puerarin
2.3甲基化水平对细胞ERα mRNA表达的影响为明确ERα基因启动子甲基化程度与ERα mRNA表达水平是否有相关性。应用半定量 RT-PCR 方法检测成骨细胞中ERα mRNA的表达,细胞用不同浓度梯度葛根素处理12 d后进行检测。发现随着葛根素浓度增加,ERα 基因启动子甲基化程度逐渐减弱;同时也发现随着浓度增加,细胞中ERα mRNA表达逐渐增强,25 μmol/L葛根素浓度时表达最强。见图5、表2。

图5 葛根素处理后成骨细胞ERα mRNA表达Figure 5 The expressions of ERα mRNA in cells treated by different concentrations of puerarin
2.4葛根素对细胞增殖的影响MTT法测定成骨细胞增殖促进率,随着葛根素浓度增加,成骨细胞的细胞增殖呈现显著增加,25 μmol/L浓度培养最强,此后随浓度增加,未再进一步增加,并呈现下降趋势,见表2。
2.5葛根素对细胞分化的影响p-NPP法测定细胞中碱性磷酸酶活性的绝对值与细胞量的比值来分析细胞分化能力,了解葛根素对成骨细胞分化的作用。成骨细胞分别加入0、5、10、25、50、100 μmol/L葛根素培养72 h,成骨细胞ALP活性随着葛根素浓度增加,成骨细胞分化促进率明显增加,25 μmol/L葛根素浓度培养时最强,此后增加浓度时,细胞分化促进率未再进一步增加,见表2。
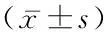
表2 葛根素处理后成骨细胞ALP活性、增殖促进率和ERα/GAPDH比值Table 2 ALP activity,cells proliferation and ERα/GAPDH on osteoblasts treated by puerarin
*P<0.05与对照组比较#P<0.01对照组比较(Dunntt检验)
3讨论
雌激素缺乏是绝经后骨质疏松的主要原因,雌激素替代疗法能有效地预防绝经后骨质疏松症的发生。但应用雌激素替代治疗也引发了某些安全问题,长期单独使用雌激素导致子宫内膜癌、乳腺癌及血栓栓塞性疾病发生率升高[2]。葛根素是从中药葛根中提取的单体化合物,是葛根的主要有效成分之一,其化学名为4,7-二羟基8-D吡喃葡萄糖醛基异黄酮,相对分子质量为 416,属于植物雌激素,具有雌激素样活性,而不良反应却较少[3]。
研究发现ERα存在于多种细胞中,包括成骨细胞膜或细胞质中,如果雌激素结合ERα,通过核内ER经典基因组效应,雌激素与ER结合后受体发生空间构象改变而形成二聚体,从而暴露DNA结合区使特异DNA序列与之结合,即靶基因调节区的雌激素效应元件(estrogen response element,ERE)与之结合,并募集辅助因子形成转录启始复合物而启动基因转录,将会激发一系列效应,调控细胞信号转导和多种细胞活动,促使细胞的增殖和分化[4-7]。随着甲基化检测手段的进展,DNA甲基化逐渐成为表观遗传学领域的一个研究热点,DNA甲基化抑制基因表达,而去甲基化增强基因表达。研究表明雌激素增强ERα基因表达,并与DNA甲基化有关。Penolazzi等[8]研究原代成骨细胞和骨髓来源MG-63 、SaOS-2细胞系ERα基因表达与ERα中F区启动子内CpG岛的甲基化,定量RT-PCR分析认为ERα中F区启动子内CpG岛的甲基化控制ERα基因转录,直接或间接影响其在特定组织基因表达。Dansranjavin 等[9]研究发现BMSC成骨表型基因呈高甲基化状态,而RT-PCR法检测OC、OPN、OSX、Runx2 mRNA表达呈阴性。
葛根素等植物雌激素防治骨质疏松的报道越来越引起人们重视,葛根素不仅抑制骨吸收,而且促使骨形成。一方面是通过影响碱性磷酸酶的活性,促进成骨细胞的分化;另一方面是通过雌激素受体介导促进成骨细胞增殖的骨形成效应[10]。葛根素与雌激素结构类似,研究葛根素对成骨细胞ERα启动子内CpG岛甲基化的影响,及其与成骨细胞ERα表达的关系,有助于我们更清楚葛根素调控成骨细胞代谢的关键环节。
本研究结果显示随着葛根素浓度梯度增加,成骨细胞 ERα启动子A 区甲基化程度逐渐减弱,25 μmol/L葛根素浓度时表达最弱,此后未进一步减弱;同时成骨细胞ERα mRNA表达增加,有明显的剂量依赖性,25 μmol/L葛根素浓度组达到峰值,此后随着浓度增加,细胞ERα表达未见明显增加。本研究结果也显示葛根素增加成骨细胞增殖分化,25 μmol/L葛根素组浓度最高,此后随着浓度增加呈现下降趋势;葛根素浓度太低(<5 μmol/L)时,细胞增殖分化不明显;达到适合浓度后(25 μmol/L)显著增强;但是浓度太高(>25 μmol/L)时,成骨细胞增殖分化有减弱趋势,这可能为葛根素毒性作用损伤细胞所致,仍需要进一步研究。
综上所述,葛根素达到适合浓度后可能通过抑制成骨细胞 ERα启动子A 区甲基化水平,增强细胞ERα mRNA表达,进而促使成骨细胞增殖分化。因此,葛根素可能将是绝经后骨质疏松治疗的一种有效药物,并且与雌激素相比,它的不良反应明显较少,有利于绝经后骨质疏松的长期治疗。
[参考文献]
[1]Galea GL,Meakin LB,Sugiyama T,et al.Estrogen receptor α mediates proliferation of osteoblastic cells stimulated by estrogen and mechanical strain,but their acute down-regulation of the Wnt antagonist Sost is mediated by estrogen receptor β[J].J Biol Chem,2013,288(13):9035-9048.
[2]Fuhrman BJ,Schairer C,Gail MH,et al.Estrogen metabolism and risk of breast cancer in postmenopausal women[J].J Natl Cancer Inst,2012,104(4):326-339.
[3]Udomsuk L,Chatuphonprasert W,Monthakantirat O,et al.Impact of Pueraria candollei var.mirifica and its potent phytoestrogen miroestrol on expression of bone-specific genes in ovariectomized mice[J].Fitoterapia,2012,83(8):1687-1692.
[4]Chen FP,Hu CH,Wang KC.Estrogen modulates osteogenic activity and estrogen receptor mRNA in mesenchymal stem cells of women[J].Climacteric,2013,16(1):154-160.
[5]Zaman G,Jessop HL,Muzylak M,et al.Osteocytes use estrogen receptor alpha to respond to strain but their ERalpha content is regulated by estrogen[J].J Bone Miner Res,2006,21(8):1297-1306.
[6]Almeida M,Iyer S,Martin-Millan M,et al.Estrogen receptor-α signaling in osteoblast progenitors stimulates cortical bone accrual[J].J Clin Invest,2013,123(1):394-404.
[7]Almeida M,Martin-Millan M,Ambrogini E,et al.Estrogens attenuate oxidative stress and the differentiation and apoptosis of osteoblasts by DNA-binding-independent actions of the ERalpha[J].J Bone Miner Res,2010,25(4):769-781.
[8]Penolazzi L,Lambertini E,Giordano S,et al.Methylation analysis of the promoter F of estrogen receptor alpha gene: effects on the level of transcription on human osteoblastic cells[J].J Steroid Biochem Mol Biol,2004,91(1/2):1-9.
[9]Dansranjavin T,Krehl S,Mueller T,et al.The role of promoter CpG methylation in the epigenetic control of stem cell related genes during differentiation[J].Cell Cycle,2009,8(6):916-924.
[10]Lagari VS,Levis S.Phytoestrogens in the prevention of postmenopausal bone loss[J].J Clin Densitom,2013,16(4):445-449. GL,Meakin LB,Sugiyama T,et al.Estrogen receptor α mediates proliferation of osteoblastic cells stimulated by estrogen and mechanical strain,but their acute down-regulation of the Wnt antagonist Sost is mediated by estrogen receptor β[J].J Biol Chem,2013,288(13):9035-9048.
(本文编辑:许卓文)
[收稿日期]2014-12-19;[修回日期]2015-01-06
[基金项目]甘肃省中医药管理局科研课题(GZK-2013-26)
[作者简介]吕海宏(1969-),男,陕西西安人,兰州大学第一医院副主任医师,医学博士,从事骨质疏松疾病诊治研究。
[中图分类号]R735.7
[文献标志码]A
[文章编号]1007-3205(2015)04-0385-06
Puerarin reduces methylation of estrogen receptor α promoter in osteoblasts and regulates its proliferation and osteoblastic differentiation
LV Hai-hong,TANG Xu-lei,FU Song-bo
(Department of Endocrinology,the First Hospital of Lanzhou University,Lanzhou 730000,China)
[Abstract]ObjectiveThe study shows that puerarin regulates pathway of metabolism in osteoblasts and provides the theoretical foundation for treating methods of postmenopausal osteoporosis.MethodsCulture of primary calvarial osteoblasts in rats were digested,and used in experiments.Then,the cells were treated with different concentrations of puerarin(5,10,25,50,100 μmol/L) in different groups,respectively.The methylation status of CpG islands in estrogen receptor α(ERα) gene promoter region of genome DNA was analyzed by nested-methylation-specific PCR;ER-α gene mRNA expression was examined by semiquantitative reverse transcription PCR analysis.The proliferation and viability of osteoblasts were assayed by MTT assay using the spectrophotometric method.Furthermore,the differentiation of osteoblast-like cells by p-nitrophenyl phosphate were identified.ResultsThe cultured osteoblasts treated by puerarin with different concentrations reduced in de novo methylation in promoter region of ERα gene with a concentration-treating manner,and a dose-dependent raising effect on osteoblasts proliferation and differentiation(P<0.01).Meanwhile,ER-α gene mRNA expressions in osteoblasts treated by puerarin with different concentrations became stronger and stronger,until in the 25 μmol/L treating group,their expressions were the stongest(P<0.01).ConclusionPuerarin reduces DNA methylation in promoter region of ERα in osteoblasts and enhences ERα gene mRNA expressions in osteoblasts.Above results possible influence its proliferation and osteoblastic differentiation.
[Key words]osteoblasts;puerarin;dna methylation;estrogen receptor α
