酶消化法分离培养原代肺动脉平滑肌细胞及免疫组化鉴定
2015-12-28,,,,,,
,, ,,,,
(1.南华大学医学院应用解剖研究所,湖南 衡阳 421001; 2.南华大学附属第一医院病理科)
·技术与方法·
酶消化法分离培养原代肺动脉平滑肌细胞及免疫组化鉴定
王爱平1,李严兵1,谢巍1,曹宇辉1,彭田红1,周小兵,龚邵新*2
(1.南华大学医学院应用解剖研究所,湖南 衡阳 421001; 2.南华大学附属第一医院病理科)
目的建立体外胶原酶消化法分离培养大鼠肺动脉平滑肌细胞(PASMCs)及免疫鉴定的方法。方法采用I型胶原酶对PASMCs进行体外培养。在无菌环境下,分离提取雄性Sprague Dawley(SD)大鼠肺动脉主干,剥离外膜、剔除内皮细胞,经酶消化法,体外培养PASMCs。倒置相差显微镜观察PASMCs生长状态及特点;台盼兰测定细胞活力;免疫细胞染色法进行平滑肌α-肌动蛋白(α-SM actin)鉴定。结果酶消化法分离培养的PASMCs 3 d后,可见细胞贴壁呈梭形生长,6 d后生长迅速呈典型的峰-谷状生长,9 d后达90%融合。通过形态学观察及免疫荧光染色法鉴定表明:培养的细胞为PASMCs;细胞存活率为98.5%;原代培养8~10 d后即可传代,3-10代细胞生长迅速、细胞形态不易发生改变,可用于进行细胞实验。结论采用I型胶原酶消化法简单易行、可靠、PASMCs生长迅速、传代周期短的特点;尤为重要的是,培养的原代PASMCs可用于肺动脉高压和肺血管重构的研究工作。
酶消化法; 大鼠肺动脉平滑肌细胞; 免疫细胞化学; SD大鼠
肺动脉高压(pulmonary arterial hypertension,PAH)是以肺血管阻力的增加和肺动脉压力持续增高为特征的进展性疾病,肺血管重构作为PAH的重要病理特征,对其机理进行深入研究有助于进一步阐述PAH的发生、发展机制[1-3]。研究表明,肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增殖和肥大引起的肺血管重构是导致PAH的关键病理因素[4,5]。由此可见,PASMCs是研究PAH发病机制和治疗药物筛选的重要手段。酶消化法是原代分离培养PASMCs的常用方法,但大多采用多种酶联合消化[8,9]。本研究采用I型胶原酶消化分离PASMCs,并结合自己培养心得加以改进,建立SD大鼠PASMCs原代培养技术,旨在为进一步研究PAH的发病机制和防治药物奠定基础。
1 材料与方法
1.1 试验动物
SPF级雄性Sprague Dawley (SD)大鼠,体重110~150 g,由南华大学实验动物学部提供。
1.2 主要试剂
DMEM培基,胎牛血清( fetal bovine serum,FBS) 、I型胶原酶粉末、青-链霉素( 双抗) 均为Hyclone产品;α-肌动蛋白单克隆抗体(α-actin) 抗体购自Abcam公司;PBS粉末购自北京鼑国生物有限公司;胰蛋白酶购自美国Sigma公司;MTS粉末购于Promega公司;鼠二步法检测试剂盒(PV-6001)、DAB显色试剂盒购自北京中杉金桥有限公司。
1.3 主要仪器
荧光倒置显微镜(日本OlympusBX-51),CO2细胞培养箱(美国Thermo公司),酶标仪检测仪(德国Beckman公司),高性能超净工作台(上海瑞仰净化装备有限公司),离心机(上海安亭科学仪器厂)。
1.4 原代细胞培养
SD 大鼠(110~150g )实验前禁食,自由进水。络合碘及75%的酒精依次消毒后,颈动脉放血处死;无菌操作下迅速分离出心肺组织,仔细剥离出肺动脉主干和左右肺动脉干,将其转移至无菌操作台中,更换器械,置于装有PBS的培养皿中,将动脉外膜纤维结缔组织剥离干净,充分漂洗之后,取出放入盛有正常培养基(为含有20%FBS的DMEM培基,双抗与培基的比例为1∶100)的剥离培养皿中;锋利眼科剪沿肺动脉干纵向剪开肺动脉,使内膜朝上,沿着内膜用解剖镊来回轻刮遍数遍,去除内膜;然后用眼科剪将中膜反复剪成碎小组织块,最后将碎块移入预先盛有含0.1%的I型胶原酶的离心管中(酶的体积为组织块体积的10~15倍);将此离心管置于CO2培养箱中,每15~20 min轻微摇动一次,密切观察其消化状态,待动脉碎块消化成透明絮状物时(消化时间大约需2~3 h),1 000 r/min离心5 min,弃上清液;向其加入5 mL含有20%FBS的DMEM培基,充分吹打混匀后转移入25 cm2的培养瓶中,置于37 ℃、5%CO2培养箱中继续培养。培养3天后开始观察,6天后可见细胞呈梭形,并呈“谷—峰状”,9天后PASMCs长满瓶底的90%,即可行传代培养。
1.5 传代培养
当细胞生长至培养瓶80%~ 90%左右融合时,往培养瓶内加入0.25%胰蛋白酶1mL消化细胞,显微镜下观察细胞,待细胞发生皱缩变圆,细胞间隙增大时,弃掉胰酶消化液,停止消化,消化时间大约为2~3 min,再加入5 mL含20%胎牛血清的DMEM培基,多次反复轻柔吹打培养瓶壁,显微镜观察贴壁细胞的漂浮情况,将适宜密度的细胞悬液分置于1~2个培养瓶,加适量20%胎牛血清DMEM培养液,置于37 ℃、5%CO2培养箱中继续培养。细胞传代至第3~11代时可用于细胞实验。
1.6 台盼兰检测PASMCs的活力
收集消化后的细胞悬液,用血细胞计数板计算细胞数。细胞悬液与0.4%台盼兰溶液以9∶1吹打混匀,3 min内吸取1滴用血细胞计数板计数活细胞及死细胞数目,评价标准:显微镜下观察,死细胞被染成蓝色,而活细胞呈无色透明状;并统计存活率[活细胞率%=活细胞总数/(活细胞总数+死细胞总数)×100%],每管细胞悬液重复3次,取平均数为结果。
1.7 培养细胞的鉴定
1.7.1 活细胞形态学观察:应用倒置相差显微镜观察细胞大小、形态及生长特点。
1.7.2 α-actin免疫组化染色鉴定:将第3代细胞接种于12孔板,培养1~ 2天后,待细胞60%融合时;PBS漂洗2遍后,用10%的多聚甲醛固定细胞20 min,PBS漂洗后,再用0.4%Triton X-100透化处理20 min。PBS漂洗,用PV-6001试剂盒中3%H2O2室温孵育10 min(已阻断内源性过氧化物酶),滴加小鼠抗大鼠α-actin一抗( 1∶100,150 μL/孔),37 ℃孵育2 h或4度冰箱过夜 ;PBS洗净后,滴加生物素标记的山羊抗小鼠IgG抗体,室温放置30 min,PBS冲洗,200 μL/孔的DAB溶液显色,苏木素复染,倒置显微镜下观察,以胞质出现棕黄色为阳性结果,同时计算阳性百分率。
2 结 果
2.1 PASMC的生长情况
消化分离的原代PASMC呈圆形,悬浮在DMEM培养液中,于培养后2天呈分散状贴壁生长;培养3天后显微镜下观察贴壁的原代PASMC生长旺盛(图1),细胞形状大致一致,成梭型,胞质伸展,聚集成团状生长,但平滑肌细胞特有的“峰~谷”状不明显;酶消化后6天原代PASMC生长快速,基本融合成单层,成丛的紧密排列镜下透明度及遮光性强(图2)。

图1 大鼠原代PASMCs(100×,原代第4天)

图2 大鼠原代PASMCs(100 ×,原代第6天)
传代后PASMC生长较快,传代后2d即可融合,PASMC呈长梭型,可观察到细胞多处区域重叠,至第3代时纯度可达98%以上。
2.2 培养细胞台盼兰染色结果
台盼蓝染色后,共计数1088个细胞,其中36个为阳性细胞,约有96.7%的细胞为阴性反应,说明培养的PASMCs存活率较高。
2.3 PASMC的免疫细胞化学染色
取第3代的PASMCs进行α-actin免疫组化染色,于高倍镜下可见胞核呈淡蓝色,卵圆形居中,胞浆染成棕黄色,高倍镜下可见胞浆内有大量棕色与细胞长轴平行的纤维细丝,阴性对照除未加一抗外,其余均相同;随机选择5个视野计数200个细胞,见4个细胞未着色,结果显示PASMC的染色阳性率为98%,表明所培养的细胞是高纯度的肺动脉平滑肌细胞(图3)。
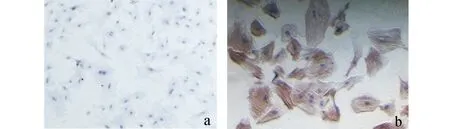
图3 大鼠原代PASMCs鉴定(100 × ) a.阴性对照;b. Alpha-smooth muscle actin 免疫组化
3 讨 论
研究结果证实,肺动脉平滑肌细胞增殖及肥大在PAH肺血管重构过程中起重要作用[6,7]。因此,进一步深入研究PASMCs在处理因素作用下的生长特点已成为目前PAH肺血管重构的攻关重点。要进行上述研究,必须首先建立肺动脉平滑肌细胞体外培养的方法。近年来,对PASMCs原代培养的研究都集中于多种酶联合消化和贴壁法[8-10],上述两种方法均有经济、方便、技术难度较低的特点,但复合胶原酶法所采用的酶数量及种类较多,较难控制消化时间,而贴块培养法则周期较长。因此,通过本人的不断探索,发现使用单一胶原酶消化法具有操作简单、分离过程短、细胞存活率高等多种优点。鉴于以上结果,本实验研究成功建立了I型胶原酶消化法来培养原代PASMCs的方法。
实验结果证明,在本研究中0.08%~0.2%范围内胶原酶的消化浓度,以0.1%的胶原酶消化效果最好,在此浓度的胶原酶消化状态下,细胞生长迅速,传代周期短。同时在研究中发现,如果原代消化下来的细胞数少,贴壁细胞之间的间隙就比较大,预示细胞生长不良。因此,消化后细胞密度对PASMCs的生长至关重要,而细胞密度的高低主要取决于胶原酶的活性、消化时间以及剪碎组织块的大小等因素。I型胶原酶的活性随存放时间延长,其活性降低,因此配制好的胶原酶应尽早使用(或-20 ℃保存可达3个月),以求最好的消化效果;消化时间是影响细胞存活能力的重要因素,消化时间过长,可导致细胞膜受损,细胞贴壁不牢,消化时间过短,细胞数量较少,细胞生长不良,因此,消化时间过长或过短都将影响分离后细胞的质量[11];组织块的大小大约为1mm3,过大或过小均将影响消化时间,导致细胞的存活率降低;另外,缩短取样过程也是提高细胞活力的一个重要因素。酶消化法与传统贴壁法比较操作简单,增加了原代培养的细胞基数和细胞存活率,传代后细胞生长速度快,重要的是细胞增殖代次减少,细胞变异较小,生理性状稳定性高。传统的组织贴片法操作相对繁琐,除延长取样时间外,还加大污染的可能性;本研究方法从处死SD大鼠到剪段肺动脉血管结束,整个取样过程在半小时内能完成,减少污染,更为重要的是用胶原酶消化细胞能在短时间内获得大量细胞的特点,尤其适用于科研。PASMCs体外培养一个典型的特征,呈典型的“谷一峰”状生长。本研究方法培养的PASMCs符合这一生长特性,因此从细胞生长特点提示,所培养细胞为PASMCs。
国内外研究证实,血管中的α-actin为细胞中六种肌动蛋白亚类之一,在血管平滑肌中特异性表达,具有收缩功能(SMCs具有收缩表型的重要标志物),为肌肉细丝及细胞骨架微丝的主要成分[12,13]。本研究采用免疫细胞组化法行培养细胞鉴定,首先我们发现培养细胞胞浆中含有典型的与长轴平行排列的细丝,细胞呈阳性反应,然而小鼠抗大鼠α-actin在血管内皮细胞和成纤维细胞中几乎不表达;其次细胞来源为所分离的肺动脉血管组织;以上符合肺血管平滑肌细胞的免疫细胞学结构特征,结果表明本研究方法培养的细胞是SD大鼠肺动脉平滑肌细胞。在传代培养过程中,细胞保持着收缩表型,具有成活率高的特性,可广泛用于PAH肺血管的重建的研究。这一方法的建立为深入研究肺动脉高压肺血管重构的机理提供了良好的研究手段。
PASMCs是心血管疾病产生的重要病理生理基础。本实验方法获取SD大鼠PASMCs方法简单、可靠,为以PASMCs作为靶细胞提供了技术方法,尤为重要的是为研究PAH肺血管重构的机理及药物筛选奠定基础。
[1] Thenappan T,Shah SJ,Rich S,et al.A USA-based registry for pulmonary arterial hypertension: 1982-2006[J].Eur Respir J,2007,30: 1103-1110.
[2] Chan SY,Loscalzo J.Pathogenic mechanisms of pulmonary arterial hypertension[J].J Mol Cell Cardiol,2008,44(1): 14-30.
[3] Macchia A1,Marchioli R,Tognoni G,et al.Systematic review of trials using vasodilators in pulmonary arterial hypertension why a new approach is needed[J].Am Heart J,2010,159(2): 245-257.
[4] Sakao S,Tatsumi K.Vascular remodeling in pulmonary arterial hypertension: multiple cancer-like pathways and possible treatment modalities[J].Int J Cardiol,2011,147(1): 4-12.
[5] Dahal BK,Cornitescu T,Tretyn A,et al.Role of epidermal growth factor inhibition in experimental pulmonary hypertension[J].Am J Respir Crit Care Med,2010,181(2): 158-167.
[6] Hall SM,Hislop AA,Wu Z,et al.Remodeling of the pulmonary arteries during recovery from pulmonary hypertension induced by neonatal hypoxia[J].J Pathol,2004,203(1): 575-583.
[7] Riley DJ,Thakker VS,Wilson FJ,et al.Role of proteolysis and apoptosis in regression of pulmonary vascular remodeling[J].Physiol Res,2000,49(5): 577-585.
[8] 钱国清,王良兴,陈婵,等.大鼠细小肺动脉平滑肌细胞原代培养和鉴定的方法研究[J].中国应用生理学杂志,2010,26(1): 125-128.
[9] 辛毅,龚达,习昕,等.酶联合消化法和贴块法分离小鼠肺动脉平滑肌细胞及其生物学特性的研究[J].中国生物工程杂志,2013,33(9): 10-16.
[10] 王静,戴爱国.原代大鼠肺动脉平滑肌细胞的提取和鉴定以及缺氧对其增殖的影响[J].中国呼吸与危重监护杂志,2012,11(2): 147-153.
[11] 来利红,壬如兴,蒋文平.酶消化法急性分离大鼠主动脉平滑肌细胞及其鉴定[J].苏州大学学报,2008,28(1): 23~25.
[12] Yao QP,Zhang P,Qi YX,et al.The role of SIRT6 in the differentiation of vascular smooth muscle cells in response to cyclic strain[J].Int J Biochem Cell Biol,2014,49C: 98-104.
[13] 候乐伟,廖明芳,翁剑锋,等.α-平滑肌肌动蛋白在人胸主动脉夹层中的表达[J].现代生物医学进展,2010,10(1): 113-114.
[14] Shen J,Yang X,Xiao WH,et al.Vasohibin is up-regulated by VEGF in the retina and suppresses VEGF receptor 2 and retinal neovascularization[J].FASEB J,2006,20(6): 723-725.
MethodsofCultureofRatPulmonaryArterySmoothMuscleCellsandIdentification
WANG Aiping,LI Yanbing,XIE Wei,et al
(Instituteofappliedanatomy,schoolofmedicine,SouthChinauniversity)
ObjectiveTo set up the methods of rat pulmonary artery smooth muscle cells (PASMCs) isolation,culture and immunological identification in vitro.MethodsThe PASMCs cultured in vitro with type I collagenase.Before the PASMCs cultured,male SD rat pulmonary trunk separated were subjected to outer membrane peel and endothelial cells remove by enzymatic digestion in a sterile environment.We observed the status and characteristics of PASMCs with inverte phase contrast microscope,determined the cell viability with trypan blue staining,and indentified the α- smooth muscle actin (α-SM actin) with immuncytochemistry staining.
ResultsThe cultured PASMCs subjected to enzymatic digestion and isolation presented shuttle shape at d 3,typical peak - valley -like growth at d6,and 90% confluence at d9.The morphological observation and immuncytochemistry staining identification showed that: the cells cultured were PASMCs; cell survival rate up to 98.5%; the primary cultures can be passaged at d8~ d10 and cells can be used for cell experiments at 3th generation to 10th for stable morphology and fast growth.ConclutionsThe method type I collagenase digestion is easy operation and reliable,the primary cultured PASMCs presented fast growt and short cell cycle can be used for pulmonary arterial hypertension and pulmonary vascular remodeling study.
Enzyme Digestion; PASMCs; SD-rat; immunocytochemistry
10.15972/j.cnki.43-1509/r.2015.01.020
2014-06-07;
2014-09-28
湖南省教育厅科研项目(13C837),湖南省科技厅项目(2014FJ3016)
*通讯作者,E-mail: sabaoth_gong@aliyun.com
R563
A
(此文编辑:秦旭平)
