PRMT2慢病毒表达载体的构建及鉴定
2015-12-28,,,,,
,,,,,
(南华大学附属第一医院临床医学研究所,湖南 衡阳 421001)
·技术与方法·
PRMT2慢病毒表达载体的构建及鉴定
钟警,杨心治,张艳敏,高海花,秦旭平,文格波*
(南华大学附属第一医院临床医学研究所,湖南 衡阳 421001)
目的构建精氨酸甲基转移酶2(PRMT2)慢病毒表达载体。方法通过PCR扩增PRMT2 cDNA,将PRMT2 cDNA连接于GV308载体,经测序确认后,将GV308/PRMT2与pHelper 1.0和pHelper 2.0共转染至293T细胞中,收获病毒,通过Real time PCR测定滴度; 将PRMT2慢病毒表达载体侵染293T细胞,通过四环素诱导和Western blot检测PRMT2慢病毒表达载体的表达能力。结果在感染PRMT2 慢病毒载体293T细胞中能检测到PRMT2-3Flag融合蛋白的表达。结论成功构建PRMT2的慢病毒表达载体。
PRMT2; 慢病毒载体; 基因治疗
乳腺癌是女性最常见的恶性肿瘤之一,其病因尚不清楚。近年来,乳腺癌的发病率呈低龄化和逐年上升趋势。研究表明,乳腺癌的发生发展与多种因素有关,其中,雌激素/雌激素受体α(estrogen/estrogen receptor α,E2/ERα)参与了乳腺癌细胞的增殖、分化及凋亡,在乳腺癌的发生发展过程中起着重要作用[1-3]。ERα在配体(雌激素)作用下形成同源二聚体,在不同的病理生理条件下,同源二聚体与不同靶基因启动子区中的雌激素反应元件(estrogen response elements,ERE)结合,并在ERα众多共调节因子作用下,激活靶基因转录[4-5]。精氨酸甲基转移酶2(protein arginine methyltransferases,PRMT2)是PRMTs家族成员之一。研究表明,PRMT2仅具有微弱的甲基转移酶活性,却能以配体依赖的形式提高ERα的转录活性,被确认为一种ERα的共调节因子[6]。PRMT2亦能提高其他核受体如雄激素受体和孕激素受体的转录活性[7]。最近的研究表明,PRMT2还可通过转录因子甲基化、组蛋白甲基化和RNA差异剪接等多种机制发挥不同的转录调节作用[7-9],并在细胞分化、炎症反应、NF-κB与瘦素信号转导途径中起着一定作用[10-12]。由此可见,PRMT2的作用是非常复杂的。前期研究表明,PRMT2基因在乳腺癌组织中的表达明显高于癌旁正常组织,在正常组织中表达于胞核,而在癌组织中则主要表达于肿瘤细胞的胞浆,因此,推测,PRMT2极有可能在肿瘤的发生发展中起重要作用。本研究将构建表达PRMT2的慢病毒载体,为阐明PRMT2在乳腺肿瘤发生的作用提供有效生物学工具。
1 材料与方法
1.1 细胞培养
293T细胞培养使用含10%胎牛血清(Gibco)、2 mmol/L glutamine 和100 U青霉素的DMEM (Hyclone,UT),在37 ℃ 5%CO2条件下进行培养。
1.2 PRMT2过表达质粒载体构建
提取293T细胞总RNA,经逆转录后PCR获得PRMT2 cDNA,引物序列如下:PRMT2-P1:5′-AAC CGT CAG ATC GCA CCG GCG CCA CCA TGG CAA CAT CAG GTG ACT G-3′,PRMT2-P2:5′-TCC TTG TAG TCC ATG AAT TCT CTC CAG ATG GGG AAG ACT T-3′,引物由捷瑞生物技术公司合成。PRMT2 cDNA经AgeI/EcoRI 双酶切后与GV308 载体(上海吉凯基因化学技术有限公司)连接。取连接产物5 μL转化Top10感受态大肠杆菌,铺琼脂平板(含50 μg/mL 氨苄青霉素),37 ℃过夜培养。次日挑取单菌落,经小量扩增,提取质粒并纯化后送上海生工生物技术公司测序鉴定。
1.3 PRMT2过表达慢病毒在293T细胞内的包装
按阳离子脂质体LipofectamineTM2000 (Invitrogen公司)试剂盒说明操作,将PRMT2过表达慢病毒表达载体质粒和pHelper 1.0与 pHelper 2.0通过共转染入293T细胞中,37 ℃孵育过夜后改换含丙酮酸钠和非必需氨基酸的DMEM完全培养基继续培养,72 h后将细胞培养基以4 ℃ 3 000 r/min离心15 min,弃沉淀,将含有慢病毒颗粒的上清液分装后,冻存于-80 ℃。
1.4 Real time定量PCR法测定病毒滴度
24孔板每孔加入500 μL培养基,接种约1 ×105个293 T细胞。次日,准备7个每管含有90 μL培养基的无菌Ep管;将待测定病毒原液10 μL加入到第一个管中,混匀后,取10 μL加入到第二个管中,继续相同操作直到最后一管。待测细胞每孔吸去90 μL培养基,分别加入稀释好的病毒溶液,将细胞放入37 ℃,5%CO2培养箱中培养24 h,加入新鲜培养基500 μL继续培养24 h后,抽提RNA进行RT-qPCR检查细胞中目的基因的拷贝数。Real time定量PCR目的基因引物序列如下:PRMT2-P3:5′-AAT TCC GTG GTG TTG TCG-3′;PRMT2-P4:5′-AAG GTC CGC TGG ATT GAG-3′。内参引物序列如下:Actin1:5′-GTG GAC ATC CGC AAA GAC-3′; Actin2:5′-AAA GGG TGT AAC GCA ACT A-3′。反应结束后得到Ct值,Ct值的含义是:每个反应管内的荧光信号到达设定阈值时所经历的循环数。
1.5 Western blot
PRMT2表达慢病毒感染293T细胞后72 h,将细胞裂解液(10 mol/L HEPES,10 mmol/L KCl,1 mmol/L EDTA,pH 8.0,0.1% NP-40,1 mmol/L DTT,1 mmol/L PMSF和0.5 mmol/L Na3VO4)置冰上预冷,30 min后制备抽提细胞蛋白。12% SDS-PAGE 胶电泳分离,转膜。5%牛奶封闭45 min后,孵育Flag 一抗(1∶3 000)1 h,而后孵育羊抗小鼠IgG(1∶4 000) 1 h。化学荧光系统( Pierce,IL)检测。
2 结 果
2.1 PRMT2 Tet-on表达载体的构建及鉴定
参照Lentiviral Expression System说明书构建PRMT2慢病毒载体,并通过测序检验(图1)。结果显示: PRMT2序列成功插入到GV308载体AgeI/EcoRI 双酶切位点,测序证实序列与实验设计的碱基序列一致。

图1 PRMT2慢病毒表达载体构建 A:GV308载体; B:载体酶切电泳(1:Marker,2:载体酶切产物,3:未酶切载体); C:PRMT2基因PCR扩增电泳图 (1:Marker,2:扩增产物);D:重组载体PCR鉴定(1,2:阴性对照,3:阳性对照,4:Marker,5~12:PRMT2 1~8号重组子)
2.2 PRMT2慢病毒载体的包装及病毒滴度测定
病毒包装质粒混合物和GV308/PRMT2重组质粒载体通过脂质体共转染293T宿主细胞48 h,收集培养基进行病毒滴度测定,结果发现,在本次滴度检测中,10-4μL组样品和Control组样品的Ct值存在显著差异,所以认为在10-4μL组样品中存在病毒颗粒。假定该组样品含有至少1个病毒颗粒,则病毒的滴度为:2.0 ×108TU/mL(图2,表1)。

图2 病毒滴度检测 Real-time PCR检测病毒滴度的荧光曲线,不同颜色曲线代表不同病毒滴度
表1不同浓度病毒感染后样品组的Ct值及表达量分析
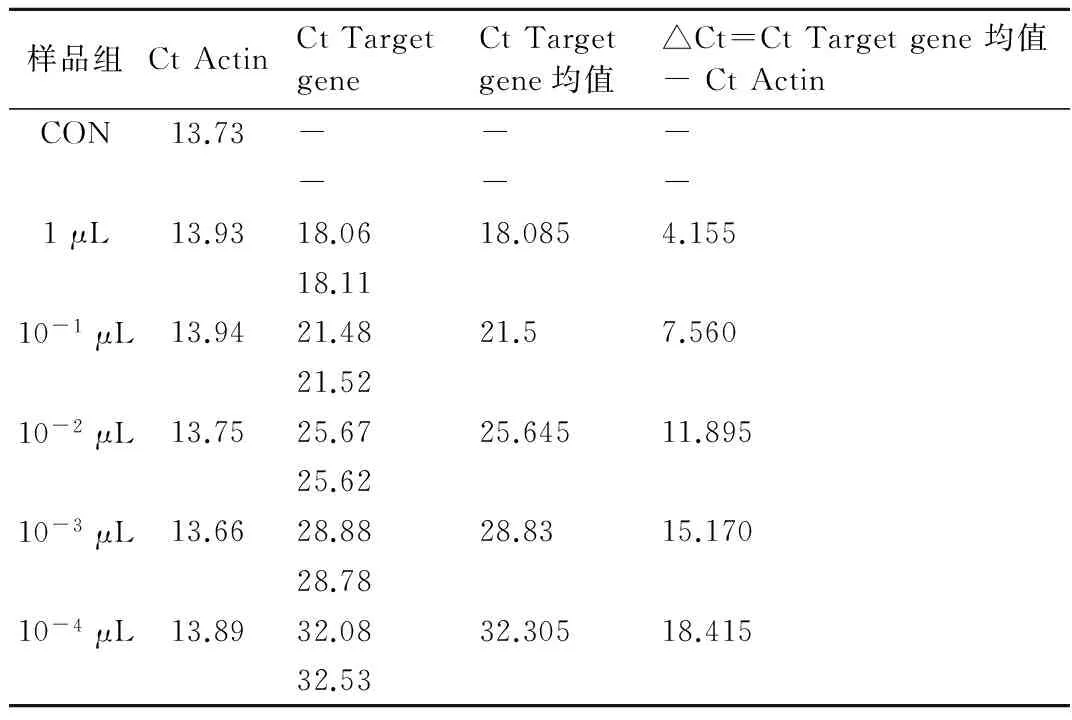
样品组CtActinCtTargetgeneCtTargetgene均值△Ct=CtTargetgene均值-CtActinCON13.73------1μL13.9318.0618.0854.15518.1110-1μL13.9421.4821.57.56021.5210-2μL13.7525.6725.64511.89525.6210-3μL13.6628.8828.8315.17028.7810-4μL13.8932.0832.30518.41532.53
Ct Actin:Actin 循环数;Ct Target gene:靶基因循环数;Ct Target gene均值:两次实验靶基因循环数的均值;△Ct=Ct Target gene 均值- Ct Actin:两次实验靶基因循环数的均值与Actin 循环数的差值。
2.3 PRMT2慢病毒载体能在293 T细胞内表达
为确认PRMT2慢病毒是否可以在细胞内表达,选用PRMT2具有较低内源性表达的293T细胞作为病毒感染模型。细胞经病毒感染72 h后,用四环素诱导PRMT2蛋白表达,显微镜观察293T 细胞形态变化,结果发现部分细胞形态逐渐演变成长梭形,纤维细胞样形态,呈现上皮-间质细胞转换(epithelial-mesenchymal transition,EMT)现象(图3)。提取总蛋白,通过Western blot检测细胞内PRMT2-3Flag融合蛋白的表达,结果表明PRMT2-3Flag在293T细胞中具有表达(图4)。
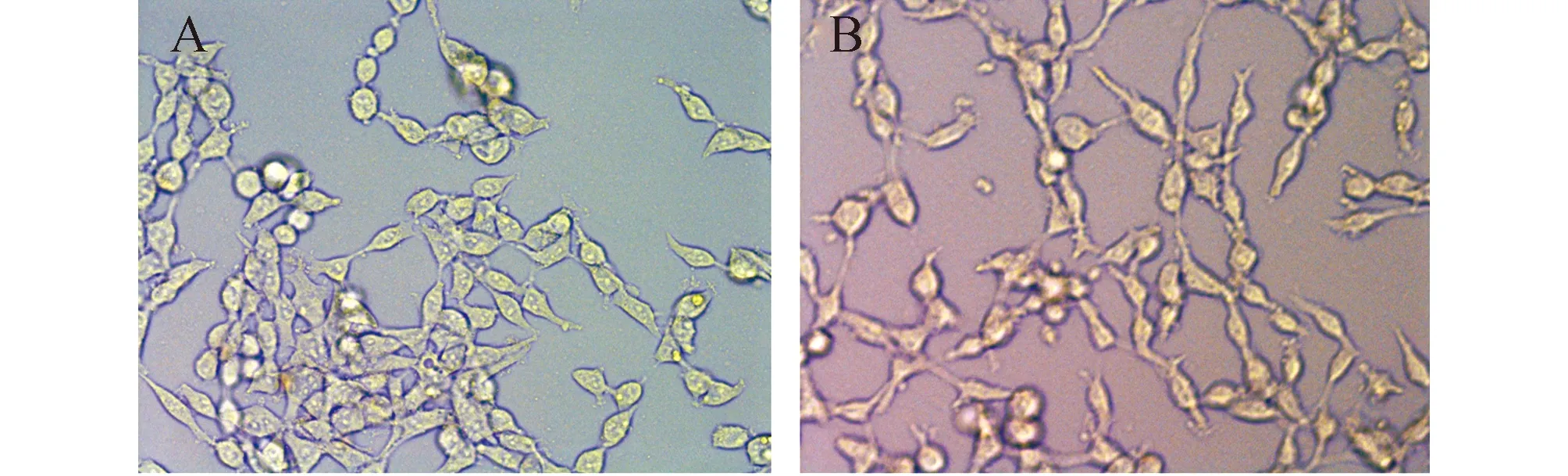
图3 四环素诱导293T细胞表达PRMT2前后细胞形态改变(200×) A:无四环素诱导; B:四环素诱导后

图4 PRMT2慢病毒表达载体在293T细胞中诱导表达PRMT2-3Flag融合蛋白 1:PRMT2慢病毒表达载体感染293T细胞,无四环素诱导;2:PRMT2慢病毒表达载体感染293T细胞,四环素诱导;3:阴性对照,293T细胞;4:阳性对照,WB标准品——SURVIVIN-3FLAG-GFP.
3 讨 论
PRMTs家族是哺乳动物细胞中常见的酶类,目前发现其有11个成员,具有不同的生物学功能[13-14]。近年的研究表明,PRMTs成员与肿瘤的生成及侵袭转移关系密切。Mathioudaki等研究表明,PRMT1的高表达与乳腺癌的进展有关[15]。Yoshimatsu等采用基因芯片检测发现,PRMT1与PRMT6参与了肺癌和膀胱癌的增殖[16]。Al-Dhaheri等的研究表明,PRMT4(Coactivator-associated arginine methyltransferase 1,CARM1)是ERα阳性乳腺癌细胞分化和增殖的重要决定因子[17]。Frietze等的研究表明,CARM1能够通过上调核转录因子E2F1而促进乳腺癌细胞的增殖[18]。
我们前期的研究结果表明,PRMT2主要表达于乳腺、甲状腺、卵巢和子宫等雌激素相关的组织器官,而在前列腺、睾丸等雄激素相关的组织器官中表达较低[19]。而且,我们采用荧光素酶双报告基因检测与免疫共沉淀技术发现,在ERα阳性乳腺癌MCF7细胞中,PRMT2能与ERα直接作用,在10nM雌激素作用下能显著提高ERα的转录活性[20]。以上结果提示PRMT2可能在E2/ERα信号传导途径中发挥着重要作用。Park等的研究表明,E2/ERα能够上调snail与slug的表达,而下调E-cadherin的表达,促进EMT的形成,诱导卵巢癌细胞的转移[21]。我们推测,PRMT2有可能通过E2/ERα介导,上调snail的表达,而下调E-cadherin的表达,促进EMT的形成,诱导乳腺癌细胞的侵袭转移。EMT是一种以上皮表型缺失和间质表型获得为主要特征的基本生理、病理现象,在胚胎发育以及细胞生长增殖中起着重要作用[22]。近年的研究表明,EMT参与了上皮性肿瘤的侵袭与转移[23]。因此,EMT分子调控机制的研究为预防肿瘤转移提供强有力的实验依据。我们成功构建了PRMT2的慢病毒表达载体,感染293T细胞后在四环素的诱导下,部分细胞形态发生了明显的间质化改变,呈现EMT现象,这提示PRMT2高表达可能促进EMT的形成,从而参与乳腺癌发生发展及转移过程,但PRMT2具体通过何种机制参与乳腺癌发生发展及转移过程还有待进一步阐明。
本实验成功构建了PRMT2的慢病毒载体,并获得了较高滴度PRMT2重组病毒,进一步实验证实在四环素诱导下,239T细胞中该重组病毒可成功被诱导表达PRMT2-3Flag融合蛋白,由于该病毒载体具有3Flag和Puromycin抗性筛选标记,PRMT2重组病毒可进一步用于细胞和动物模型的建立,为进一步构建稳定性表达PRMT2乳腺癌细胞株和获得PRMT2转基因动物模型奠定了基础,同时也为深入探索PRMT2在乳腺癌发生发展及转移过程中的作用机制提供了强有力的生物学工具。
[1] 刘英华,何宁,姜淑卿,等.雌激素相关受体α与雌激素受体α通路相关性研究[J].中华肿瘤防治杂志,2013,20(17): 1306-1309.
[2] Sayeed A,Konduri SD,Liu W,et al.Estrogen receptor alpha inhibits p53-mediated transcriptional repression: implications for the regulation of apoptosis [J].Cancer Res,2007,67(16): 7746-7755.
[3] 陆瑶,李青春,方向军,等.乳腺癌微小钙化灶与C-erbB-2、ER、PR表达的相关性[J].中南医学科学杂志,2012,40(6): 559-562.
[4] Girault I,Bieche I,Lidereau R.Role of estrogen receptor alpha transcriptional coregulators in tamoxifen resistance in breast cancer [J].Maturitas,2006,54(4): 342-351.
[5] Lupien M,Eeckhoute J,Meyer CA,et al.Coactivator function defines the active estrogen receptor alpha cistrome [J].Mol Cell Biol,2009,29(12): 3413-3423.
[6] Qi C,Chang J,Zhu Y,et al.Identification of protein arginine methyltransferase 2 as a coactivator for estrogen receptor alpha [J].J Biol Chem,2002,277(32): 28624-28630.
[7] Meyer R,Wolf SS,Obendorf M.PRMT2,a member of the protein arginine methyltransferase family,is a coactivator of the androgen receptor [J].J Steroid Biochem Mol Biol,2007,107(1-2 ): 1-14.
[8] Yoshimoto T,Boehm M,Olive M,et al.The arginine methyltransferase PRMT2 binds RB and regulates E2F function [J].Exp Cell Res,2006,312(11): 2040-2053.
[9] Blythe SA,Cha SW,Tadjuidje E,et al.beta-Catenin primes organizer gene expression by recruiting a histone H3 arginine 8 methyltransferase,Prmt2 [J].Dev Cell,2010,19(2): 220-231.
[10] Ganesh L,Yoshimoto T,Moorthy NC,et al.Protein methyltransferase 2 inhibits NF-{kappa}B function and promotes apoptosis [J].Mol Cell Biol,2006,26(10): 3864-3874.
[11] Iwasaki H,Kovacic JC,Olive M,et al.Disruption of protein arginine N-methyltransferase 2 regulates leptin signaling and produces leanness in vivo through loss of STAT3 methylation [J].Circ Res,2010,107(8): 992-1001.
[12] Dalloneau E,Pereira PL,Brault V,et al.Prmt2 regulates the lipopolysaccharide-induced responses in lungs and macrophages [J].J Immunol,2011,187(9): 4826-4834.
[13] Bedford MT.Arginine methylation at a glance [J].J Cell Sci,2007,120(Pt 24): 4243-4246.
[14] Bedford MT,Richard S.Arginine methylation an emerging regulator of protein function [J].Mol Cell,2005,18(3): 263-272.
[15] Mathioudaki K,Scorilas A,Ardavanis A,et al.Clinical evaluation of PRMT1 gene expression in breast cancer [J].Tumour Biol,2011,32(3): 575-582.
[16] Yoshimatsu M,Toyokawa G,Hayami S,et al.Dysregulation of PRMT1 and PRMT6,Type I arginine methyltransferases,is involved in various types of human cancers [J].Int J Cancer,2011,128(3): 562-573.
[17] Al-Dhaheri M,Wu J,Skliris GP,et al.CARM1 is an important determinant of ERalpha-dependent breast cancer cell differentiation and proliferation in breast cancer cells [J].Cancer Res,2011,71(6): 2118-2128.
[18] Frietze S,Lupien M,Silver PA,et al.CARM1 regulates estrogen-stimulated breast cancer growth through up-regulation of E2F1 [J].Cancer Res,2008,68(1): 301-306.
[19] Zhong J,Cao RX,Hong T,et al.Identification and expression analysis of a novel transcript of the human PRMT2 gene resulted from alternative polyadenylation in breast cancer [J].Gene,2011,487(1): 1-9.
[20] Zhong J,Cao RX,Zu XY,et al.Identification and characterization of novel spliced variants of PRMT2 in breast carcinoma [J].FEBS J,2012,279(2): 316-335.
[21] Park SH,Cheung LW,Wong AS,et al.Estrogen regulates Snail and Slug in the down-regulation of E-cadherin and induces metastatic potential of ovarian cancer cells through estrogen receptor alpha [J].Mol Endocrinol,2008,22(9): 2085-2098.
[22] Thiery JP,Acloque H,Huang RY,et al.Epithelial-mesenchymal transitions in development and disease [J].Cell,2009,139(5): 871-890.
[23] 赵俊卿,李云峰,杨之斌,等.肿瘤细胞发生细胞上皮-间质转变机制的研究[J].肿瘤,2010,30(10): 890-893.
TheEstablishmentandIdentificationofLentiviruswithPRMT2Expression
ZHONG Jing,YANG Xinzhi,ZHANG Yanmin,et al
(InstituteofClinicalMedicine,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo obtain Lentivirus with PRMT2 expression.MethodsPRMT2 cDNA was obtained from cDNA pool by RT-PCR,and the PRMT2 cDNA was ligated with GV308 vector; the GV308/PRMT2 plasmid confirmed by sequencing was cotranfected with pHelper 1.0 and pHelper 2.0 into 293T cells to obtain PRMT2 Lentivirus; titer of Lentivirus with PRMT2 expression was assessed by Real Time PCR; the expression of PRMT2 was induced by Doxycycline hyclate and detected by Western blot in PRMT2 Lentivirus infected 239T cells.ResultsPRMT2 Lentivirus could express PRMT2 in 239T cells.ConclusionLentivirus with the expression of PRMT2 was successfully established.
PRMT2; lentivirus; gene therapy
10.15972/j.cnki.43-1509/r.2015.01.019
2014-09-04;
2014-11-29
国家自然科学基金青年项目(31200573)、国家自然科学基金面上项目(81272906)和湖南省自然科学基金(12JJ3116)
*通讯作者,Email:Zhongjing2002@hotmail.com
R737.9
A
(此文编辑:秦旭平)
