HPLC-MS/MS法测定大鼠血浆中酸枣仁皂苷A含量及其药动学研究
2015-12-27张妍解军波张彦青
张妍,解军波,张彦青,*
(1.天津商业大学生物技术与食品科学学院制药工程系,天津300134;2.天津市食品生物技术重点实验室,天津 300134)
HPLC-MS/MS法测定大鼠血浆中酸枣仁皂苷A含量及其药动学研究
张妍1,2,解军波1,2,张彦青1,2,*
(1.天津商业大学生物技术与食品科学学院制药工程系,天津300134;2.天津市食品生物技术重点实验室,天津 300134)
建立高效液相色谱-质谱串联(HPLC-MS/MS)法检测大鼠血浆中酸枣仁皂苷A的含量,并应用于药动学研究。大鼠静注(4mg/kg)或灌胃(20mg/kg)给药,不同时间取血,血浆样品经处理后,采用HPLC-MS/MS法测定酸枣仁皂苷A含量,色谱柱为Waters YMCTM ODS-AQ S-5 120A(2.0×100mm)分析柱,以电喷雾离子化串联质谱(ESI)及多反应监测扫描模式(MRM)进行检测,流动相为甲醇-水(0.1%甲酸)=50∶50,流速为0.3mL/min,柱温为30℃,根据测定结果求算药物的药动学参数。酸枣仁皂苷A在40 ng/mL~4 000 ng/mL的浓度范围内线性关系良好(r2=0.999 1),各浓度水平的精密度及稳定性的RSD均小于15%,提取回收率均大于85%。大鼠注射给药后主要药动学参数分别为Ke0.28/h,t1/22.55 h,AUC0→t2 839.89 h·ng/mL,AUC0→∞3 201.51 h·ng/mL,灌胃给药后主要药动学参数分别为Ke0.51/h,t1/21.35 h,AUC0→t206.02 h·ng/mL,AUC0→∞211.13 h·ng/mL。经计算,酸枣仁皂苷A在大鼠体内的生物利用度为1.32%。本试验所建立的检测方法快速简便、精密度好、灵敏度高及稳定性好,适用于酸枣仁皂苷A在大鼠体内血药浓度测定及药代动力学的研究。
酸枣仁皂苷A;药动学;高效液相色谱-质谱串联;生物利用度
酸枣仁是鼠李科植物酸枣(Ziziphus psinosa Hu)的干燥成熟种子,具有敛汗、养肝、宁心安神等多种功效[1]。酸枣仁皂苷A((Jujuboside A,JuA)是酸枣仁的有效成分之一,具有镇静、催眠,降压、降脂、抗缺氧、增强免疫功能以及对心脏的保护等广泛的药理效应,其应用前景十分诱人[2-4]。本研究建立了HPLC-MS/MS法测定大鼠血浆中酸枣仁皂苷A的含量并对其药动学进行了研究。研究结果显示建立的方法快速简便、精密度好、灵敏度高及稳定性好,适用于大鼠血浆中酸枣仁皂苷A的含量测定。
1 仪器与试药
Agilent 1100 Series高效液相色谱仪、G1322A在线脱气机、G1312B二元泵、G1316B柱温箱、G1315C DAD紫外检测器、G1367D自动进样器、Masshunter色谱工作站:Agilent,USA;BP211D型十万分之一电子天平:Satorius,Germany;ZH-2型涡流混合器:天津大学无线电厂;AS10200A型超声波清洗器:昆山超声仪器有限公司;酸枣仁皂苷A对照品购自中国食品药品检定研究院;甲酸(96%)购自美国Tedia公司;色谱纯甲醇与超纯水均购自J.T.Baker公司。
Wistar雄性大鼠体重(200±20)g(天津药物研究所),给药前禁食24h,不禁水,大鼠血浆由实验室制备。
2 方法与结果
2.1 分析条件
2.1.1 色谱条件
色谱柱为:Waters YMCTMODS-AQS-5 120A(2.0× 100mm),柱温为30℃,流动相为(0.1%甲酸溶液)-甲醇(50∶50);流速0.3mL/min,进样量为20μL。
2.1.2 质谱条件
离子源:电喷雾ESI(-)源,检测方式:多反应检测(MRM),电喷雾电压:4 000 V,雾化气体:N2,雾化气压力:35Pa;干燥气体:N2,干燥气流速:8 L/min;离子源温度:350℃,碰撞气体:高纯氮气,碰撞气压力:0.15MPa。酸枣仁皂苷A的质谱分析的条件参数如表1。

表1 酸枣仁皂苷A质谱分析的条件参数Table1 Parameter of Mass Spectra of Jujuboside A
按前述色谱和质谱条件对血浆样品中酸枣仁皂苷A的含量进行测定,记录色谱图。图1和图2分别为酸枣仁皂苷A对照品、空白血浆样品及样品中酸枣仁皂苷A的MS2-Scan全扫描色谱图及目标化合物的MRM色谱图。由图可知样品中酸枣仁皂苷A峰型良好,方法具有较好的分离度和灵敏度,可以进行定量分析。

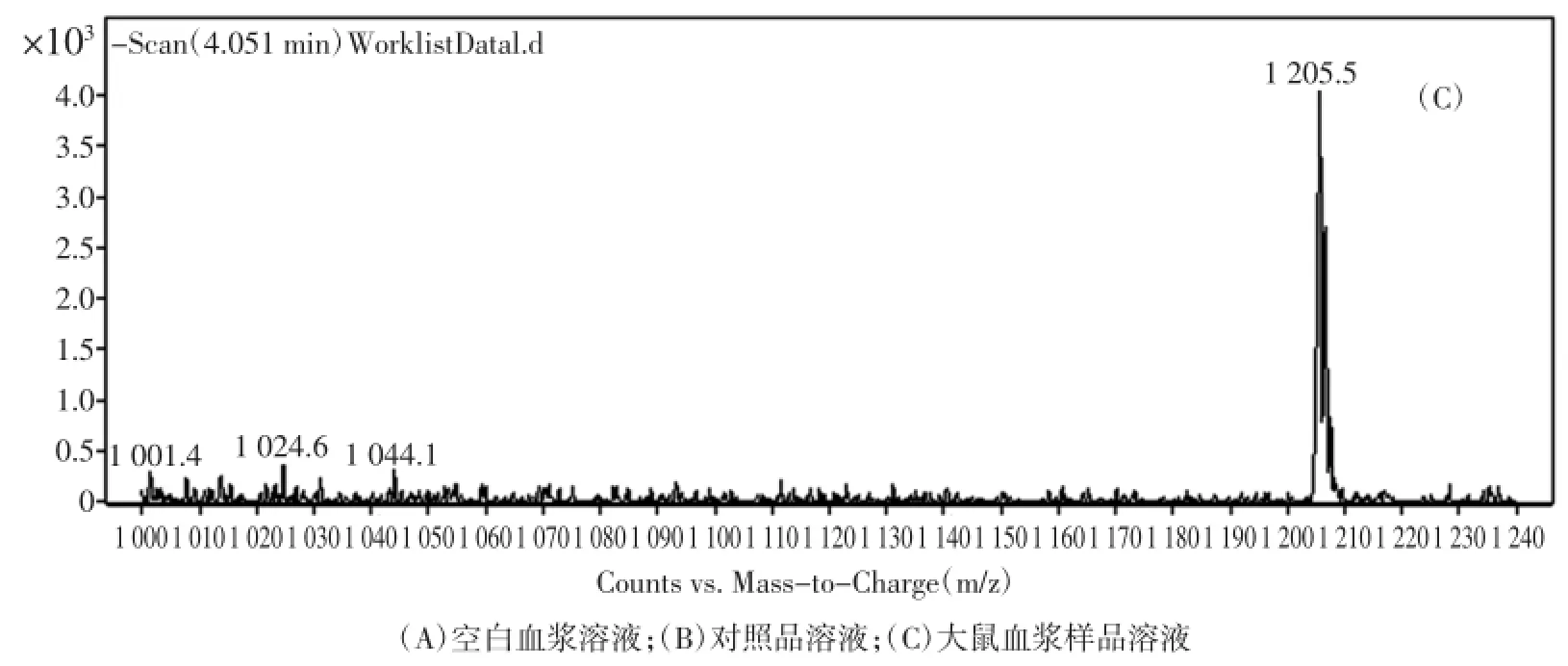
图1 酸枣仁皂苷A的MS2-Scan全扫描色谱图Fig.1 Representative M S2-Scan Chromatograms of JuA
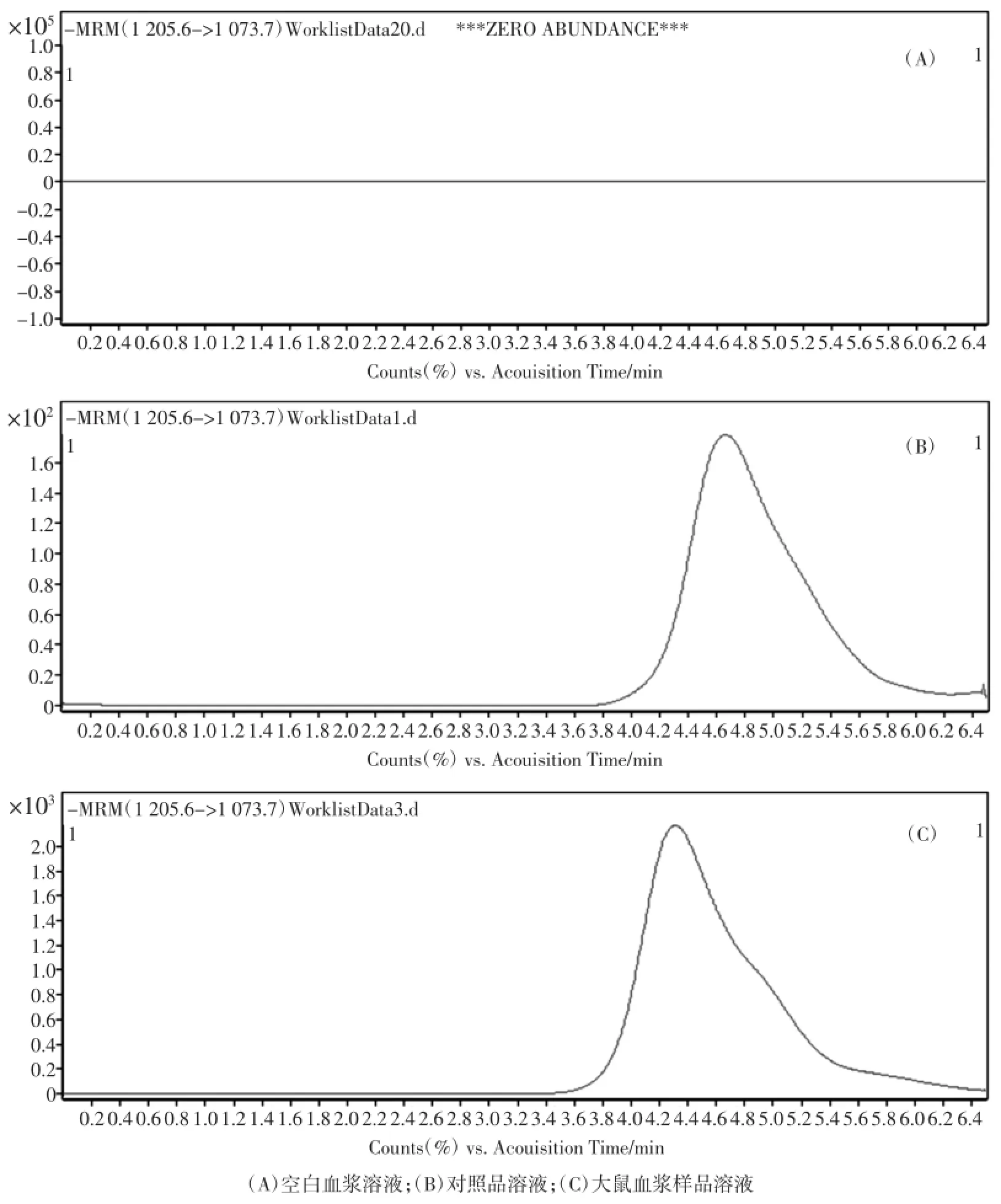
图2 酸枣仁皂苷A样品的MRM色谱图Fig.2 Representative MRM Chromatograms of JuA
2.2 对照品贮备液的配制
精密称量酸枣仁皂苷A对照品10mg,置10mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀后即得浓度分别为1mg/mL的对照品溶液。
2.3 供试品溶液的制备
精密量取酸枣仁皂苷A对照品溶液100μL置1.5mL离心管中,挥干后加入100μL大鼠空白血浆,涡旋混匀,再加入甲醇溶液200μL,涡旋10 min,6000 r/min离心10min,取200μL上清置干净的1.5mL离心管中,补加100μL水,涡旋5min混匀,过滤后即得供试品溶液。
2.4 标准曲线的制备
取适量1mg/mL酸枣仁皂苷A对照品溶液用甲醇稀释,配制成40、80、200、400、800、1000、2000和4 000 ng/mL系列浓度的供试品溶液,按照2.3项所示方法进行处理,按前述色谱和质谱条件测定。以样品浓度为横坐标,峰面积为纵坐标,进行线性回归,得标准曲线方程。酸枣仁皂苷A在40 ng/mL~4 000 ng/mL的浓度范围内线性关系良好,标准曲线方程为Y= 4.75X+36.35,r2=0.999 1。
2.5 精密度试验
按照2.3项制备方法,制备40、400、4 000 ng/mL 3个浓度水平的供试品溶液,精密吸取供试品溶液20μL进样,连续进样5次,计算得酸枣仁皂苷A峰面积的RSD分别为4.43%、2.12%和1.92%,表明精密度良好。
2.6 稳定性试验
按照2.3项制备方法,制备40、400、4 000 ng/mL 3个浓度水平的供试品溶液,于-20℃条件下保存,测定样品时,在室温条件下放置融化样品。分别于0、3、6、12、24、48 h进行分析,测定色谱峰面积,计算得各浓度水平的酸枣仁皂苷A峰面积的RSD分别为9.17%、6.82%和4.76%,表明稳定性良好。
2.7 重现性试验
按照2.3项制备方法,制备40、400、4 000 ng/mL 3个浓度水平的供试品溶液各5份供试液,依法测定,计算得各浓度水平的酸枣仁皂苷A峰面积的RSD分别为7.26%、4.43%和3.97%,表明重现性良好。
2.8 提取回收率试验
按照2.3项制备方法,制备40、400、4 000 ng/mL 3个浓度水平的供试品溶液测定酸枣仁皂苷A的含量。再分别取40、400、4 000 ng/mL 3个浓度水平的酸枣仁皂苷A对照品溶液100μL于1.5mL离心管中挥干,分别加入按照2.3法处理的未加药的空白血浆200μL,补加100μL水后,摇匀,过滤后进样测定酸枣仁皂苷A的含量。按照公式(1)计算得大鼠血浆中酸枣仁皂苷A提取回收率分别为85.64%、91.64%和86.69%,表明该方法提取回收率良好。

3 药动学研究
取Wistar大鼠10只,随机平均分为尾静脉注射给药组和口服灌胃给药组,用乙醚使之轻度麻醉,将新鲜配制的酸枣仁皂苷A标准品生理盐水注射剂对大鼠分别进行尾静脉注射(剂量为4mg/kg)和口服灌胃给药(剂量为20mg/kg),给药后立即使之清醒。尾静脉给药组给药后于10、30min、1、1.5、2、3、4、6 h和8 h经大鼠眼底静脉丛采血约400μL~500μL,注入含有0.1%肝素钠的抗凝管中轻摇混匀,6 000 r/min离心10min后取上层血浆。口服灌胃给药组给药后于10、30min、1、1.5、2、3、4、6、8 h和10 h经大鼠眼底静脉丛采血后同上处理方法分离血浆。按照2.3法处理血浆样品,测定血浆中的药物浓度,计算相应药动学参数和平均血药浓度-时间曲线,如表2和图3所示。
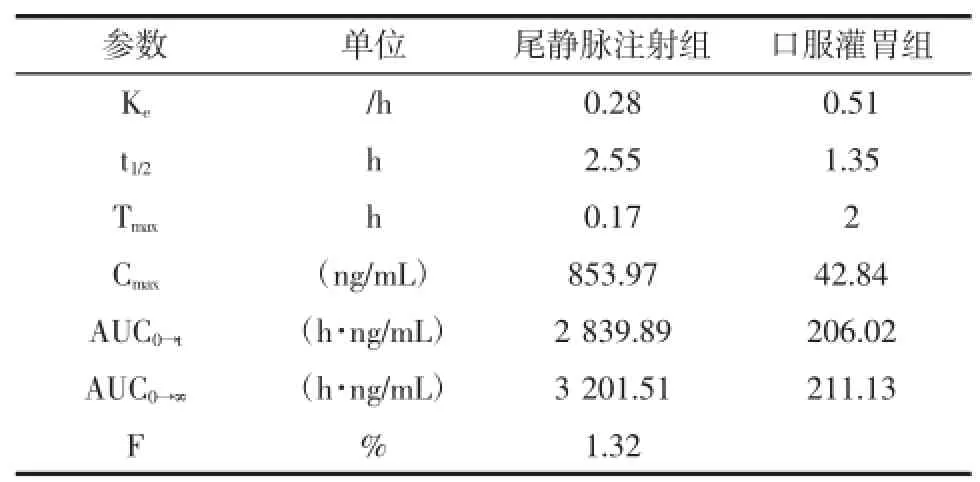
表2 大鼠给药后酸枣仁皂苷A药动学参数Table2 The pharmacokinetic parameters of JuA in rats following intravenous administration and oral administration of JuA
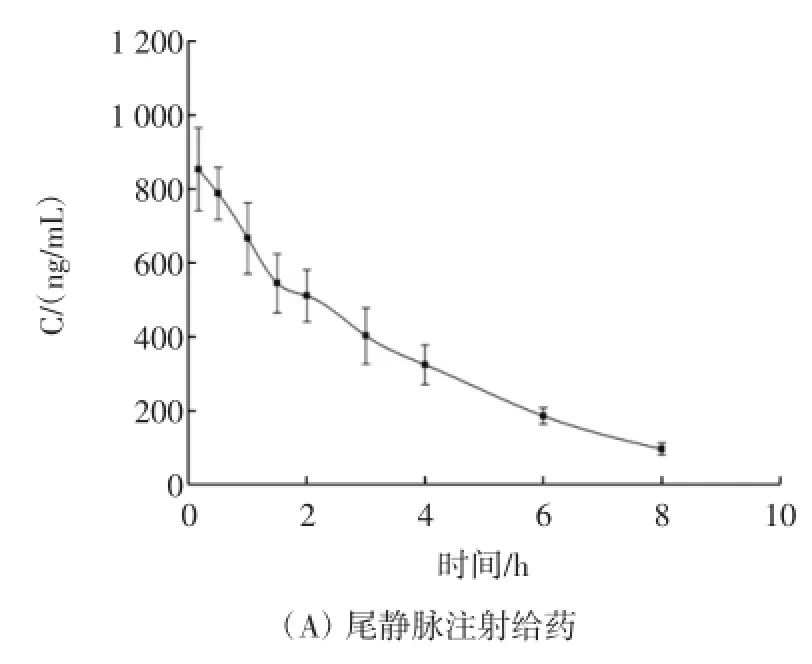
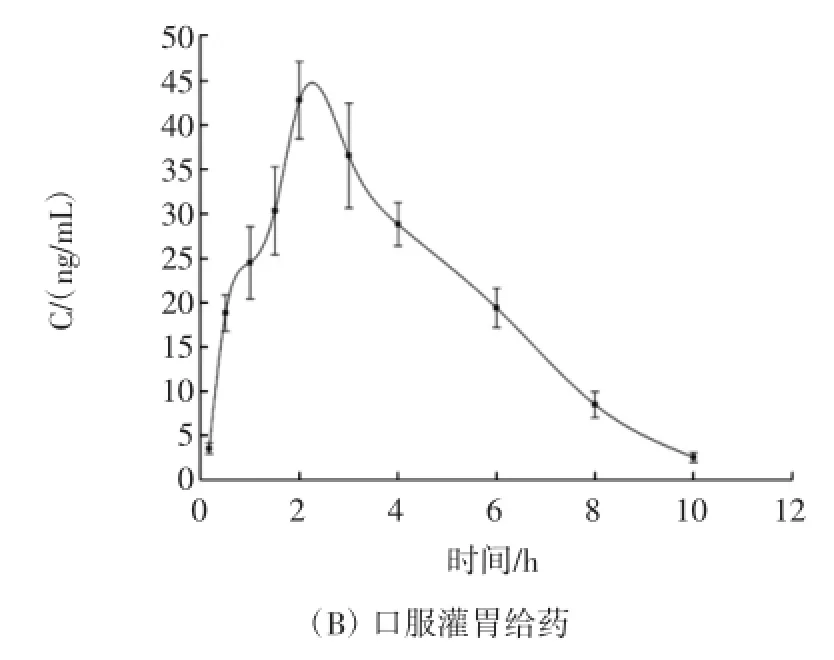
图3 两种不同给药途径的平均血药浓度-时间曲线Fig.3 Mean(±SD)plasma concentration-time profiles of JuA
4 讨论
本试验建立了准确灵敏且快速的高效液相色谱-质谱联用技术(HPLC-MS/MS)来测定大鼠血浆样品中酸枣仁皂苷A的浓度。结果显示,大鼠血浆样品中的酸枣仁皂苷A在40 ng/mL~4 000 ng/mL的浓度范围内线性关系良好,各浓度水平的精密度及稳定性的标准偏差均小于15%,提取回收率均大于85%,由此说明药物经本方法处理后性质稳定,符合血浆样品分析的各项要求,适用于大鼠血浆中酸枣仁皂苷A的含量测定。
本研究以Wistar大鼠为实验动物,以尾静脉注射给药方式作为对照,研究酸枣仁皂苷A灌胃给药后,药物在大鼠体内的药代动力学过程。结果表明,酸枣仁皂苷A在大鼠体内呈现线性动力学特征,但该药物经灌胃给药后的生物利用度很低,初步推测药物可能是以原型的形式或发生某种转化后大量存在与胃肠道中,或是通过其他途径发挥药效作用,具体结论仍需进一步实验对其进行佐证。
[1] 中华人民共和国药典[M].北京:化学工业出版社,2010
[2]Shea J L,Mochizuki T,Sagvaag V,et al.Rapid eye movement(REM) sleep homeostatic regulatory processes in the rat:changes in the sleep-wake stages and electroencephalographic power spectra[J]. Brain Research,2008,1213:48-56
[3] Wang X H,Li Z,Wang X.Sedative and hypnotic effects of suanzaoren decoction in different dose[J].Journal of Shanxi College Traditional Chinese Medicine,2006,7:19-20
[4] Cao J X,Zhang Q Y,Cui SY,et al.Hypnotic effect of jujubosides from Semen Ziziphi Spinosae[J].Journal of Ethnopharmacology, 2010,130:163-166
Determination of Jujuboside A in Rat Plasm a by HPLC-MS/M S and Its Pharmacokinetics Study
ZHANG Yan1,2,XIE Jun-bo1,2,ZHANG Yan-qing1,2,*
(1.Tianjin University of Commerce,School of Biotechnology and Food Science,Department of Pharmaceutical Engineering,Tianjin 300134,China;2.Tianjin Key Laboratary of Food Biotechnology,Tianjin 300134,China)
To establish a method for the determination of the concentration of Jujuboside A(JuA)in rat plasma by liquid chromatography-mass/mass spectrometry(HPLC-MS/MS),and study its pharmacokinetics.The rats were intravenously (4 mg/kg)or oral(20 mg/kg)administrated JuA.Blood samples were drawn from the palpebra at different stages.The concentrations of JuA in the plasma were determined by the HPLC-MS/MS method.Chromatographic separation was carried out with a security guard Waters YMCTM ODS-AQS-5 120A(2.0×100 mm)(Waters,USA).HPLC-MS/MS was performed on a triple-quadrupole mass spectrometry equipped with electrospray ionization(ESI)and negative multiple reaction monitoring (MRM).The mobile phase consisted of methanol-water-formic acid (50∶50∶0.1),delivered at the flow rate of0.3mL/min under 30℃.The method was linear over the concentration range of 40 ng/mL-4 000 ng/mL(r2=0.999 1).The relative standard deviations of the assay were less than 15.0%for the low,and the recovery of the method was more than 85%.The pharmacokinetic parameters were as follows:Ke0.28/h,t1/22.55 h,AUC0→t2 839.89 h·ng/m L,AUC0→∞3 201.51h·ng/mL in rat with intravenous administration,and Ke0.51/h,t1/21.35h,AUC0→t206.02h·ng/mL,AUC0→∞211.13 h·ng/mL in rat with oral administration.The bioavailability of JuA was1.32%.The developed method was successfully applied to the estimation of the pharmacokinetic parameters of JuA.
Jujuboside A;pharmacokinetic;HPLC-MS/MS;bioavailability
10.3969/j.issn.1005-6521.2015.03.028
2013-11-22
张妍(1987—),女(汉),硕士研究生,从事生物活性物质的分离筛选的研究工作。
*通信作者:张彦青(1974—),女(汉),副教授。
