壳寡糖对杏果实抗病性及活性氧代谢的影响
2015-12-27阿衣木古丽艾赛提王英贾盼盼朱璇
阿衣木古丽·艾赛提,王英,贾盼盼,朱璇
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052)
壳寡糖对杏果实抗病性及活性氧代谢的影响
阿衣木古丽·艾赛提,王英,贾盼盼,朱璇*
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052)
为研究壳寡糖处理对杏果实贮藏期间抗病作用中活性氧变化的影响。以新疆塞买提杏为试验材料,选用分子量5000u、浓度为0.50%的壳寡糖对杏果实进行减压渗透处理。处理后的杏果实贮藏在温度为4℃、RH 90%~95%的冷库中,定期测定杏果实接种发病率、病斑直径、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)的活性和超氧阴离子(Superoxideanion,·)产生速率及过氧化氢(Peroxide,H2O2)的含量。结果表明,壳寡糖处理的杏果实发病率显著低于对照果实,且可诱导杏果实早期·和H2O2的含量的积累,并使·产生速率和H2O2含量在杏果实贮藏后期保持在较低水平,增强了杏果实中SOD、CAT、POD和APX的活性。说明壳寡糖处理可降低果实发病率,诱导活性氧的迸发和相关抗氧化酶酶活性的显著增强,提高了果实的抗病性。
杏;壳寡糖;活性氧;抗病性
杏(Prunusarmeniacal)属蔷薇科,李属,属于呼吸跃变型果实[1]。杏是新疆主要栽培果树之一,据2011年新疆统计年鉴所示,新疆杏树种植面积为21.2万hm2,占全疆果树种植面积的21.37%,杏果实产量为132.3万t,是疆内水果总量的22.28%[2]。新疆独特的地理环境是新疆的鲜杏风味独特,营养丰富,既可以制干也可以鲜食,深受广大消费者喜爱。但是杏后熟期短,采后常温下几天内果实变软、品质、风味迅速下降并造成大量果实腐烂。研究表明,杏采后腐烂损失主要是由病原微生物侵染引起的,引起杏采后腐烂的病原菌主要有链格孢(Alternaria alternata)、青霉(Penicillium expansum)、根霉(Rhizopusstolonifer)。目前主要通过化学杀菌剂控制杏的采后腐烂,但随着人们对食品安全和质量要求的增加,化学杀菌剂的长期和广泛使用所带来的农残超标、抗性菌株的产生以及环境污染等问题日益引起人们的关注,因此化学杀菌剂的使用越来越受到限制。因此,寻求新的、安全的、对环境友好的、并对杏果实贮藏品质有良好效果的新型保鲜方法是生产上亟待解决的问题。
研究表明,果蔬经物理的、化学的以及生物的方法预先处理后,可提高果蔬自身的免疫机制减少病原菌的侵染,从而延长果蔬的贮运期和货架期,具有安全、无污染和简单易行的特点,具有很大的应用潜力。目前诱导抗病性作为防治果蔬采后病害的一个重要方面已受到国内外的广泛关注,为果蔬产品病害的防治开辟了一条新途径[3]。壳寡糖(oligochitosan)是指由壳聚糖经酸水解或酶水解而制得的2个~10个氨基葡萄糖组成的低聚糖而获得的低聚合度水溶性的糖类。壳寡糖比普通的壳聚糖具有更强的抑菌能力,且水溶性好、可生物降解,对人畜无毒,并且能诱导植物产生抗病性,是诱导果蔬抗病性的重要因子[4]。近年来,壳寡糖在园艺产品中的应用受到重视,作为一种外源性生物激发子,应用于柑橘、杏、枣、青椒等园艺产品采后病害的控制[5-8]。
研究发现,活性氧与果蔬抗病反应密切相关。在果蔬的抗病反应中,活性氧爆发被认为是引起果蔬早期抗病反应的重要因子,一方面产生的H2O2和超氧阴离子(O2-·)直接攻击病原菌,抑制病原微生物发育;另一方面爆发的活性氧分子如H2O2可作为第二信使参与植物系统抗病性的诱导[9]。低浓度的活性氧积累对果蔬是有益和必需的,而高浓度活性氧对果蔬是有害的。在果蔬的抗病反应中,诱抗剂还会激发果蔬体内形成一系列清除活性氧的体系,使果蔬体内活性氧水平保持动态平衡。目前有关壳寡糖诱导抗病性和活性氧代谢的研究主要集中在对植物幼苗和悬浮培养细胞的诱抗反应上,如郭红莲和zhao等研究发现,壳寡糖处理可以诱导草莓悬浮培养细胞和烟草幼苗活性氧的迸发[10-11]。但是有关壳寡糖处理对果实诱导其抗病反应中活性氧代谢含量变化研究较少,本实验以采后杏果实为材料,研究了壳寡糖处理后对杏果实采后黑斑病发病率的变化及杏果实体内活性氧的产生及活性氧清除相关酶活性的变化,探讨其诱导杏果实抗病性的机制,为壳寡糖在杏果实病害控制上的应用提供理论依据。
1 材料和方法
1.1 试验材料和设备
赛买提杏于2012年6月25日采摘于新疆库车县乌恰镇,大小和成熟度均匀,无病虫害和机械损伤;壳寡糖分子量5 000 u,脱乙酰度90%,食品级,购自济南海得贝海洋生物工程有限公司。
供试病原菌:链格孢菌(Alternaria alternata(Fr.)Keissl)株由新疆农业大学果蔬采后生理研究实验室提供。
超净工作台:苏州净化设备厂;高压灭菌锅:YXQ-SG46-280S上海博讯实业有限公司;生化培养箱:江苏南通五金电器厂;显微镜:XSP-2CA厦门Motic实业集团有限公司;紫外分光光度计:TU-1810北京普希通用仪器有限责任公司;循环水式多用真空泵:SHBIII郑州长城科工贸有限公司;电子分析天平:AL204-IC梅特勒-托利多仪器厂上海有限公司;电热恒温水浴锅:北京市永光明医疗仪器厂;高速冷冻离心机:GL-20G-II上海安亭科学仪器厂。
1.2 壳寡糖损伤接种发病率和病斑直径测定
参考Molloy的方法进行[12]。杏采收后,用分子量为5 000,浓度0.50%壳寡糖以减压方式处理杏果实(将杏果实浸入到真空干燥器中,抽真空至压为0.05MPa时保持2min,然后恢复到常压让果实继续浸泡10min,取出自然晾干后)进行损伤接种,以蒸馏水处理的杏果实作为对照。接种前用70%的酒精擦拭杏果实表面进行消毒,然后用灭菌铁钉在杏果实中部穿刺一个直径为0.50mm深度为0.30mm的孔,然后用微量进样器将15μL交孢链格孢孢子悬液(1×106cfu/mL)注射到孔中,待菌液吸收后单果包装,置于塑料筐内,于4℃、90%~95%RH的冷库中贮藏。每天观察杏果实的接种发病率和利用十字交叉法测量病斑直径。以注射孔菌斑直径大于0.50mm时即为接种发病果实。每处理用果30个,重复3次。果实接种发病率计算公式如下:

1.3 测定方法及指标
用分子量为5 000,浓度0.50%壳寡糖以减压方式处理杏果实(将杏果实浸入到真空干燥器中,抽真空至压为0.05MPa时保持2min,然后恢复到常压让果实继续浸泡10min,取出自然晾干),将处理后的杏果实置于温度为4℃、RH 90%~95%的冷库中贮藏,以蒸馏水处理的杏果实作为对照,每处理用杏果实4kg,重复3次。每隔7天从冷库中取出杏果实进行各项相关指标的测定。
1.3.1 H2O2含量的测定
H2O2含量测定参照Zhou的方法进行测定并改进[13]。H2O2含量以μmol/g FW表示,测定时重复3次。
1.3.3 CAT活性的测定
CAT活性测定参照曹建康方法,采用比色法测定[15]。以每克鲜重(FW)果蔬样品每分钟吸光度变化值增加0.01时为1个过氧化物酶活性单位(U),则U= 0.01△OD240·min-1·g-1FW。
1.3.4 SOD活性的测定
SOD的测定参照曹建康的方法[15]。以每分钟每克鲜重(FW)果蔬组织的反应体系对氮蓝四唑(NBT)光化还原的抑制为50%时为一个SOD活性单位(U)表示,结果以U/g·FW表示。
1.3.5 POD活性的测定
参照曹建康方法,采用分光光度计法测定[15]。以每克鲜重(FW)果蔬样品每分钟吸光度变化值增加1时为1个过氧化物酶活性单位(U),则U=△OD470·min-1· g-1FW。
1.3.6 APX活性的测定
APX活性参考Nakano的方法进行并改进[16]。以每克鲜重(FW)样品每分钟OD290值变化0.01时为一个酶活性单位(U),则U=0.01△OD290·min-1·g-1FW。
2 数据分析
应用Spass16.0软件对数据进行方差分析,并利用邓肯式多重比较进行差异显著性分析,P<0.05表示差异显著。
2.1 结果与分析
2.1.1 壳寡糖处理对杏果实损伤接种发病率的影响
如图1所示,壳寡糖处理降低了杏果实接种交孢链格孢菌(A.alternata)的发病率。在接种后的第21天壳寡糖处理的杏果实接种发病率比对照低50.0%(P<0.05);在接种后第28天,对照组发病率已达到66.67%,壳寡糖处理组仍然保持着较低的发病率,发病率为33.33%,比对照组小50.07%(P<0.05)。
2.1.2 壳寡糖处理对杏果实接种病斑直径的影响
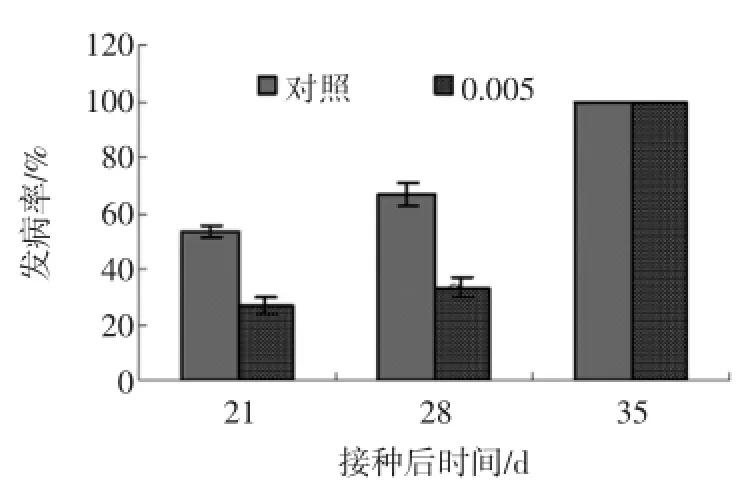
图1 壳寡糖处理对杏果实损伤接种发病率的影响Fig.1 Effectsof oligochitosan on disease incidenceof apricot fruit inocu lated w ith Alternaria alternata after harvest
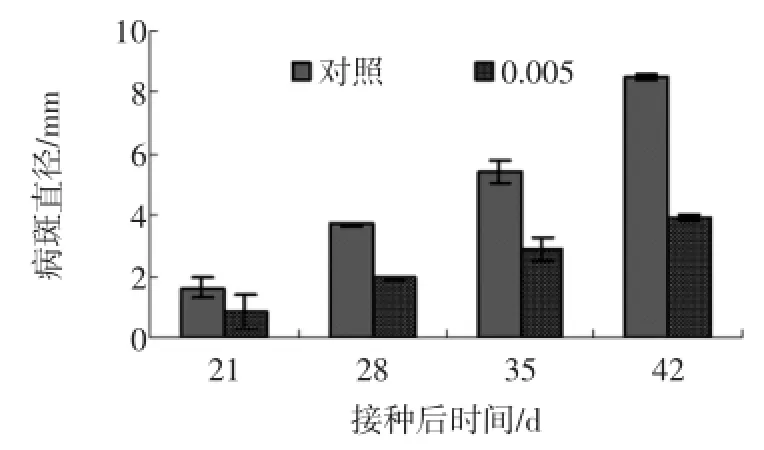
图2 壳寡糖处理对杏果实接种病斑直径的影响Fig.2 Effects ofoligochitosan on lesion diam er teofapricot fruit inoculated w ith Alternaria alternata after harvest
由图2可知,壳寡糖处理组病斑直径一直低于对照,在接种后的第21、28天和35天壳寡糖处理组杏果实病斑直径分别为0.85、1.92、2.91mm,比对照小47.48%、48.50%、46.75%(P<0.05)。在接种后的第42天,壳寡糖处理病斑直径为3.92mm,比对照组小54.02%(P<0.05)。试验结果表明,壳寡糖处理能有效抑制杏果实接种病斑直径的增加。
2.1.3 壳寡糖处理对杏果实H2O2含量的影响
在贮藏前期,壳寡糖处理组杏果实H2O2含量高于对照,后期含量下降,如图3所示。
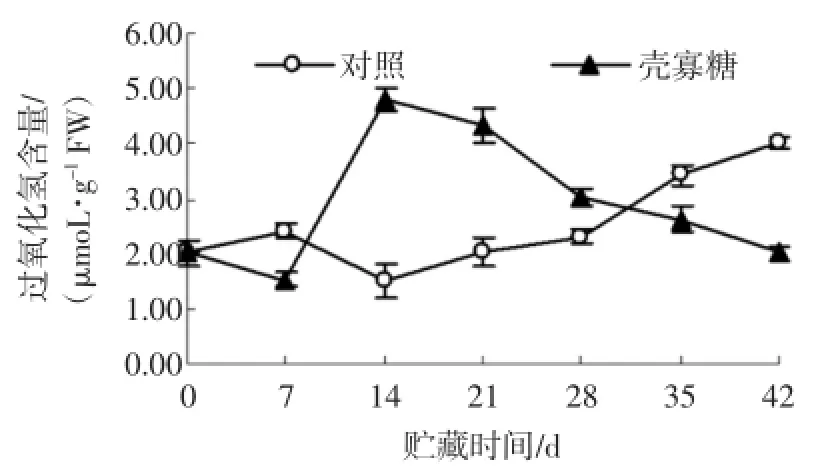
图3 壳寡糖处理对杏果实过氧化氢含量的影响Fig.3 Effectsofoligochitosan on H2O2contentofapricot fruit
在杏果实贮藏的第14天,壳寡糖处理H2O2含量达到最大值4.82μmoL/g FW,高于对照2.17倍。随后,壳寡糖处理H2O2含量开始下降,并且在后期低于对照的含量。试验结果表明,壳寡糖能引起杏果实早期短暂的含量积累,在后期H2O2水平降低。
2.1.4 壳寡糖处理对杏果实O2-·产生速率的影响
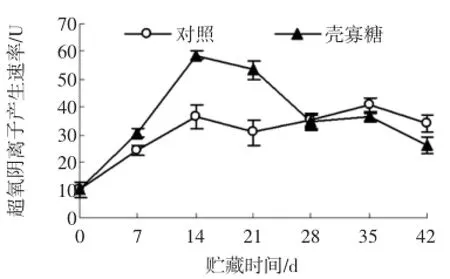
图4 壳寡糖处理对杏果实超氧阴离子产生速率的影响Fig.4 Effectsofoligochitosan on O2-·product rate of apricot fruit
壳寡糖处理对杏果实CAT活性的影响见图5。
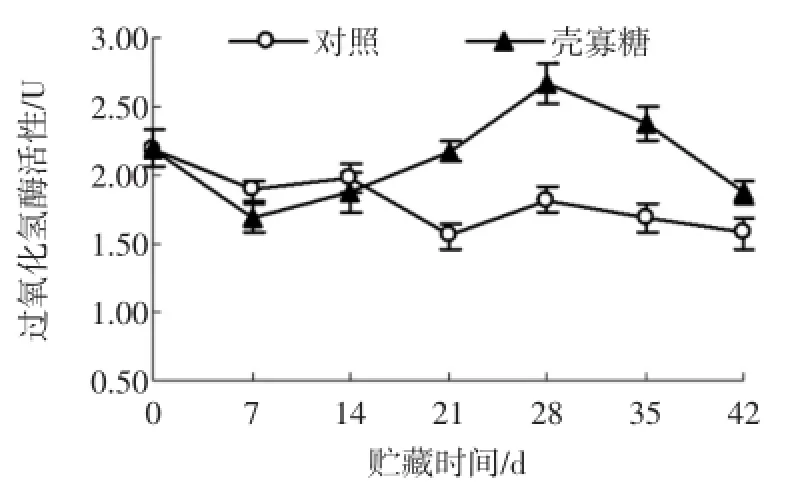
图5 壳寡糖处理对杏果实过氧化氢酶活性的影响Fig.5 Effectsof oligochitosan on catalaseactivity ofapricot fruit
由图5可以看出,在贮藏前期,壳寡糖处理组的CAT活性低于对照组;贮藏14天后,壳寡糖处理组的CAT活性呈现明显的上升趋势,此后的贮藏时间一直高于对照组。在贮藏的第2天,壳寡糖处理组CAT活性达到最高,比对照组高46.59%(P<0.05);在贮藏的第42天,高于对照18.62%(P<0.05)。
2.1.6 壳寡糖处理对杏果实SOD活性的影响
壳寡糖处理对杏果实SOD活性的影响见图6。
SOD是植物体内重要的抗氧化酶,与活性氧清除密切相关。如图6所示,在杏果实贮藏前期,壳寡糖处理组和对照组SOD酶活性差异不明显,在贮藏14 d后,壳寡糖处理组SOD酶活性呈现明显的上升趋势。在贮藏的第21天和第42天,壳寡糖处理组SOD酶活性分别比对照组高60.23%(P<0.05)和28.74%(P<0.05)。
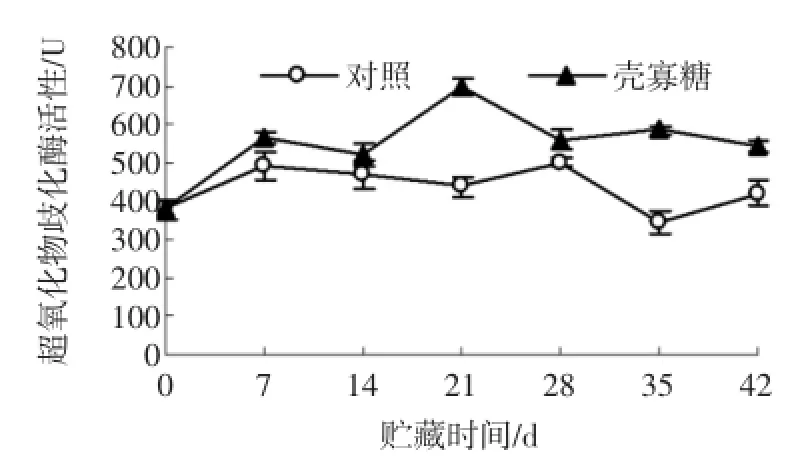
图6 壳寡糖处理对杏果实超氧化物岐化酶活性的影响Fig.6 Effectsof oligochitosan on superoxide dismutase activity of apricot fruit
2.1.7 壳寡糖处理对杏果实POD活性的影响
壳寡糖处理对杏果实POD活性的影响见图7。
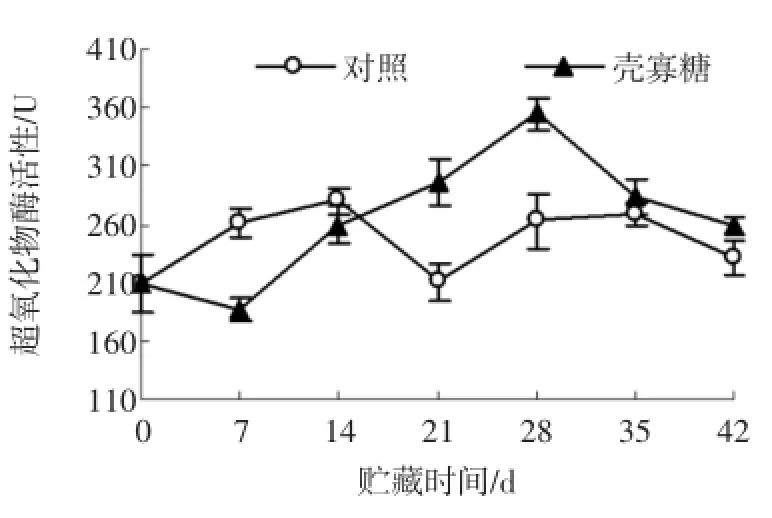
图7 壳寡糖处理对杏果实过氧化物酶活性的影响Fig.7 Effectsof oligochitosan on peroxidase activity of apricot fruit
POD是广泛存在于植物体内的氧化还原酶,其作用主要是催化氧化还原反应中产生的H2O2。由图7所示,在贮藏前期,壳寡糖处理组的POD活性低于对照组;贮藏14 d后,壳寡糖处理组的POD活性呈现明显的上升趋势,此后的贮藏时间一直高于对照组。在贮藏的第21、28天和42天,壳寡糖处理组杏果实的POD活性分别比对照高40.47%(P<0.05)、34.78%(P<0.05)和12.10%(P<0.05)。
2.1.8 壳寡糖处理对杏果实APX活性的影响
壳寡糖处理对杏果实APX活性的影响见图8。
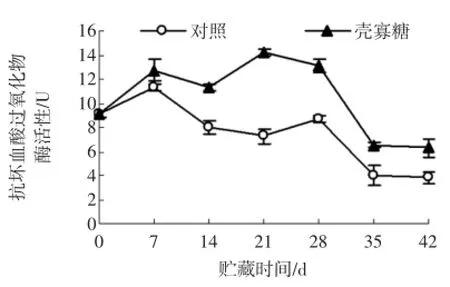
图8 壳寡糖处理对杏果实抗坏血酸氧化酶活性的影响Fig.8 Effectsof oligochitosan on ascorbateperoxidase activity of apricot fruit
由图8可知,杏果实在贮藏过程中APX活性呈先上升后下降的趋势,壳寡糖处理组杏果实APX活性在整个贮藏期均高于对照组。在贮藏的第21天和42天,壳寡糖处理组杏果实的APX酶活性分别比对照组高95.02%(P<0.05)和65.79%(P<0.05)。试验结果表明,壳寡糖处理可增强杏果实APX活性。
3 讨论
壳寡糖已被广泛用于植物抗病性的诱导和病害的防治[17-18],已有研究结果表明,在园艺产品采后处理方面,采后壳寡糖处理能诱导柑橘、杏、枣、青椒等果实对病原菌侵染的抗性反应,有效降低果实的发病率[5-8]。本研究表明,用分子量5 000 u,浓度0.5%壳寡糖处理采收后的杏果实,能有效降低杏果实的损伤接种发病率和病斑直径。
近年来,人们对果蔬采后活性氧的代谢和相关抗氧化酶变化规律的深入研究发现,各种诱抗剂不仅可以诱导采后果蔬抗病性提高,同时还能诱导活性氧含量的增加,许多研究表明,在诱导处理的前期,果实的活性氧水平迅速升高[19-21]。H2O2的快速积累是植物-病原菌互作过程中出现的早期事件之一[22]。本实验中,壳寡糖处理暂时地抑制了杏果实的CAT活性,有利于H2O2在果实组织内快速积累,这与Wendehenne等和Xu等的研究结果是一致[23-24]。壳寡糖处理后果实H2O2水平的升高是与壳寡糖抑制了CAT活性而显著提高SOD活性密切相关。在果实与病原菌相互作用过程中,杏果实组织内升高的H2O2水平本身可参与抗菌物质的合成;参与POD作用下的细胞壁物质的氧化交联反应,形成结构性屏障以阻止病原菌的进一步扩展;而且H2O2可作为第二信使诱导一些编码病程相关蛋白的基因的表达,参与植物系统抗病性的诱导[17,25]。
活性氧的积累还可能对果实组织造成伤害,加速果实的衰老进程。但在正常情况下,果实能很快调整体内生化代谢,以减轻这种氧化胁迫。近年的研究证实,诱抗剂可以诱导果蔬活性氧的迸发和激发果蔬体内一系列清除活性氧的体系,来抵御活性氧及氧自由基对细胞膜系统的伤害,SOD、CAT、POD和APX均在在活性氧清除过程中起着重要作用,通常作为一种应激反应随着活性氧水平变化而变化[25]。本试验中,壳寡糖处理杏果实的SOD、CAT和POD活性在贮藏14天后均出现增加趋势,明显高于对照;APX可通过AsAGSH循环催化细胞内H2O2转变成H2O,壳寡糖处理杏果实的APX活性在整个贮藏过程中均高于对照果实,与此相应的是,壳寡糖处理杏果实的H2O2含量和O2-·产生速率均在贮藏14天后出现下降趋势,在贮藏后期低于对照果实。因此,壳寡糖处理杏果实可以诱导发生与植物抗病反应类似的活性氧变化,活性氧释放在前期迸发,后期活性清除酶活性增加,活性氧含量的变化与SOD、CAT、APX和POD的活性变化具有密切关系。
综上,壳寡糖所诱导的果实抗病反应与活性氧水平的变化密切相关,果实体内存在着一套维持活性氧平衡的生化机制,控制着活性氧的合成、积累和消除,在诱导处理的前期,果实的活性氧水平迅速升高,壳聚糖可能是通过调节SOD、CAT、POD、APX和GR等保护酶的活性,降低果实内O2-·、·OH和H2O2等活性氧的积累,升高的活性氧即可能是作为传递侵染信号的信号分子在起作用。而抗氧化酶活性的升降及抗氧化剂水平的升高表明受诱导果实既可尽其所能地抑制病原物的侵入和繁殖,又可使活性氧对其自身的危害降至最低。
[1] 邢军,杨洁,郑力.新疆杏子分布及贮藏保鲜的可行性分析研究[J].新疆大学学报:自然科学版,2005,22(1):79-81
[2]新疆维吾尔自治区统计局.新疆统计年鉴[M].北京:中国统计出版社,2011(8):335-336
[3] TERRY L A,JOYCE D C.Elicitors of induced resistance in postharvesthorticultural crops:a brief review[J].PostharvestBiologyand Technology,2004,32:1-13
[4] 杜昱光.壳寡糖的功能研究及应用[M].北京:化学工业出版社, 2009
[5] 王丽,赵盼,孟祥红.壳聚(寡)糖对柑橘酸腐、黑腐病菌的抑制作用及对采后病害的防治[J].食品工业科技,2011,32(12):424-427
[6]贾盼盼,朱璇,朱健江,等.壳寡糖对杏果实贮藏品质的影响[J].食品工业科技,2012,33(17):353-356
[7] YAN Jiaqi,LIJian,ZHAOHongwei,etal.Effects of oligochitosan on postharvestAlternaria Rot,storage quality,and defense responses in Chinese Jujube(Zizyphus jujuba Mill.cv.Dongzao)fruit[J]. Journalof Food Protection,2011,74(5):783-788
[8] 王博宇,郭红莲,李喜宏,等.采后青椒黑斑病的抗病性诱导初步研究[J].食品科技,2009,34(1):57-59
[9]黄艳,明建,曾凯芳.果蔬诱导抗病性中的信号转导途径[J].食品科学,2009,30(7):291-294
[10]郭红莲,白雪芳,李曙光,等.壳寡糖诱导草莓细胞活性氧代谢的变化[J].园艺学报,2003,30(5):577-579
[11]ZHAOXM,SHEXP,YUWQ,etal.Effectsofoligochitosan on tobacco cells and role of endogenous nitric oxide burst in the resistance of tobacco to tobaccomosaic virus[J].Journal of Plant Pathology,2007,89(1):69-79
[12]MOLLOY C,CHEAH L H,KOOLAARD JP.Induced resistance a-gainst Sclerotinia sclerotiorum in carrots treated with enzymatically hydrolysed chitosan[J].Postharvest Biology and Technology,2004, 33(1):61-65
[13]ZHOU Biyan,WANG Jihua,GUO Zhenfei,etal.A simple colorimetric method for determination of hydrogen peroxide in plant tissues[J].PlantGrowth Regulation,2006,49:113-118
[14]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2001:46-52
[15]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:112-115,96-97
[16]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascobate specific peroxidase in spinach chloroplasts[J].PlantCell Physiology, 1981,22(5):867-880
[17]邓丽莉,明建,曾凯芳.寡聚糖类物质诱导果蔬抗病性的防御机制研究进展[J].食品科学,2009,30(7):266-269
[18]Kim SK,Rajapakse N.Enzymatic production and biological activities of chitosan oligosaccharides(COS):a review.Carbohydrate Polymers,2005,62:357-368
[19]ZENGKai-fang,CAO Jian-kang,JIANGWei-bo.Enhancing disease resistance in harvestedmango(Mangifera indica L.cv.‘Matisu’) fruitby salicylic acid[J].Science of Food and Agriculture,2006 (86):694-698
[20]ZHU Xuan,WANG Qiu-ming,CAO Jian-kang,et al.Postharvest infiltration ofBTH reduces infection ofmango fruit(Mangifera indica L.cv.Tainong)by Colletotrichum gloeosporioides and enhances resistance inducing compounds[J].Journalof Phytopathology,2008, 156:68-74
[21]LIYan,YINHeng,WANGQing,etal.Oligochitosan induced Brassica napus L.production of NO and H2O2and their physiological function[J].Carbohydrate Polymers,2009,75(4):612-617
[22]BAKER C J,ORLANDIEW.Active oxygen in plant pathogenesis [J].AnnualReview of Phytopathology,1995,33:299-321
[23]WENDEHENNE D,DURNER J,CHEN Z,et al.Benzothiadiazole, an inducer of plantdefenses,inhibits catalase and ascorbate peroxidase[J].Phytochemistry,1998,47:651-657
[24]XU X B,TIAN SP.Salicylic acid alleviated pathogen-induced oxidative stress in harvested sweet cherry fruit[J].Postharvest Biology and Technology,2008,49(3):379-385
[25]BREUSEGEM F V,VRANOVA E,DAT JF.The role ofactive oxygen speciesin plantsignal transduction[J].PlantScience,2001,161 (3):405-414
Effect of O ligochitosan Treatm ent on Induce Disease Resistance and Active Oxygen M etabolism in Apricot Fruits
Ayimuguli·aisaiti,WANGYing,JIA Pan-pan,ZHUXuan*
(Xinjiang AgriculturalUniversity,CollegeofFood Scienceand PharmaceuticalScience,Departmentof Food Science,Urumqi830052,Xinjiang,China)
The objective of the study was to exp lore the effect of oligochitosan treatment on active oxygen metabolism ofapricot fruits.The Saimaitiapricot fruit(Prunusarmeniacal)wasused asmaterialsand treated by vacuum infiltration 0.50%oligochitosan solution (molecularweight:5,000 u).The treated apricot fruitwere stored at4℃,90%-95%RH.Superoxide dismutase(SOD),catalase(CAT),peroxidase(POD),ascorbic acid peroxidase (APX)the related active oxygenmetabolism,superoxygen anion (O2-·)production rate and hydrogen peroxide (H2O2)content were determined.Results indicated that the disease incidence in oligochitosan-treated fruits was significantly lower than that in control fruits.Oligochitosan treatment accelerated H2O2contentand·production rate.The activitiesof SOD,POD,APX and CATwere enhanced.The studies suggested that oligochitosan-treated can decreased the disease incidence,accelerated biosynesis of hydrogen H2O2,enhanced activities of SOD,CAT,POD and APX,improved the disease resistance of apricot fruits.
apricot;oligochitosan;reactiveoxygen species;disease resistance
10.3969/j.issn.1005-6521.2015.05.030
2013-10-15
国家自然科学基金(31060232)
阿衣木古丽·艾赛提(1986—),女(维吾尔),硕士,研究方向:果蔬贮藏与保鲜。
*通信作者:朱璇(1971—),女(汉),博士,研究方向:果蔬贮藏与保鲜。
