木糖醇脱氢酶基因高拷贝表达载体构建及在酿酒酵母中的表达
2015-12-27葛菁萍裴芳艺黄守锋赵靖雯孙红兵平文祥
葛菁萍, 裴芳艺, 黄守锋, 赵靖雯, 宋 刚, 孙红兵, 洛 雪, 平文祥,2*
(1.黑龙江大学生命科学学院 微生物省高校重点实验室,黑龙江 哈尔滨 150080;2.农业微生物技术教育工程研究中心,黑龙江 哈尔滨 150500)
木糖醇脱氢酶基因高拷贝表达载体构建及在酿酒酵母中的表达
葛菁萍1, 裴芳艺1, 黄守锋1, 赵靖雯1, 宋 刚1, 孙红兵1, 洛 雪1, 平文祥1,2*
(1.黑龙江大学生命科学学院 微生物省高校重点实验室,黑龙江 哈尔滨 150080;2.农业微生物技术教育工程研究中心,黑龙江 哈尔滨 150500)
木糖醇脱氢酶(xylitol dehydrogenase, XDH)可以氧化木糖醇生成木酮糖,处于木糖代谢的节点位置。利用PCR方法克隆得到了休哈塔假丝酵母(Candidashehatae) 20335的木糖醇脱氢酶基因、质粒pKT0150的ADH1终止子序列和G418抗性基因(KanR),以及酿酒酵母(Saccharomycescerevisiae) W5特定的2.2 kb的rDNA片段。以酿酒酵母整合载体p406ADH1为骨架,利用基因工程手段构建一个多拷贝整合表达载体pLX-AGRX。将重组载体pLX-AGRX线性化转入到酿酒酵母W5后,通过高浓度G418筛选和PCR双重鉴定,证实重组载体pLX-AGRX已整合到酿酒酵母W5基因组上,测定木糖醇脱氢酶酶活可达65.957 4 U/mg。
休哈塔假丝酵母;木糖醇;木糖醇脱氢酶;载体构建;酿酒酵母
木质纤维素是丰富的可再生资源,广泛存在于工农业的废弃物中[1]。木质纤维素原料经预处理和水解会生成大量的葡萄糖、木糖和阿拉伯糖[2],因此,廉价且储量丰富的木质纤维素类生物质不仅可以作为生产燃料乙醇的底物,解决当前能源危机和环境污染等问题[3],而且还可以利用其水解产物中的木糖,进行木糖醇和木酮糖的生产[4-5]。木糖是半纤维素水解液中除葡萄糖外的另一种主要成分,最高可占半纤维素水解糖类的34%[6],但是自然界中的微生物普遍对木糖的利用率较低[2],因此提高木糖的生物转化率,可促进对半纤维素水解液的利用,从而实现对木质纤维素原料的全糖利用。以工业生产乙醇的菌株酿酒酵母Saccharomycescerevisiae为例,虽然具有许多优良特性[7],但其缺乏将木糖转化为木酮糖(xylulose)的关键酶系,即木糖还原酶(xylose reudetase, XR)和木糖醇脱氢酶,因而不能利用木糖[8-9]。其中,木糖还原酶可以还原木糖生成木糖醇(xylitol),木糖醇脱氢酶进而可以氧化木糖醇生成木酮糖[10-13]。木糖醇和木酮糖被定义为稀有糖,广泛应用于食品、医药等领域[14]。因此,利用基因工程手段将木糖还原酶基因和木糖醇脱氢酶基因克隆进入酿酒酵母体内,可以实现以木质纤维素为原料,生产木糖醇和木酮糖。本研究是从休哈塔假丝酵母(Candidashehatae) 20335中克隆木糖醇脱氢酶基因(xyl2),以整合载体p406ADH1为骨架,在其中引入G418抗性基因KanR作为显性选择标记,以酿酒酵母同源的rDNA基因为整合位点,提高该整合质粒的拷贝数,同时引入酿酒酵母强启动子ADH1序列及其终止子序列,用于提高目的基因xyl2的表达量,最终构建一个高拷贝高效表达木糖醇脱氢酶活力的整合表达载体。本研究为改造酿酒酵母特性,使其可以充分利用半纤维素水解液中的木糖成分,并转化生成木糖醇及木酮糖提供了基因基础。
1 材料与方法
1.1 材料
1.1.1 菌种及质粒 大肠埃希菌EscherichiacoliDH5α,酿酒酵母菌株(Saccharomycescerevisiae) W5,休哈塔假丝酵母(Candidashehatae) 20335由本实验室保存。质粒pMD18-T购自大连宝生物工程有限公司,载体构建骨架pKT0150和质粒p406ADH1购自Addgene公司。
1.1.2 主要培养基 LB液体培养基,用于E.coli的培养;YPD液体培养基,用于C.shehatae和S.cerevisiae的培养。
1.1.3 酶和主要试剂盒 EasyPfu DNA聚合酶、TaqDNA聚合酶购自北京全式金生物技术有限公司;限制性核酸内切酶KpnI、XhoI、NdeI、XbaI、HpaI购自宝生物工程有限公司;T4 DNA连接酶购自宝生物工程有限公司。YeastBusterTM酵母蛋白抽提试剂盒购自Novagen公司;真菌DNA提取试剂盒(目录号60304-50)购自绵阳高新区天泽基因工程有限公司;柱式胶回收试剂盒(目录号DP208/209)及柱式小量质粒抽提试剂盒(目录号W5001)均购自上海华舜生物技术有限公司;DNA纯化试剂盒购自Promege公司。
1.2 方法
1.2.1 引物设计 参照GenBank中已登陆的热带假丝酵母(Candidatropicali,序列号:DQ220745)和树干毕赤酵母(Pichiastipitis,序列号:NC009068)的xyl2基因序列,设计xyl2-up、xyl2-down简并引物对,用于克隆xyl2基因全长。另设计3对引物分别用于扩增G418抗性基因KanR、ADH1终止子片段及2.2 kb rDNA片段,在各上下游引物中分别加入用于质粒构建所需的酶切位点,同时在5′端加入保护碱基,各限制性内切酶位点为构建元件定向克隆到构建骨架质粒载体p406ADH1而设计。各引物序列见表1。

表1 引物序列及所加入的酶切位点
注:“+”为上游引物,“-”为下游引物;加下划线部分为酶切位点序列
1.2.2 各构建元件的克隆 利用设计的4对引物,按以下各反应程序PCR扩增重组质粒载体构建所需的4个元件片段(表2)。得到的各基因片段与载体pMD18-T连接后转化E.coliDH5α,经PCR筛选鉴定阳性重组质粒,并分别命名为pLXT-A、pLXT-G、pLXT-R、pLXT-X。阳性重组质粒的测序由Invitrogen公司完成。
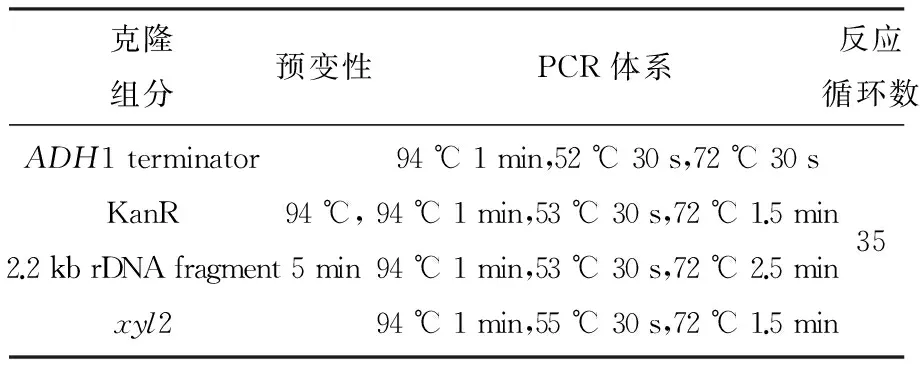
表2 4个克隆元件的PCR反应程序及相关参数
1.2.3 高拷贝整合表达载体pLX-AGRX的构建 将重组载体pLXT-A和表达载体p406ADH1用XhoI和KpnI进行双酶切后连接,构建重组表达载体pLX-A。将重组载体pLXT-G和上步构建表达载体pLX-A用NdeI和KpnⅠ进行双酶切后连接,构建重组表达载体pLX-AG。将重组载体pLXT-R和上步构建表达载体pLX-AG用NdeI单酶切后连接,构建重组表达载体pLX-AGR。将重组载体pLXT-X和上步构建表达载体pLX-AGR用XhoI和XbaI进行双酶切后连接,构建重组表达载体pLX-AGRX。将以上构建得到的质粒载体转化E.coliDH5α,提取质粒pLX-AGRX,采用酶切和PCR方法鉴定阳性克隆并保存备用。
1.2.4 重组质粒载体转化酿酒酵母 重组质粒pLX-AGRX用限制性内切酶HpaI进行单酶切线性化后,用醋酸锂法转化法对酿酒酵母W5进行转化。HpaI的单酶切位点位于特定2.2 kb rDNA片段的中部,重组质粒载体经该酶线性化后可以特异整合到酿酒酵母染色体的特定部位,以实现多拷贝同源重组。
1.2.5 重组酿酒酵母的筛选与鉴定 用含200 μg/mL(即G418对酿酒酵母W5的最低抑菌浓度)G418的YPD平板筛选阳性重组菌,当筛选平板上长出阳性重组菌后,挑选出长势较好的菌落,接种在更高浓度的G418平板上,通过提高G418浓度以筛选高拷贝的整合转化子。同时对经筛选得到的高拷贝转化子提取基因组DNA,通过PCR验证确定重组质粒载体是否已经整合到酿酒酵母的染色体上。
1.2.6 木糖醇脱氢酶酶活测定 采用考马斯亮蓝G-250染色的方法测定蛋白质浓度,粗酶液的制备采用Novagen公司的YeastBusterTM酵母专用蛋白抽提试剂盒,提取液作为粗酶液进行木糖醇脱氢酶酶活测定。木糖醇脱氢酶酶活为以l mL反应液在340 nm下检测NAD+被还原的量(即在340 nm做时间扫描)。酶的比活力定义为每mg酶蛋白,每分钟转化NAD+的μmol/L数即U/mg蛋白。
1.2.7 重组菌的稳定性测定 将筛选得到的高拷贝阳性酵母转化子接种于YPD液体培养基中,每隔12 h取样,系列稀释,以能在平板上长出单菌落为宜,分别在YPD和含G418的YPD平板上菌落计数,分别计为总菌数和带有整合质粒的菌落数,计算质粒载体稳定性。

2 结果与分析
2.1 重组T载体的构建
将所得ADH1终止子片段(283 bp)、G418抗性基因(1 457 bp)、rDNA序列、xyl2基因(1 095 bp)分别与pMD18-T载体连接后,转化E.coliDH5α,经PCR鉴定正确,进行测序,得到构建成功的4个重组T载体:pLXT-A、pLXT-G、pLXT-R、pLXT-X。PCR产物测序结果经比对,与质粒pKT0150上的ADH终止子序列和G418抗性基因的相似性分别为99%和100%。克隆的休哈塔假丝酵母的xyl2基因经比对,与毕赤树干酵母xyl2基因相似性为83%。由于GenBank数据库中没有休哈塔假丝酵母的xyl2基因序列,因此这是国内首次报道休哈塔假丝酵母的木糖醇脱氢酶基因,基因序列如图1。
2.2 高拷贝整合表达载体pLX-AGRX的构建
依次将ADH1终止子片段、G418抗性基因、特定2.2 kb rDNA片段和xyl2基因构建至质粒p406ADH1上,质粒构建过程如图2。提取质粒pLX-AGRX采用酶切和PCR进行验证,结果表明所有片段都正确连接至载体上,结果如图3。

图1 休哈塔假丝酵母木糖醇脱氢酶基因序列Fig.1 Gene sequence of Candida shehatae, xylitol dehydrogenase
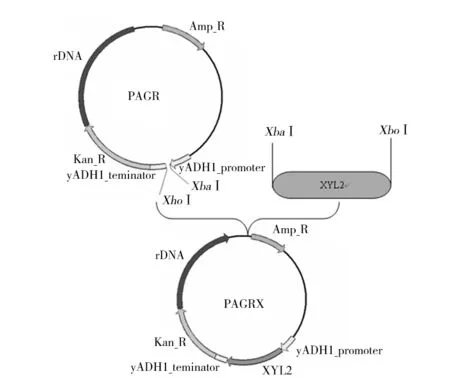
图2 构建表达载体pLX-AGRX示意图Fig.2 Construction of expression vector of pLX-AGRX

图3 Xho I和Xba I酶切鉴定结果Fig.3 Results of XhoⅠand XbaⅠdigestion reactionM1: DL15 000 Marker; 1: XhoⅠ、 XbaⅠ酶切阳性质粒pLX-AGRX-1结果; 2: XhoⅠ酶切阳性质粒pLX-AGRX-1结果; 3: XhoⅠ、 XbaⅠ酶切阴性质粒pLX-AGRX-2结果; 4: XhoI酶切阴性质粒pLX-AGRX-2结果; M2: DL2 000 MarkerM1: DNA Marker DL15 000; 1: The positive plasmid pLX-AGRX-1 digested with XhoⅠand XbaⅠ; 2: The positive plasmid pLX-AGRX-1 digested with XhoⅠ; 3: The positive plasmid pLX-AGRX-2 digested with XhoⅠand XbaⅠ; 4: The positive plasmid pLX-AGRX-2 digested with XhoⅠ; M2: DNA Marker DL2 000
由图3可以看出酶切验证结果pLX-AGRX-1和pLX-AGRX-2,2个质粒均呈阳性结果,图中呈现清晰的2条目的条带,1条在7 925 bp左右,另1条在1 095 bp左右,成功构建表达载体pLX-AGRX。
2.3 重组酿酒酵母的筛选与鉴定
选取最高G418浓度(800 μg/mL)YPD平板上长势较好的6个单菌落,作为重组菌株,分别命名为LX-1、LX-2、LX-3、LX-4、LX-5、LX-6。对筛选得到的6个高拷贝转化子提取基因组DNA,通过PCR扩增木糖醇脱氢酶基因,由图4可以确定质粒载体已整合到酿酒酵母的染色体上,以初始菌株酿酒酵母W5作为阴性对照,结果显示W5无此条带,证明构建的重组质粒载体pLX-AGRX已整合于酿酒酵母W5的染色体基因组中。
图4 阳性转化子的PCR鉴定结果Fig.4 PCR identification of positive transformantM: DNA Marker DL2 000; 1、 2、4~7: 转化子PCR结果; 3: W5基因组PCR结果M: DNA Marker DL2 000; 1, 2, 4~7: PCR result of the transformants; 3: PCR result of W5 genome
2.4 重组酿酒酵母的木糖醇脱氢酶酶活
测得受体菌酿酒酵母W5、供体菌休哈塔丝酵母20335及选取的6个转化子的木糖醇脱氢酶酶活结果见表3。
从酶活的测定结果可以看出,选取的6个转化子XDH活力均高于受体菌W5,但活力不如供体菌20335。6个耐G418抗性的重组菌株LX-1、LX-2、LX-3、LX-4、LX-5和LX-6,其酶活分别为48.194 9、49.184 1、47.032 2、65.957 4、34.606 1、60.463 3 μ/mg。LX-4、LX-6重组菌XDH活力与W5相比有较大幅度提高,分别为W5的2.16和1.98倍;LX-1、LX-2、LX-3重组菌XDH活力居中,分别为W5的1.58、1.61、1.54倍;LX-5重组菌XDH活力较小,为W5的1.13倍。结果表明所构建的质粒载体pLX-AGRX转化酿酒酵母细胞W5后成功地实现了木糖醇脱氢酶的高效表达。

表3 不同菌株中木糖醇脱氢酶的比活力(U/mg)
2.5 重组菌的稳定性
重组菌LX-4连续传代60世代后的稳定性为99.69%,表明所构建的高拷贝整合表达载体已稳定地整合到了工业酿酒酵母W5的染色体上,成为其基因组的一部分,使目的基因具有良好的遗传稳定性。重组菌株适合非选择性压力条件下的工业生产粗放环境。
3 讨 论
木糖醇脱氢酶是木糖代谢的重要限速酶之一,它的活性高低直接关系到乙醇产量的多少。本研究根据已有木糖醇脱氢酶蛋白相似性较高的特点设计简并引物,首次扩增得到休哈塔假丝酵母的木糖醇脱氢酶基因并构建高效表达木糖醇脱氢酶基因的高效表达载体pLX-AGRX。所构建的质粒必须有以下特点:一是载体上要有完整的表达盒,本研究用ADH1终止子替换CYC1终止子,然后插入木糖醇脱氢酶基因,与质粒本身自带的ADH1启动子构成完整的表达盒;二是载体上要有用于筛选阳性重组子的选择标记,本研究中构建质粒所使用的选择标记是目前文献报道中广泛使用的G418抗性基因,该基因克隆于Addgene公司的商品化质粒pKT0150;三是载体上要有与酿酒酵母同源的整合位点,酵母基因组中rDNA有100~200个重复单元,本研究以此为整合位点以提高木糖醇脱氢酶的表达量。
本研究得到的木糖醇脱氢酶酶活较高,最高的重组菌LX-4酶活可达65.957 4 U/mg,为W5的2.16倍。分析主要原因可能是本研究选用的提取酵母总蛋白的方法与以前报道的不同,本研究在测定木糖醇脱氢酶酶活之前提取粗酶液时,选择了Novagen公司的YeastBusterTM酵母专用蛋白抽提试剂盒对酵母菌株的活性蛋白进行提取。用该试剂盒中提供的试剂对酵母细胞进行处理后,显微镜镜检处理后的菌体细胞,基本看不到完整的细胞,细胞破碎率在95%以上,得到的粗提物中蛋白量大,活性蛋白比例较高,木糖醇脱氢酶的活力得以充分发挥。
[1] 辛亮, 秦锐, 宋刚, 等. 丙酮酸脱羧酶基因和乙醇脱氢酶基因表达载体的构建[J]. 微生物学杂志, 2012, 32(2): 9-14.
[2] 杨柳, 叶菁, 陈小燕, 等. 木糖异构酶基因xylA 表达载体构建[J]. 微生物学杂志, 2014, 34(3): 9-13.
[3] 钟桂芳, 付秀辉, 孙君社, 等. 发酵木糖生产酒精的研究进展及其应用前景[J]. 微生物学杂志, 2004, 24(1): 42-45.
[4] Sun Y, Cheng JY. Hydrolysis of lignocellulosic materials for ethanol production: a review[J]. Bioresource Technology, 2002,83(1): 1-11.
[5] Ladisch MR, Lin KW, Voloch M, et al. Process considerations in the enzymatic hydrolysis of biomass[J]. Enzyme and Microbial Technology, 1983, 5(2):82-102.
[6] 张洁宁, 田沈, 杨秀山. 提高木糖代谢能力的酿酒酵母Y5-X3的初步构建[J]. 可再生能源, 2012, 30(4): 47-51.
[7] 汤斌, 张风琴, 汤文晶, 等. 酿酒酵母代谢木糖工程菌的构建[J]. 食品与发酵工业, 2011, 37(11): 16-20.
[8] 张颖, 马瑞强, 洪浩舟, 等. 微生物木糖发酵产乙醇的代谢工程[J]. 生物工程学报, 2010 , 26(10): 1436-1443.
[10]Chu BCH, Lee H. Genetic improvement ofSaccharomycescerevisiaefor xylose fermentation[J]. Biotechnology Advances, 2007, 25: 425-441.
[11]沈煜, 王颖, 鲍晓明, 等. 酿酒酵母木糖发酵酒精途径工程的研究进展[J]. 生物工程学报, 2003, 19(5): 636-640.
[12]蒋凯, 李崎, 顾国贤. 构建高产谷胱甘肽啤酒酵母基因工程菌提高啤酒抗老化能力的研究[J]. 生物工程学报, 2007, 23(6): 1071-1076.
[13]Yuan Ping, Hong-Zhi Ling, Jing-Ping Ge, et al. Xylitol production from non-detoxified corncob hemicellulose acidhydrolysate byCandidatropicalis[J]. Biochemical Engineering Journal, 2013, 75: 86-91.
[14]张玉宝. 转化木糖醇生产L-木酮糖菌株的筛选[D]. 泰安: 山东农业大学,2013.
Construction of High-Copying Vector of Xylitol Dehydrogenase Gene and Its Expression in Saccharomyces cerevisiae
GE Jing-ping1, PEI Fang-yi1, HUANG Shou-feng1, ZHAO Jing-wen1, SONG Gang1, SUN Hong-bing1, LUO Xue1, PING Wen-xiang1, 2
(1.Coll.ofLifeSci.,HeilongjiangUni.,Agric.Microorg.Tech.Edu.Engin.Res.Ctr.,HeilongjiangProv.,Harbin150080; 2.Microb.Tech.Res.Ctr.forAgric.Edu.Pro.,HeilongjiangProv.,Harbin150500)
Being in a node position in xylose metabolism, xylitol dehydrogenase (XDH) is able to oxidate xylitol into xylulose. In this experiment the XDH genexyl2, ADH1 terminal subsequence and resistant gene G418 (KanR) of palsmid pKT0150 from the genome ofCandidashehatae20335 using PCR cloning, as well as specific 2.2 kb rDNA fragment ofS.serevisiaeW5 were obtained. The multicopying integrated expression vector pLX-AGRX was constructed using integrated vector p406ADH1 ofS.serevisiaeas a framework by means of genetic engineering. The recombinant vector pLX-AGRX was linearized and transferred intoS.cerevisiaeW5, then screened through high concentration G418 and PCR for double characterization, and proved that the recombinant vector pLX-AGRX was integrated into genome ofS.serevisiaeW5, it was tested that the activity of XDH was as high as 65.957 4 U/mg.
Candidashehatae; xylitol; xylitol dehydrogenase; vector construction;S.cerevisiae
国家自然科学基金项目(31270143);国家自然科学基金项目(31270534);国家自然科学基金项目(31470537);
葛菁萍 女,博士,教授,硕士生导师。主要研究方向为微生物学。E-mail:gejingping@126.com。
* 通讯作者。男,博士,教授,硕士生导师。主要研究方向为微生物遗传育种。Tel:0451-86609016,E-mail:wenxiangping@aliyun.com
2015-03-09;
2015-04-20
Q933
A
1005-7021(2015)05-0008-05
10.3969/j.issn.1005-7021.2015.05.002
黑龙江省高等学校科技创新团队(农业微生物发酵技术)项目(2012td009)