入侵植物紫茎泽兰叶内生真菌多样性研究
2015-12-26潘田扬殷照青李仙杰管清莹张汉波
潘田扬, 殷照青, 李仙杰, 韦 然, 管清莹, 蒋 欢, 张汉波*
(1.云南大学 生命科学学院,云南 昆明 650091;2. 云南白药集团股份有限公司, 云南 昆明 650500)
入侵植物紫茎泽兰叶内生真菌多样性研究
潘田扬1, 殷照青1, 李仙杰1, 韦 然1, 管清莹1, 蒋 欢2, 张汉波1*
(1.云南大学 生命科学学院,云南 昆明 650091;2. 云南白药集团股份有限公司, 云南 昆明 650500)
外来入侵植物通常要和当地的生物发生相互关系并对当地生态系统产生影响。为表明叶内生真菌是否有利于紫茎泽兰(Eupatoriumadenophorum)的入侵力,首次调查了其叶内生真菌多样性。利用过夜冰冻组织法和常规的麦芽汁琼脂平板培养法,分别于3、6月份从昆明西山、金殿种群分离得到312个菌株,根据其ITS基因差异,分为77个可操作分类单元(OTUs),系统发育地位分布在Agaricomycetes、Dothideomycetes、Sordariomycetes和 Pezizomycetes 4个纲。在低阶分类上这些真菌可分为19个属,优势属为链格孢属(Alternaria)(25.09%)和炭疽菌属(Colletotrichum)(10.80%)。有2.09%的菌株属于未知真菌。相比较,6月份的紫茎泽兰种群比3月份具有较高的内生真菌多样性。结果表明,入侵植物紫茎泽兰叶内生真菌非常丰富,这些真菌是否对紫茎泽兰的入侵力具有影响值得今后深入研究。
紫茎泽兰;入侵植物;内生真菌多样性;过夜冰冻组织法(ONFIT);麦芽汁琼脂平板培养法(MEA)
紫茎泽兰(Eupatoriumadenophorum)是我国危害最为严重的外来入侵植物之一。其原产中美洲,大约于20世纪40年代从中缅边境传入云南省,现已在云南、贵州、四川、广西、西藏等省区广泛分布,并不断向华中及华东方向蔓延。紫茎泽兰入侵的地区,物种多样性和生态稳定性明显降低,给我国的经济和环境造成了巨大的损失,防治形势极其严峻,因此了解其入侵机理对防治措施具有重要指导意义。目前有多个假说来解释生物入侵机理,比较有说服力的有新武器假说(Novel Weapons)、天敌逃逸假说(Enemy Release Hypothesis,ERH)、积累当地病原微生物假说(Accumulation of local pathogens)、空生态位假说(Empty Niche Hypothesis)等。最近有研究者认为叶内生菌能够增强植物的生态竞争能力,从而促进其入侵[1],这一观点正在成为当前生物入侵机理的研究热点。叶内生真菌是指一大类全部或大部分时间生活在植物叶细胞内或是细胞间隙,对植物未造成明显疾病症状的真菌。它们通常能提高宿主抵抗不良环境的能力,比如抗干旱、抗动物啃食、抗病原菌攻击等[2]。然而,这些结果主要来自对本土植物的研究。直到最近,人们才认识到外来植物垂直传播(Vertically Transmitted Endophytes, VTEs)内生真菌可能协助宿主入侵并建立种群[3]。比如,有内生菌的植株更容易在环境中建立种群[1];内生真菌Neotyphodiumcoenophialum能够促进外来植物Loliumarundinaceum入侵具有较高物种多样性的生物群落[4]等。相反,水平传播(Horizontally Transmitted Endophytes,HTEs)的内生菌对宿主的作用却很少引人注意[2],外来植物水平传播真菌的研究报道更是稀少。前期研究工作中我们发现紫茎泽兰的叶内生真菌主要是通过水平传播在入侵地获得[5]。那么,紫茎泽兰的叶内生真菌对其入侵力是否有影响呢?要回答这个问题,前提是系统探明紫茎泽兰叶内生真菌组成情况。本研究采用两种分离叶内生真菌的方法——过夜冰冻组织法(Overnight Freeze Incubation Technique,ONFIT法)和常规内生真菌分离法(Malt-extract Agar,MEA法),来探讨紫茎泽兰叶内生真菌不同地点、季节的组成情况,为进一步探讨内生真菌对紫茎泽兰入侵力的影响研究提供实验材料,进而为探明外来植物与本地微生物的相互作用关系奠定基础。
1 材料与方法
1.1 材料
研究样地为云南省昆明西山和金殿。西山样地位于经度(E)102°37.751,纬度(N)24°58.292,海拔1 953 m;金殿样地位于经度(E)102°47.253,纬度(N)25°05.145,海拔2 006 m。两样地受人为干扰少,紫茎泽兰长势旺盛,盖度在90%~100%。在样地内选取长势健康的紫茎泽兰植株,剪取由上而下的第4对健康无病斑的叶片,分装于纸质信封中,带回实验室24 h内处理。每个季节每个样地9个植株重复。
1.2 方法
1.2.1 分离方法 ①过夜冰冻组织法(ONFIT法): 将紫茎泽兰叶片浸于70%酒精15 s,再浸入5% NaClO 3 min进行表面消毒,置于无菌吸水纸上通风干燥15 min,平铺于装有无菌水的灭菌塑料盒上,-20 ℃冰冻24 h后取出,用自封袋罩袋室温放置6~7 d,观察统计出现的菌落形态和数量。每个样地每个季节共研究9对叶片。②常规内生真菌分离法(MEA法):将健康紫茎泽兰叶片靠中部叶脉组织剪成2 mm2小片,浸于0.5% NaClO 2 min,再浸入70%酒精2 min,用无菌镊子取出小叶片,将其平贴于2% MEA平板上。每叶片挑16小片放置,用封口膜封口,室温下放置3 d后连续观察统计出现的菌落形态和数量。每个样地每个季节共研究9对叶片。
1.2.2 菌株分子鉴定 采用CTAB真菌DNA提取法对分离得到的叶内生真菌提取DNA,然后使用引物ITS4和ITS5对其ITS rRNA基因进行扩增。使用3种限制性内切酶(BsuRI/HaeIII酶、HinfI酶和RsaI酶)对ITS基因的PCR产物进行酶切,3种酶切分型相同的归为一个“可操作分类单元 (Operational Taxonomic Unit,OTU)”,每个OTU中选择1个克隆为代表进行ITS rRNA基因扩增后,用小量胶回收试剂盒回收,送生物公司测序(深圳华大基因)。测序结果通过DNAStar、Chromas软件校对,并在NCBI中BLAST比对下载已发表的最高相似序列,相关序列用MEGA 4软件经CLUSTALW比对,采用Jukes-Cantor模型构建N-J树。
1.2.3 数据统计分析 利用Shannon-Wiener(H)指数反映内生真菌的多样性。H=-∑PilnPi,其中,H表示Shannon多样性指数,Pi表示第i个物种的比例,ln表示Pi的自然对数。为了比较不同群落的物种结构差异,将每个OTU包含的菌株编辑成与代表菌株相同的序列,使用SONS软件对不同地点、季节以及方法进行种群结构相似度分析。
2 结果与分析
2.1 物种多样性分析
采用两种实验方法共获得312个菌株,其ITS rRNA基因经3个限制性内切酶酶切后分为77个OTU。计算的多样性指数表明2种方法分离内生真菌的效果明显不同(表1)。3月份样品中,ONFIT法获得的内生真菌共有50株,其物种数有18种,而MEA法获得的共36株内生真菌中,其物种数有20种,多样性指数约为ONFIT法的1.1倍;6月份样品中,ONFIT法和MEA法分别获得菌株118和108个,其物种数分别为23和51种,MEA法分离到的内生真菌多样性指数为ONFIT法的近2.2倍。无论3月还是6月份,MEA法分离得到的物种多样性指数均较ONFIT法高。
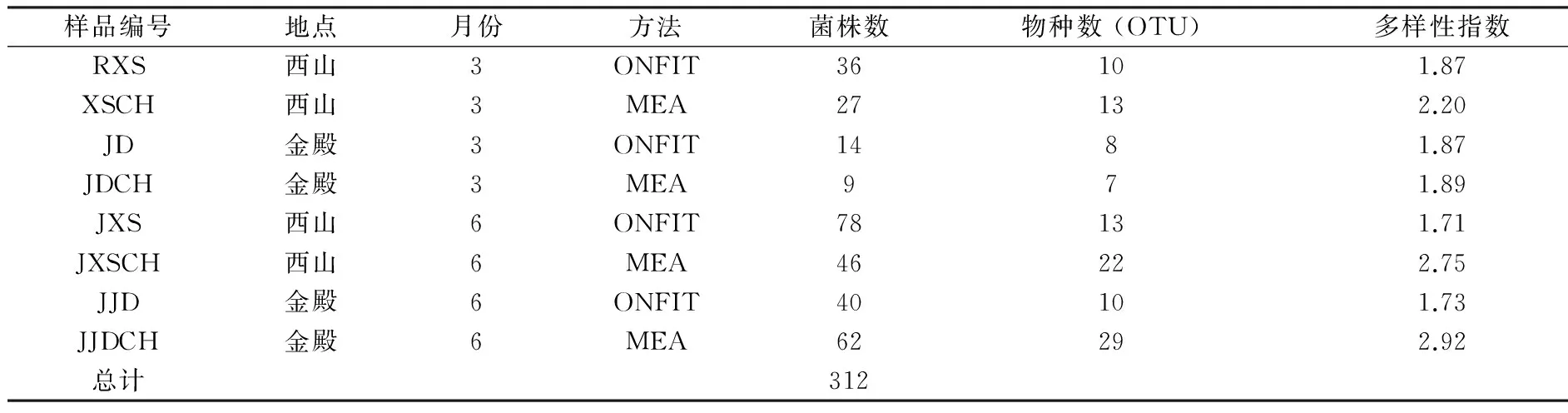
表1 ONFIT法和MEA法分离内生真菌的比较
使用SONS软件对不同地点、季节以及方法进行种群相似度比较(表2)。由表2可见,来自于不同方法的种群差异最大;不同季节的差异次之;而不同地点的种群差异最小。因此,采用合适的分离方法对研究物种多样性有明显影响。

表2 使用SONS软件对不同内生菌种群进行非参数估计
注:X、J分别表示从西山和金殿分离获得的菌株;S、L分别表示于3月和6月分离获得的菌株;O、M分别表示采用ONFIT法和MEA法分离获得的菌株;字母后面的数字1、2分别表示菌株从西山、金殿分离获得;θYC表示种群结构相似指数,括号内的值为标准误差
2.2 系统发育分析
将每个OTU选取代表菌株测序,成功59个(在GenBank上的登录号为JX624261~JX624319),代表了287个菌株。将代表菌株序列和其与NCBI上最近序列构建系统发育树(图1)。可以看出,这些真菌属于2个门(Basidiomycota和 Ascomycota)的4个纲(Agaricomycetes、Dothideomycetes、Sordariomycetes和 Pezizomycetes)。
在低阶分类上,这些真菌可分为19个属(表3)。其中Alternaria和Colletotrichum为两类优势菌,其比例分别为25.09%和10.80%。Alternaria由ONFIT法分离得到,在获得的72个Alternaria菌株中,仅4株来自于MEA方法。而Colletotrichum多由MEA法得到,在获得的31个Colletotrichum菌株中有21株是MEA法分离得到的。此外,Xylaria、Diaporthe、Phoma、Rachicladosporium四个属的菌株数也较多。
MEA法能分离得到一些ONFIT法未能获得的菌株,如Phanerochaete、Sordria、Nernania、Nodulisporium、Phyllosticta及Preussia,基本都出现于6月份通过MEA法获得的内生真菌中。系统树上也可看出紫茎泽兰叶内生真菌的组成情况在3月份及6月份有所差异。
使用2种分离方法在3月份分离得到的内生菌(属水平)在6月份均可再分离到,但在6月份出现的Phanerochaete、Coprinopsis、Nemania、Nodulisporium、Lecythophora、Phyllosticta、Pezizomycetes菌株,在3月份均未分离到。
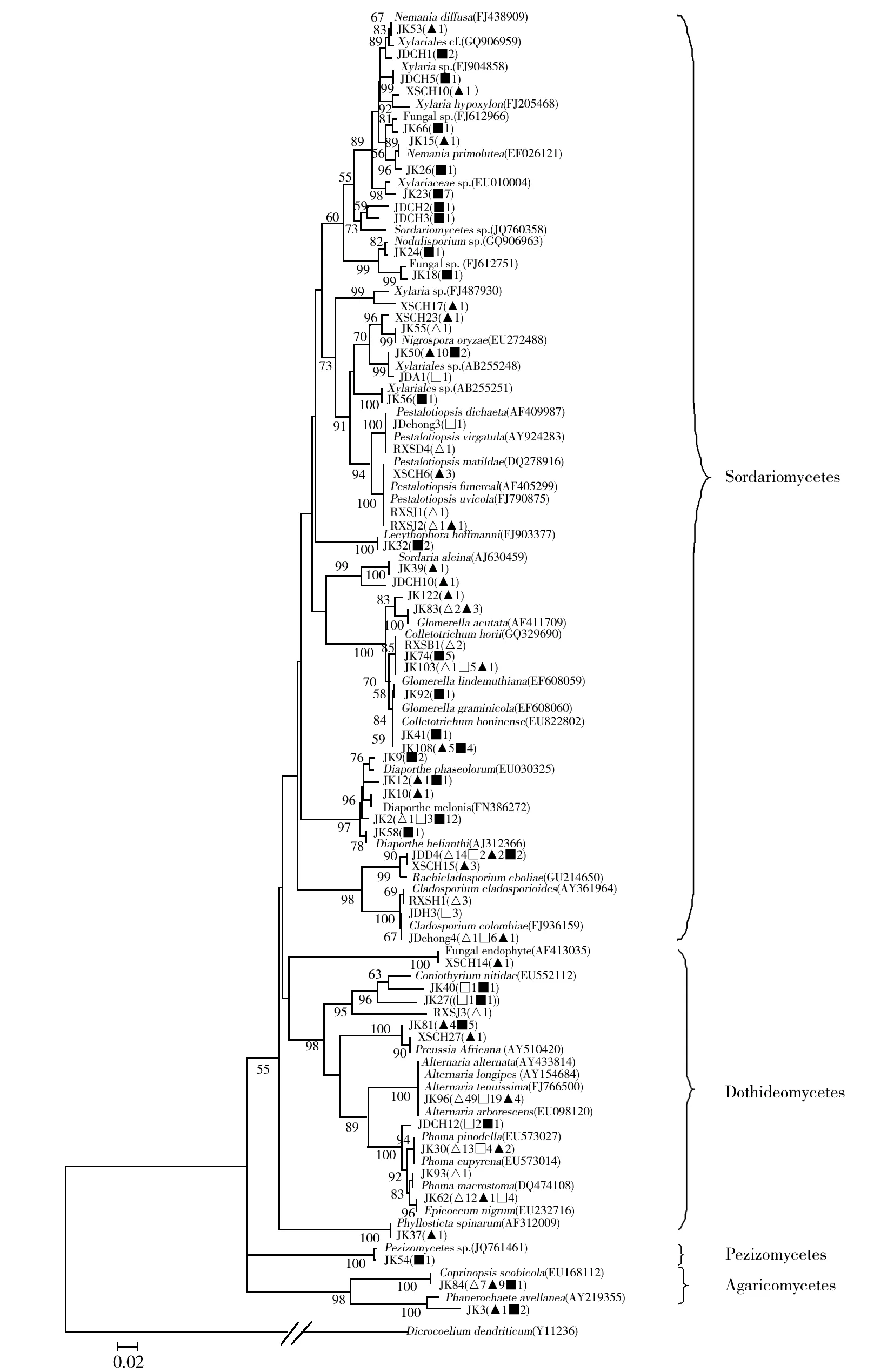
图1 ITS rRNA基因构建的系统发育树Fig.1 Phylogenetic tree constructed from ITS rRNA gene sequences
符号△和▲分别表示菌株采用ONFIT法和MEA法在西山分离获得;符号□和■分别表示菌株采用ONFIT法和MEA法在金殿分离获得;符号后面的值为获得的菌株数;相似序列后为该序列在GenBank的登录号;树上的值为bootstrap支持率;比例尺表示2%的序列差异;序列Dicrocoeliumdendriticum(Y11236)为外群
△ and ▲ represent strains isolated by ONFIT and MEA method from Xishan mountain, respectively; □ and ■ represent strains isolated by ONFIT and MEA method from Golden Temple, respetively; The values following the symbol represent strain number corresponding to the isolating method and location. GenBank accession numbers of reference sequences are shown in parentheses. Bootstrap values (1 000 replications) of >50% are indicated at branch nodes. The scale bar represents 2% estimated sequence divergence.Dicrocoeliumdendriticum(Y11236) is used as the outgroup
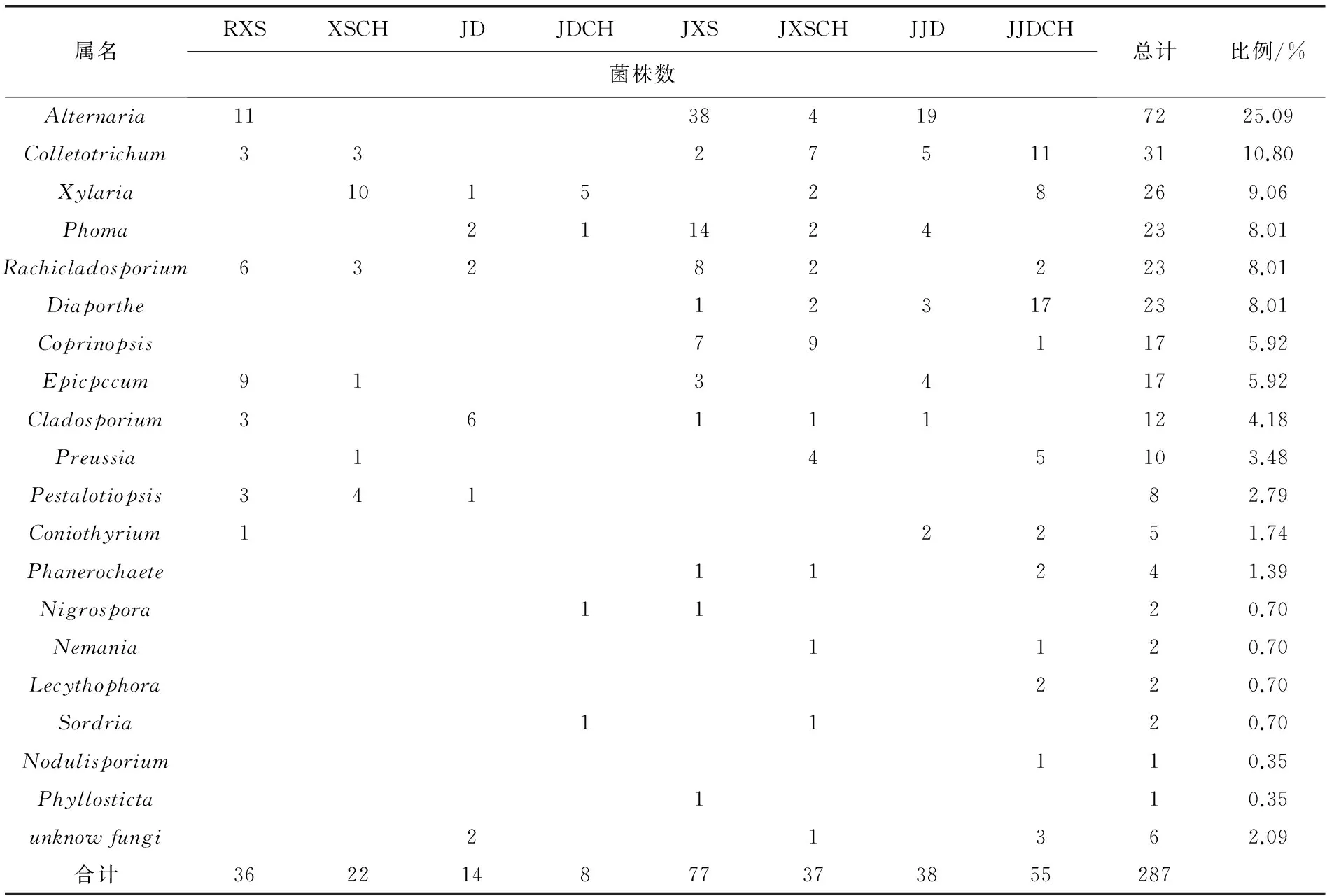
表3 两种方法分离昆明西山、金殿样地紫茎泽兰叶内生真菌在属水平上的分布
3 讨 论
前期工作发现紫茎泽兰叶内生真菌多样性随叶片年龄增加而递增,第3、4、5对叶片物种数较高[5];加上3月份有的紫茎泽兰植株仅有4对健康叶片存在,因此,本次研究仅调查了植株第4对叶的内生真菌组成情况。
结果发现,紫茎泽兰叶内生真菌在系统发育上属于担子菌门和子囊菌门的4个纲(图1),至少分为了19个属(表2)。目前有关入侵植物水平传播内生真菌的研究工作很少,仅见Shipunov等对入侵北美的黑矢车菊(Centaureastoebe)的报道。他们从美国西北部至东部及加拿大境内矢车菊中共分离得到的2 291株内生真菌,来自8个纲,最为常见的属为Alternaria。与矢车菊相比较,紫茎泽兰的内生菌组成范围相对较窄。然而,未来扩大地理范围的研究工作应当能够观察到更加多样的内生真菌物种存在。有44.3%的紫茎泽兰内生真菌属于Sordariomycetes纲,44.9%属于Dothideomycetes纲,但83.8%的矢车菊菌株属于Dothideomycetes纲。在属水平,尽管两种入侵植物的优势真菌都是Alternaria,但矢车菊其他常见的Botrytis及Fusarium在紫茎泽兰中却未分离得到,而紫茎泽兰常见内生菌如Colletotrichum、Xylaria、Rachicladosporium在矢车菊中也未出现(图1、表3)。因此,同样是菊科植物,其叶内生真菌的物种组成有较大的差异。
内生真菌通常能够产生一些植物生长激素、蛋白因子等来促进宿主植物的生长[6]。不过,Newcombe等[7]发现内生真菌对入侵植物黑矢车菊的生长一般呈负反馈作用,只有当黑矢车菊与其他植物竞争时,内生菌才通过产生化感物质来抑制其他植物生长来增加宿主的竞争优势。这些结果表明植物内生菌对宿主的生理功能比较复杂,受多种外界因素的影响。我们也发现内生菌Colletotrichum对紫茎泽兰的生长无明显促进作用,但对其逃逸天敌(抗昆虫啃食)表现为一定程度的有利作用[8]。因此,这些优势内生真菌对紫茎泽兰入侵力的影响值得进一步深入研究。
有报道表明入侵植物内生真菌多数是一些非宿主专一性菌株,如Colletotrichum、Phoma等既有植物内生菌也有植物泛病原菌。可以看到,从紫茎泽兰叶内分离到的很多属也是植物本身常见病原菌,如两种优势菌链格孢菌Alternaria以及炭疽菌Colletotrichum。早期有报道表明从紫茎泽兰叶病斑分离到的真菌很多属于Alternaria[9]。这些结果暗示紫茎泽兰叶内生真菌与植物病原菌可能有很广泛的联系,未来值得深入研究这些从病斑与健康叶组织分离得到的内生菌的遗传关系。
从分离方法上看,普遍适用的MEA法确实能够分离出更多样的内生真菌类群。 ONFIT法最初是用来分离链格孢菌(Alternaria)的有效方法,我们的研究发现其确实能够分离出较多的链格孢菌。其分离出的内生真菌种类明显较少的原因之一可能在于,各种内生真菌在冰冻叶片上蔓延生长,由于菌株间存在相互竞争关系,生长快的菌抑制了同区域内其他菌的生长,后者不能形成可见菌落从而不能被分离出来[5]。此外,紫茎泽兰6月份的内生菌物种多样性要比3月份高。这种差异可能与不同季节的环境因素有关,比如湿度[10]。因为昆明6月份较3月份潮湿,而很多水平传播的真菌是通过孢子进行传播[2],降水的增多有利于其孢子感染。此外,本次研究只对ITS基因进行扩增也限制了对其物种组成的准确鉴定,未来采用多基因分析方法并结合形态学分类将能更准确全面阐明紫茎泽兰叶内生真菌的多样性。
由于本次研究的紫茎泽兰种群仅来自昆明地区的2个样点,取样位置较接近,内生真菌的物种组成差异是否随地理环境改变而改变需要扩大样地进行研究。其次,真菌生长受温度影响较大,但昆明季节温度差异不显著,因此本次研究的结果尚不能很好地体现温度差异对紫茎泽兰内生真菌的多样性影响。
[1] Rodrigues R J, Redmen R S, Henson M. The role of fungal symbioses in the adaptation of plant to high stress environments[J]. Mitigation and Adaptation Strategies for Global Change, 2004, 9(3): 261-272.
[2] Arnold A E. Understanding the diversity of foliar endophytic fungi: progress, challenges, and frontiers[J]. Fungal Biology Reviews, 2007, 21(2-3): 51-66.
[3] Saikkonen K, Wali P, Helander M, et al. Evolution of endophyte-plant Symbioses[J]. Trends in Plant Science, 2004, 9(6): 275-280.
[4] Rudgers J A, Mattingly W B, Koslow J M. Mutualistic fungus promotes plant invasion into diverse communities[J]. Oecologia, 2005, 144(3): 463-471.
[5] Jiang H, Shi Y T, Zhou Z X, et al. Leaf chemistry and co-occurring species interactions affecting the endophytic fungal composition ofEupatoriumadenophorum[J]. Annals of Microbiology, 2011, 61(3): 655-662.
[6] 赵明治, 杨秀芬, 张明, 等. 一种促进植物根系生长的极细链格孢菌蛋白质分离、纯化和生物功能[J]. 中国生物防治, 2007, 23(2): 170-173.
[7] Newcombe G, Shipunov A, Elgenbrode S D, et al. Endophytes influence protection and growth of an invasive plant [J]. Communicate and Integrative Biology, 2009, 2(1): 29-31.
[8] 陈莉敏. 优势内生真菌对紫茎泽兰的生长和逃逸天敌作用研究[D].昆明:云南大学, 2012.
[9] 屠然,黎亚洁,李颖,等. 入侵植物紫茎泽兰叶斑真菌多样性及其致病性研究[J].云南大学学报, 2009, 31(5): 521-527.
[10]邓祖军, 曹理想, Vrijmoed-Lilian L P, 等. 红树林植物桐花树内生真菌类群分布的研究[J].热带海洋学报, 2010, 29(3): 77-81.
Diversity of Foliar Endophytic Fungi of Invasive Plant Purpurstem Eupatorium (Eupatorium adenophorum)
PAN Tian-yang1, YIN Zhao-qing1, LI Xian-jie1, WEI Ran1, GUAN Qing-ying1, JIANG Huan2, ZHANG Han-bo1
(1.Coll.ofLfeSci.,YunnanUni.,Kunming650091; 2.YunnanBaiyaoGroupLtd.,Kunming650500)
An exotic invasive plant usually has mutual relation with local organisms and they will affect local eco-system. In order to show whether the foliar endophytic fungi (FEF) of purpurstem Eupatorium (PE) conduce to the invasion, the diversity of FEF of PE was investigated for the first time in this study. Fresh and healthy leaves of PE populations from Mt. Xishan and Golden Temple were collected in March and June, and a total of 312 fungal strains were isolated using routine MEA (malt-extract agar) and ONFIT (overnight freeze incubation technique). Based on the differences of ITS gene, these fungi were divided into 77 operational taxonomic units (OTUs), phylogenetically belonging to the Class of Agaricomycetes, Dothideomycetes, Sordariomycetes, and Pezizomycetes. At lower taxonomy level, they were divided into 19 genera, and the dominant fungi includeAlternariasp. (25.09%) andColletotrichumsp. (10.80%). There were 2.09% strains belonging to unknown fungi. Relatively, higher diversity of endophytes from PE was found in June than those in March. The results showed that FEF in invasive PE was rich, whether these fungi has any influences on the invasion of PE is worth to study deeper in the future.
Eupatoriumadenophorum; invasive plant; diversity of endophytic fungi; overnight freeze incubation technique (ONFIT); MEA method
云南大学大学生创新性实验项目(121067306);国家自然科学基金项目(30960077,31360153)
潘田扬 女,大学本科。主要从事古生物学研究。E-mail: panty9@163.com
* 通讯作者。男,博士,教授,博士生导师。主要从事微生物生态学研究。Tel:0871-65031412, E-mail: zhhb@ynu.edu.cn
2014-03-14;
2015-03-19
Q93
A
1005-7021(2015)05-0073-06
10.3969/j.issn.1005-7021.2015.05.013