猪圆环病毒Ⅱ型抗体检测ELISA试剂盒的制备
2015-12-27王爱萍李鹏飞周景明张改平祁艳华扣莉云车志芬
王爱萍, 李鹏飞, 周景明, 张改平, 祁艳华,扣莉云, 车志芬, 蒋 敏
(郑州大学 生命科学学院 河南 郑州 450001)
猪圆环病毒Ⅱ型抗体检测ELISA试剂盒的制备
王爱萍, 李鹏飞, 周景明, 张改平, 祁艳华,扣莉云, 车志芬, 蒋 敏
(郑州大学 生命科学学院 河南 郑州 450001)
猪圆环病毒(PCV)两个血清型中只有PCV2为致病性病毒.将ORF2蛋白作为抗原建立区别两型PCV的血清学检测方法.去除N端信号肽的ORF2片段在大肠杆菌中BL21(DE3)中进行了表达.SDS-PAGE凝胶电泳表明在26 kD处有一个明显的表达条带,并且可以和猪圆环病毒阳性血清发生反应,表明重组蛋白表达成功.以表达的ORF2蛋白作为包被原,建立了检测猪圆环病毒、猪繁殖与呼吸综合征病毒抗体的间接ELISA方法.与商品化试剂盒同时检验78份临床血清,符合率为95 %;同时与猪瘟病毒、猪细小病毒、猪伪狂犬病毒均无交叉反应.
猪圆环病毒; ORF2; 抗体检测; 试剂盒
0 引言
猪圆环病毒病是由猪圆环病毒Ⅱ型(porcine circovirus type 2, PCV2)引起的一种猪的重要传染性疾病,PCV2的感染会引起免疫抑制,引发其他疾病的感染,如断奶仔猪多系统衰竭综合征(post weaning multisystemic wasting syndrome, PMWS)、猪呼吸道疾病综合征(porcine respiratory disease complex, PRDC)、猪皮炎与肾病综合征(porcine dermatitis and nephropathy syndrome, PDNS)和繁殖障碍[1].
PCV2自被发现以来,在世界范围内广泛流行,对养猪业造成了巨大的损失[2].PCV2目前被分为PCV2a、PCV2b和PCV2c 3个基因型,其中PCV2b的毒力最强,在自然条件下流行范围最广[3].碱基突变率较高可能是PCV2流行的一大原因,这也暗示了未来将会出现新的PCV2亚型.对于PCV2的感染,目前尚无有效的预防和治疗措施,传统的检测方法大多需要复杂的实验仪器和操作,仅适用于实验室检测.所以,建立一种特异性强、敏感性高、快速简便的检测方法对疾病的早期诊断是至关重要的,可以从根本上有助于相关疾病的防控.目前,对PCV2开放阅读框研究较深入的是ORF1和ORF2[4].ORF1编码的Rep蛋白,与病毒的复制有关,其序列非常保守,在两型PCV中同源性很高[5];而ORF2编码的Cap蛋白与病毒的结构有关,是型特异性抗原,含有和PCV2阳性血清反应的位点[6].本实验旨在通过原核表达系统表达可溶性的ORF2蛋白作为包被抗原,进而研制出一种快速有效的猪圆环病毒抗体ELISA检测试剂盒.
1 材料和方法
1.1 主要试剂和酶
IPTG、卡那霉素购自Solarbio公司,HRP标记羊抗猪IgG购自Abbkine公司,AEC酶底物显色试剂盒购自中彬金桥,预染Marker购自Thermo公司,猪圆环病毒阳性血清和阴性血清购自美国VMRD公司,咪唑购自科密欧公司,脱脂奶购自上海生工.
1.2 重组ORF2蛋白的表达及条件优化
将载体pET-28a-ORF2转化大肠杆菌BL21(DE3)感受态细胞,从平板上挑取阳性克隆,接种于含30 mg/mL卡那霉素的LB培养基中,培养过夜.次日取50 μL菌液接种于5 mL含有30 mg/mL卡那霉素的LB培养基中,37 ℃培养2 h至OD600值为0.6~0.8,加入终浓度为1 mM的IPTG,诱导8 h后取样.同时诱导菌种pET-28a-BL21(DE3)作为阴性对照.SDS-PAGE凝胶电泳鉴定蛋白表达情况.
1.3 重组ORF2蛋白的可溶性分析
取2 μL重组菌种pET-28a-ORF2-BL21 加入2 mL含30 mg/mL卡那霉素的LB培养基中,培养过夜.次日取1 mL菌液接种于100 mL含有30 mg/mL卡那霉素的LB培养基中,37 ℃培养2 h至OD600值为0.6~0.8,加入IPTG后分别于25 ℃,30 ℃,37 ℃诱导蛋白表达.诱导后,12 000 rpm,离心20 min收集菌体,用裂解缓冲液重悬,于冰水浴中超声破碎.超声条件为:超声3 s,停3 s,工作时间20 min.将超声后的产物12 000 rpm,离心20 min,沉淀用PBS重悬,分别取上清、沉淀做SDS-PAGE凝胶电泳,鉴定蛋白可溶性.
1.4 重组ORF2蛋白的纯化与鉴定
使用镍柱亲和层析对可溶性的ORF2蛋白进行纯化,设置流速为1 mL/min,使蛋白与层析柱充分结合.分别用250 mM、500 mM的咪唑洗脱目的蛋白. 将收集到的蛋白液用SDS-PAGE凝胶电泳鉴定其组分.洗脱得到的ORF2蛋白立即放入PBS缓冲液中,透析72 h,期间每4 h换液一次.取20 μL纯化过的蛋白样品,进行SDS-PAGE凝胶电泳.染色前,进行Western blot分析,其中一抗选用PCV2阳性血清.
1.5 PCV2抗体检测ELISA方法的建立
1.5.1 抗原包被浓度和血清最佳稀释度的确定 用CBS梯度稀释ORF2蛋白,使终浓度分别为20 μg/mL,10 μg/mL,5 μg/mL,2.5 μg/mL,1.25 μg/mL,0.625 μg/mL,0.312 5 μg/mL,每孔50 μL加入96孔酶标板,4 ℃包被过夜.37 ℃封闭后,加入阳性和阴性血清.按1∶500,1∶1 000,1∶2 000,1∶4 000,1∶8 000将阴阳性血清稀释后,每孔50 μL加入96孔酶标板.PBST洗涤3次后加入稀释过的HRP-兔抗猪IgG,每孔50 μL,37 ℃反应1 h,加入TMB底物显色.显色15 min后加入终止液50 μL终止反应,在10 min内用酶标仪读出各孔的OD450值.比较阴性血清和阳性血清的OD450值,选取阳性血清OD450值接近1.0且P/N值最低的一组,作为抗原最佳包被浓度和血清的稀释度.
1.5.2 最佳包被条件的确定 以已经确定的包被浓度包被重组ORF2蛋白,50 μL/孔加入酶标板.设置包被条件分别为:37 ℃ 2 h;4 ℃过夜;37 ℃ 3 h;37 ℃ 4 h.封闭后,加入最佳稀释度的阴性和阳性血清,其余步骤按照常规ELISA方法操作.显色后比较阴性血清和阳性血清的OD450值及P/N值,确定抗原包被的最佳条件.
1.5.3 最佳封闭液的确定 以最佳包被浓度包被重组ORF2蛋白,50 μL/孔加入酶标板.分别用1 % BSA,5 % BSA,5 %脱脂奶,5 %猪血清37 ℃封闭2 h.其余步骤按照常规ELISA方法操作.显色后比较阴性血清和阳性血清的OD450值及P/N值,确定最佳封闭液.
1.5.4 一抗血清最佳反应时间的确定 以已经确定的包被浓度包被重组ORF2蛋白,50 μL/孔加入96孔酶标板.封闭后,将阴阳性血清按照已经确定的稀释度加入96孔酶标板,设置血清在37 ℃反应时间为30 min,60 min,90 min,其余步骤按照常规ELISA方法操作.显色后比较阴性血清和阳性血清的OD450值及P/N值,确定一抗血清最佳反应时间.
1.5.5 酶标二抗最佳工作浓度的确定 以已经确定的包被浓度包被重组ORF2蛋白,50 μL/孔加入酶标板.封闭后,将阴阳性血清按照已经确定的稀释度加入96孔酶标板,37 ℃孵育后,将酶标二抗梯度稀释,按1∶2 000,1∶5 000,1∶8 000加入96孔酶标板.其余步骤按照常规ELISA方法操作.显色后比较阴性血清和阳性血清的OD450值及P/N值,确定酶标二抗最佳稀释浓度.
1.5.6 酶标二抗最佳工作时间的确定 以已经确定的包被浓度包被重组ORF2蛋白,50 μL/孔加入酶标板.封闭后,将阴阳性血清按照已经确定的稀释度加入96孔酶标板,37 ℃孵育.加入最佳稀释浓度的酶标二抗,分别设置二抗反应时间为30 min,45 min,60 min,其余步骤按照常规ELISA方法操作.显色后比较阴性血清和阳性血清的OD450值及P/N值,确定酶标二抗最佳工作时间.
1.5.7 显色时间的确定 以最佳包被浓度包被重组ORF2蛋白,50 μL/孔加入酶标板.封闭后,将阴阳性血清按照已经确定的稀释度加入96孔酶标板,37 ℃孵育.加入最佳稀释浓度的酶标二抗,37 ℃孵育后,加入TMB底物,设置显色时间分别为5 min,10 min,15 min.显色后比较阴性血清和阳性血清的OD450值及P/N值,确定最佳显色时间.

1.6 交叉反应实验
用建立的ELISA方法同时检测PCV2、猪瘟病毒(CSFV)、猪繁殖与呼吸综合症病毒(PRRSV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)的阳性血清,分析此检测方法是否会与其他病原体的抗体产生交叉反应.
1.7 临床血清样品检测
用建立的ELISA方法检测78份不同抗体效价的血清样本,与商品化的试剂盒(深圳绿诗源)的检测结果比较,确定该检测方法结果的可靠性.
1.8 试剂盒重复性和保存时间实验
使用不同批次组装的试剂盒检测同样的6份待检样品,分析其变异系数.将试剂盒放置在37 ℃,在不同时间段采样,分析其各个组分的P/N值,分析试剂盒各组分保存的时间.
2 结果与分析
2.1 重组ORF2蛋白的表达及鉴定
37 ℃、220 rpm震荡培养重组菌种pET-28a-ORF2-BL21,待OD600值达到0.6~0.8时,加入终浓度为1 mM的IPTG,进行诱导.诱导8 h后取样,SDS-PAGE凝胶电泳鉴定蛋白表达情况,同时用pET-28a-ORF2-BL21菌液样品做对照(图1),结果表明,与pET-28a-BL21相比,重组菌种pET-28a-ORF2-BL21在26 kD处有明显的表达条带.
2.2 重组ORF2蛋白的可溶性分析
本实验设置25 ℃、30 ℃和37 ℃3个温度梯度分别诱导蛋白表达,超声后分别取上清,沉淀进行SDS-PAGE凝胶电泳分析(图2).结果表明,在30 ℃诱导时,可溶性蛋白的产量最高.

M:Marker;1~4:pET-28a-ORF2-BL21 诱导产物; 5:pET-28a-BL21诱导产物图1 重组蛋白ORF2的SDS-PAGE分析Fig.1 SDS-PAGE analysis of recombinant ORF2 protein

M:Marker;1:37 ℃诱导上清;2:37 ℃诱导沉淀; 3:30 ℃诱导上清;4:30 ℃诱导沉淀;5:25 ℃诱导上清; 6:25 ℃诱导沉淀;7.空载对照图2 重组蛋白ORF2的可溶性分析Fig.2 Solubility analysis of recombinant ORF2 protein
2.3 重组ORF2蛋白的纯化与反应原性鉴定
由于重组蛋白带有His标签,故选用镍柱亲和层析对重组蛋白进行纯化,结果见图3.使用猪圆环病毒阳性血清作为一抗,对蛋白样品进行Western blot分析(结果如图4).结果表明,表达的重组ORF2蛋白能够和PCV2的阳性血清反应,出现明显的反应条带,大小约为26 kD.证明了表达的重组ORF2蛋白可以有效地作为包被原识别PCV2阳性血清中的抗体.
2.4 PCV2抗体检测ELISA方法的建立
2.4.1 抗原最佳包被浓度和血清最佳稀释度的确定 由表1可知,当重组蛋白的包被浓度为5 μg/mL时,OD450值为0.979,P/N值最高,为6.157,此时血清稀释浓度为1∶1 000.由此确定出,抗原的最佳包被浓度为5 μg/mL,血清的最佳稀释度为1∶1 000.
2.4.2 重组抗原包被条件的确定 结果如表2所示,在抗原4 ℃包被过夜的条件下,P/N值最高,因此确定4 ℃过夜为抗原的最佳包被条件.

M:Marker;1:500 mM咪唑洗脱蛋白图3 重组蛋白ORF2纯化结果Fig.3 Purification of recombinant ORF2 protein

M:Marker;1:重组蛋白与PCV2阳性血清反应图4 重组ORF2蛋白与PCV2阳性血清反应Fig.4 Reaction between ORF2 and PCV2 positive serum 表1 重组ORF2蛋白最佳包被浓度与血清稀释度的确定Tab.1 The best package concentration of antigen and sera dilution

血清稀释倍数抗原包被浓度/μg·mL-1201052.51.250.6250.3125+2.6151.791.1720.5850.410.2190.1541∶500-0.370.3380.290.2240.2670.2180.205P/N7.0685.2964.0412.6121.5361.0050.751+1.8321.7130.9790.5370.2890.2190.1321∶1000-0.2890.2110.1590.1490.1470.1350.145P/N6.3398.1186.1573.6041.9661.6220.91+1.8950.8520.7380.310.2220.170.1141∶2000-0.1810.1490.140.1050.1210.0960.089P/N10.475.7185.2712.9521.8351.7711.281+2.1320.9430.3630.1750.140.1110.0861∶4000-0.2610.1750.0890.0880.0940.0940.087P/N8.1695.3894.0791.9891.4891.1810.989+1.7860.5460.3530.1880.1120.0930.081∶8000-0.270.0650.0680.0630.0640.0690.06P/N6.6158.45.1912.9841.751.3481.333

表2 重组抗原最佳包被条件的确定Tab.2 Best package condition of antigen
2.4.3 最佳封闭液的确定 重复两次实验,结果如表3,当使用5 %脱脂奶作为封闭液时,P/N值最高,因此确定最佳封闭液为5 %脱脂奶.

表3 最佳封闭液的确定Tab.3 Determination of best blocking solution
2.4.4 一抗血清最佳反应时间的确定 重复两次试验,结果如表4所示,当一抗血清反应时间为30 min时,阴性血清OD450最低,P/N值最低,因此确定一抗血清最佳反应时间为30 min.
2.4.5 酶标二抗最佳稀释度的确定 重复两次实验,结果如表5,当酶标二抗的稀释浓度为1∶5 000时,P/N值最高,因此确定酶标二抗最佳稀释度为1∶5 000.
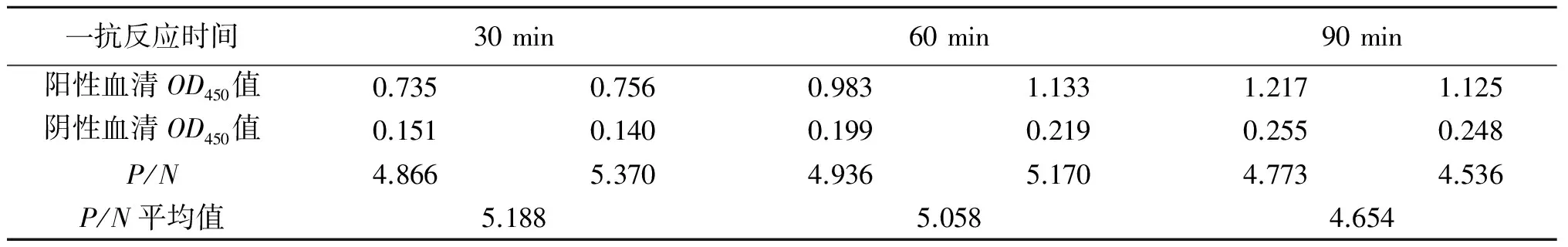
表4 一抗血清最佳反应时间的确定Tab.4 Determination of optimal reaction time of serum

表5 酶标二抗最佳稀释浓度的确定Tab.5 Determination of second antibody dilution
2.4.6 酶标二抗最佳反应时间的确定 通过两次重复试验,结果如表6,当酶标二抗反应时间为60 min时,P/N值最高,因此确定酶标二抗最佳工作时间为60 min.

表6 酶标二抗最佳反应时间的确定Tab.6 Determination of optimal reaction time of second antibody
2.4.7 显色时间的确定 结果如表7所示,当显色时间为 5 min时,P/N值最高,因此确定最佳显色时间为5 min.

表7 最佳显色时间的确定Tab.7 Determination of optimal reaction time of TMB


表8 PCV2阴性血清检测结果Tab.8 Detection results of negative serum samples
2.5 交叉反应实验
使用建立的ELISA方法同时检测PCV2、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)的阳性血清,结果如表9所示,除PCV2阳性血清外,其他血清的OD450值均小于0.25,说明该方法具有很好的特异性.

表9 交叉反应实验结果Tab.9 Results of crossing reaction
2.6 临床样品检测
使用上述方法方法对78份临床血清样品进行检测,同时和商品化试剂盒(深圳绿诗源)进行对比.结果表明,本方法与商品化试剂盒的符合率达到95%,结果可信度高.
2.7 试剂盒重复性和保质期的确定
使用3个不同批次组成的试剂盒对6个待检血清进行检测,具体结果如表10所示,该试剂盒的变异系

表10 试剂盒重复性分析Tab.10 Detection results of repeatability of ELISA kit
数均小于10 %,说明具有良好的重复性.保存期实验证明,试剂盒在37 ℃放置1个月内,各组分保持稳定.
3 讨论
PCV2的基因组为共价闭合的单链、环状DNA,含有11个开放阅读框.ORF1编码与病毒复制相关的Rep蛋白,该蛋白氨基酸序列非常保守,是决定PCV1和PCV2之间抗原交叉反应性的区域.而ORF2编码的结构蛋白核苷酸同源性比较低,两型PCV之间无交叉反应.PCV2的ORF2蛋白含有4个反应位点,其中第12~18和第34~41位氨基酸残基与Cap蛋白的定位有关,而69~83和117~131位氨基酸残基是与PCV2抗血清反应的位点[8].所以用Cap蛋白作为诊断抗原,用来构建快速、灵敏的猪圆环病毒抗体检测方法是可行的.本研究将ORF2基因的信号肽基因序列去掉后在大肠杆菌BL21(DE3)中进行表达,通过条件优化,最终确定30 ℃,0.8 mM的IPTG诱导时,可溶性的蛋白最多.使用镍柱亲和层析对表达的蛋白进行纯化,最终得到高纯度的重组ORF2蛋白.
本研究在大肠杆菌中表达了的ORF2蛋白的主要抗原序列,并以此为基础,成功建立了间接ELISA方法来进行PCV2血清中抗体的检测.确定了最佳抗原包被浓度(5 μg/mL)、包被时间(4 ℃过夜)、封闭液(5 %脱脂奶)、一抗(1∶1 000,1 h)和二抗(1∶5 000,1 h)的稀释浓度及作用时间、显色时间(5 min),从而减少了非特异性反应.在很多报告中,均以BSA作为封闭液的封闭效果较好,但是本研究中,以5 %的脱脂奶作为封闭液时,P/N值最高,效果最好.脱脂奶具有廉价、易得等优点,因此非常适用于商品化使用.
用深圳绿诗源生产的PCV2抗体检测试剂盒的检测结果作为基础,对本研究建立的检测方法进行评估.结果表明本研究建立的ELISA检测方法与商品化试剂盒的符合率为95 %,并且与CSFV,PRRSV,PPV,PRV均无交叉反应,可以用于PCV2的临床诊断和流行病学调查.
[1] Sylla S, Cong Y L,Sun Y X,et al.Protective immunity conferred by porcine circovirus 2 ORF2-based DNA vaccine in mice[J].Microbiol Immunol, 2014,58(7):398-408.
[2] Kim J,Jung K,Chae C.Prevalence of porcine circovirus type 2 in aborted fetuses and stillborn piglets[J].Vet Rec,2004,155(16):489-492.
[3] 刘玲利,崔克.猪圆环病毒疫苗研究进展[J].中国热带医学,2013,13(11):1428-1430.
[4] Fenaux M,Opriessnig T,Halbur P G,et al.Two amino acid mutations in the capsid protein of type 2 porcine circovirus (PCV2) enhanced PCV2 replication in vitro and attenuated the virus in vivo[J].Journal of Virology,2004,78(24):13440-13446.
[5] Sun X,Wertz N,Lager K M,et al.Antibody repertoire development in fetal and neonatal piglets. XV. Porcine circovirus type 2 infection differentially affects serum IgG levels and antibodies to ORF2 in piglets free from other environmental factors[J].Vaccine,2012,31(1):141-148.
[6] Chao A,Fu P,Guo X,et al.Immune efficacy in mice by recombinant pseudorabies virus PGO expressing ORF2 gene of porcine circovirus type 2 [J].Acta Microbiol Sin,2014,54(2):211-217.
[7] 王春林.猪圆环病毒2型间接ELISA试剂盒以及免疫试纸条的研制[D].南京:南京农业大学,2012.
[8] Guo H C, Feng X M,Sun S L,et al.Immunization of mice by hollow mesoporous silica nanoparticles as carriers of porcine circovirus type 2 ORF2 protein[J].Virol J,2012,9:108.
(责任编辑:王浩毅)
Production of PCV2 Antibody Detection ELISA Kit
WANG Ai-ping, LI Peng-fei, ZHOU Jing-ming, ZHANG Gai-ping, QI Yan-hua,KOU Li-yun, CHE Zhi-fen, JIANG Min
(SchoolofLifeScience,ZhengzhouUniversity,Zhengzhou450001,China)
Porcine circovirous(PCV)can be sub-classified two serotypes and only PCV2 is pathogenic. ORF2 could be used as special antigen to construct a serum detection method. After deleting the signal sequence, the rest ORF2 sequence was expressed in Escherichia coli BL21(DE3). Result of SDS-PAGE gel electrophoresis indicated a 26 kD stripe, which was consistent with the predicted. Besides, the recombinant ORF2 protein could react with PCV2 positive serum. ORF2 without signal sequence was successfully expressed in E. coli. Based on the expressed ORF2 protein, ELISA method was set up for detecting PCV2 antibodies. The method presented 95 % coincidence with commercial ELISA kit and no cross-actions with CSFV, PPV, PRV and PRRSV were detected.
PCV2; ORF2; antibody detection; ELISA
2015-04-18
郑州市科技创新团队项目,编号131PCXTD622;河南省科技攻关项目,编号132102110142.
王爱萍(1970-),女,青海西宁人,教授,博士,主要从事分子免疫学和免疫学检测技术研究,E-mail:pingaw@zzu.edu.cn;通讯作者:祁艳华(1983-),女,河南焦作人,助理实验师,研究生,主要从事分子免疫学研究,E-mail:yanhuaqi2007@163.com.
S85
A
1671-6841(2015)03-0092-07
10.3969/j.issn.1671-6841.2015.03.018
引用文本:王爱萍,李鹏飞,周景明,等.猪圆环病毒Ⅱ型抗体检测ELISA试剂盒的制备[J].郑州大学学报:理学版,2015,47(3):92-98.
