小麦B淀粉的糖化工艺
2015-12-26张军合饶平凡王星丽胡蕊薪
张军合,饶平凡,王星丽,胡蕊薪
(河南科技学院食品学院,河南新乡453003)
小麦B淀粉的糖化工艺
张军合,饶平凡,王星丽,胡蕊薪
(河南科技学院食品学院,河南新乡453003)
以谷朊粉生产过程中的副产物B淀粉为原料,通过测定反应液DE值得变化,分析糖化时间、糖化酶添加量、普鲁兰酶添加量以及糖化酶和普鲁兰酶协同作用对糖化过程的影响规律,找出最佳糖化工艺,为B淀粉的进一步发酵利用奠定基础。结果显示:反应时间为120min,糖化酶和普鲁兰酶协同作用添加量为25 U/g(以B淀粉干基计),DE值达到93.8%。
B淀粉;糖化;DE值
B淀粉作为谷朊粉生产中的副产物,因其含有戊聚糖、粗脂肪等而呈现出色泽比较暗,含杂质多,粘性大,难以分离等特点,如果直接作为饲料,其含有的非淀粉多糖不能被内源消化酶分解,不利于被单胃动物吸收,直接排放又会造成环境污染。B淀粉中最主要的成分是,其数量可达原料面粉总量的10%~20%或者整个淀粉含量的35%左右[1],关于B淀粉的综合利用已经有过一些报道,但到目前为止仍未有比较合理的方法。因此,随着谷朊粉生产的迅速增加,开发其下脚料B淀粉浆的有效利用已成为刻不容缓的问题[2]。
由于小麦B淀粉颗粒小不易处理,排到环境中会造成环境污染,利用起来又比较困难,以B淀粉浆为原料直接发酵利用是一个非常不错的选择。
对B淀粉糖化条件和普鲁兰酶协同作用进行了分析,研究糖化过程中各DE值的变化规律,为B淀粉的后续利用提供参考。
1 材料与方法
1.1 实验材料
中鹤集团三相卧螺法生产谷朊粉的B淀粉浆。水分含量由参考文献[3]所示方法测定。将小麦B淀粉从冰箱中拿出,化冻后搅拌均匀,取一定量于培养皿上并记录数据,放入干燥箱中,40℃干燥30min,105℃干燥,直至质量相差小于0.002,得出B淀粉含量。
1.2 主要实验试剂
氢氧化钠、3,5-二硝基水杨酸:天津市德恩化学试剂有限公司;酒石酸钠钾、亚硫酸钠:天津市博迪化工股份有限公司;葡萄糖、盐酸、氯化钾:天津市科密欧化学试剂厂;α-耐高温淀粉酶(酶活2万U/m L):郑州市福源生物科技有限公司;糖化酶(酶活5万U/g):内蒙古赤峰蒙娇生化有限公司;普鲁兰酶(酶活2 000U/ mL):济宁和美生物工程有限公司。
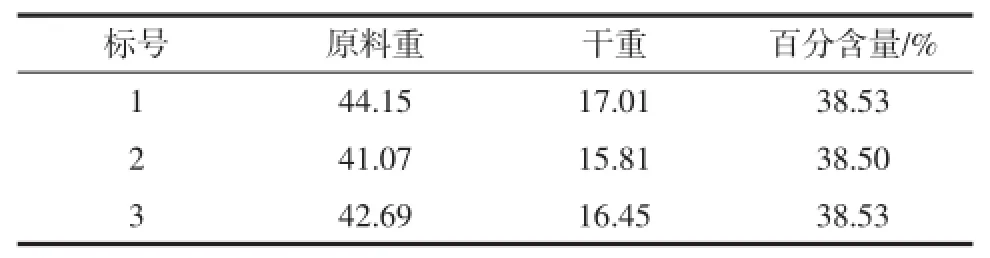
表1 原浆中干物质含量Table1 Content of starch B in raw material
1.3 主要实验仪器
LT 502型电子天平:常熟市天量责任有限公司;722N型可见分光光度计:精科(上海)仪器有限公司;HH-4型恒温水浴锅:江苏金坛市中大仪器厂;电冰箱:中国海尔集团;滤纸:杭州特种纸业有限公司;pH计:上海盛磁仪器有限公司;电磁炉:中国美的;干燥箱:浙江余姚仪器有限公司。
1.4 B淀粉糖化工艺流程
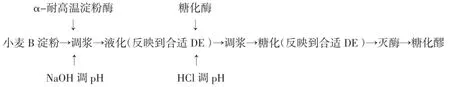
1.5 DE值的测定
采用DNS法[4]。
葡萄糖标准曲线:y=7.108 6x-0.096 5,式中:x为葡萄糖浓度,(mg/mL);y为OD值。
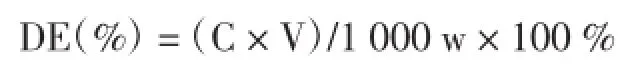
式中:C为标准曲线求得的还原糖浓度,(mg/mL);V为稀释后体积,m L;w为B淀粉含量,g。
2 结果与分析
2.1 糖化酶作用条件分析
影响B淀粉糖化的因素有很多本实验主要从时间加酶量两个因素考虑,讨论糖化酶的最适条件。2.1.1 时间对糖化DE值的影响
将液化后的料液降到60℃之下,调料液pH为4.0~4.5,加入25U/g(以干基计)普通糖化酶,在60℃水浴中分别保温30、60、90、120、150、180min,取出后测定糖化液的DE值见图1。
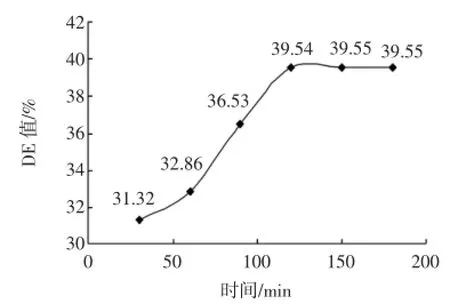
图1 时间对糖化DE值的影响Fig.1 Effect of reaction time on saccharification
图1中,30min~120min时,随着反应时间的延长,底物被降解的速率较大,DE值增加显著,120min后,糖化速率减慢,DE值趋于平稳,因此,将响应面中的时间定为60min~120min。
2.1.2 加酶量对糖化DE值的影响
将液化后的料液降到60℃之下,调料液pH为4.0~4.5,在60℃水浴中保温120min,分别加入15、20、25、30、35、40 U/g(以干基计)普通糖化酶,取出后测定糖化液的DE值见图2。
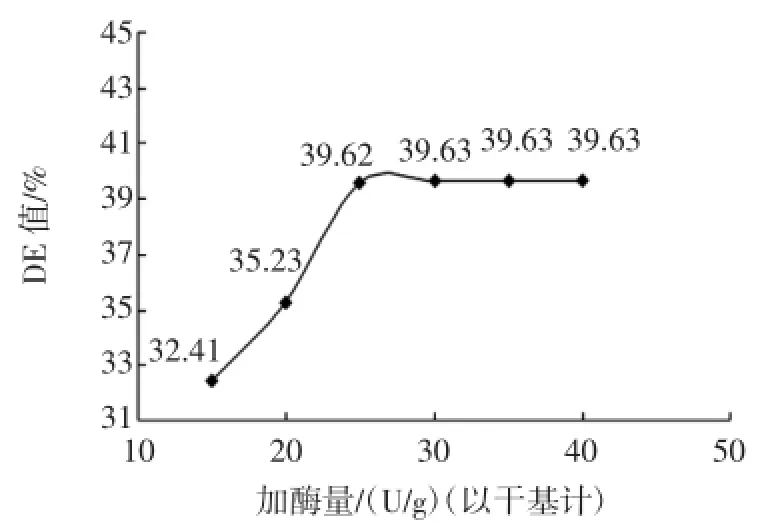
图2 加酶量对糖化DE值的影响Fig.2 Effect of enzyme amount on saccharification
由图2可知:加酶量为15U/g(以干基计)~25U/g(以干基计)时,由于酶量的增加,加快了底物的降解,DE值递增;25 U/g后,DE值保持在一个稳定的水平,这是因为底物已被饱和,即使增加酶添加量,反应速率也不会增大,DE值也不会增加。因此,将响应面中的反应时间定为15U/g(以干基计)~25U/g(以干基计)。
2.1.3 响应面实验
选择时间、加酶量2个因素,使用设计专家软件6.0(Design2Expert Software 6.0)做二因素三水平共13个实验点(5个中心点)的响应面分析实验。这13个实验点可分为两类:其一是析因点,自变量取值在各因素所构成的三维顶点,共有8个析因点;其二是零点,为区域的中心点,零点实验重复5次,用以估计实验误差。液化液的DE为响应值(指标值)。表2为响应面实验因素水平表,表3为响应面实验数据表。
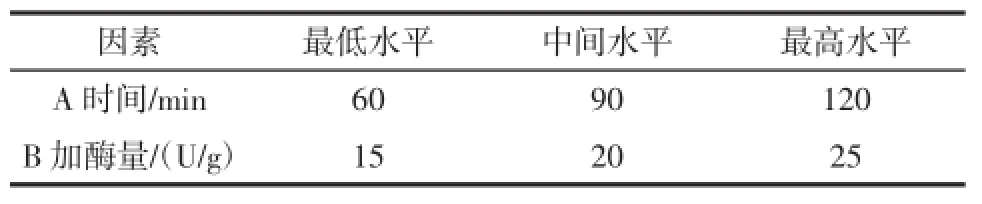
表2 响应面试验因素水平表Table2 Factors and levels of response surface
Design-Expert Software6.0对表3中的实验数据进行分析后推荐使用“Quadratic”(二次方程式)的数学模型。表4为方差分析表,糖化液DE值的数学模型如下
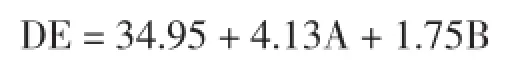
式中:A为时间;B为加酶量。
从方差分析表可知在本实验设定的区域范围内(见表4),时间、加酶量(它们的“Pro>F”值分别为<0.000 1、<0.000 1)对糖化化液的DE值影响显著。
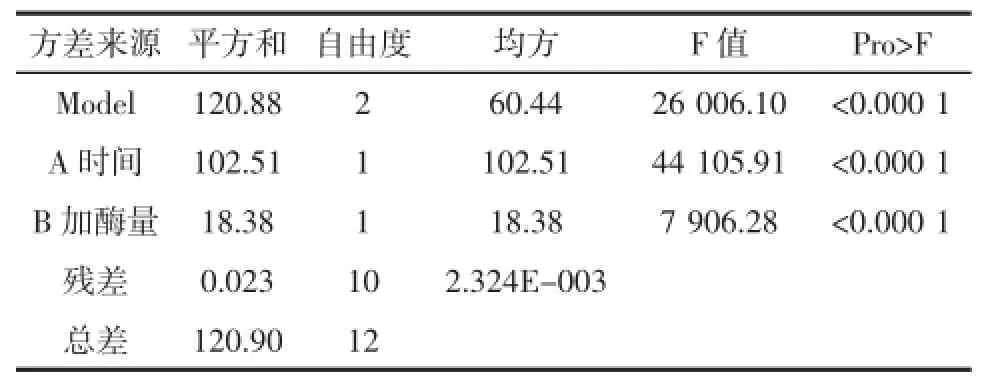
表4 方差分析表Table4 Variance analysis
使用Design-Expert Software6.0软件优化得到的最佳液化工艺条件为加酶量25U/g(以干基计)、时间120min,理论液化DE值为40.837 2%(实现可能性100%)。表5是对最佳工艺条件的验证。

表5 最佳工艺条件验证Table5 Proof of optimal condition
由表5可见实际的平均提取率与理论提取率极为接近。
2.2 普鲁兰酶作用效果的结果与分析
本实验主要从时间加酶量两个因素来考虑普鲁兰酶对糖化DE值的影响,讨论最适糖化条件。
2.2.1 时间对糖化DE值的影响
将液化后的料液降到60℃之下,调料液pH为4.0~4.5,加入25U/g(以干基计)普鲁兰酶,在60℃水浴中分别保温30、60、90、120、150、180min,取出后测定糖化液的DE值见图3。
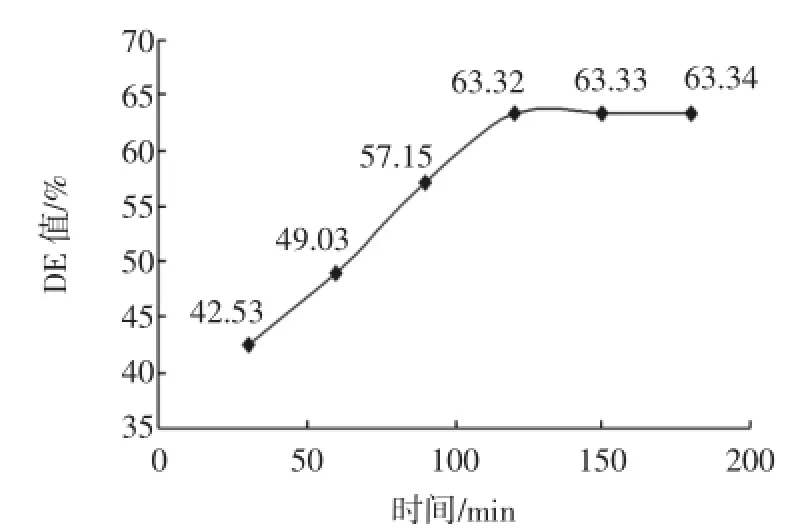
图3时间对糖化DE值的影响Fig.3 Effect of reaction time on saccharification
图3显示:30min~120min时,DE值随着反应时间的延长增加的比较快,料液被降解的比较快,120min后,料液被分解速度减慢,DE值稳定在一个水平。由图3将响应面中时间定为60min~120min。
2.2.2 加酶量对糖化DE值的影响
将液化后的料液降到60℃之下,调料液pH为4.0~4.5,在60℃水浴中保温120min,分别加入15、20、25、30、35、40 U/g(以干基计)普通糖化酶,取出后测定糖化液的DE值近岸图4。
由图4可知:加酶量为15U/g(以干基计)~25U/g(以干基计)时,由于酶量的增加,加快了底物的降解,DE值递增;25 U/g后,DE值保持在一个稳定的水平,这是因为底物已被饱和,即使增加酶添加量,反应速率也不会增大,DE值也不会增加。因此,将响应面中的反应时间定为15U/g(以干基计)~25U/g(以干基计)。
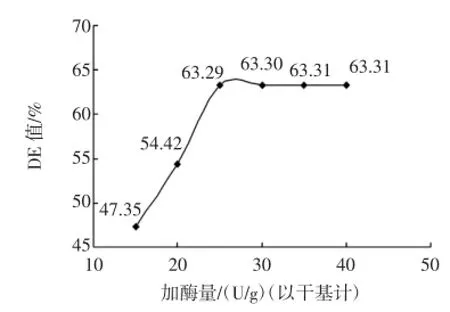
图4加酶量对糖化DE值的影响Fig.4 Effect of enzyme amount on saccharification
2.2.3 响应面实验
选择时间、加酶量2个因素,使用设计专家软件6.0(Design2Expert Software 6.0)做二因素三水平共13个实验点(5个中心点)的响应面分析实验。表6为响应面实验因素水平表。
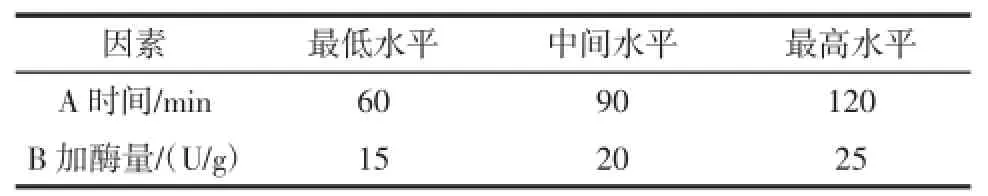
表6响应面试验因素水平表Table 6 Facrors and levels of response surface
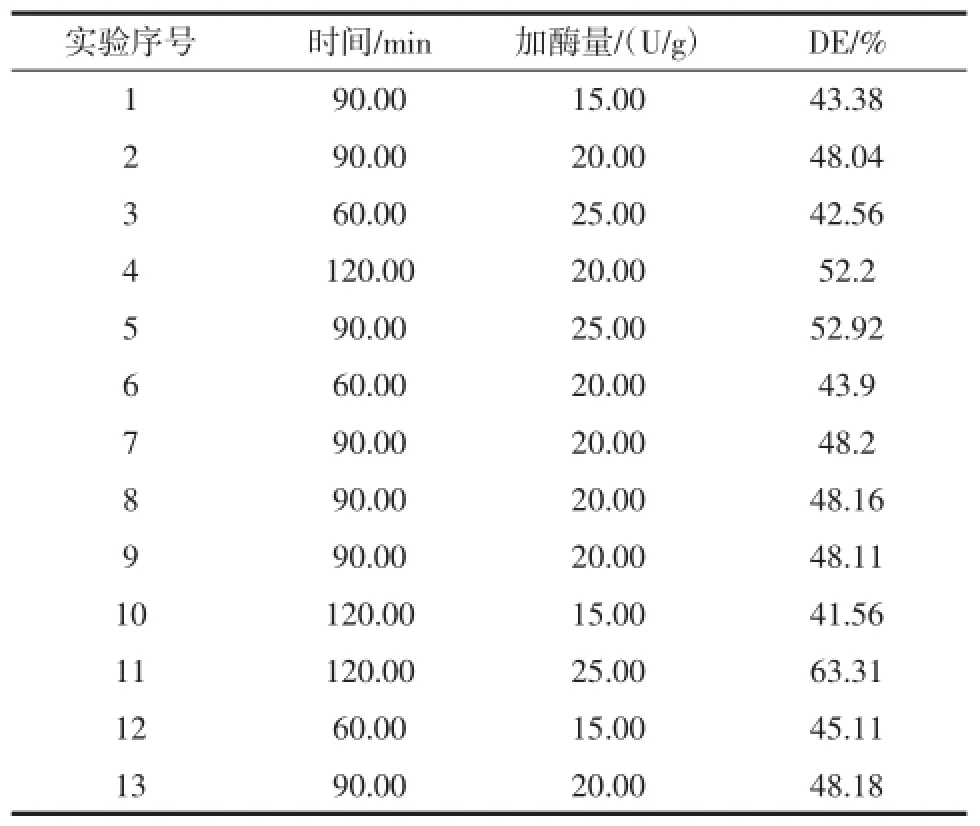
表7 响应面试验数据表Table7 Results of response surface
Design-Expert Software6.0对表7中的实验数据进行分析后推荐使用“Quadratic”(二次方程式)的数学模型。表8为方差分析表,糖化液DE值的数学模型如下:DE=48.15+4.30A+4.79B+6.08AB
式中:A为时间,B为加酶量。
从方差分析表可知在本实验设定的区域范围内(见表9),时间、加酶量、时间与加酶量的交互作用(它们的“Pro>F”值分别为<0.000 1、<0.000 1、<0.000 1)对糖化化液的DE值影响显著。
表9方差分析表Table9 Variance analysis
使用Design-Expert Software6.0软件优化得到的最佳液化工艺条件为加酶量25U/g(以干基计)、时间120min,理论液化DE值为63.312 5%(实现可能性100%)。表10是对最佳工艺条件的验证。

表10 最佳工艺条件验证Table 10 Proof of optimal condition
由表10可见实际的平均提取率与理论提取率极为接近。
响应面两种因素得出一个立体图形,能清晰看出时间、加酶量之间的关系见图5。
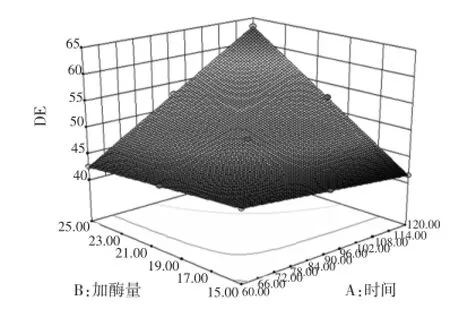
图5 时间与加酶量共同对糖化DE值的影响Fig.5 Effect of enzyme amount and time on saccharification
2.3 糖化酶与普鲁兰酶协同作用
根据以上实验对糖化过程进行研究,探究整个过程糖化酶与普鲁兰酶的协同作用对糖化的影响。加糖化酶25U/g(以干基计)普鲁兰酶25U/g(以干基计)在60℃水浴锅中分别加热30、60、90、120、150、180min,结果见图6。
由图6可知在150min时糖化DE值达到最大93.8%,远大于糖化酶与普鲁兰酶的单独作用,使糖化更为完全。
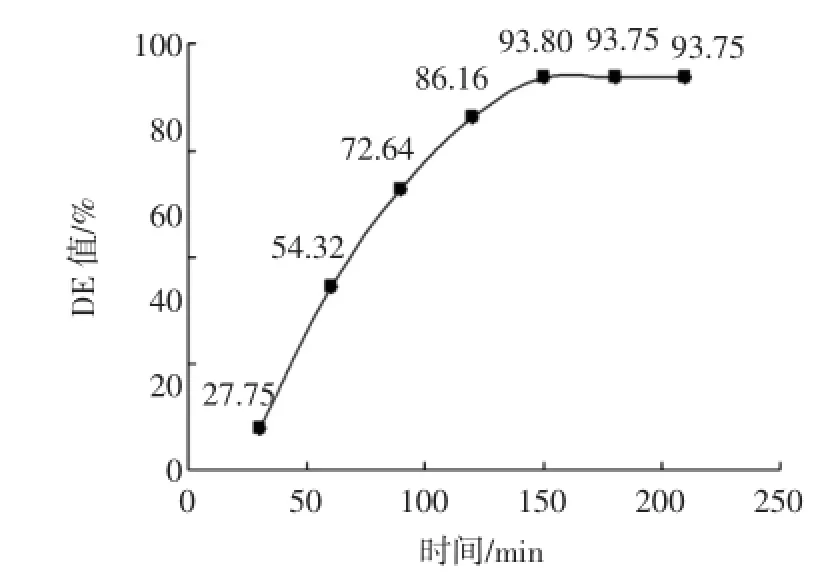
图6 糖化酶与普鲁兰酶协同作用对糖化DE值的影响Fig.6 Effect of Cooperation of of saccharification enzyme and pullulan enzyme on saccharification
3 结论
通过单因素试验研究了反应时间、加酶量对反应液糖化DE值的影响,结果显示:在120min内随着反应时间增加的DE值逐渐增加,然后稳定在一个水平:随着加酶量的增加,反应液糖化程度增大,当加酶量增加到25U/g后,反应液的DE值稳定在一个水平。在单因素试验的基础上进行了响应面试验,响应面试验结果得到了最优的糖化(包括加糖化酶与普鲁兰酶两种情况)工艺条件为:反应时间为120min,加酶量为25U/g小麦B淀粉(以干基计)。
在糖化过程中同时加糖化酶与普鲁兰酶,DE值达到93.8%,同时缩短糖化时间,提高效率。
[1]吴加根.谷物与大豆食品工艺学 [M].北京:中国轻工业出版社,2005
[2] 金树人,黄继红.中国小麦淀粉生产发展与前景[J].广西轻工业, 2005(4):14-15
[3] 柯惠玲,李庆龙.谷物品质分析[M].武汉:湖北科学技术出版社, 2008
[4]刘俊红.生物乙醇原料——艾蒿纤维素降解优化工艺研究[J].中国酿造,2011(10):58-61
Saccharification Technology Research of Wheat Starch B
ZHANG Jun-he,RAO Ping-fan,WANG Xing-li,HU Rui-xin
(Food College,Henan Institute of Science and Technology,Xinxiang 453003,Henan,China)
Taking starch B,by-product of gluten production,as raw material,this paper analyzed effects of time,amount of saccharification enzyme,cooperation of saccharification enzyme and pullulan enzyme on saccharification.By measuring the change of DE value after the reaction liquid,find out the optimal reaction conditions,laying foundation for the further fermentation.Results showed that in the process of saccharification,DE increased first,then remain relatively stable,the optimum conditions of saccharification were as followed. DE value came to 93.8%with saccharification enzyme amount of 25 U/g(dry basis)by cooperation of pullulan enzyme and reaction time of120min.
starch B;saccharification;DE value
10.3969/j.issn.1005-6521.2015.01.018
2014-08-26
新乡市重点科技攻关计划项目(编号:ZG14029);河南省教育厅科学技术重点研究项目(编号:14A550013);国家级大学生创新训练计划项目(编号:201310467051)
张军合(1972—),男(汉),副教授,博士,研究方向:淀粉科学与工艺。
