采用高效液相色谱-质谱考察家福捕鸟蛛粗毒中多肽和蛋白质的多样性
2015-12-26胡朝暾刘中华
胡朝暾, 肖 震, 周 熙, 陈 佳, 陈 波, 刘中华*
(1. 怀化学院生命科学系,民族药用植物资源研究与利用湖南省重点实验室,湖南 怀化418008;2. 湖南师范大学,蛋白质化学与发育生物学教育部重点实验室,湖南 长沙410081)
蜘蛛是地球上最古老的生物之一,它由大约4亿年前泥盆纪的蛛形纲祖先进化而来。除昆虫外,蜘蛛是地球上最成功的最具多样性的无脊椎动物[1]。现在已经鉴定的蜘蛛种类为44 906 种,分为114 个科[2]。家福捕鸟蛛是一种生活在中国广西、云南等热带山区的毒性较强的蜘蛛新种。该种蜘蛛最先于2008 年在云南被发现[3],笔者于2012 年4月在广西宁明县中越边境的山区发现了该种蜘蛛。
目前,蜘蛛毒素的研究是一个热门的研究领域,是继蛇毒和蝎毒之后又一个天然毒素研究的热点,这是因为蜘蛛毒素是有重要研究价值的具有特定药理学活性新型化合物的潜在来源[1,4,5],而且,不同种类的蜘蛛其毒腺分泌不同的毒素分子。作为最近才发现和鉴定的新种蜘蛛——家福捕鸟蛛必然包含很多具有特定药理学活性的新型毒素分子。因此,我们采用高效液相色谱(HPLC)技术和基质辅助激光解吸离子化飞行时间质谱(MALDI-TOF-MS)技术分离和鉴定家福捕鸟蛛粗毒中多肽的组成,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)技术和液相色谱-电喷雾四极杆飞行时间质谱(LCESI-QTOF-MS)技术分离和鉴定粗毒中的蛋白质组成。这些技术不仅在蜘蛛毒素研究中应用广泛[6-11],而且在药品分析、生化分析、中草药有效成分分析及临床检测等领域广泛应用[12-15]。通过鉴定家福捕鸟蛛粗毒中的多肽和蛋白质,我们对家福捕鸟蛛粗毒中多肽和蛋白质的多样性进行了初步分析,为家福捕鸟蛛毒素分子的分离和活性鉴定提供线索。
1 实验部分
1.1 试剂与仪器
α-氰基-4-羟基肉桂酸(CCA)、三氟乙酸(TFA)、Bio-Rad Protein Assay Dye Reagent、Marker 等均购自Sigma 公司,十二烷基硫酸钠(sodium dodecylsulfate,SDS)、甘氨酸、丙烯酰胺、N,N-亚甲基双丙烯酰胺为Amresco 公司产品,乙腈为国产色谱纯试剂,其他为国产分析纯试剂。
Waters Alliance 2695 高效液相色谱仪,配Waters 2489 紫外检测器(美国Waters 公司)(用于多肽的分离纯化);Ultraflex 型基质辅助激光解吸飞行时间质谱仪(德国Bruker 公司)(用于粗毒的鉴定);microTOFQ-II 电喷雾四极杆飞行时间串联质谱仪(Bruker 公司)(用于蛋白质的鉴定);Ultimate 3000 液相色谱仪(戴安公司),Bio-Rad Protein II 垂直平板电泳系统,Biophotometer plus 核酸蛋白测定仪(德国Eppendorf 公司)。
1.2 家福捕鸟蛛毒液的采集及蛋白质含量的测定
家福捕鸟蛛采集于广西宁明县的山区,并带回湖南在室内人工饲养。成年的家福捕鸟蛛饲养于用网状材料覆盖的塑料桶中,每日给水,每个星期喂以猪肝(切成约1 ~2 cm3的块状)、蟑螂或面包虫。采用电刺激的方法每2 个星期采集毒液一次[6]。采集的毒液为无色透明的液体。毒液蛋白质含量的测定采用改良后的考马斯亮蓝染色法进行。实验除了将G-250 染液换成Bio-Rad Protein Assay Dye Reagent 外,其他操作过程与考马斯亮蓝染色法完全相同。
1.3 粗毒的RP-HPLC 分离
粗毒用去离子水溶解至质量浓度为10 g/L,于4℃以14 000 r/min 离心30 min,然后用0.22 μm 微孔过滤器过滤;毒液在反相HPLC 系统上进行分离纯化;上样体积为100 μL;分离柱是C18 柱(Phenomenex 100 Å,250 mm×4.6 mm,5 μm);流动相:A 为0.1%TFA 水溶液,B 为含0.1% TFA 的乙腈;线性梯度洗脱[11]:0 ~50 min,0 ~50% B;流速为1.0 mL/min,在215 nm 波长下检测并收集洗脱峰,每分钟收集1 管。洗脱峰经冷冻干燥后用30 μL 含0.1% TFA 的50% 乙腈水溶液溶解,用于质谱鉴定。
1.4 粗毒的MALDI-TOF-MS 鉴定
质谱分析在MALDI-TOF 质谱仪上进行。用含0.1% TFA 的50% 乙腈水溶液溶解CCA 基质至质量浓度为10 g/L,取0.5 μL 样品与1.0 μL 10 g/L的CCA 基质液混合,然后取0.5 μL 混合液在质谱仪的点样盘上点样,室温下自然风干后测定样品的相对分子质量。采用线性模式,离子源加速电压为20 kV,N2激光波长337 nm,脉冲宽度3 ns,离子延迟提取150 ns,真空度5.33×10-5Pa (4 ×10-7Torr),阳离子模式。
1.5 粗毒的SDS-PAGE 分析
粗毒用去离子水溶解至质量浓度为10 g/L 的溶液,于4 ℃以14 000 r/min 离心30 min,然后用0.22 μm 微孔过滤器过滤。溶液采用SDS-PAGE的方法(15% 的分离胶和5% 的浓缩胶)进行粗毒蛋白质相对分子质量的测定。电泳完成后用考马斯亮蓝G-250 进行染色。
1.6 粗毒的三维直观图分析
按照1.3 节和1.4 节方法进行色谱分离和质谱鉴定。质谱采集和数据分析分别用Bruker Daltonics Flexcontrol 软件和Flexanalysis 软件,将所得到的数据以洗脱时间为X 轴,以质荷比为Y 轴,以质谱峰强度为Z 轴制作Landscape,直观展示家福捕鸟蛛粗毒中多肽的疏水性(与洗脱时间有关)、相对分子质量以及丰度的分布。
1.7 粗毒胶内蛋白质的酶解
粗毒胶内蛋白质原位酶解参考文献[16]的方法进行。
1.8 粗毒LC-ESI-QTOF-MS 分析及蛋白质的搜寻鉴定
粗毒的质谱分析及蛋白质的搜寻鉴定参考文献[16]的方法进行。
2 结果与讨论
2.1 家福捕鸟蛛毒液
本实验采用电刺激方法采集家福捕鸟蛛毒液,毒液为无色透明的液体,易溶于水。每只家福捕鸟蛛每次约能射毒液5 ~20 μL。家福捕鸟蛛新鲜毒液重量为1.07 mg/μL,毒液冻干后的重量为51.3 μg/μL,新鲜毒液蛋白质含量为9.15 μg/μL,粗毒对美洲蜚蠊的半致死剂量(LD50)为85.62 μg/g。
2.2 粗毒的RP-HPLC 分离、MALDI-TOF-MS 鉴定和SDS-PAGE 分析
典型的家福捕鸟蛛粗毒的反相高效液相色谱图见图1A。从图1A 中可以看出,家福捕鸟蛛粗毒的成分复杂,在215 nm 下可以检测到40 多个色谱峰,大部分色谱峰的保留时间处于5 ~15 min 和25 ~40 min 两个时间区域,对应的乙腈体积分数分别为5% ~15% 和25% ~40%。保留时间为5 ~15 min区域的色谱峰在相对分子质量设定为1 000 ~10 000 的MALDI-TOF-MS 鉴定中没有显示任何质谱峰,表明这一区域的洗脱峰主要是一些低相对分子质量的有机化合物和盐类。保留时间为25 ~40 min 区域的色谱峰经MALDI-TOF-MS 鉴定为多肽分子,此区域多肽分子是家福捕鸟蛛粗毒含量最丰富的成分,也是后续开展家福捕鸟蛛毒素结构与功能研究的主要部分。
为了对家福捕鸟蛛粗毒中的蛋白质组分有个初步了解,采用SDS-PGAE 对粗毒中蛋白质相对分子质量的分布进行了测定,结果表明,除了相对分子质量在10 000 以下的多肽外,电泳图谱显示粗毒在50、72 和90 kD 附近有3 条明显的条带(图1B)。
众所周知,蜘蛛粗毒主要由蛋白质类、多肽类以及低相对分子质量的有机化合物和盐类组成,其中含量最多的是多肽类化合物[6]。质谱技术特别是MALDI-TOF-MS 技术的发展为蜘蛛毒素的鉴定提供了强有力的技术支持[17]。因此,我们通过MALDI-TOF-MS 技术对家福捕鸟蛛粗毒进行鉴定。实验结果表明:在线性模式下,相对分子质量设定为1 000 ~10 000 范围内,粗毒通过MALDI-TOF-MS鉴定到大约20 多个质谱峰。质谱峰的相对分子质量分布于2 000 ~8 000 之间,大部分处于3 000 ~4 500 之间(图1C)。
2.3 粗毒的三维直观图分析
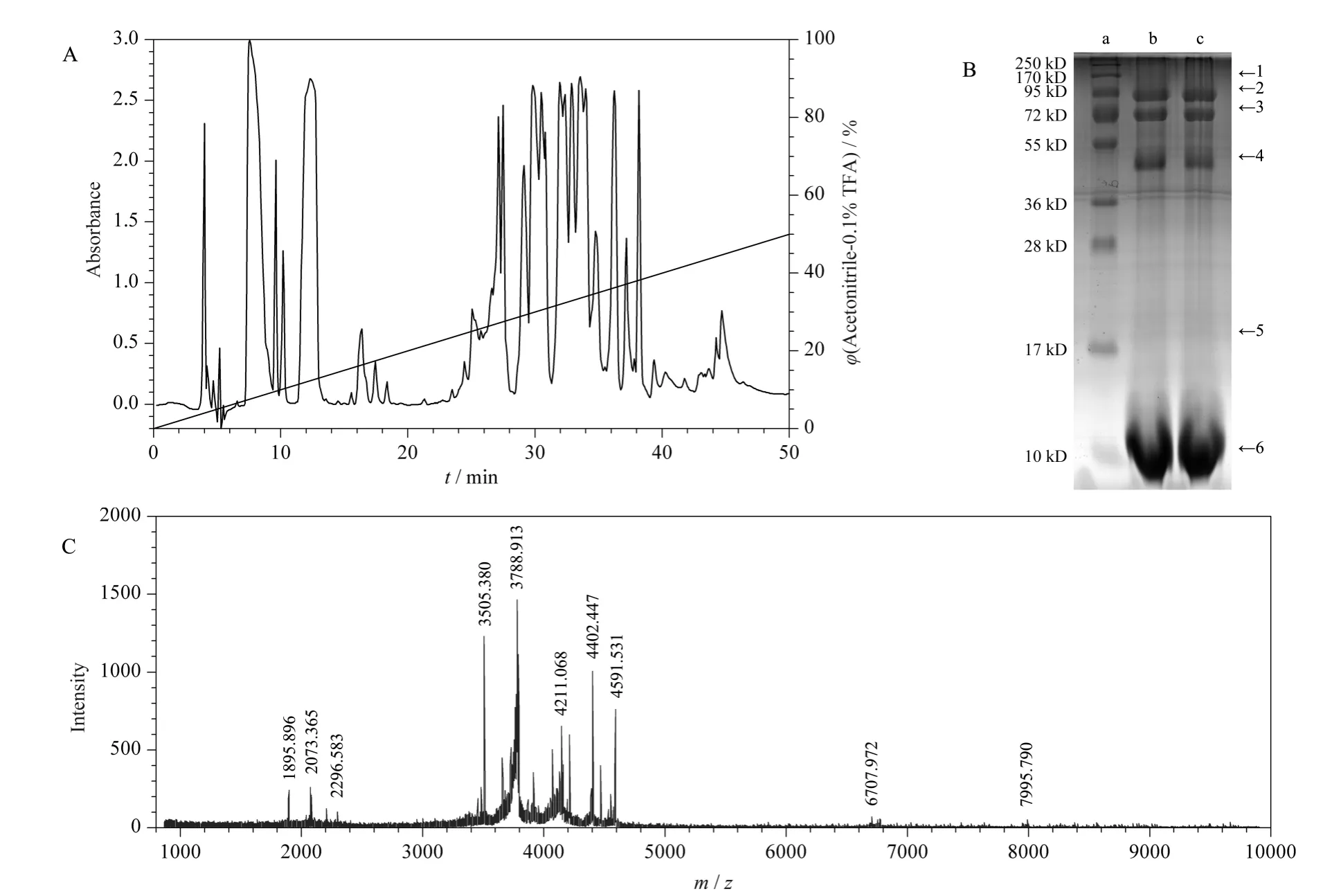
图1 家福捕鸟蛛粗毒的分离和质谱鉴定Fig.1 Separation and mass spectrometric identification of the S. jiafu venom
由于蜘蛛粗毒的复杂性及技术的局限性,蜘蛛毒素的系统性研究一直是瓶颈。MALDI-TOF-MS技术及液相色谱-质谱联用(LC-MS)技术的发展为蜘蛛毒素的系统分析提供了可能[18],Escoubas等[19]采用这种技术从澳大利亚漏斗网蛛两种蜘蛛粗毒中分别鉴定到了633 个和1 018 个多肽分子。这是第一次在蜘蛛粗毒中鉴定到如此多的多肽分子,远高于以前普遍认为的每种蜘蛛毒腺含有50 ~100 个多肽分子[20,21]。而且研究还发现漏斗网蛛粗毒中的多肽的相对分子质量呈双峰分布,主要分布于3 000 ~5 000之间,其次分布于6 500 ~8 500 范围内。这与虎纹捕鸟蛛[22]、海南捕鸟蛛[23]、敬钊缨毛蛛[24]的研究结果类似。
采用MALDI-TOF-MS 结合HPLC 分离技术,我们对家福捕鸟蛛粗毒多肽与蛋白质的多样性进行了研究。大部分的色谱峰都含有一定相对分子质量的多肽类物质,个别峰甚至含有多达十几个不同相对分子质量的多肽,说明在蜘蛛毒素中存在相对分子质量不同但疏水性特别接近的组分。本实验一共鉴定到238 个多肽分子,显示了粗毒多肽分子的多样性(见图2A)。研究还发现家福捕鸟蛛粗毒中多肽的相对分子质量也呈现双峰分布,但其相对分子质量的分布特征与已报道的其他蜘蛛不同。其多肽的相对分子质量分布为:62.5% 的多肽毒素分布在3 000 ~4 500 之间,33.2% 的多肽毒素分布在1 000~3 000 之间,在6 500 ~8 500 范围内很少(见图2B)。这说明家福捕鸟蛛毒素和其他蜘蛛毒素在进化上采用了不同的方式。因此,进一步研究家福捕鸟蛛与其他蜘蛛毒素中多肽的分布差异,将有助于了解蜘蛛毒素的进化机制。
通过整合实验数据,以流分(fraction number)为X 轴,以质荷比为Y 轴,以质谱峰强度为Z 轴绘制家福捕鸟蛛粗毒多肽分子的三维直观图(图2C)。该直观图对家福捕鸟蛛粗毒提供了详细的注释。通过直观图可以直观地看到每一个多肽分子的保留时间、相对分子质量以及质谱峰强度,而且在反相高效液相色谱分离中没有完全分开的多肽分子通过三维直观图中相对分子质量的差异能够区分开。从图2C 中可以发现多肽分子主要处于相对分子质量在3 000 ~4 500、保留时间在15 ~45 min 范围内。
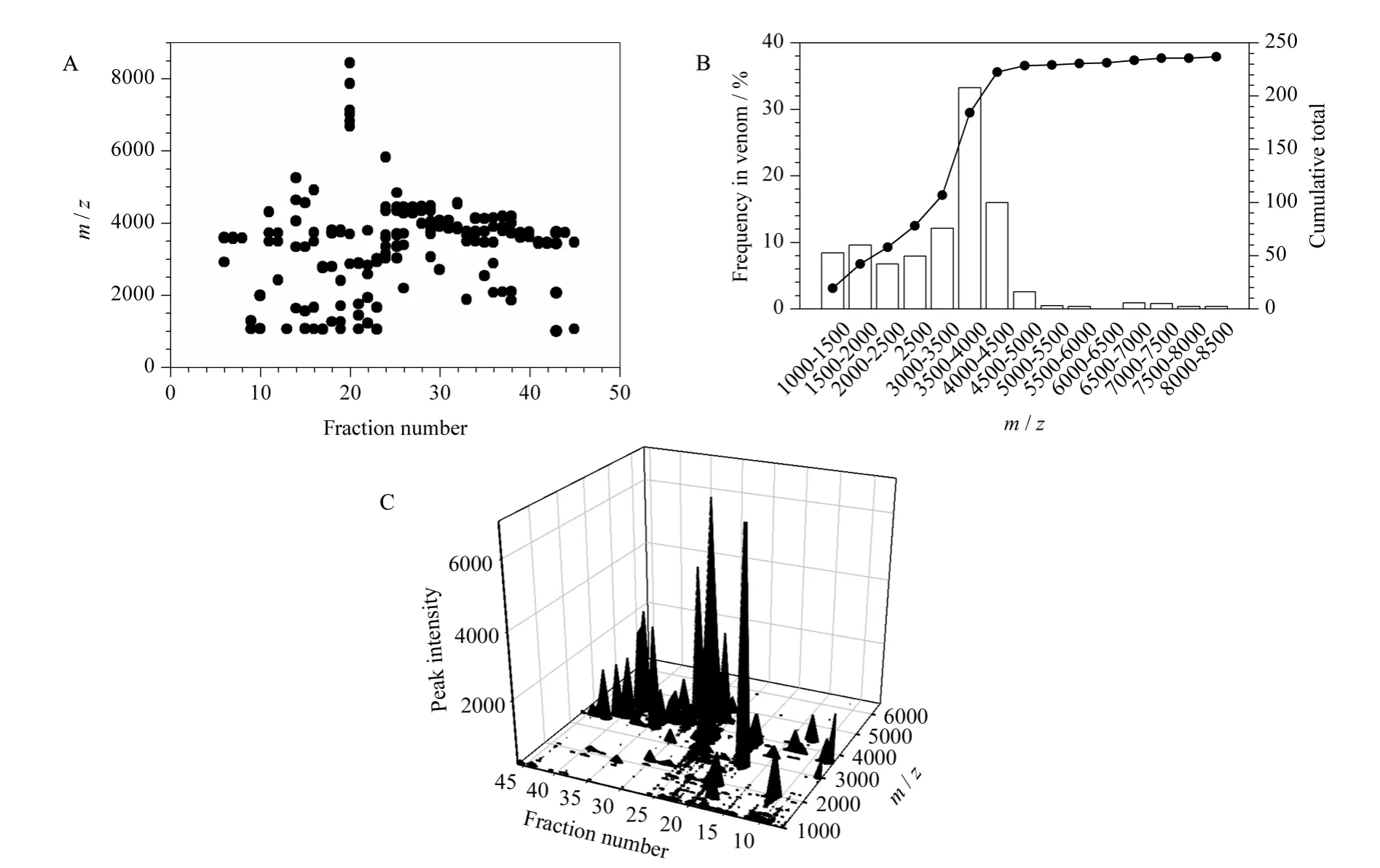
图2 家福捕鸟蛛粗毒的分子多样性Fig.2 Molecular diversity of the S. jiafu venom
虽然在整体水平上我们对蜘蛛粗毒的相关知识有了初步的了解,但在很大程度上我们对其多肽分子多样性和丰度的了解相当有限,因此低估了其分子多样性,主要原因如下[19]:1)蜘蛛粗毒是一个由很多结构和活性不同的成分组成的复杂混合物,除了占大部分的多肽和蛋白质外,蜘蛛毒素中含有很多盐类和小分子化合物,这些盐类和小分子化合物大多数很容易离子化,这些离子化的物质干扰多肽的离子化过程,使得实验结果不准确;2)蜘蛛粗毒中经常会存在一些相对分子质量和疏水性特别接近的多肽分子,这些多肽分子在RP-HPLC 分离和MALDI-TOF-MS 鉴定时很难区分;3)蜘蛛粗毒中虽然多肽分子数量成百上千,但是除了数量有限的多肽分子含量较高,是高丰度多肽分子外,大部分多肽分子在粗毒中含量很低,现有的质谱技术很难将其区分和鉴定。
2.4 粗毒LC-ESI-QTOF-MS 分析及蛋白质的搜寻鉴定
为了使家福捕鸟蛛粗毒中分离的蛋白质能够被有效地鉴定,粗毒经SDS-PAGE 分离后切割为6 个条带(图1B)。条带被取下,经脱色、还原烷基化后采用胰蛋白酶酶解。酶解结束后,用含有不同体积分数的乙腈水溶液对条带进行萃取,合并萃取液,冻干,保存于冰箱。质谱分析时,每一条带酶解后的多肽混合物先通过Dionex 的反相LC 分离后在线进入Bruker 公司的microTOFQ II 质谱分析系统进行质谱分析。获得的数据经Bruker 公司的Data Analysis 4.0 软件分析后以mgf 文件输出。将得到的mgf 文件采用Mascot 软件中的串联质谱数据搜索功能(MS/MS Ions Search)搜索,由于没有专门的蜘蛛毒素蛋白质数据库,因此本文采集到的MS/MS 数据在进行数据库搜寻时所选数据库范围为SwissProt(蛋白序列数据库)。
实验发现酶切得到的6 个条带中都鉴定得到了蛋白质(条带6 还鉴定得到了3 种多肽毒素)。条带3 鉴定得到的蛋白质种类最多,达到13 种蛋白质。其中有6 种蛋白质属于血蓝蛋白多链,包括Hemocyanin A chain、Hemocyanin C chain、Hemocyanin D chain、Hemocyanin E chain、Hemocyanin F chain 和Hemocyanin G chain。另外,还鉴定得到2 种钾离子通道蛋白、2 种角蛋白、1 种钙蛋白酶、1 种AF-17 蛋白和1 种胰蛋白酶。胰蛋白酶和角蛋白在其他条带的鉴定中多次出现,考虑到这两种蛋白质可能是实验污染所致,故将这两种蛋白质在结果中剔除。从家福捕鸟蛛粗毒中我们共鉴定得到了14 种蛋白质:血蓝蛋白、线粒体ATP 合成酶、钙蛋白酶、神经软骨蛋白、钾离子通道蛋白、线粒体载体蛋白、锌指蛋白、多梳蛋白等(见表1)。在家福捕鸟蛛粗毒中鉴定发现了血蓝蛋白,这与实验室前期研究结果类似。本室研究生在对敬钊缨毛蛛[24]、大腹园蛛[25]和虎纹捕鸟蛛[26]3 种蜘蛛粗毒进行质谱鉴定时均鉴定得到血蓝蛋白。
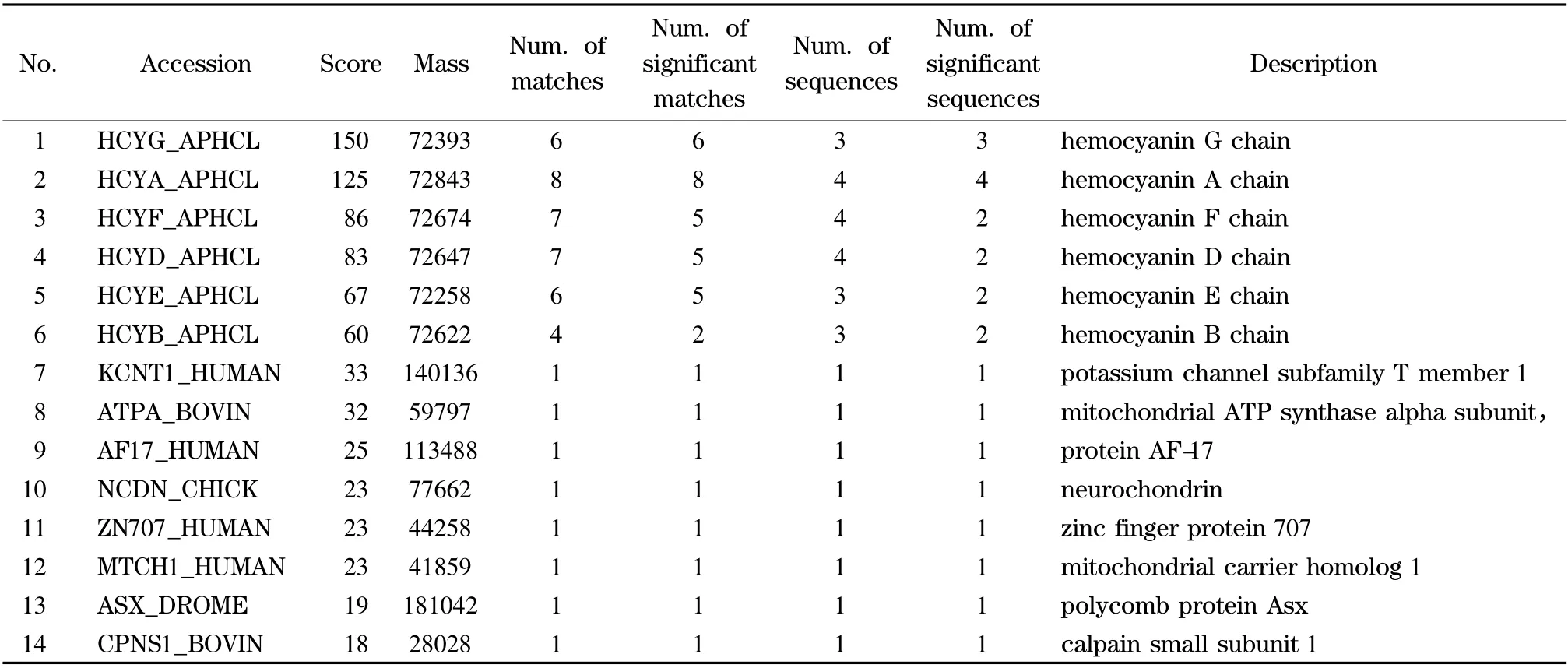
表1 家福捕鸟蛛粗毒中蛋白质的质谱鉴定结果Table 1 MS identification results of proteins from S. jiafu venom
3 结论
本文采用高效液相色谱分离和质谱鉴定技术对家福捕鸟蛛粗毒中多肽与蛋白质的多样性进行了初步分析。通过色谱分离和质谱鉴定从粗毒中鉴定得到238 个多肽分子。这些结果表明家福捕鸟蛛粗毒中多肽种类丰富。该研究结果为后续开展家福捕鸟蛛毒素分子的分离纯化与功能研究打下基础。同时也表明高效液相色谱分离技术和质谱鉴定技术是开展蜘蛛毒素研究的一种行之有效的技术。
本文在进行家福捕鸟蛛粗毒蛋白质鉴定时发现蛋白质种类偏少,造成鉴定蛋白质种类偏少的最主要原因是蜘蛛基因组或蛋白质组数据库的缺乏;另外,仪器灵敏度不高也是一个主要原因。随着更高灵敏度仪器的出现,以及将来蜘蛛基因组或蛋白质组数据库的建立,必将有更多的家福捕鸟蛛毒素蛋白质得到鉴定。
[1] Saez N J,Senff S,Jensen J E,et al. Toxins,2010,2:2851
[2] Platnick N I. The World Spider Catalog,Version 15. American Museum of Natural History. (2014-06-24). http:// research.amnh.org/entomology/spiders/catalog/index.html
[3] Zhu M S,Zhang R. J Arachnol,2008,36:425
[4] Klint J K,Senff S,Rupasinghe D B,et al. Toxicon,2012,60:478
[5] Windley M J,Herzig V,Dziemborowicz S A,et al. Toxins,2012,4:191
[6] Liang S P. Toxicon,2004,43:575
[7] Tao H,Chen J J,Xiao Y C,et al. Biochemistry,2013,52(42):7439
[8] Tang C,Zhou X,Zhang Y X,et al. Sci Rep,2015,5:9241
[9] Zhang H,Huang P F,Meng E,et al. PLOS ONE,2015,10(2):e0117099
[10] Tang C,Zhou X,Huang Y,et al. Toxicon,2014,92:6
[11] Liu Z H,Dai J,Dai L J,et al. J Biol Chem,2006,281:8628
[12] Tang S Y,Wang Y X,Wen P W,et al. Chinese Journal of Chromatography (唐圣芸,王远兴,温平威,等. 色谱),2014,32(2):184
[13] Wang X,Chi Y M,Kang A,et al. Chinese Journal of Chromatography (王星,池玉梅,康安,等. 色谱),2014,32(12):1326
[14] Chen X Z,Gong Y Q,Guo S L. Biotechnology Bulletin(陈信忠,龚艳清,郭书林. 生物技术通报),2012(6):43
[15] Dai L J,Xiang Q L,Li Y,et al. Scientia Agricultura Sinica(代龙军,项秋兰,黎瑜,等. 中国农业科学),2012,45(11):2328
[16] Gao J,Li J,Feng C,et al. Eletrophoresis,2013,34(2):215
[17] Escoubas P,Célérier M L,Nakajima T. Rapid Commun Mass Spectrom,1997,11(17):1891
[18] Liang S. Expert Rev Proteomics,2008,5(5):731
[19] Escoubas P,Sollod B,King G F. Toxicon,2006,47:650
[20] Escoubas P,Rash L. Toxicon,2004,43:555
[21] Tedford H W,Sollod B L,Maggio F,et al. Toxicon,2004,43:601
[22] Yuan C H,Jin Q H,Tang X,et al. J Proteome Res,2007,6:2792
[23] Tang X,Zhang Y,Hu W,et al. J Proteome Res,2010,9:2550
[24] Liao Z,Cao J,Li S,et al. Proteomics,2007,7:1892
[25] Duan Z G. [PhD Dissertation]. Changsha:Hunan Normal University (段志贵. [博士学位论文]. 长沙:湖南师范大学),2012:18
[26] Yuan C,Jin Q,Tang X,et al. J Proteome Res,2007,6:2792
