疏水整体柱在线固相萃取与高效液相色谱-串联质谱联用测定牛肝中5 种阿维菌素类药物残留
2015-12-26张瑶琴艾连峰王学生王曼曼徐厚君郝玉兰
李 欣, 张瑶琴, 艾连峰, 王学生* , 王曼曼, 徐厚君, 郝玉兰
(1. 华北理工大学公共卫生学院,河北 唐山063000;2. 河北出入境检验检疫局,河北 石家庄050000)
阿维菌素类药物(avermectins,AVMs)是由放线菌产生的一组大环内酯类抗生素,凭借杀虫活性强、虫谱广的特点,广泛应用于动物养殖[1,2]。阿维菌素类药物具有神经毒性和发育毒素,脂溶性较高,极易在动物体内特别是动物肝脏中残留,人体长期食用这类动物肝脏后会导致神经系统及生殖系统紊乱[3,4]。按照世界卫生组织5 级分类标准,阿维菌素类药物被列为高毒化合物[5]。美国、欧盟和中国等均制定了阿维菌素类药物的最高残留限量[6,7]。
通常,由于食品样品基质自身的复杂性,且待测物往往处于痕量状态,因此需要对样品进行前处理以去除杂质并浓缩待测物。现有的食品中阿维菌素类药物残留的前处理方法主要是固相萃取法,包括C18固相萃取柱[8]和碱性氧化铝固相萃取柱[9,10]。这些前处理材料均为一次性使用,成本高,且前处理为离线操作,容易出现人为操作误差和污染。与离线固相萃取方法相比,在线固相萃取净化技术有效地简化了前处理过程,同时保证了方法的灵敏度,自动化程度高[11-13]。因此,发展可以重复使用的固相萃取材料,并建立在线分析测定牛肝中阿维菌素类药物残留的方法具有重要的研究意义和实际价值。
研究表明,作为一种固相萃取材料,整体柱(monolithic column)结构连续多孔,比表面积大,同时具有良好的生物兼容性。目前,离子交换整体柱、分子印迹整体柱已经成功应用于食品、环境和生物样品的前处理[14-20]。本实验利用以甲基丙烯酸丁酯为单体的疏水作用整体柱作为在线固相萃取净化介质,结合高效液相色谱-串联质谱(HPLC-MS/MS)分析测定了牛肝中5 种阿维菌素类药物的残留。
1 实验部分
1.1 仪器和试剂
SHIMADZU LC-2010 型液相色谱仪(岛津公司,日本);在线净化液相色谱-串联质谱仪(Thermo Fisher 公司,美国),由CTC 多功能自动进样器、两个四元梯度液相泵、六通阀切换装置、多元柱切换装置和TSQ Quantum Ultra 三重四极杆质谱仪组成;Sigma 3K-15 型离心机(Sigma 公司,美 国);PT2100 型均质器(KINEMATICA 公司,瑞士);DKZ-2 型电热恒温振荡水槽(上海精宏实验设备公司);Milli-Q 纯化系统(Millipore 公司,美国)。
甲基丙烯酸丁酯(butyl methacrylate,BMA)和乙二醇二甲基丙烯酸酯(ethylene dimethacrylate,EDMA)均购自阿拉丁试剂公司,正丙醇购自天津市光复精细化工研究所,偶氮二异丁腈和聚乙二醇400 购自天津市大茂化学试剂厂。乙酸铵、甲酸、异丙醇、乙腈(ACN)、丙酮和氨水均为色谱纯,购自Sigma-Aldrich 公司。
标准物质:阿维菌素(abamectin,ABM,纯度97%)、伊维菌素(ivermectin,IVM,纯度96%)、多拉菌素(doramectin,DOP,纯度96%)、莫西菌素(moxidectin,MOX,纯度87%)和依普菌素(eprinomectin,EPR,纯度91%)购自德国Dr. Ehrenstorfer 公司。
实验所用牛肝样品为送检样品。
1.2 标准储备液和标准工作液的配制
分别准确称取5 种阿维菌素类药物标准物质10.0 mg(折合纯度后),用甲醇配制质量浓度为100.0 mg/L 的标准储备液,待用。准确移取适量上述5 种标准储备液,用甲醇稀释成1.0 mg/L 混合标准工作液,4 ℃下避光保存。
1.3 聚甲基丙烯酸丁酯疏水整体柱的制备
参照文献[21]方法合成疏水整体柱。将单体BMA(1.0 mmol)、交联剂EDMA(3.0 mmol)、致孔剂正丙醇(13.0 mmol)、聚乙二醇400(2.5 mmol)和引发剂偶氮二异丁腈10 mg,在室温下超声混合、脱气后灌入不锈钢柱管(10 mm×2.1 mm)中,两端密封,55 ℃水浴中反应4 h 后接入到高压泵,用甲醇冲洗,得到聚甲基丙烯酸丁酯疏水整体柱(poly(BMA-co-EDMA)整体柱)。
1.4 样品的制备
牛肝绞碎、混合均匀后,准确称取2.0 g 置于50 mL 离心管中,加入8 mL 乙腈,10 000 r/min 下均质1 min,5 000 r/min 下离心5 min,取上清液于50 mL 离心管中。重复提取两次后合并上清液,用乙腈定容至30 mL。取3 mL 于10 mL 玻璃离心管中,氮吹至干,用乙腈复溶并定容至1 mL,经0.22 μm 微孔滤膜过滤,滤液供HPLC-MS/MS 测定。
1.5 在线净化固相萃取与HPLC-MS/MS 条件
1.5.1 在线净化及HPLC 条件
在线净化又称在线固相萃取和富集技术,程序分为净化和分离两个过程,在线净化过程(on-line cleanup chromatography,OCC)通过上样泵(loading pump)驱动净化流动相在制备的poly(BMAco-EDMA)整体柱上完成,分离过程(HPLC)是洗脱泵(eluting pump)驱动分析流动相在分析柱上完成。整个程序与色谱分析同步完成,其间通过两个六通阀切换实现流路变化,从而实现固相萃取处理试样与分析测定的在线自动化。
在线固相萃取包括上样、淋洗、转移、平衡4 个步骤。上样泵流动相A 为10 mmol/L 乙酸铵水溶液、B 为乙腈、C 为丙酮/乙腈/异丙醇(1 ∶1 ∶1,v/v/v)。HPLC 分析柱为Hypersil GOLD C18柱(100 mm×4.6 mm,3 μm,Thermo Fisher 公司,美国)。洗脱泵流动相A 为乙腈,流动相B 为0.1% 氨水溶液。进样量为50 μL。在线净化程序见表1,其中OCC 在程序中每步的变化采用瞬变模式,HPLC 每步的变化除第4 步采用渐变模式外,其他步骤之间的转换均采用瞬变模式。程序中各步所用流路模式如图1 所示。

表1 牛肝中阿维菌素类药物的在线净化和HPLC-MS/MS 分离程序Table 1 Gradient elution procedure of on-line clean-up and HPLC-MS/MS of the avermectins from bovine liver
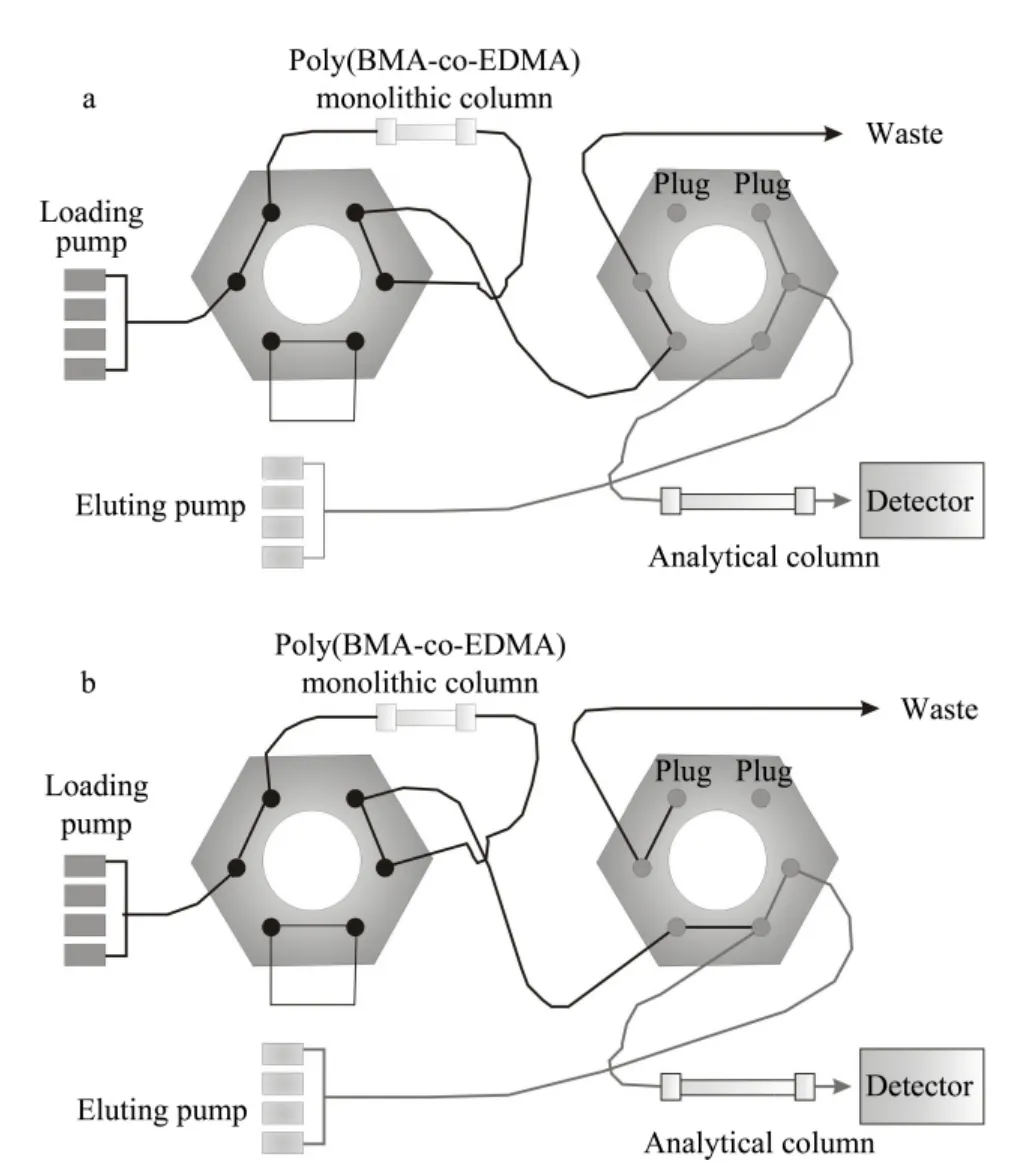
图1 在线净化流路切换模式示意图Fig.1 Schematic diagrams of on-line cleanup flow channel switching
1.5.2 MS/MS 条件
电离源:大气压化学电离源(APCI);扫描模式:多反应监测(MRM)负离子扫描;鞘气压力:40 unit;辅助气压力:30 unit;离子源温度:350 ℃;APCI 电流:4 μA;源内诱导解离电压(SID):10 V;毛细管温度:350 ℃;Q1和Q3单位分辨率:Q1=0.4 u,Q3=0.7 u;其他测定条件见表2。
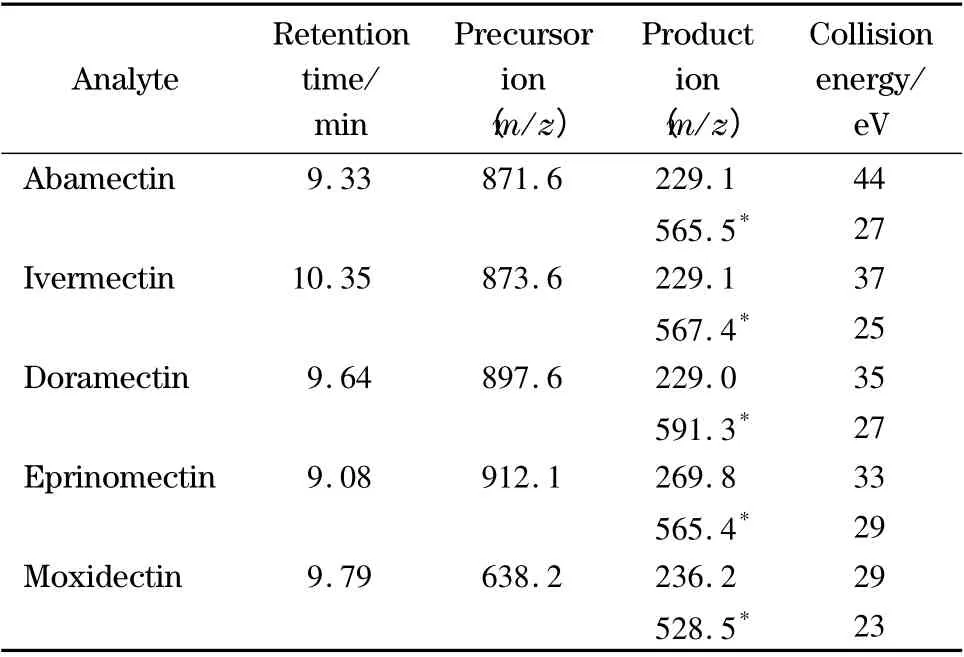
表2 HPLC-MS/MS 分析待测物的保留时间、母离子、子离子和裂解能量Table 2 Retention times,precursor ions,product ions and collision energies of the analytes for HPLC-MS/MS analysis
2 结果与讨论
2.1 基于poly(BMA-co-EDMA)整体柱在线固相萃取阿维菌素类药物的条件优化
阿维菌素类药物是一种弱极性的化合物,C18固相萃取柱往往用于食品样品中该类药物的固相萃取。本实验合成的poly(BMA-co-EDMA)整体柱,由于聚合物骨架表面带有丁基而成为一种典型的疏水作用整体柱[22,23]。为了考察poly(BMA-co-EDMA)整体柱对牛肝样品的净化和富集能力,将poly(BMA-co-EDMA)整体柱接入高效液相色谱仪(配紫外检测器),在梯度洗脱模式下,分别对牛肝提取液和阿维菌素标准溶液作为典型分析物进样分析。当流动相为10 mmol/L 乙酸铵缓冲溶液时,牛肝提取液中的大量杂质流出,而在该条件下未发现阿维菌素色谱峰;当流动相由10 mmol/L 乙酸铵缓冲溶液转变为乙腈时,阿维菌素可由乙腈洗脱(图2)。可见,poly(BMA-co-EDMA)整体柱能够有效去除牛肝提取液中的杂质并富集阿维菌素。
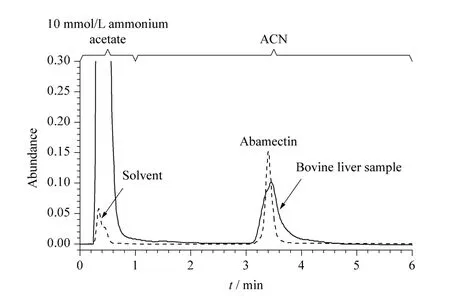
图2 牛肝提取液和阿维菌素标准溶液的色谱图Fig.2 Chromatograms of a bovine liver sample and abamectin standard solution
应用制备的poly(BMA-co-EDMA)整体柱,不接分析柱,采用分流模式对在线固相萃取参数(主要是对上样流动相的种类和洗脱流速)进一步优化。分别以0.5% 甲酸水溶液、纯水、10 mmol/L 乙酸铵缓冲溶液为上样流动相,乙腈作为洗脱流动相,对上样流动相进行考察。结果如图3 所示,上样流动相为纯水或0.5% 甲酸水溶液时,阿维菌素类药物的色谱峰拖尾严重,峰形不佳;以10 mmol/L 乙酸铵缓冲溶液为上样流动相时,色谱峰尖锐、集中,上样效率最高,因此选用10 mmol/L 乙酸铵缓冲溶液为上样流动相。
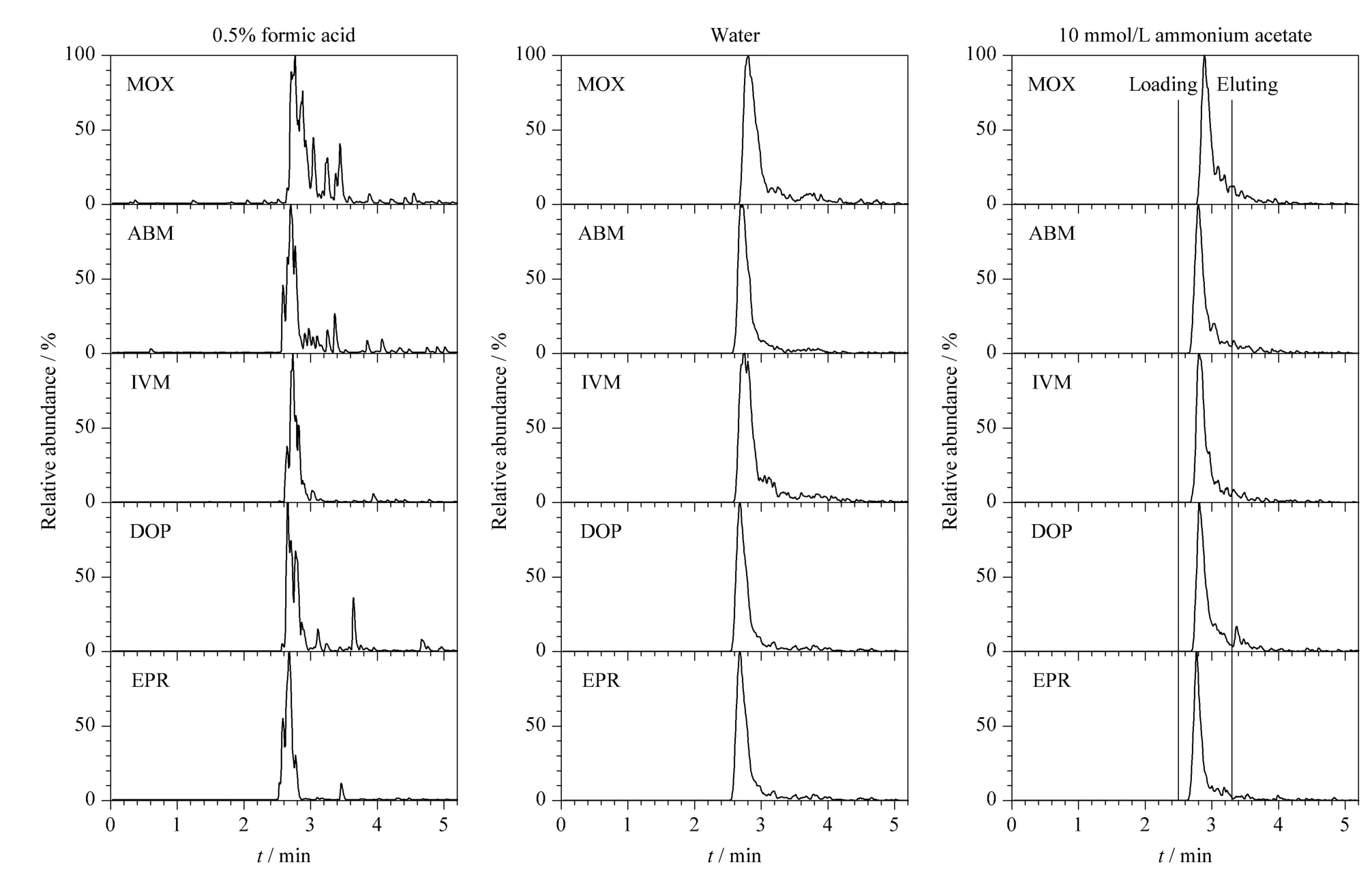
图3 不同上样流动相下阿维菌素类药物的MRM 谱图Fig.3 MRM chromatograms of on-line SPE of the avermectins under different loading solutions
在洗脱过程中,以10 mmol/L 乙酸铵缓冲溶液为上样流动相,乙腈为洗脱流动相,分别在流速为0.3、0.5、0.8 mL/min 条件下对阿维菌素类药物进行洗脱。随着流速的增大,5 种阿维菌素类药物的色谱峰峰形逐渐改善(见图4),但考虑到连接分析柱后仪器承受的压力过大会对仪器产生不利影响,故最终选用0.5 mL/min 作为洗脱流速。
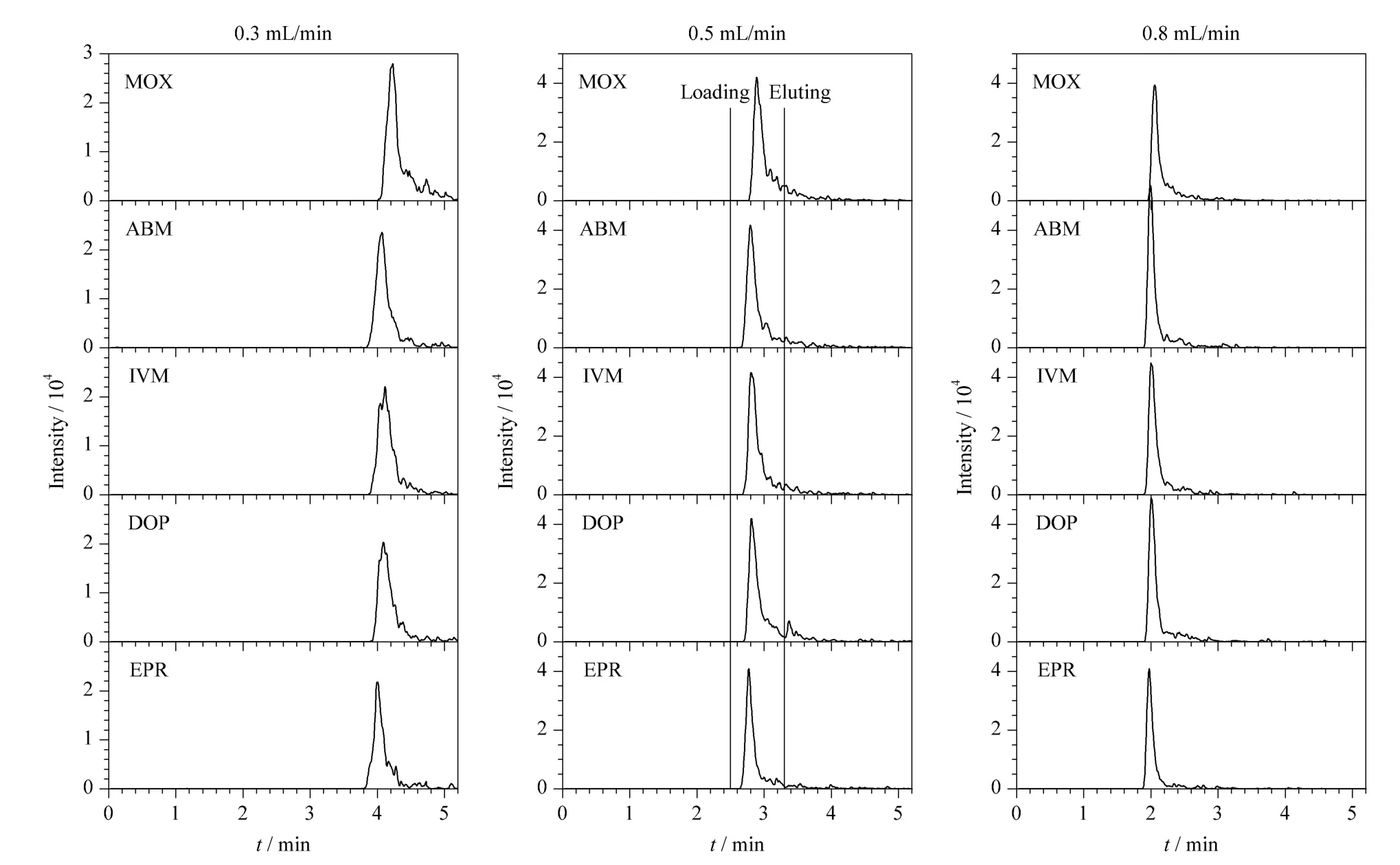
图4 不同洗脱流速下阿维菌素类药物的MRM 谱图Fig.4 MRM chromatograms of on-line SPE of the avermectins under various elution flow rates
2.2 HPLC-MS/MS 条件的确立
整个固相萃取过程为自动化控制,在线固相萃取和HPLC-MS/MS 联用能够提高方法的自动化程度和灵敏度,同时降低人为操作引起的误差和成本。在线净化柱处理的分析物洗脱后直接转移至HPLC-MS/MS 系统进行分析,从而实现前处理和分离测定的连接。分析流动相的种类影响化合物检测的灵敏度、峰形及分离效果。图5 是分别选用乙腈-0.5% 甲酸溶液(1 ∶9,v/v)、乙腈-0.1% 氨水溶液(1∶9,v/v)为分析流动相时阿维菌素类药物的响应值。可见使用乙腈-0.1% 氨水溶液为分析流动相时阿维菌素类药物的响应值较高,这是因为碱性环境下阿维菌素类药物易电离形成[M-H]-离子。
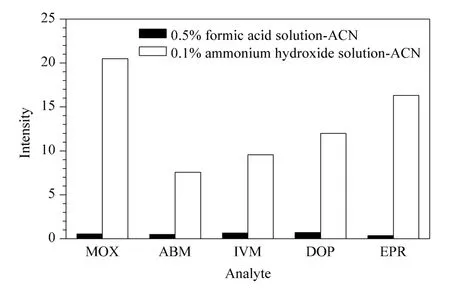
图5 不同分离流动相条件下阿维菌素类物质的响应值Fig.5 Responses of avermectins with different desorption solutions
阿维菌素类药物在质谱的电喷雾离子源(ESI)和大气压力化学离子源(APCI)模式下均有响应,ESI 模式下[M+NH4]+或[M+Na]+正离子响应强;APCI 模式下[M-H]-负离子响应强。实验对两种模式进行了考察,发现APCI 模式下5 种分析物的响应值较ESI 模式下的响应值稳定,且基质效应影响小,尤其是对于肝脏这类复杂样品,ESI 模式基质效应明显,响应值下降50%。因此,本方法选择APCI 离子源。MRM 及离子源参数的优化是用蠕动泵以10 μL/min 向质谱系统注入1.0 mg/L 的标准溶液来确定最佳的质谱条件,包括选择特征离子对,优化鞘气压力、辅助气压力、碰撞能量等质谱分析条件。
2.3 基质效应
基质与溶剂标准曲线斜率的比值可反映基质效应的强弱。斜率比值在0.8 ~1.2 范围内显示基质效应不明显,超出该范围则显示基质效应较为明显。用乙腈配制1、5、10、20、50、70 和100 μg/L 的系列混合标准溶液;称取牛肝阴性样品,按照前处理步骤提取净化,以提取液稀释标准溶液,得到一系列与溶剂标准溶液相同浓度的基质混合标准溶液,分别以标准溶液的质量浓度为横坐标(X,μg/L),峰面积(Y)为纵坐标进行线性回归分析。结果显示,溶剂和基质标准曲线的线性良好,相关系数r 均大于0.995。如表3 所示,以牛肝为基质的基质标准曲线与溶剂标准曲线的斜率比值未超出0.8 ~1.2 的范围,基质效应不明显。结合图2 的实验结果,poly(BMA-co-EDMA)整体柱对于牛肝中的阿维菌素类药物残留具有良好的净化作用。
2.4 方法的线性范围和检出限
按照1.4 节方法对牛肝阴性样品进行处理,用提取液稀释配制一系列标准溶液,经poly(BMA-co-EDMA)在线固相萃取-HPLC-MS/MS 分析,以分析物的峰面积(Y)对溶液的质量浓度(X,μg/L)线性回归,得到方法的线性范围为1 ~100 μg/L,线性相关系数r>0.995。将一定量的阿维菌素类药物标准溶液加入至牛肝阴性样品中,依照本法处理、测定,以信噪比(S/N)为10 计阿维菌素类药物的定量限为5 μg/kg。图6 是添加10 μg/kg 阿维菌素类药物的牛肝样品的MRM 谱图。结果表明,制备的poly(BMA-co-EDMA)整体柱可以有效地去除牛肝中复杂基质的干扰,实现了样品纯化富集的目的,达到国家标准(GB/T 21320-2007)所规定的测定要求。
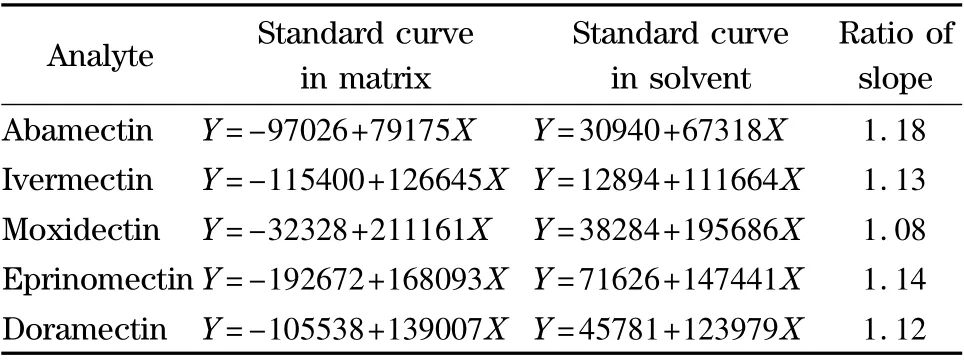
表3 牛肝提取液和溶剂的标准曲线及其斜率比值Table 3 Standard curves of avermectins in solvent and matrix ratios and their slope ratios
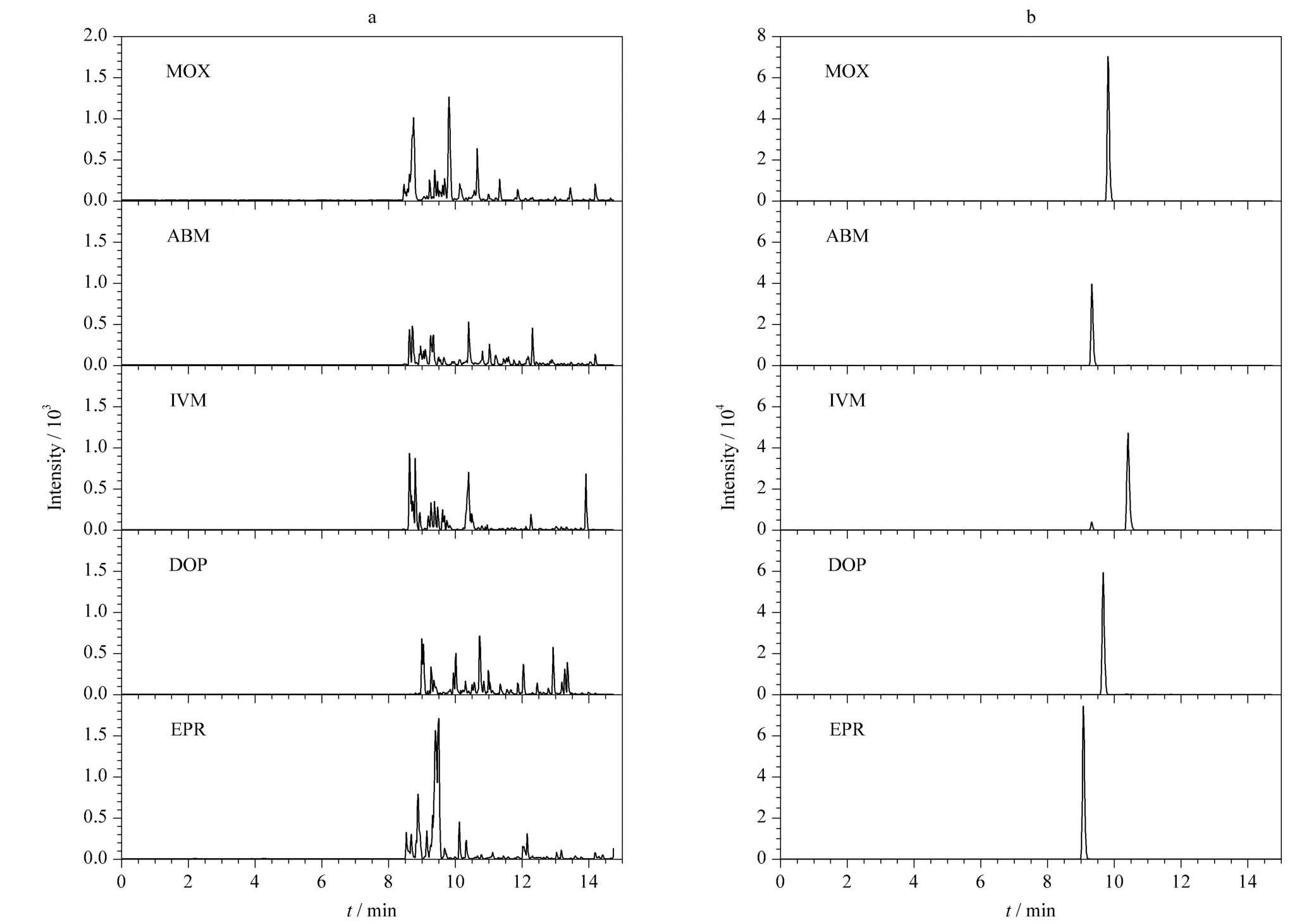
图6 (a)空白牛肝样品和(b)添加10 μg/kg 阿维菌素类药物的牛肝样品的MRM 色谱图Fig.6 MRM mass chromatograms of (a)a blank bovine liver sample and (b)a bovine liver sample spiked with avermectins at 10 μg/kg
2.5 方法的回收率和精密度
在阴性样品中分别添加4 个不同浓度的标准溶液进行加标回收和精密度试验。通过回归方程计算,得到加标回收率和相对标准偏差(RSD)(见表4),方法的加标回收率为77.4% ~98.4%,日内和日间相对标准偏差分别为4.46% ~8.03% 和4.79%~8.68%。
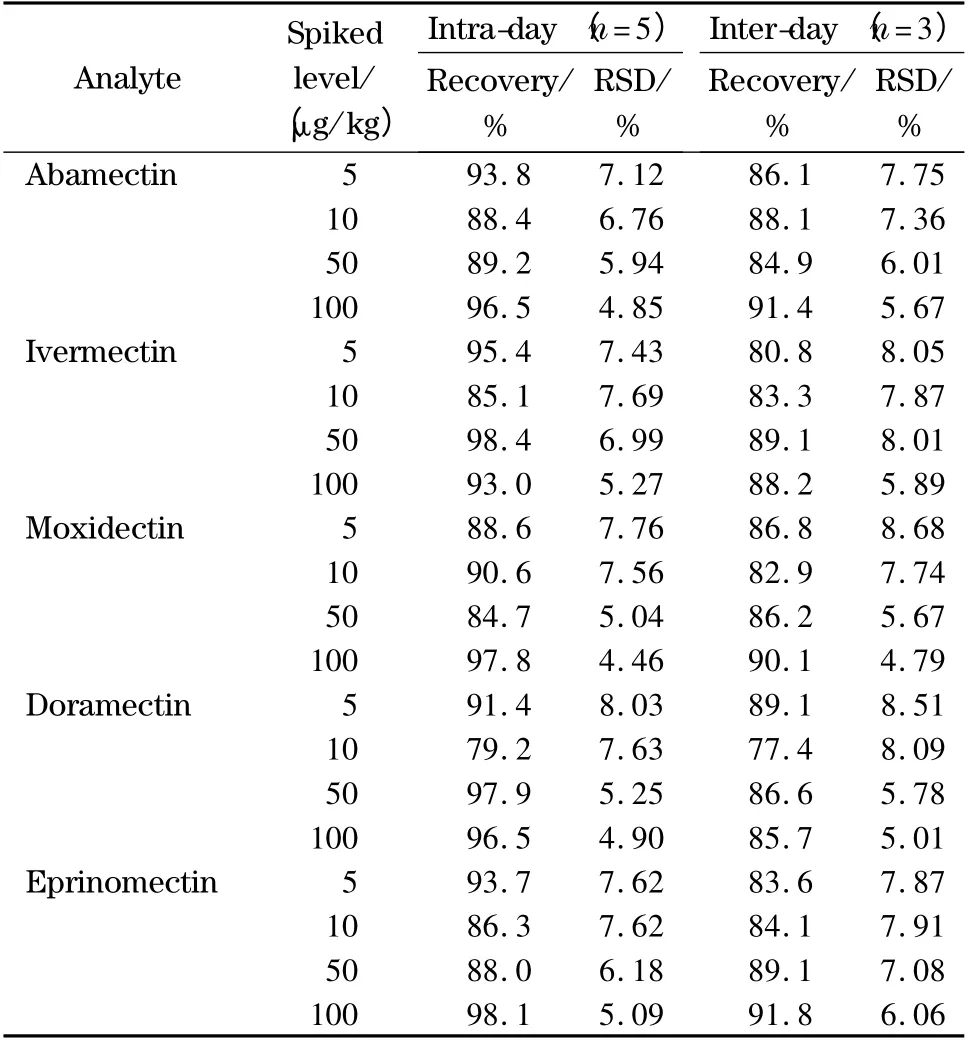
表4 空白牛肝中5 种阿维菌素类药物的加标回收率和精密度Table 4 Recoveries and RSDs of the five avermectins spiked in a blank bovine liver sample
2.6 Poly(BMA-co-EDMA)整体柱的使用寿命
在优化的条件下,同一根poly(BMA-co-EDMA)整体柱在重复使用400 次后,其背压和萃取效率均无明显变化。不同使用次数和不同批次整体柱对牛肝基质中阿维菌素药物在线净化前处理后得到的谱图无明显差异,色谱峰峰形良好,响应值稳定,说明该整体柱具有良好的机械强度、稳定性和重现性。相比于传统的一次性使用的固相萃取柱,该整体柱能够反复使用,节约了分析成本。
2.7 实际样品测定
应用该在线净化分析测定方法对送检的61 例牛肝样品进行分析,其中5 例检出伊维菌素,含量在5.6 ~6.4 μg/kg 之间。
3 结论
本实验建立了以poly(BMA-co-EDMA)整体柱在线固相萃取,结合高效液相色谱-串联质谱分析测定牛肝中阿维菌素类药物残留的方法,满足了国家标准对阿维菌素类药物残留的测定要求;方法的自动化程度高,萃取材料可以重复使用达400 次以上,极大地节约了分析成本,有望推广用于其他复杂基质中弱极性药物残留分析的前处理。
[1] Moreira N,Bernardi M M,Spinosa H S. Neurotoxicol Teratol,2014,43:33
[2] Cao Y,Deng W,Li Y P,et al. Chinese Journal of Pesticide Science (曹源,邓维,李永平,等. 农药学学报),2014,16(1):54
[3] Merola V M,Eubig P A. Vet Clin North Am Small Anim Pract,2012,42(2):313
[4] Chukwudebe A C,Beavers J B,Jaber M,et al. Environ Toxicol Chem,1998,17(6):1118
[5] Rubensam G,Barreto F,Hoff R B,et al. Food Contr,2013,29(1):55
[6] European Food Safety Authority. EFSA J,2014,12(9):3823
[7] GB 28260-2011
[8] GB/T 21320-2007
[9] Pozo O J,Marin J M,Sancho J V,et al. J Chromatogr A,2003,992:133
[10] Tao Y F,Yu G,Chen D M,et al. J Chromatogr B,2012,897:64
[11] Piestansky J,Marakova K,Veizerova L,et al. Anal Chim Acta,2014,826:84
[12] Liu R Z,Ruan T,Wang T,et al. Talanta,2014,120:158
[13] Yang X T,Hu Y F,Li G K. J Chromatogr A,2014,1342:37
[14] Ai L F,Ma Y S,Chen R C,et al. Chinese Journal of Analytical Chemistry (艾连峰,马育松,陈瑞春,等. 分析化学),2013,41(8):1194
[15] Zhang Z B,Ou J J,Lin H,et al. Chemical Journal of Chinese Universities (张振宾,欧俊杰,林辉,等. 高等学校化学学报),2013,34(9):2011
[16] Zhang C J,Pan J L,Zhang Z M,et al. Chinese Journal of Chromatography (张成江,潘加亮,张卓旻,等. 色谱),2014,32(10):1034
[17] Namera A,Saito T. TrAC-Trend Anal Chem,2013,45:182
[18] Wei Y,Chen X,Yang S C,et al. Chinese Journal of Analytical Chemistry (韦誉,陈霞,杨胜超,等. 分析化学),2014,42(4):495
[19] Zhang L,Wang H. Journal of Instrumental Analysis (张立,王海. 分析测试学报),2014,33(7):739
[20] Sun L,Lu Y,Yang T,et al. Chinese Journal of Analysis Laboratory (孙蕾,鹿毅,杨涛,等. 分析试验室),2014,33(7):791
[21] Liu Y,Wang M M,Ai L F,et al. J Sep Sci,2014,37(13):1648
[22] Zheng H J,Liu Q W,Jia Q. J Chromatogr A,2014,1343:47
[23] Xu Y,Xu P Z,Cao Q,et al. Chinese Journal of Analytical Chemistry (徐溢,徐平洲,曹强,等. 分析化学),2008,36(12):1636
