固相萃取-超高效液相色谱-串联质谱法同时测定食品接触塑料制品中10 种苯并三唑类紫外吸收剂
2015-12-26勾新磊赵新颖池海涛周明强刘伟丽
勾新磊, 赵新颖, 池海涛, 高 峡,2, 周明强, 刘伟丽,2*
(1. 北京市理化分析测试中心,有机材料检测技术与质量评价北京市重点实验室,北京100089;2. 北京市食品安全分析测试工程技术研究中心,北京100089)
苯并三唑类化合物(benzotriazoles,BZTs)是一类紫外吸收剂,吸收280 ~400 nm 范围内的紫外光变为激发态,然后以光和热的形式将能量释放出来[1,2]。该类化合物常作为添加剂用于减少塑料制品的光降解和老化,延长使用寿命。近年来的研究表明,某些BZTs 具有一定的毒性。Yamano 等[3]认为2-(2-羟基-5-甲基苯基)苯并三唑(UV-P)会导致皮炎和皮肤过敏。Kim 等[4]研究表明BZTs 具有生物蓄积性,并影响生物体的长度和重量。Fent等[5]认为BZTs 对雄性激素有拮抗作用,会导致生物体甲状腺系统和脂肪酸代谢失衡。
近年来,聚乙烯(PE)、聚丙烯(PP)、聚酯(PET)、聚苯乙烯(PS)、聚胺(PA)等塑料包装制品广泛应用于食品接触类材料中。由于直接接触食品,塑料包装制品中残留的BZTs 很可能会迁移到食品中,造成二次污染[6,7]。我国国家标准[8]中仅规定了UV-P、2-(2-羟基-3,5-二枯基苯基)苯并三唑(UV-234)、2-(2-羟基-3,5-二叔丁基苯基)-5-氯苯并三唑(UV-327)的特定迁移量分别为30、1.5、30 mg/kg,而对允许添加的2-(2-羟基-3,5-二叔戊基苯基)苯并三唑(UV-328)、2-(2-羟基-5-叔辛基苯基)苯并三唑(UV-329)、2,2′-亚甲基双(4-叔辛基-6-苯并三唑苯酚)(UV-360)未限定其最大残留量和特定迁移量。除此之外,我国没有检测食品接触类材料中BZTs 的相关标准。
目前报道的紫外吸收剂的检测方法有液相色谱法(LC)[9-13]、气 相 色 谱-质 谱 联 用 法(GCMS)[14,15]、液 相 色 谱-串 联 质 谱 法(LC-MS/MS)[16,17]。其中,大多数方法都针对化妆品和环境样本中二苯甲酮类紫外吸收剂,针对食品接触类材料中BZTs 的检测方法报道甚少。张居舟等[13,18]利用LC 检测了食品包装中的2-(2-羟基-3-叔丁基-5-甲基苯基)-5-氯苯并三唑(UV-326)和UV-327,但方法的检出限低,检测BZTs 数量较少。本文建立了同时检测食品接触塑料制品中10 种BZTs 的固相萃取-超高效液相色谱-串联质谱(SPE-UPLC-MS/MS)分析方法。方法准确、简便、快速,检出限低,可以用于食品接触塑料制品中BZTs 的检测。
1 实验部分
1.1 仪器与试剂
Acquity 超高效液相色谱仪,XEVO TQ 串联质谱仪,Masslynx 4.1 工作站(美国Waters 公司);超声波清洗器(KQ6000V,昆山超声仪器有限公司);N-EVAP-112 氮吹仪(美国Organomation 公司);Milli-Q 超纯水器(美国Millipore 公司)。
UV-P、2-(2-羟基-5-叔丁基苯基)苯并三唑(UV-PS)、UV-234、UV-326、UV-327、UV-328、UV-329、2-(2-羟基-3-仲丁基-5-叔丁基苯基)苯并三唑(UV-350)(纯度≥97%,购自上海安谱),2-(2-羟基-3,5-二叔丁基苯基)苯并三唑(UV-320)(纯度≥99%,购自德国Dr. Ehrenstorfer 公司),UV-360(纯度≥98%,购自日本TCI 公司)标准品结构式见图1;Sep-Pak C18 固相萃取柱(500 mg/3 mL,美国Waters 公司);甲醇、乙腈、正己烷、乙酸乙酯为色谱纯(美国Fisher 公司);二氯甲烷、丙酮为色谱纯(安徽时联特种溶剂股份有限公司);实验用水为经Milli-Q 净化系统(0.22 μm 过滤膜)制备的去离子水;其他试剂均为分析纯。样品为矿泉水瓶、面包袋、一次性食品袋等,均购自超市。
1.2 标准溶液配制
分别准确称取适量上述标准物质,用甲醇溶解、定容,制得质量浓度均为1 000 mg/L 的单标准储备液。准确移取各标准储备液,混合于100 mL 容量瓶中,甲醇定容,配制成每种标准物质均为1 mg/L的混合对照品储备液。所有溶液均在4 ℃下保存。
1.3 样品处理
食品塑料包装用水洗净自然晾干后,剪成面积小于5 mm×5 mm 的碎片。准确称取0.2 g,置于100 mL 具塞锥形瓶中,用50 mL 甲醇-二氯甲烷(1 ∶1,v/v)于40 ℃超声提取40 min,将提取液转移至鸡心瓶中,于40 ℃减压浓缩至干,以2 mL 丙酮-二氯甲烷(9 ∶1,v/v)混合溶剂溶解残渣。
C18 固相萃取小柱使用前依次用5 mL 甲醇、5 mL 水、3 mL 丙酮-二氯甲烷(9 ∶1,v/v)混合溶剂活化。将溶解残渣的溶液转移至活化好的固相萃取小柱,用1 mL 丙酮淋洗,弃去流出液,再用4 mL 甲醇洗脱,收集洗脱液于氮吹管中,于40 ℃氮吹至干,用甲醇定容至1 mL,过0.22 μm 有机滤膜,供UPLCMS/MS 测定。
1.4 色谱和质谱条件
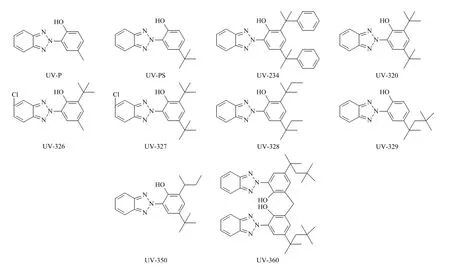
图1 10 种BZTs 的结构式Fig.1 Structural formulas of the ten BZTs
色谱柱:Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm);流动相:A 为0.1%(v/v)甲酸水溶液,B 为甲醇溶液。流速为0.3 mL/min,柱温为35 ℃。梯度洗脱程序:0 ~6 min,90% B ~94% B;6 ~7 min,94% B ~99% B;7 ~12 min,99% B;12 ~12.5 min,99% B ~90% B;12.5~14 min,90% B。
质谱条件:电喷雾电离正离子模式(ESI+);多反应监测(MRM)模式;毛细管电压为3.0 kV;萃取电压为5.0 V;离子源温度为150 ℃;脱溶剂气温度为350 ℃;脱溶剂气流速为650 L/h;锥孔气流速为20 L/h。
2 结果与讨论
2.1 质谱条件的选择
在ESI 模式下,采用蠕动泵以10 μL/min 的速度分别将10 种BZTs 的标准溶液单独注入质谱的离子源中,测定其在正、负离子模式下的质谱信号强度。实验结果表明,在ESI+模式下,10 种BZTs 均可获得较高丰度的[M+H]+准分子离子峰。确定母离子后,采用子离子扫描方式进行二级质谱分析,对子离子进行优化选择,以确定定量离子和定性离子。然后对离子源温度、去溶剂气温度及流量、锥孔气流量进行优化,使目标物质的离子化效率达到最佳。10 种BZTs 质谱参数如表1 所示。
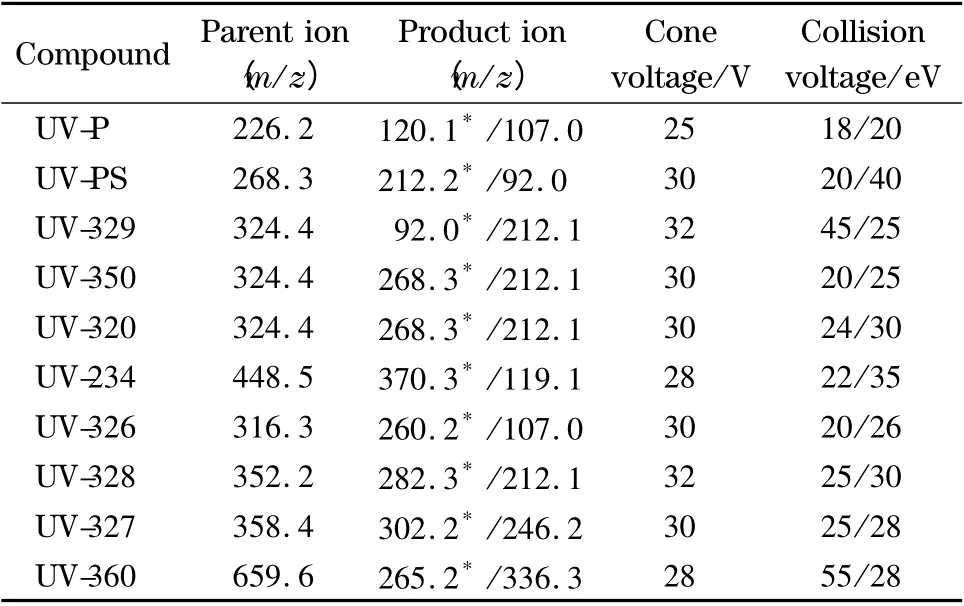
表1 10 种BZTs 的质谱参数Table 1 MS/MS acquisition parameters for the ten BZTs
2.2 色谱条件的优化
实验采用Waters ACQUITY UPLC BEH C18分离柱,分别比较了甲醇-水、甲醇-0.1% (v/v)甲酸水溶液、乙腈-0.1% (v/v)甲酸水溶液3 种流动相体系的分离效果。结果表明,甲醇-0.1% (v/v)甲酸作流动相时的效果最好。相对于乙腈体系,使用甲醇为有机相可以获得更好的分离效果和仪器响应。在流动相中加入0.1% (v/v)甲酸有助于化合物的离子化,使目标物响应增强,灵敏度提高。采用梯度淋洗,可提高苯并三唑类化合物各组分在色谱柱中的分析效率。图2 为10 种BZTs 叠加的总离子流色谱图。
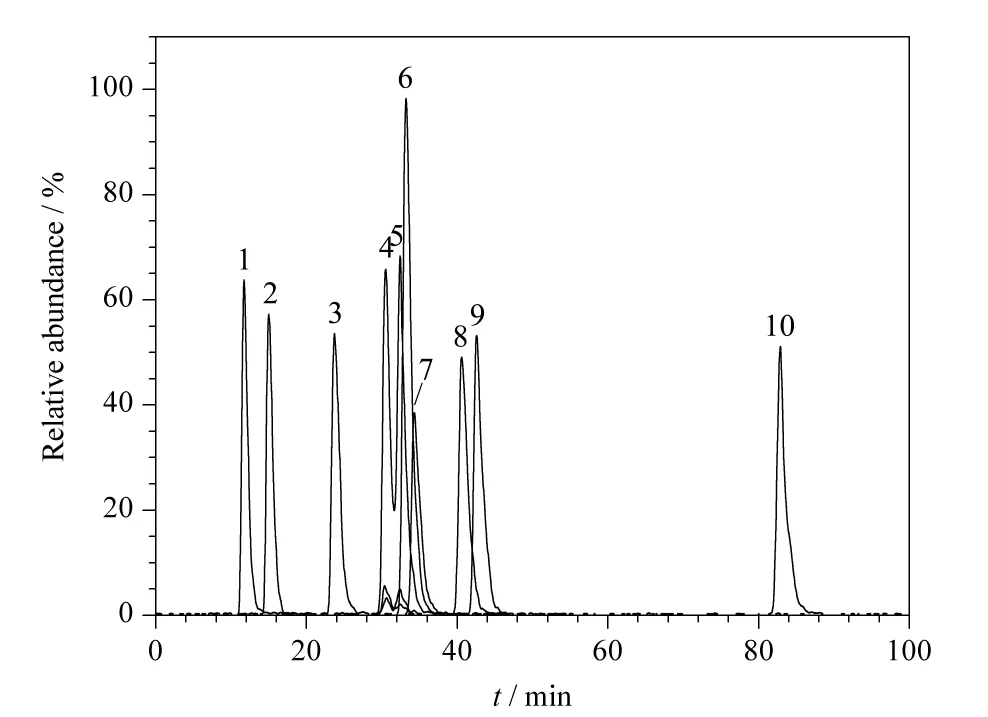
图2 10 种BZTs 叠加的总离子流色谱图Fig.2 Combined total ion chromatograms of the ten BZTs
2.3 提取条件的优化
由于BZTs 极性相对较弱,其在水中的溶解性差,但能溶于大多数有机溶剂。因此本实验选择PP、PE、PET 等空白食品接触塑料制品,添加标准溶液制备加标样品,分别考察了丙酮、正己烷、乙腈、乙酸乙酯、二氯甲烷、甲醇、甲醇-二氯甲烷混合溶液作为提取溶剂时各个目标化合物的提取效果。结果表明,在100 μg/kg 的加标水平下,丙酮的回收率相对较低;乙酸乙酯、二氯甲烷和甲醇都有较好的回收率;使用甲醇-二氯甲烷作为提取溶剂时,10 种BZTs 的平均回收率最佳(见表2)。
实验进一步考察了提取时间对提取效率的影响。结果如图3 所示,超声40 min 后目标化合物的回收率并没有明显提高,考虑到提取效率,本方法确定超声时间为40 min。
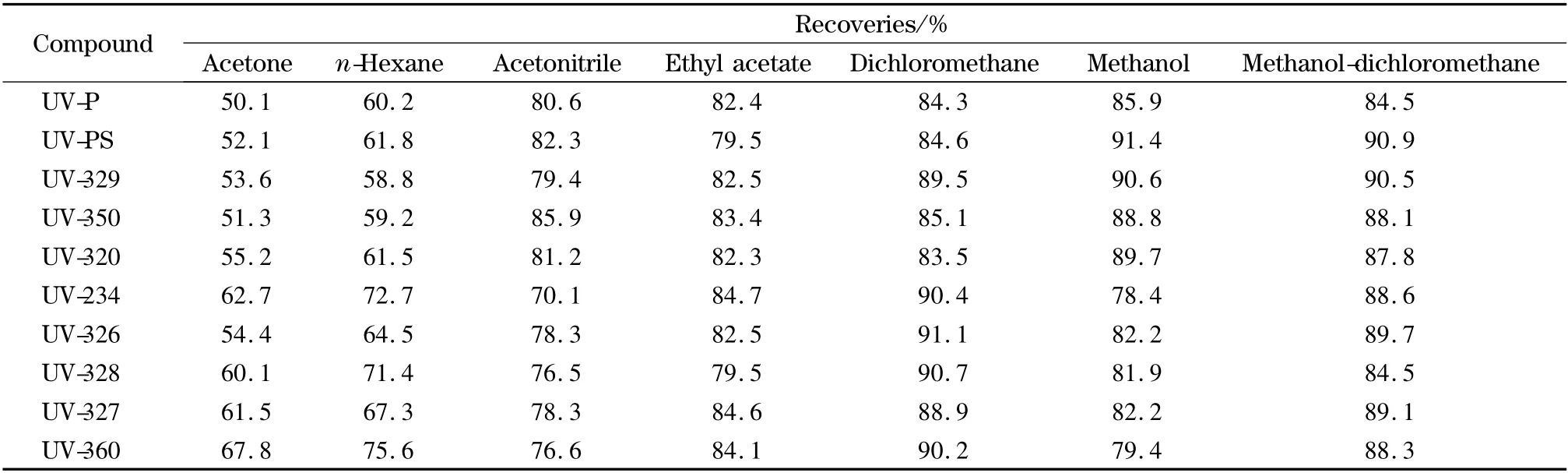
表2 100 μg/kg 加标水平下不同提取溶剂对回收率的影响Table 2 Effect of different extraction solvents on recoveries of the ten BZTs spiked at 100 μg/kg
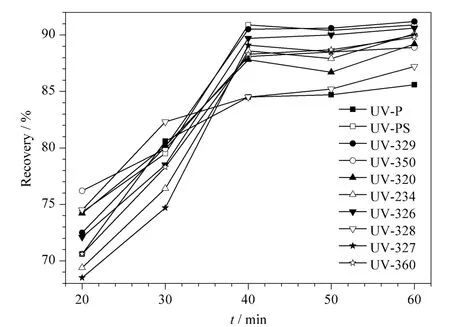
图3 不同超声时间对10 种BZTs 回收率的影响Fig.3 Effect of different extraction times on recoveries of the ten BZTs
2.4 净化条件的优化
实验考察了弗罗里硅土柱、石墨化炭黑柱和C18 柱的净化效果。结果如图4 所示,C18 柱的净化效果和回收率较好。上样后用丙酮去除色素、油墨等杂质,用甲醇洗脱,在收集的第5 mL 洗脱液中检测不到任何目标物。因此,用4 mL 甲醇即可完全洗脱目标物。
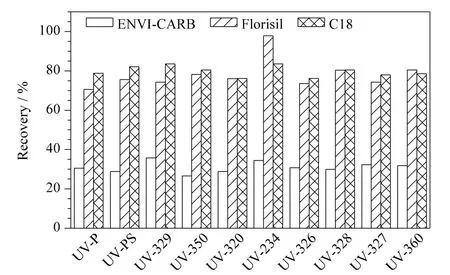
图4 不同固相萃取柱对10 种BZTs 回收率的影响Fig.4 Effect of different SPE columns on recoveries of the ten BZTs
2.5 方法的线性关系和检出限
以基质匹配的方法绘制标准曲线,以空白样品的甲醇提取液作为标准溶液的稀释溶液,精确配制1.0 ~100.0 μg/L 的10 种BZTs 混合标准工作溶液,在选定的色谱条件和质谱条件下进行测定,依据特征离子色谱峰的S/N≥3 确定方法的检出限,S/N≥10 确定方法的定量限。结果表明,10 种BZTs 在1.0 ~100.0 μg/L 范围内呈现良好的线性关系,线性相关系数均大于0. 996(见表3),说明本方法适用于食品接触类材料中10 种BZTs 的定量分析。
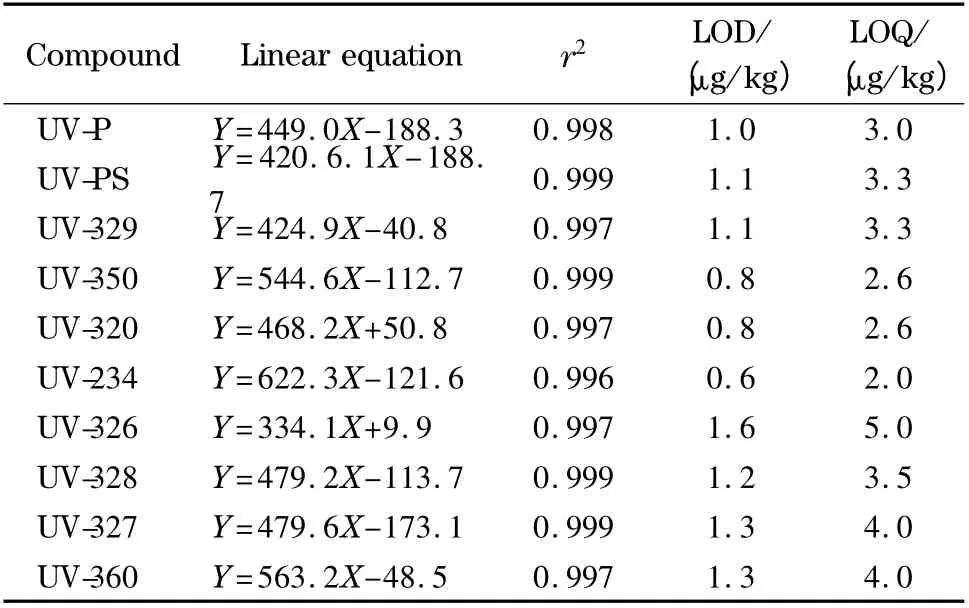
表3 10 种BZTs 的线性方程、相关系数、检出限和定量限Table 3 Linear equations,correlation coefficients,LODs and LOQs of the ten BZTs
2.6 方法的加标回收率和精密度
以空白食品塑料包装材料为样品,分别添加不同浓度的标准溶液,进行添加回收率和精密度试验。10.0、20.0、100.0 μg/kg 添加水平下,每个平行测定6 次。结果如表4 所示,不同水平下各待测物的平均回收率为75.2% ~85.3%,相对标准偏差为1.0% ~5.7%,能满足10 种BZTs 的测定要求。
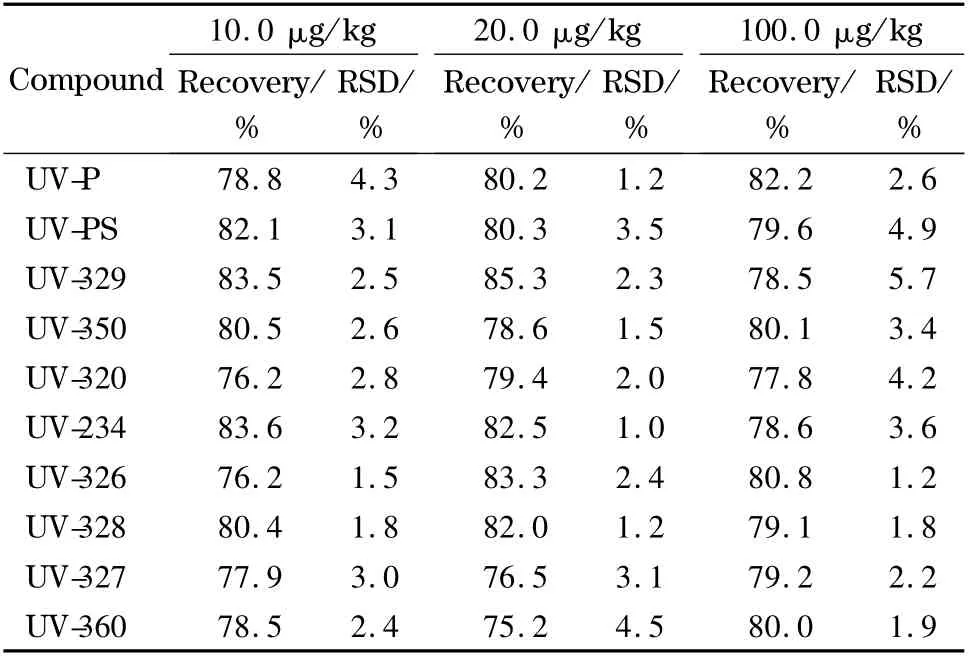
表4 回收率和精密度检测结果Table 4 Results of precision and recovery tests (n=6)
2.7 样品分析
利用本方法对PE、PET、PS、PA 等食品接触塑料制品类材料共10 个样品进行检测。结果在一种PE 材料食品包装袋中检测出UV-360 残留,含量为187.5 μg/kg(见图5)。
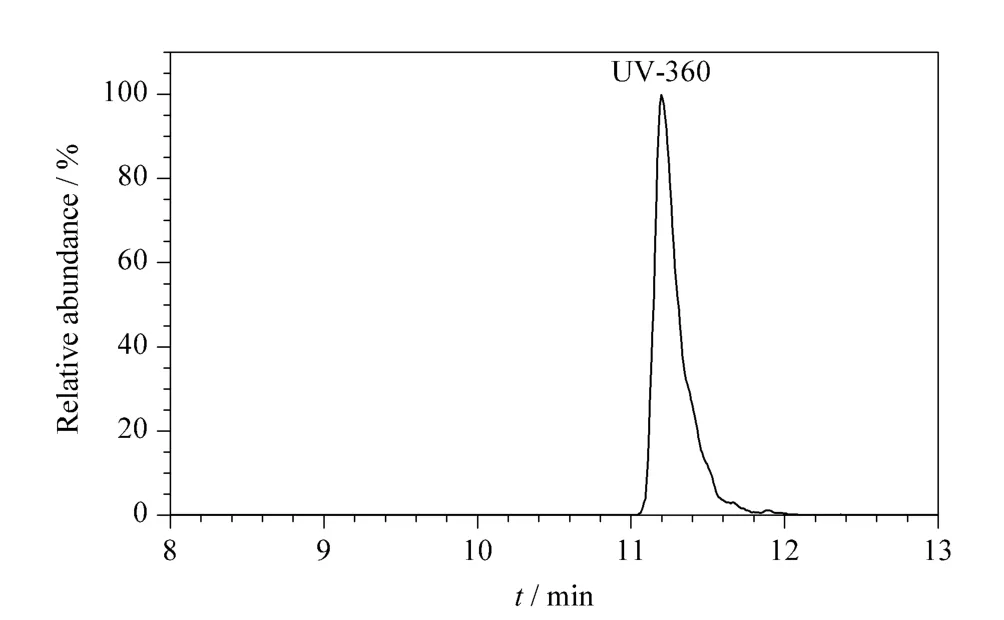
图5 PE 食品包装袋中UV360 的MRM 色谱图Fig.5 MRM chromatogram of UV360 in a PE food packaging bag
3 结论
本文建立了固相萃取-超高效液相色谱-串联质谱法同时测定食品接触塑料制品中10 种BZTs 的分析方法。样品采用甲醇-二氯甲烷混合溶剂提取,SPE 柱净化,UPLC-MS/MS 检测。该方法操作简便、检出限低、准确度高,能够满足食品接触塑料制品中BZTs 的检测要求,为保障食物安全提供了检测技术支持。
[1] Baran D,Balan A,Stubhan T,et al. Synthetic Met,2012,162:2047
[2] Pei K,Cui Z H,Chen W. J Mol Struct,2013,1032:100
[3] Yamano T,Shimizu M,Noda T. J Health Sci,2001,47(2):123
[4] Kim J,Isobe T,Ramaswamy B R,et al. Chemosphere,2011,82:751
[5] Fent K,Chew G,Li J,et al. Sci Total Environ,2014,482/483:125
[6] Ai L F,Guo C H,Ge S H,et al. Packaging Engineering (艾连峰,郭春海,葛世辉,等. 包装工程),2011,32(13):4
[7] Ai L F,Guo C H,Ge S H,et al. Journal of Instrumental Analysis (艾连峰,郭春海,葛世辉,等. 分析测试学报),2011,30(1):13
[8] GB 9685-2008
[9] Mao X Q,Bian H T,Qu B C. Chinese Journal of Chromatography (毛希琴,边海涛,曲宝成. 色谱),2013,31(8):775
[10] Li C F,Li Y,Chen Z N,et al. Chinese Journal of Chromatography (李成发,李英,陈枝楠,等. 色谱),2014,32(6):616
[11] Huang X F,Liu L Y,Xu Q,et al. Chinese Journal of Analytical Chemistry (黄雄风,刘绿叶,许群,等. 分析化学),2014,42(12):1846
[12] Liu H X,Yang Y X,Ma M G,et al. Chinese Journal of Analytical Chemistry (刘海霞,杨尧霞,马明广,等. 分析化学),2015,43(2):207
[13] Zhang J Z,Li J,Shao D L,et al. Chinese Journal of Chromatography (张居舟,李静,邵栋梁,等. 色谱),2012,30(2):190
[14] Casado J,Rodríguez I,Carpinteiro I,et al. J Chromatogr A,2013,1293:126
[15] Casado J,Nescatelli R,Rodríguez I,et al. J Chromatogr A,2014,1336:1
[16] Liu R,Ruan T,Wang T,et al. Talanta,2014,120:158
[17] Lin W X,Sun X Q,Ma J. Chinese Journal of Chromatography (林维宣,孙兴权,马杰. 色谱),2013,31(5):410
[18] Li J,Zhang J Z,Shao D L,et al. Journal of Instrumental Analysis (李静,张居舟,邵栋梁,等. 分析测试学报),2011,30(4):435
