高效液相色谱-串联质谱法同时测定人尿液中7 种邻苯二甲酸酯代谢物
2015-12-26许媛媛金忠秀胡海婷任玲玲陶芳标
高 慧, 许媛媛,, 孙 丽, 金忠秀, 胡海婷,盛 杰, 任玲玲, 陶芳标,*
(1. 安徽医科大学公共卫生学院儿少卫生与妇幼保健学系,安徽 合肥230032;2. 安徽人口健康与优生省级实验室,安徽 合肥230032)
邻苯二甲酸酯(phthalic acid esters,PAEs)是一类具有软化作用的化合物,全球每年消耗量高达几百万吨[1]。主要用作塑化剂,广泛用于食品包装、医疗器械、家居装饰、儿童玩具以及个人护理产品中[2]。PAEs 在使用过程中极易释放,已普遍存在于大气、水体、食物等多种环境介质中。人类主要通过消化道、呼吸道、静脉注射和皮肤接触等途径暴露[2],在体内迅速水解为生物活性增强的单酯,可进一步发生氧化或羟基化反应[3,4]。这些代谢产物经内源性葡萄糖醛酸化以增加水溶性,主要经尿液排出体外[3]。因此,目前尿液中代谢物常作为相应PAEs 的生物标志物,评估近期暴露水平[3,4]。研究表明,PAEs 具有潜在的生殖和发育毒性、神经毒性[5]、甲状腺毒性以及增加儿童哮喘和过敏风险等,危害人类健康。可见,建立准确、灵敏的暴露评估方法,对今后的健康研究和卫生政策制定至关重要。
国内对饮食[6-8]、化妆品[9]、土壤[10]等样品中PAEs 的检测方法报道较多,但尿液中PAEs 代谢物的实验检测方法多为国外学者建立,国内报道较少[11]。目前常见的人类尿液PAEs 代谢物检测方法有气相色谱-质谱(GC-MS)法、高效液相色谱(HPLC)法[12-15]和高效液相色谱-串联质谱(HPLCMS/MS)法等[11,16]。本实验室建立了同时检测尿液中7 种PAEs 代谢物的高效液相色谱-电喷雾-串联质谱(HPLC-ESI-MS/MS)分析方法,操作简便、结果准确、灵敏度高、重现性好,为今后评价人类多种PAEs 暴露水平及健康科学研究奠定了实验基础。
1 实验部分
1.1 仪器与试剂
1200 HPLC-6410 MS Agilent 液相色谱/质谱联用仪,配电喷雾离子源(美国Agilent 公司);Oasis®MAX(3 mL/60 mg)SPE 小柱(美国Waters 公司);N-EVAP-122 氮吹仪(美国Organomation 公司);美国Millipore 纯水仪;SK-1 快速混匀器(金坛市科技仪器有限公司);HZS-H 电热恒温水浴振荡器(哈尔滨市东联电子技术开发有限公司)。
LC-MS 级甲醇、乙腈和水均购自美国Honeywell 公司;β-葡萄糖醛酸酶、LC-MS 级无水乙酸、分析纯醋酸铵均购于美国Sigma-Aldrich 公司;分析纯氨水、色谱级无水甲酸均购于西陇化工股份有限公司。
邻苯二甲酸酯标准品原液(100.0 mg/L,纯度≥99%):邻苯二甲酸单甲酯(MMP 和13C-MMP)、邻苯二甲酸单乙酯(MEP 和13C-MEP)、邻苯二甲酸单丁酯(MBP 和13C-MBP)、邻苯二甲酸单苄酯(MBzP 和13C-MBzP)、邻苯二甲酸-单-乙基己基酯(MEHP 和13C-MEHP)、邻苯二甲酸-单-(2-乙基-5-羟基己基)酯(MEHHP 和13C-MEHHP)和邻苯二甲酸-单-(2-乙基-5-酮基己基)酯(MEOHP 和13CMEOHP),均购于美国剑桥同位素实验室。
1.2 溶液的配制
1.2.1 标准储备液
准确量取MMP、MEP、MBP、MBzP、MEHP、MEHHP 和MEOHP 及其13C 标记单酯的标准品原液1 mL 于10 mL 容量瓶中,乙腈定容,配制为10.0 mg/L 的单标准储备液和内标单标准储备液。
1.2.2 标准工作液配制
准确量取10.0 mg/L 各单标准储备液1 mL 于同一10 mL 容量瓶中,乙腈定容,配制1.0 mg/L 的混合标准工作液;同时配制1.0 mg/L 的内标混合标准工作液,操作步骤同上。
1.2.3 内标定容液配制
准确量取1.0 mg/L 内标混合标准工作液1 mL于干净的50 mL 容量瓶中,加入LC-MS 级乙腈9 mL,LC-MS 级水定容,配制为20.0 μg/L 的混合内标定容液。
1.2.4 系列标准溶液的配制
准确量取1.0 mg/L 混合标准工作液2 mL 于10 mL 容量瓶中,加入0.2 mL 内标混合标准工作液(1.0 mg/L),LC-MS 级水定容,配制为200.0 μg/L的标准溶液;此后逐级稀释,采用20.0 μg/L 混合内标定容液定容,配制100.0、50.0、25.0、10.0、5.0、1.0、0.2 μg/L 的系列标准溶液,保证溶液中13C-内标物浓度均为20.0 μg/L。
1.3 实验条件与方法
1.3.1 高效液相色谱条件
色谱柱:Agilent ZORBAX SB-Phenyl(100 mm×2.1 mm,3.5 μm);流动相:A 相为0.1% (v/v,下同)乙酸水溶液,B 相为0.1% 乙酸乙腈溶液。洗脱梯度:0 ~8 min,20%B ~50%B;8 ~13 min,50%B ~60%B;13 ~17 min,60% B;17 ~19 min,60% B ~90%B;19 ~21 min,90% B;21 ~23 min,90% B ~20% B;23 ~27 min,20% B。流速为0.2 mL/min;柱温35 ℃;连续自动进样,进样量为10 μL。
1.3.2 质谱条件
电喷雾离子源负离子模式(ESI-);毛细管电压为4 000 V;雾化气压力为275.8 kPa,干燥气温度为300 ℃,流速为9.0 L/min;多反应监测(MRM)模式检测;碰撞气和载气均为高纯氮气。7 种PAEs 及其内标物的定量离子对、保留时间、碎裂电压、碰撞能量等质谱参数见表1。
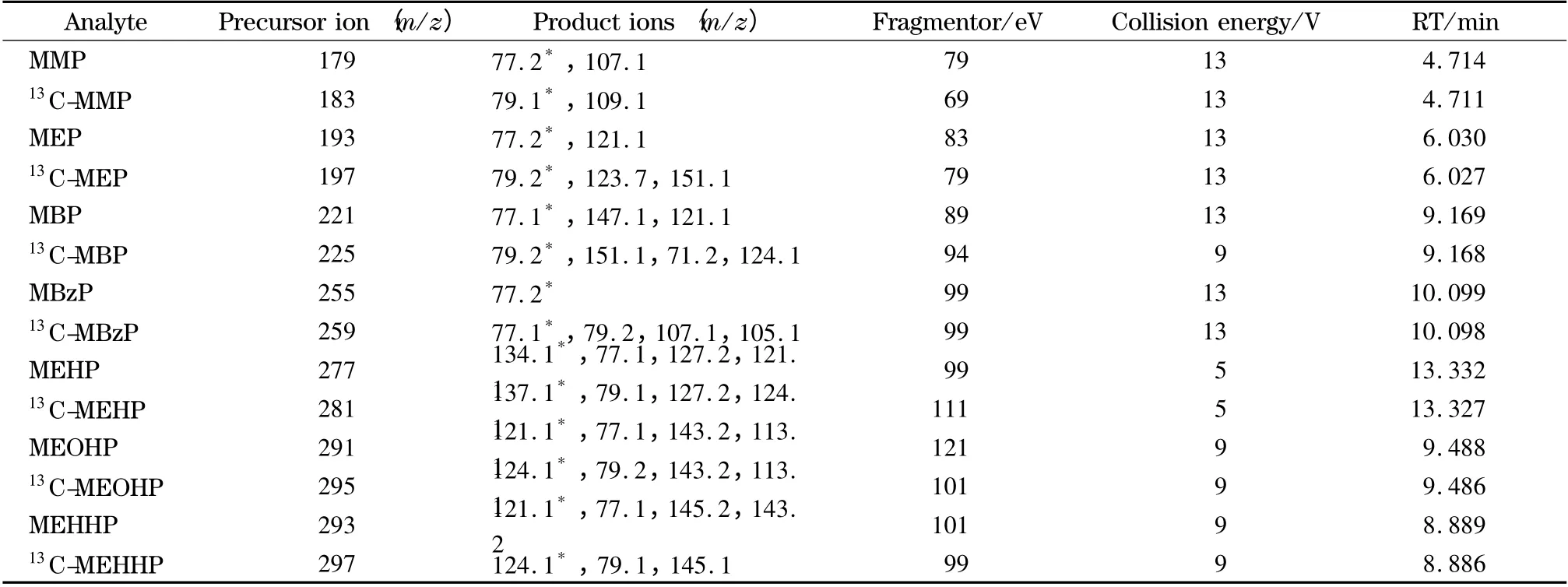
表1 7 种邻苯二甲酸单酯及其内标的特征离子对、碎裂电压、碰撞能量和保留时间等质谱参数Table 1 Precursor and product ion transitions,fragmentors,collision energies and retention times (RT)of the native and labeled seven phthalate metabolites
1.3.3 尿液的收集与处理
孕妇晨尿收集于马鞍山市妇幼保健院,采用聚丙烯尿杯收集,经转速3 500 r/min 离心10 min 后,取上清液于聚丙烯尿管中,-80 ℃冰箱保存。实验时,取出冷冻储存的尿液,在室温条件下缓慢解冻,经转速3 500 r/min 离心10 min 后,取上清尿液1 mL 于玻璃试管中,分别加入200 μL 乙酸铵缓冲液(1 mol/L,pH 5.0)、50 Units β-葡萄糖醛酸酶和4 μL 内标混合工作液(1.0 mg/L),盖上玻璃盖,涡旋混匀后于37 ℃水浴振荡120 min。固相萃取小柱经3 mL 甲醇和3 mL 水活化后,将酶解处理后的尿样上样,再分别采用5% 氨水溶液、纯甲醇和2% 甲酸-40% 甲醇-水溶液淋洗,最后采用2% 甲酸-甲醇溶液洗脱。洗脱液经55 ℃水浴氮吹至微润后以0.2 mL 体积比为1 ∶4 的乙腈和水溶液定量复溶,供HPLC-MS/MS 分析。
2 结果与讨论
2.1 尿液前处理过程优化
2.1.1 酶添加量的优化
尿液中PAEs 代谢产物以游离态和葡萄糖醛酸结合态两种形式存在,且部分代谢物的结合态所占比例较高,因此对样品进行去葡萄糖醛酸基的酶解处理十分必要。根据文献[11],确定解离酶为β-葡萄糖醛酸酶,酶解温度为37 ℃。文献报道的解离酶温育时间60 ~120 min、酶解环境pH 5.0 ~7.0、酶适宜用量各不相同。选取一份志愿者晨尿,分别将尿液酸化为pH 5.0、6.0、6.5 和7.0,添加足够酶量后温育120 min,发现pH 5.0 的环境中,酶解效果最佳(见图1)。确定尿液的适宜酸环境为pH 5.0 后,在另一志愿者各等份尿液中各加入酶量0、5、50 和100 Units 分别温育60、90、120 min 进行酶解,以MBP 测定结果为指标。结果(见图2)发现,当酶添加量为50 Units 并温育120 min 时,与酶添加量为100 Units 的MBP 测定结果无统计 学 差 异(p =0.070),综合考虑时间和成本,确定样品酶解处理的酶适宜用量为50 Units,温育时间为120 min。
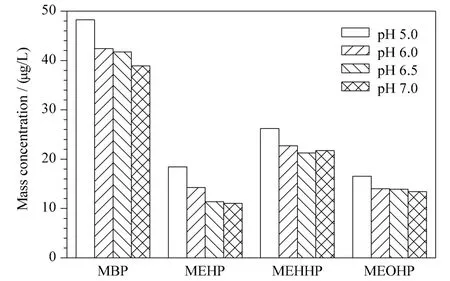
图1 志愿者尿液在pH 5.0 ~7.0 酸化处理后MBP、MEHP、MEHHP 和MEOHP 的质量浓度(μg/L)Fig.1 Mass concentrations of MBP,MEHP,MEHHP and MEOHP in volunteer urine after acidification at pH 5.0-7.0 levels
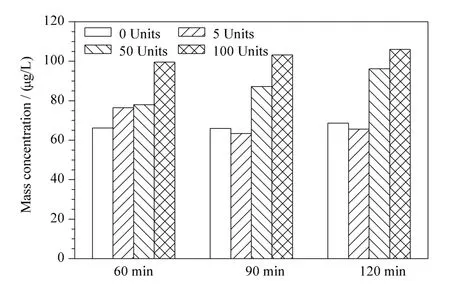
图2 志愿者尿液在不同的酶添加量和温育时间处理后MBP 的质量浓度Fig.2 Mass concentrations of MBP in volunteer urine after processing with various amounts of glucuronidase enzyme and at various incubation times
2.1.2 净化条件优化
通过比较Waters OASIS®HLB 柱(3 mL/60 mg)和MAX 柱(3 mL/60 mg)的萃取效果,确定采用MAX 柱进行固相萃取。这是由于MAX 柱为混合阴离子交换柱,具有阴离子交换和反相吸附两种模式,因此本次实验采用了3 个步骤进行淋洗。在上样后采用5% 氨水(淋洗液A)过柱,促进酸性的邻苯二甲酸单酯化合物离子化,提高其在MAX 柱的保留水平;再用纯甲醇(淋洗液B)淋洗减少有机杂质;2% 甲酸-40% 甲醇-水溶液(淋洗液C)淋洗去除酸性杂质且调节柱的酸碱度,便于洗脱;最后采用2% 甲酸-甲醇溶液洗脱。通过比较不同使用量的洗脱剂(1 ~6 mL),发现洗脱剂≥3 mL 时洗脱效果相似;考察淋洗液C 中不同甲醇含量(0 ~50% )的淋洗效果,发现使用20% ~40% 甲醇的淋洗液C 时,7种PAEs 代谢物的回收率较好。为了更多地去除杂质,认为选择甲醇含量为40% 的淋洗液C 最合适(见图3);最后比较了淋洗液A、B 和C 不同配比的淋洗效果,发现采用1 mL 淋洗液A、1.5 mL 淋洗液B 和1 mL 淋洗液C 的淋洗程序时回收率最佳(见图4)。
2.1.3 样品处理过程优化
为了避免塑料产品中塑化剂迁移污染,尿液处理材料均为玻璃制品,现洗现用。经重铬酸洗液过夜浸泡至少12 h,采用高纯水反复洗涤后,用LCMS 级甲醇润洗两遍,高温180 ℃烘1 h 备用。每一批次样品处理的同时,采用LC-MS 级水做两个平行空白样品,用于本底值扣除,以降低批次间的误差。
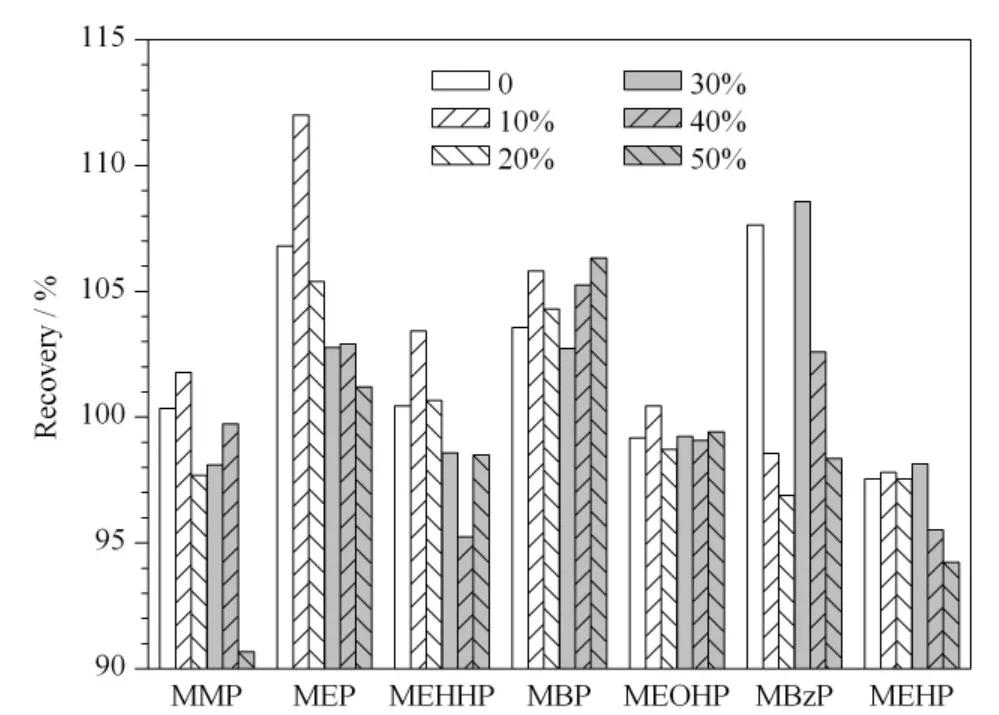
图3 采用不同甲醇含量(0 ~50%)的淋洗液淋洗后7 种PAEs 代谢物的加标回收率Fig.3 Recoveries of the seven phthalate metabolites after washing by the solutions of 0-50% methanol-2% acetic acid in water
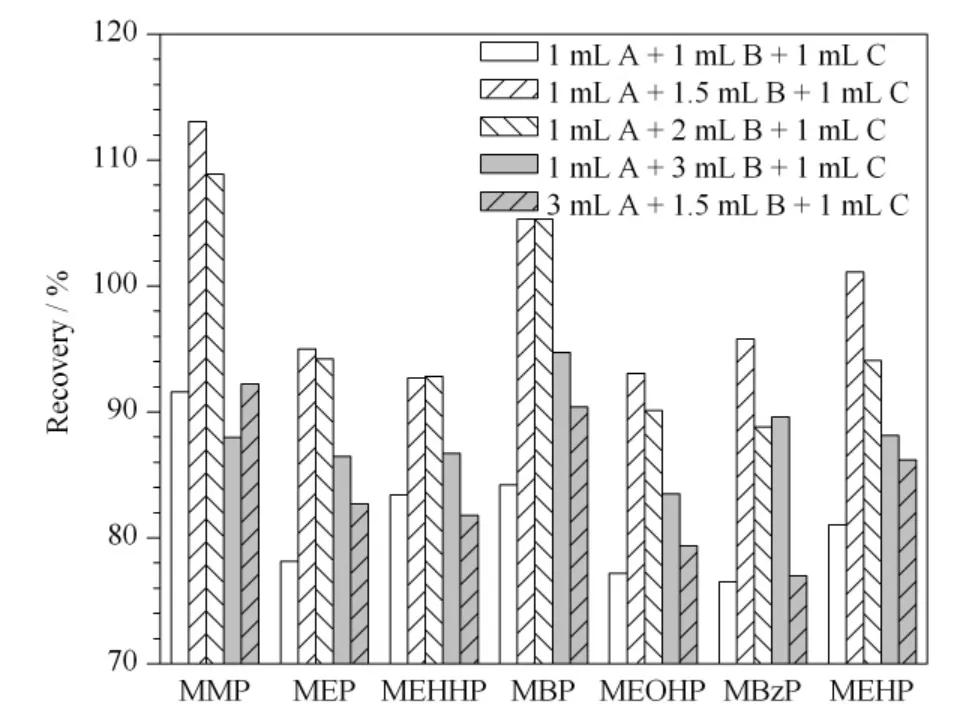
图4 采用不同体积配比的5%氨水溶液、纯甲醇和2%甲酸-40%甲醇-水溶液淋洗程序的7 种PAEs 的加标回收率Fig.4 Recoveries of the seven phthalate metabolites after processing with various eluting procedures
2.1.4 内标法定量
采用外标法定量检测时,7 种PAEs 代谢物的回收率极低(数据略);选择理化特征相似的13C-同位素作为内标物,不仅能够准确提供定性和定量信息,而且能有效避免样品基质影响,校正方法中出现的误差,显著提高检测方法的稳定性、准确度和精密度。
2.2 液相色谱及质谱条件的优化
根据国内外研究发现,PAEs 代谢物在苯基柱上的峰形及分离效果更好[15,17],因此本实验室采用ZORBAX SB-Phenyl 柱进行分离。PAEs 代谢物是一类具有极性差异的羧基化合物,在流动相中加入一定量的乙酸,抑制羧基解离,可促进其在反相柱上的保留。采用含0.1% 乙酸的乙腈-水体系作为流动相,通过梯度洗脱改变流动相的极性使混合物得到更好的分离。在8.0 ~17.0 min 时,0.1% 乙酸-乙腈溶液的浓度梯度增加缓慢,使MEOHP、MEHHP、MBP 和MBzP 4 种难分离代谢物的分离效果较好。用乙腈配制质量浓度为1.0 mg/L 的7 种PAE 代谢物单标准溶液,采用HPLC-MS/MS 自动优化,获取灵敏度高、稳定性好的MRM 检测离子对,优化碎裂电压和碰撞能量等质谱参数,结果见表1。
2.3 方法学评价
2.3.1 线性范围、检出限与定量限
准确量取适量的PAEs 混合标准工作液(1.0 mg/L),用乙腈-水(2 ∶8,v/v)稀释,获得质量浓度分别为0.2、1.0、5.0、10.0、25.0、50.0、100.0 和200.0 μg/L 的系列标准溶液(13C-内标质量浓度均为20.0 μg/L)。实验表明,邻苯二甲酸单酯在0.2~200.0 μg/L 的质量浓度范围内定量离子的相对峰面积比值(y)与质量浓度(x)的线性关系良好,相关系数r≥0.999 76,检出限(LOD,S/N=3)和定量限(LOQ,S/N =10)范围分别是13.43 ~80.21 ng/L 和44.77 ~267.37 ng/L(见表2)。
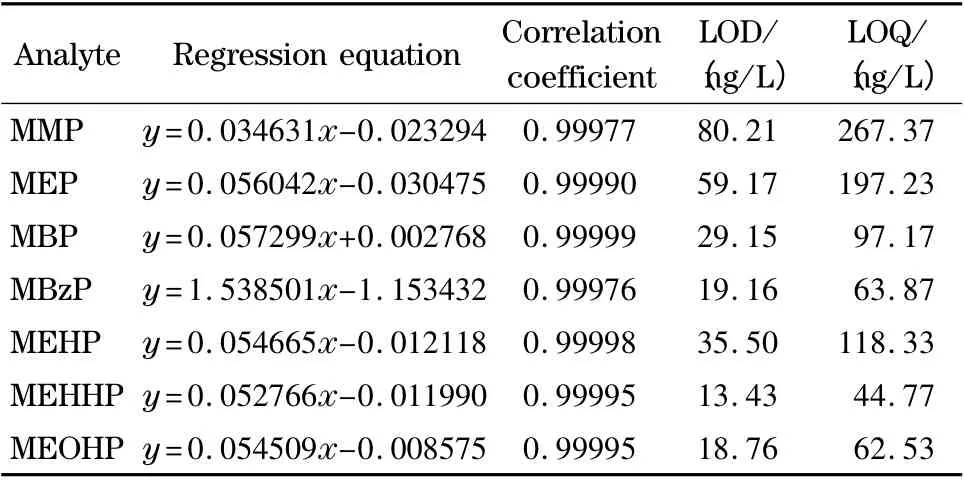
表2 尿液中7 种PAEs 代谢物的线性范围、回归方程、检出限和定量限Table 2 Linear ranges,regression equations,LODs and LOQs of the seven phthalate metabolites in human urine
2.3.2 加标回收率和精密度试验
取空白尿液数等份,分别加入不等量的7 种PAEs 混合标准溶液,配制成加标量为5.0、50.0 和200.0 μg/L 的样品,每个浓度平行6 个样品,按照前述方法处理和分析样品,计算回收率。空白尿液及加标尿液(加标量为200 μg/L)的HPLC-MS/MS总离子流图(TIC)和MRM 谱图见图5。
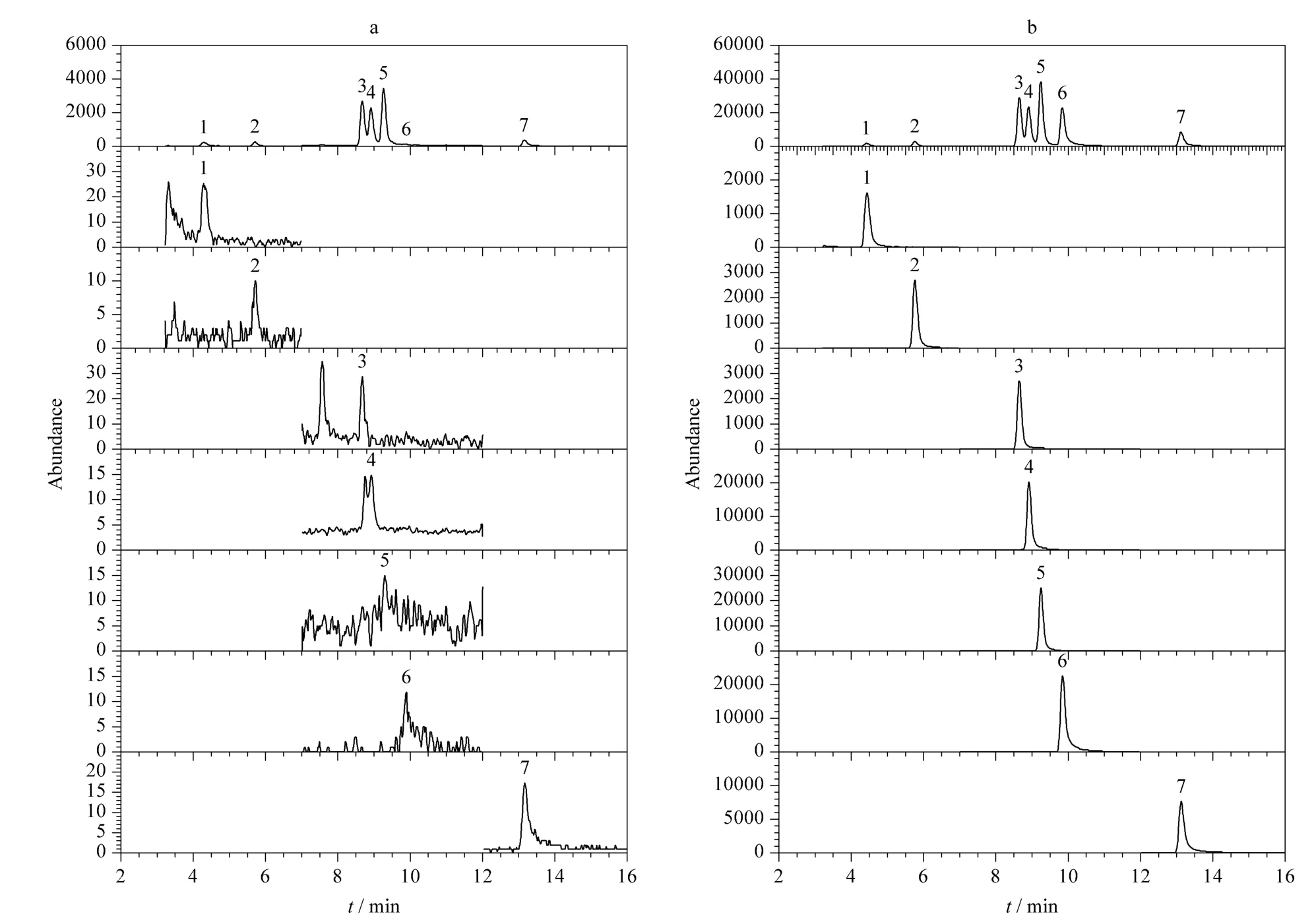
图5 (a)空白尿液及(b)加标尿液(加标量为200 μg/L)中7 种PAEs 代谢物的总离子流图(TIC)和MRM 谱图Fig.5 Total ion chromatograms (TIC)and MRM chromatograms of a mixture of the seven phthalate metabolites in (a)a non-spiked and (b)spiked (200 μg/L)human urines
分别在样品处理当日不同时间点和不同处理天数进样分析(n =6),计算日内和日间精密度。在每次进样结束后,将样品溶液更换密封垫密封,并于-20 ℃储存,以减少挥发和便于下次进样检测。回收率和精密度结果见表3。
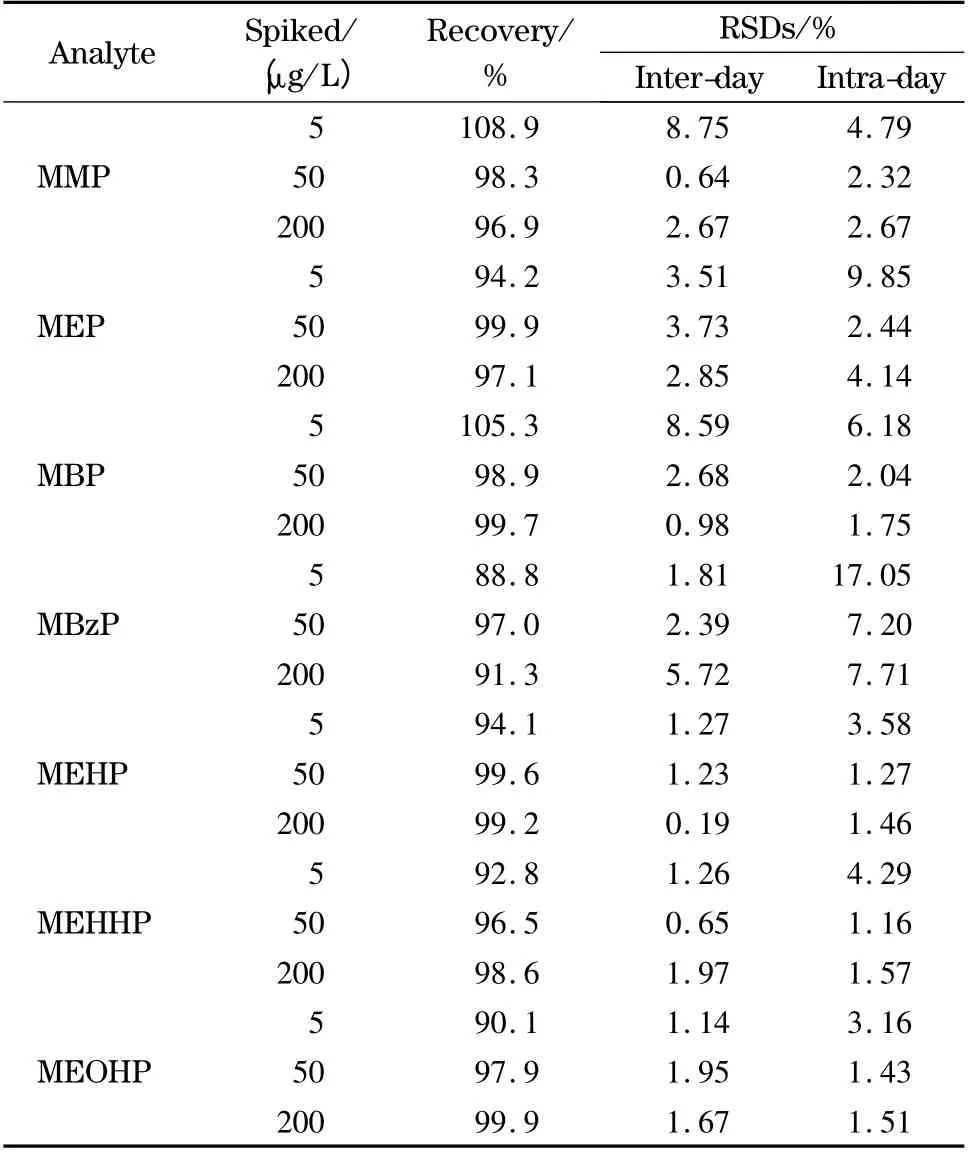
表3 尿中7 种PAEs 代谢物在3 个加标水平的加标回收率、日内和日间精密度(n=6)Table 3 Recoveries,inter-day and intra-day precisions of the seven phthalate metabolites in a urea sample at three spiked levels (n=6)
2.4 实际样品检测
2014 年9 月以来,本实验室采用该方法对800份孕妇尿样进行了7 种PAEs 代谢物的检测,结果表明,除MBzP 检出率为81.5% 外,其他6 种PAEs代谢物的检出率均高于98.3%,如表4 所示。本方法具有良好的实用性,可应用于人类多种PAEs 暴露水平的评估检测。
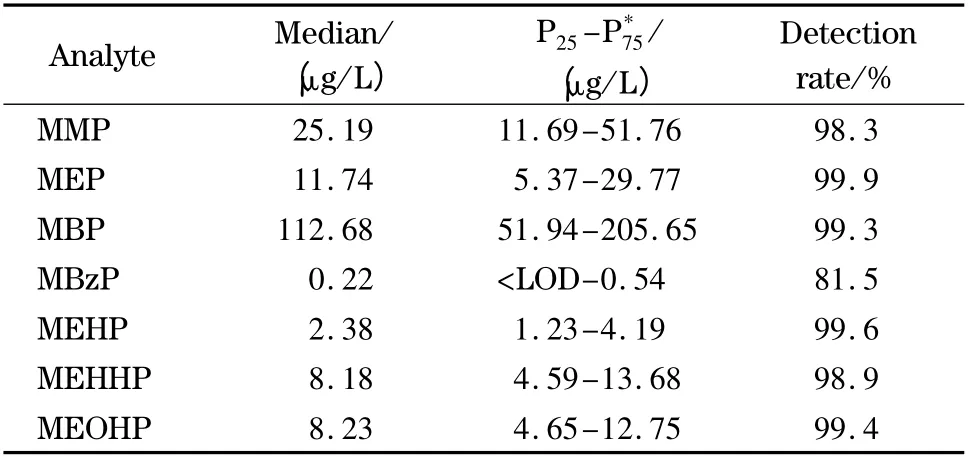
表4 孕妇尿样中7 种PAEs 代谢物的检测结果Table 4 Detection results of the seven phthalate metabolites in pregnant urine samples
3 结论
本文建立了同时测定人尿液中7 种PAEs 代谢物的HPLC-MS/MS 分析方法。本文考察了酶的适宜酸环境、酶用量、酶解时间和淋洗程序等,采用同位素内标法定量。本方法操作简便,结果可靠,检出限低,重现性好,已应用于本实验室的生物样本检测,为今后人类PAEs 暴露评估和相关健康研究奠定了良好的实验基础。
[1] Halden R U. Annu Rev Health,2010,31:179
[2] Schettler T. Int J Androl,2006,29(1):134
[3] Frederiksen H,Skakkebaek N E,Andersson A M. Mol Nutr Food Res,2007,51(7):899
[4] Wittassek M,Angerer J. Int J Androl,2008,31(2):131
[5] Miodovnik A,Edwards A,Bellinger D C,et al. Neurotoxicology,2014,41:112
[6] Sun X,Qi L,Qin T T,et al. Chinese Journal of Chromatography (孙欣,齐莉,秦廷亭,等. 色谱),2014,32(11):1260
[7] Zhang F,Li Z H,Zhang Y,et al. Chinese Journal of Chromatography (张帆,李忠海,张莹,等. 色谱),2014,32(7):735
[8] Lu L,Gong X,Feng Y L. Chinese Journal of Chromatography (芦丽,宫旭,冯有龙. 色谱),2014,32(11):1286
[9] Liang J,Zhuang W E,Wei D Q,et al. Chinese Journal of Chromatography (梁婧,庄婉娥,魏丹琦,等. 色谱),2012,30(3):273
[10] Li H,Tian F L,Ren X D,et al. Chinese Journal of Chromatography (李红,田福林,任雪冬,等. 色谱),2011,29(6):563
[11] Zhu X N,Wang G Q,Wu C H,et al. Chinese Journal of Industrial Hygiene and Occupational Diseases (朱效宁,汪国权,邬春华,等. 中华劳动卫生职业病杂志),2014,32(6):464
[12] Wu C H,Zheng L X,Zhou Z J. Chinese Journal of Industrial Hygiene and Occupational Diseases (邬春华,郑力行,周志俊. 中华劳动卫生职业病杂志),2008,26(8):494
[13] Wang W,Guo X,Wen F,et al. Journal of Environment and Health (王玮,郭欣,闻福,等. 环境与健康杂志),2011,28(8):711
[14] Lin X T,Wang X Y,Xia D G,et al. Chinese Journal of Analytical Chemistry (林兴桃,王小逸,夏定国,等. 分析化学),2011,39(6):877
[15] Dai J J,Yang K F,Jiang L L,et al. Journal of Shanghai Jiaotong University:Agricultural Science(代娟娟,杨科峰,蒋磷蕾,等. 上海交通大学学报:农业科学版),2014,32(4):82
[16] Hu X J,Zhang M,Xu X Y,et al. Journal of Hygiene Research (胡小健,张淼,徐肖雅,等. 卫生研究),2012,41(1):109
[17] Silva M J,Slakman A R,Reidy J A,et al. J Chromatogr B,2004,805:161
