基于柱前衍生-超高效液相色谱-质谱联用技术的植物提取液中氨基化合物代谢谱分析
2015-12-26张俊杰赵春霞赵燕妮赵洁妤李丽丽许国旺
张俊杰, 赵春霞, 赵燕妮, 赵洁妤, 李丽丽, 路 鑫 , 许国旺
(中国科学院大连化学物理研究所,中国科学院分离分析化学重点实验室,辽宁 大连116023)
氨基化合物是植物中的一类重要化合物,广义上包括氨基酸[1-3]、生物胺[4](单胺、多胺、无机胺)、二肽及生物碱[4,5]等,它们参与植物氮代谢过程,在植物生长代谢中发挥着重要作用。如氨基酸是构成蛋白质的结构单位,一些氨基酸本身对植物代谢有调节作用[2,3];多胺[4]、生物碱[4,5]等在植物应激及抗逆等方面均发挥着重要作用。因此对植物中氨基化合物进行分析具有十分重要的意义。打顶是烤烟大田生产中重要的农艺措施,烤烟打顶的主要作用是消除顶端优势,平衡养分分配,控制植株纵向生长,避免出现无效蕾和枝叶,协调养分的运转方向,以保证收获物有足够的养分形成产量,并使内部化合物向有利于提高烟叶品质的方向转化[6]。研究打顶对不同部位氨基化合物的影响,也有十分重要的意义,但鲜有采用代谢组学手段进行研究的报道。
氨基化合物在反相液相色谱中难以保留,离子抑制严重,造成其定量分析困难[7-9]。衍生化方法是提高其离子化效率和反相色谱保留的比较常用的方法[7-9],目前已有文献报道了众多衍生化试剂用于氨基酸及胺类化合物的分析检测,包括邻苯二甲醛[10]、乙氧基甲叉丙二酸二乙酯[11]、6-氨基喹啉-N-琥珀酰亚胺甲酯(AQC)[12-15]、苯甲酰氯[16]、7-氯-4-硝基苯恶二唑异硫氰酸苯酯[17]、4-羟基-3-甲氧基肉桂醛[18]、对甲氧基苯甲酸N-羟基琥珀酰亚胺[19]、丹磺酰氯[20-23]等。其中AQC 试剂可特异性衍生氨基化合物中含伯胺和仲胺基团的代谢物,增强胺类物质在反相色谱中的保留,提高离子化效率,从而达到更高的检测灵敏度。目前的报道多侧重于用AQC衍生某些生物样品中的氨基酸或者胺类[12-15],方法只限于对少数已知的目标化合物进行定性定量分析,尚未有同时测定植物中多种类氨基化合物的报道,因此迫切需要发展一种高灵敏的同时分析植物样品中尽可能多的氨基化合物代谢谱的分析方法。三重四极杆串联质谱(QQQ MS)和四极杆-飞行时间高分辨串联质谱(Q-TOF MS)是两种常见的空间串联质谱技术。QQQ MS 灵敏度高,定量的精密度、重现性和稳定性好,已被广泛用于目标化合物的定量分析;其母离子扫描和中性丢失扫描模式有很好的选择性和灵敏度,特别适合在复杂样品中高灵敏地筛选具有特征基团的离子,但不足是质量分辨率较低。Q-TOF MS 是高分辨质谱,且可提供MS/MS 信息,常用于未知样品的定性,但其定量能力弱于QQQ MS。
本文建立了一种基于柱前衍生-超高效液相色谱-质谱联用技术的植物提取液中氨基化合物代谢谱分析方法。充分利用超高效液相色谱-三重四极杆串联质谱(UHPLC-QQQ MS)和超高效液相色谱-四极杆-飞行时间高分辨串联质谱(UHPLC-Q-TOF MS)技术的优势,在样品中未知氨基化合物的高选择性发现及高分辨质谱定性基础上,实现高灵敏度检测。将该方法用于植物提取液分析,可实现样品中几十种氨基化合物的定性和高灵敏度检测。
1 实验部分
1.1 仪器和试剂
液相色谱系统为Agilent 1290 超高效液相系统,四极杆飞行时间高分辨质谱为Agilent 6540,三重四极杆质谱系统为Agilent 6460。高速离心机(中国天美公司)。
所用试剂包括:Waters AccQ-Tag derivation kit 衍生试剂盒(美国Waters 公司)、HPLC 级乙腈(德国默克公司)、甲酸、甲酸铵(美国Sigma-Aldrich 公司),水由Millipore 超纯水系统制备。
氨基化合物标准品中乙醇胺(ethanolamine)、丙氨酸(L-alanine)、脯氨酸(L-proline)、苯乙胺(phenylethylamine)、亮氨酸(L-leucine)、谷氨酸(L-glutamic acid)、蛋氨酸(L-methionine)、组氨酸(histidine)、2-氨 基 己 二 酸(DL-2-aminoadipic acid)、苯丙氨酸(L-phenylalanine)、3-甲氧基酪胺(3-methoxytyramine)、色氨酸(DL-tryptophan)、异丁胺(isobutylamine)购自百灵威。甘氨酸(glycine)、乙酰腐胺(acetylputrescine)、异亮氨酸(Lisoleucine)、天 冬氨酸(L-aspartic acid)、酪 胺(tyramine)、奥克巴胺(octopamine)、丙氨酰丙氨酸(alanyl-alanine)、蛋氨酸亚砜(L-methionine sulfoxide)、精氨酸(L-arginine)、丙氨酰亮氨酸(alanyl-leucine)、鸟氨酸(ornithine)、高丝氨酸(Lhomoserine)、尿囊素(allantoin)、5-氨基戊酸(5-aminovaleric acid)、多巴胺(dopamine)、天冬酰胺(L-asparagine)、谷氨酰胺(L-glutamine)、丝氨酸(DL-serine)、β-丙氨酸(β-alanine)、赖氨酸(Llysine)、缬氨酸(L-valine)购自美国Sigma 公司,3-甲基丁胺(3-methylbutylamine)购自Dr. Ehrenstorfer GmbH;γ-氨基丁酸(GABA)、哌啶酸(Lpipecolic acid)、苏氨酸(L-threonine)、羟基脯氨酸(OH-proline)、瓜氨酸(DL-citrulline)、酪氨酸(DLtyrosine)、乙胺(ethylamine)、丁胺(butylamine)购自Alfa-aesar 公司。内标氘代丙氨酸(alanine-d4)及正缬氨酸(norvaline)购自Sigma-Aldrich 公司。
1.2 植物样品预处理
烟草鲜叶样品由中国烟草研究院青州所提供,采下部叶、中部叶和上部叶,每个部位包括未打顶对照组和打顶实验组,每个叶位均有5 ~6 个生物学重复,总计33 个样品。新鲜采摘的叶片在液氮中冷冻研磨,低温冻干,-80 ℃保存,准确称取10 mg 植物叶片粉末,加入1 mL 70% (v/v)C2H5OH (含内标正缬氨酸5 μg/mL、氘代丙氨酸2.5 μg/mL),涡旋提取10 min,15 000 r/m 离心10 min,上清液用Waters AccQ-Tag derivation kit 衍生,进样分析。
AQC 衍生的具体步骤为:70 μL pH 8.8 的硼酸盐缓冲液中加入10 μL 样品或者氨基化合物混合标准溶液,涡旋5 ~10 s,混匀后加入20 μL 衍生试剂,涡旋5 ~10 s,混匀后室温下放置1 min 左右,于55℃加热10 min。
1.3 色谱-质谱条件
色谱柱采用Agilent ZORBAX Eclipse Plus C18柱(Rapid Resolution HT 100 mm×2.1 mm,1.8 μm,Agilent,USA)。流动相A:0.1% (v/v)甲酸水溶液(含5 mmol/L 甲酸铵);流动相B:乙腈。流速:0.25 mL/min;柱温:50 ℃。进样体积:定性时1 μL;UHPLC-QQQ MS 方法的进样体积为0.2 μL。液相色谱进样器温度:4 ℃。定性步骤洗脱梯度为:0 ~1 min 保持5% B 的初始流动相,20 min 时线性上升至25% B,30 min 时线性上升至99% B,30.1 min 恢复到初始流动相5% B 并保持到35 min。UHPLC-QQQ MRM MS 方法的洗脱梯度为:0 ~1 min 保持5% B 初始流动相,20 min 时线性上升至25% B,25 min 时线性上升至57% B,25.1 min 时上升至99% B 并维持99% B 到27 min;27.1 min恢复到初始5% B 并保持到30 min。
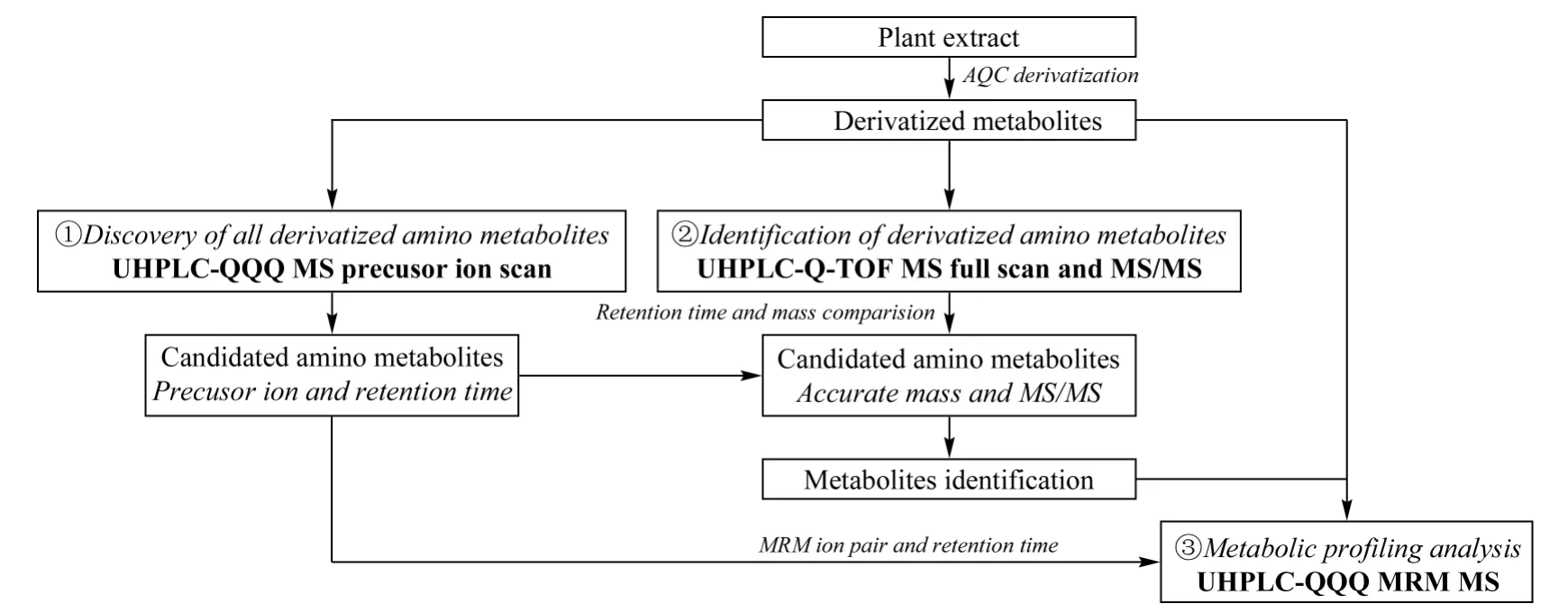
图1 基于AQC 衍生-超高效液相色谱-质谱联用技术的植物提取液中氨基化合物代谢谱分析流程Fig.1 Flow chart of metabolic profiling analysis of amino metabolites in plant extract based on AQC derivatization-UHPLC MS
Agilent 6460 三重四极杆质谱条件:ESI 正离子模式;离子源气体温度:300 ℃;气体流速:8 L/min;雾化气压力:275.8 kPa;鞘流气温度:350 ℃;鞘流气流速:8 L/min;毛细管电压:4 000 V;喷嘴电压:600 V。母离子扫描增益电压设置为400 EMV,MRM 扫描的子离子均为m/z 171,碰撞电压、碰撞能参数经过优化得到。
Agilent 6540 四极杆飞行时间质谱条件:ESI 正离子模式;离子源气体温度:300 ℃;干燥气体流速:10 L/min;雾化气压力:275.8 kPa;毛细管电压:3 500 V;碰撞电压:130 V;透镜电压:65 V。MS/MS扫描设置10、20、40 V 3 个不同碰撞能,母离子选择时间窗口为1 min,母离子质量数窗口选1 Da。
2 结果与分析
2.1 AQC 柱前衍生-超高效液相色谱-质谱联用方法的建立

图2 AQC 衍生的氨基化合物的发现和定性Fig.2 Discovery and identification of AQC derivatized amino metabolites
为实现未知样品中尽可多的氨基化合物的高灵敏度代谢谱分析,在方法建立过程中采用UHPLCQQQ MS 和UHPLC-Q-TOF MS 两种质谱技术。方法建立的具体流程如图1 所示,主要包括植物提取液衍生化、氨基化合物衍生产物的高选择性发现、高分辨质谱定性和高灵敏度代谢谱检测几个步骤。首先,植物提取液经AQC 衍生,氨基化合物所含氨基的活泼氢被衍生基团取代(见图2a),生成含有特征官能团的衍生产物。衍生产物经质谱源内诱导裂解(CID),产生特征子离子C10N2OH+7(m/z 171);以171 作为固定子离子,对衍生产物进行UHPLCQQQ MS 母离子扫描,以1 Da 为单位进行步进式母离子提取,就可高灵敏度地筛选到具有特征衍生基团(m/z 171)的离子,即得到全部衍生产物的母离子以及相应的UHPLC 保留时间。但仅靠QQQ MS得到母离子质量数(质量精度1 Da),还无法对衍生产物进行定性。为了进一步得到定性信息,下一步需要在相同的UHPLC 条件下对衍生产物进行UHPLC-Q-TOF MS 高分辨质谱全扫描(分辨率40 000)和MS/MS 扫描,得到相应保留时间衍生产物的精确质量数和二级质谱信息,以精确质量数[M]+-171.055 8 在10 ppm(10×10-6)范围内进行数据库搜索,锁定候选化合物,进一步通过二级质谱比对及标样验证,对衍生产物进行准确定性。最后,对所发现的全部衍生化的氨基化合物建立UHPLCQQQ MRM MS 高灵敏度检测方法,通过标样或动态MRM 方法进行MRM 参数优化,最终实现代谢谱的高灵敏度定量分析。图2 以新烟草碱(anatabine)为例,说明氨基化合物的筛选和定性过程。图2b 是衍生化后植物提取液UHPLC-QQQ MS 母离子的总离子流图(TIC),在保留时间8.6 min 检测到m/z 331.0 的母离子。采用相同的UHPLC 条件进行UHPLC-Q-TOF MS 分析,对应保留时间8.6 min,提取离子流图(EIC)得到该离子的精确质量数为m/z 331.156 0(见图2c),进一步对该离子进行MS/MS 分析得到二级质谱信息(见图2d),通过搜库和标样验证确认该离子为新烟草碱的衍生产物。
以烟草鲜叶提取液为例,对其中的氨基化合物进行分析。使用所建立的方法共检测到了烟草鲜叶样品中的87 种衍生化氨基化合物,包括氨基酸、胺、二肽及生物碱等物质。其中43 种氨基化合物经标样验证,根据精确质量数和文献报道初步定性了6种代谢物,包括氨[24]、二甲胺[24]、甲胺[24]、新烟草灵Ⅰ[25]、新烟草灵Ⅱ[25]及假氧尼古丁[26];根据精确质量数和二级质谱信息对4 种代谢物进行了初步定性,包括降烟碱、新烟草碱Ⅰ、假木贼碱及新烟草碱Ⅱ;此外,通过精确质量数搜库初步定性出19 种代谢物,15 种衍生产物未知。对43 种经标样验证的氨基化合物标准品的MRM 扫描的碰撞能、碰撞电压等参数进行优化,最终得到离子对扫描的最佳质谱条件(见表1)。在该条件下,所有氨基化合物的动态MRM 扫描色谱图见图3。
2.2 方法表征
?
?

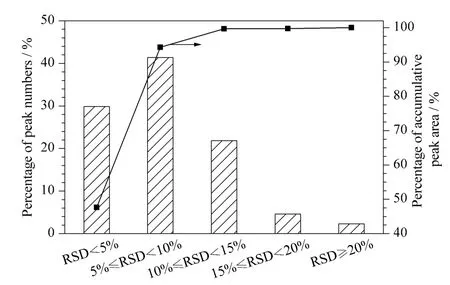
图4 UHPLC-QQQ MRM MS 方法分析AQC 衍生的氨基代谢物的重复性Fig.4 Repeatability of AQC derivatized amino metabolites by UHPLC-QQQ MRM MS
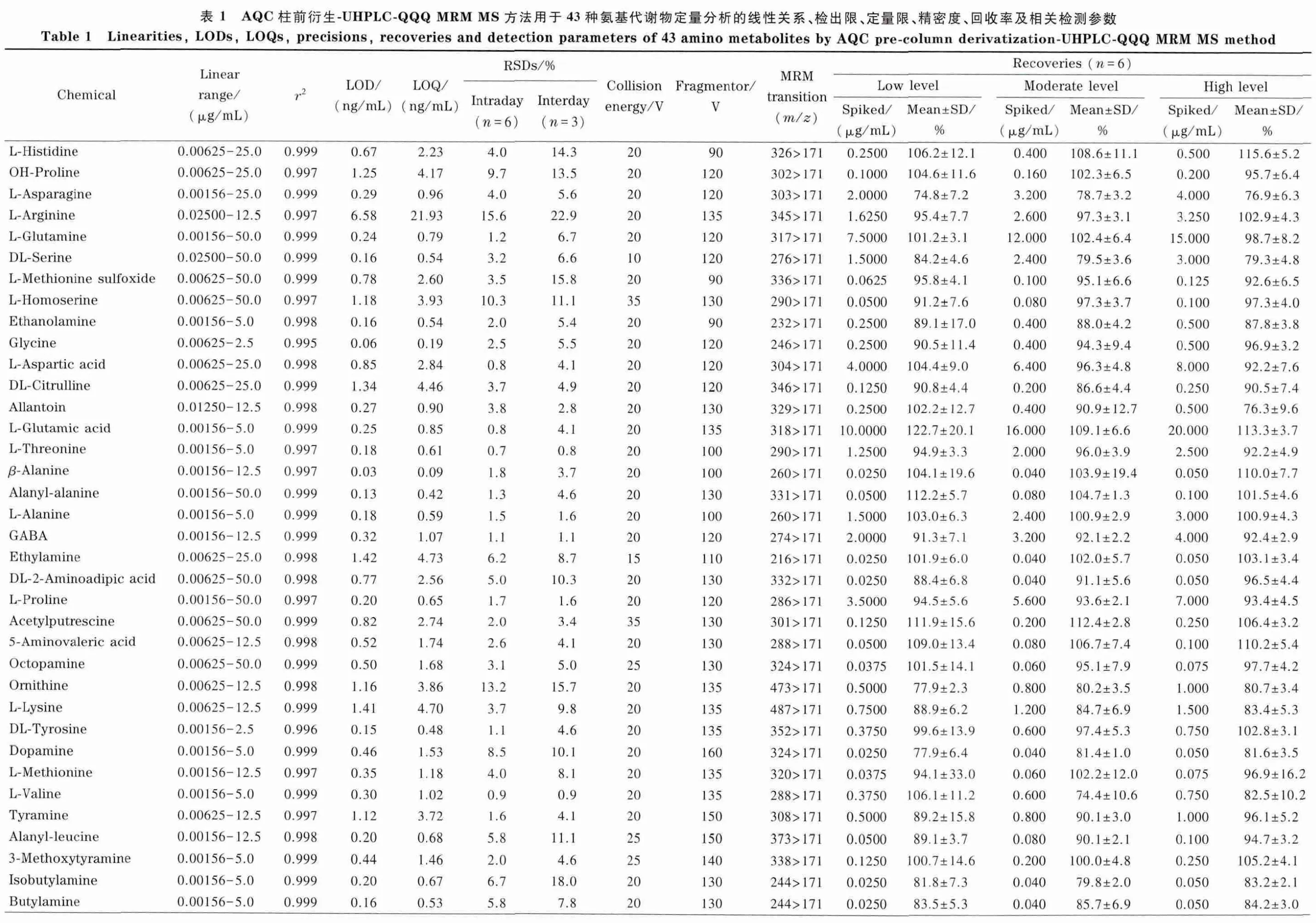
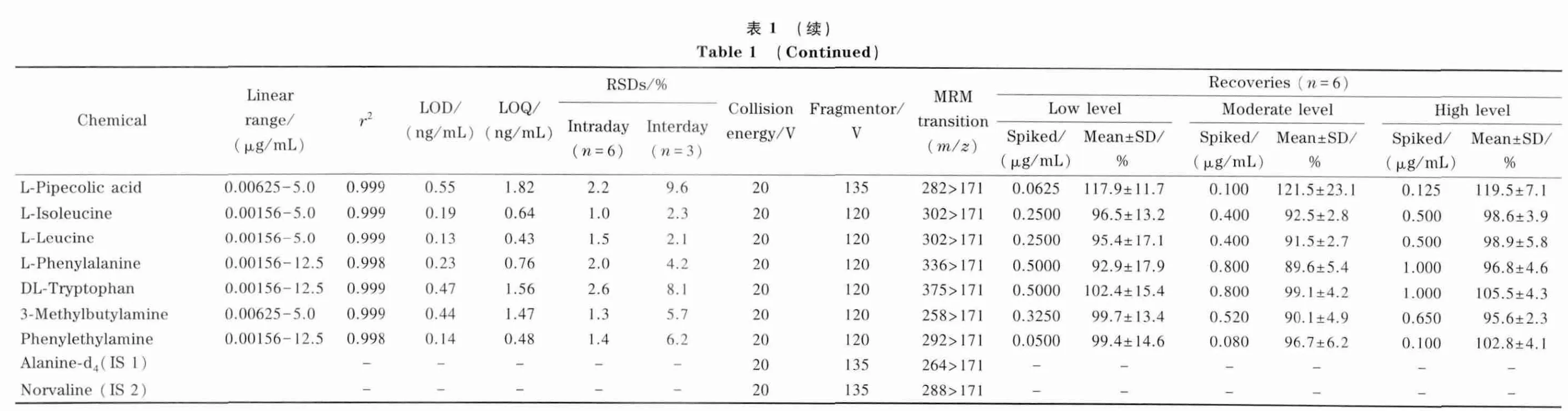
采用6 个平行制备的烟草样品考察所建立方法的重复性(见图4),除烟叶中低含量的丁胺及一个未知氨基化合物(m/z 329)外,85 个氨基化合物的相对定量RSD 均小于20%(1.5% ~18.8% 间)。采用43种代谢物对方法进行表征,结果见表1。方法的线性关系由标准样品混合标准溶液稀释至0.006 25、0.05、0.5、5、50 μg/mL 得到,线性范围可达到4 个数量级。LOQ、LOD 分别对应信噪比为10、3 时的质量浓度,方法的LOQ 为0.09 ~21.93 ng/mL,LOD 可达到0.03 ~6.58 ng/mL。日内精密度(RSD)为0.7% ~15.6%;日间精密度,除精氨酸外均小于20%(0.8% ~22.9% )。对相当于实际样品浓度50%、80%、100% 的3 个水平的加标样品进行分析,得到43 种物质的低、中、高水平加标回收率分别为74.8% ~122.7%、74.4% ~121.5%、76.3% ~119.5%。
2.3 方法应用
取成熟的烟草鲜叶上部叶、中部叶和下部叶样品33 个,分成打顶和不打顶对照两组,将所建立的代谢谱方法用于研究打顶对不同叶位烟草鲜叶中氨基化合物的影响。图5 是成熟期不同部位烟草鲜叶打顶前后氨基化合物主成分分析(PCA)的得分图,明显看出上部叶的打顶与未打顶两组样品有明显分离趋势,打顶对中部叶、下部叶影响不大,在PCA 上基本无分离趋势。采用非参数检验也表明打顶与未打顶两组有显著性差异氨基化合物在上部叶中最多(见表2),中部叶中色氨酸、谷氨酰胺、瓜氨酸、新烟草灵、假氧尼古丁、异丁胺、苯乙胺在两组间有显著差异,下部叶中仅天冬酰胺、甲胺、尿囊素在两组间有显著性差异。

图5 不同部位成熟期烟叶PCA 得分图Fig.5 PCA score plot of mature tobacco leaves on different leaf positions
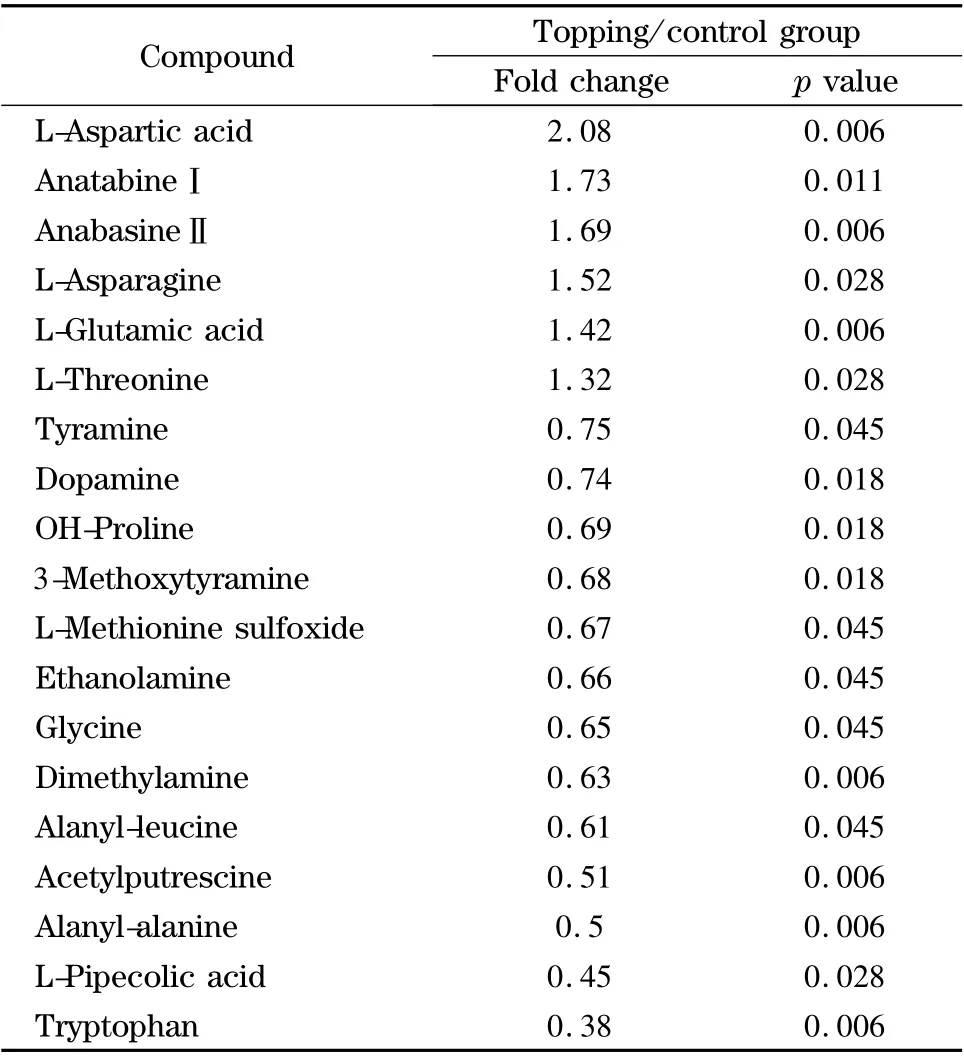
表2 上部鲜烟叶打顶组与不打顶对照组有显著性差异的氨基化合物Table 2 Significant changes of amino metabolites between the topping and the control groups of tobacco upper leaves
进一步考察了打顶对上部叶代谢的影响,图6是烟草中主要氨基化合物的代谢通路图,图中加方框的为本方法可检测到的代谢物,检测到的代谢物覆盖了烟碱合成及其上游代谢、多酚合成上游代谢、生长素合成上游代谢等过程。从两组中有显著差异化合物(p<0.05)和极显著差异化合物(p<0.01)可以看出,打顶后上部叶片参与生物碱合成的氨基化合物包括初级氨基酸谷氨酸和天冬氨酸,显著上调。莽草酸代谢路径酪氨酸、色氨酸和苯丙氨酸均显著下调,可以推测,打顶后氨基化合物流向为从初级氨基酸到烟碱。烟碱自精氨酸或鸟氨酸途径形成吡咯烷环,自天冬氨酸途径形成吡啶环,最终两环缩合形成烟碱,因此与生物碱合成相关的初级氨基酸代谢上调,表明烟草植株体内氨基化合物对于打顶的整体反应和代谢物协调性升降变化。打顶后氨基化合物到生物碱通路发生上调,而到生长素通路发生下调,已有文献[27]对不同时期打顶后烟叶中淀粉、可溶性糖、总蛋白质、烟碱含量进行比较,发现打顶对下部叶影响明显小于中上部叶片。另外,研究[27-29]报道打顶后烟碱含量升高,其他代谢物变化的报道包括打顶后上部叶谷氨酰胺及天冬酰胺合成酶活性升高[30],打顶后上部新叶生长素含量下降[31]。我们的研究结果表明,打顶后生物碱合成通路整体上调,天冬酰胺含量显著升高,谷氨酰胺含量也有升高趋势,虽未测到生长素,但生长素前体色氨酸含量降低。
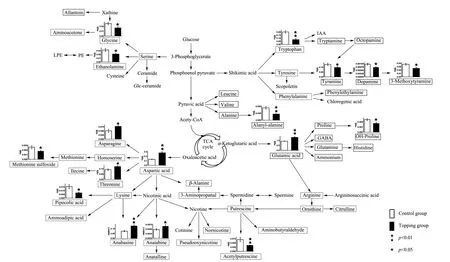
图6 打顶对上部鲜烟叶中氨基化合物生物合成的影响Fig.6 Effects of topping on amino metabolite biosynthesis of upper tobacco leaves
3 结论
建立了一种基于柱前衍生-超高效液相色谱-质谱联用技术的植物提取液中氨基化合物代谢谱分析方法。该方法充分利用了不同串联质谱的技术特点,对衍生后植物提取液中的氨基化合物进行分析。通过UHPLC-QQQ MS 母离子扫描,可特异性地发现其中的氨基化合物;进一步通过UHPLC-Q-TOF MS 高分辨质谱全扫描和二级质谱扫描对所检测到的氨基化合物进行定性;在此基础上,再通过UHPLC-QQQ MS 的MRM 模式进行氨基化合物的高灵敏度检测。该方法充分利用了三重四极杆串联质谱的高选择性和高灵敏度,以及高分辨串联质谱高质量分辨和二级质谱在定性方面的优势,可实现未知样品中氨基化合物高选择性的发现和高灵敏度的检测。该方法可检测到实际样品中的氨基化合物涉及小分子胺类、氨基酸代谢、多胺代谢和生物碱代谢通路中的氨基化合物。方法的灵敏度高、选择性好、线性范围可达到3 ~4 个数量级。该方法不但可用于植物提取液中氨基化合物的检测,也可以用于其他生物样品中氨基化合物的分析。
[1] Okumoto S,Pilot G. Mol Plant,2011,4(3):453
[2] Zeier J. Plant Cell Environ,2013,36(12):2085
[3] Huang T,Jander G,de Vos M. Phytochemistry,2011,72(13):1531
[4] Ghosh B. Indian J Exp Biol,2000,38(11):1086
[5] Dewey R E,Xie J. Phytochemistry,2013,94:10
[6] Li Y,Wang C H,Zhou C Y,et al. Chinese Tobacco Science(李影,王程辉,周初跃,等. 中国烟草科学),2013,34(6):20
[7] Bouchereau A,Guenot P,Larher F. J Chromatogr B,2000,747(1/2):49
[8] Pena-Gallego A,Hernandez-Orte P,Cacho J,et al. Food Rev Int,2012,28(1):71
[9] Erim F B. TrAC-Trends Anal Chem,2013,52(S):239
[10] Kutlan D,Molnar-Perl I. J Chromatogr A,2003,987(1/2):311
[11] Gomez-Alonso S,Hermosin-Gutierrez I,Garcia-Romero E.J Agric Food Chem,2007,55(3):608
[12] Fiechter G,Sivec G,Mayer H K. J Chromatogr B,2013,927(S):191
[13] Gaudin Z,Cerveau D,Marnet N,et al. Anal Chem,2014,86(2):1138
[14] Sun Y C,Xu X Z,Xu Y L,et al. Chinese Journal of Chromatography (孙言春,许宪祝,徐衍岭,等. 色谱),2013,31(3):275
[15] Li H L,Zhao C X,Zhang J J,et al. Chinese Journal of Chromatography (李好丽,赵春霞,张俊杰,等. 色谱),2013,31(12):1182
[16] Aflaki F,Ghoulipour V,Saemian N,et al. Food Anal Methods,2014,7(3):713
[17] Elbashir A A,Suliman F E O,Aboul-Enein H Y. Appl Spectrosc Rev,2011,46(3):222
[18] Manier M L,Spraggins J M,Reyzer M L,et al. J Mass Spectrom,2014,49(8):665
[19] Mazzotti F,Di Donna L,Napoli A,et al. J Mass Spectrom,2014,49(9):802
[20] Loukou Z,Zotou A. J Chromatogr A,2003,996(1/2):103
[21] Guo K,Li L. Anal Chem,2009,81(10):3919
[22] Gong X,Wang X X,Qi N L,et al. Food Addit Contam,2014,31(8):1431
[23] Yang Y X,Mu C L,Zhang J F. Anal Lett,2014,47(8):1290
[24] Mayer H K,Fiechter G,Fischer E. J Chromatogr A,2010,1217(19):3251
[25] Jacob P,Goniewicz M L,Havel C M,et al. Chem Res Toxicol,2013,26(11):1615
[26] Wang S N,Liu Z,Tang H Z,et al. Microbiol-SGM,2007,153:1556
[27] Yang H Q,Zhou J H,Luo Z M,et al. Hunan Agricultural Sciences (杨虹琦,周冀衡,罗泽民,等. 湖南农业科学),2004(4):19
[28] Baldwin I T. J Chem Ecol,1989,15(5):1661
[29] Geng S X,Wang S H,Liu W Q. Chinese Journal of Eco-Agriculture (耿素祥,王树会,刘卫群. 中国生态农业学报),2011,19(6):1250
[30] Liu W Q,Cui Z W,Chen X C,et al. Plant Physiology Communications (刘卫群,崔振伟,陈旭初,等. 植物生理学通讯),2006,42(6):1121
[31] Zou Y,Su Y R. Tobacco Science &Technology (邹焱,苏以荣. 烟草科技),2008(10):50
