白鱼腐败细菌的分离与鉴定
2015-12-26夏秀东刘小莉董明盛周剑忠
夏秀东,刘小莉,王 英,李 莹,董明盛,周剑忠,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095)
白鱼腐败细菌的分离与鉴定
夏秀东1,刘小莉1,王 英1,李 莹1,董明盛2,周剑忠1,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095)
通过对不同温度条件下白鱼(Anabarilius)菌落数量的统计发现, 与37 ℃相比,25 ℃培养条件更有利于白鱼携带细菌的生长,也更容易导致白鱼的腐败。通过对分离自腐败的白鱼中21 株细菌的16S rDNA序列分析后,最终确定得到了11 株不同的菌株。同时结合生化鉴定结果,将这些菌种分属7 个不同的属:2 株摩根氏菌(Morganella),3 株变形杆菌(Proteus),2 株漫游球菌(Vagococcus),1 株葡萄球菌(Staphylococcu),1 株泰瑞芽孢杆菌(Terribacillus),1 株赖氨酸芽孢杆菌(Lysinibacillus),1 株透明颤菌(Vitreoscilla)。其中摩根氏菌和变形杆菌同属肠杆菌科,是腐败白鱼的优势菌,可能是白鱼的特定腐败菌 (specific spoilage organisms,SSO)。
白鱼;腐败菌;分离;16S rDNA;鉴定
鱼类腐败指的是鱼体在微生物的作用下蛋白质、氨基酸及其他含氮化合物被分解为氨、组胺、吲哚、三甲胺、硫化氢等小分子物质使鱼体产生臭味的过程[1]。鱼体的腐败一般要经历如下阶段[2]:第1阶段,机体自身酶系统作用的过程,发生僵硬现象;第2阶段,一段时间后,机体逐渐恢复原来的柔韧度;第3阶段,机体中或者黏附侵入的细菌就会大量繁殖,分泌大量水解酶例如蛋白酶、脂酶、核酸酶,以及脱羧酶类如组氨酸脱羧酶、鸟氨酸脱羧酶等加速了机体的进一步分解。第3阶段是鱼体真正发生腐败变质的过程。
寻找导致水产品腐败的微生物种类,才能有效进行水产品腐败的靶向抑制,是研发水产品加工保藏技术、提高水产品质量的前提。对水产食品腐败微生物长期研究发现,水产品所含微生物中只有部分微生物参与腐败过程,因此提出了特定腐败菌(specific spoilage organism,SSO)的概念[3]。目前对鱼类特定腐败菌的研究主要集中在对假单胞菌(Pseudomonas spp.)与腐败希瓦氏菌(Shewanella putrefaciens)的研究[4]。由于鱼的种类、生活水域、捕获季节、贮藏条件等的不同,导致鱼体所携带的微生物组成复杂多样。因此,有必要对不同鱼种和不同的运输、加工、贮藏条件进行特定腐败菌研究,以确定其特定腐败菌,从而有效实施靶向抑制。本研究通过对腐败后的白鱼(Anabarilius)中的细菌进行计数并对分离得到的细菌进行分子生物学和生化鉴定,旨在确定导致白鱼腐败的可能SSO,为改进水产品的加工保藏技术和延长白鱼产品的货架期提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
白鱼购自江苏省南京市玄武区孝陵卫菜市场。
PCA(plate count agar)琼脂培养基 上海盛思生化科技有限公司;MRSA(man rogosa sharpe medium agar)、MSA(mannitol salt agar)和GTA(glucose tryptone agar)琼脂培养基 北京路桥技术有限责任公司;VRBDA(violet red bile dextrose agar)琼脂培养基北京奥博星生物技术有限责任公司;TIANamp Bacteria DNA kit 天根生化科技(北京)有限公司;Premix TaqTM日本TaKaRa公司;细菌生化鉴定管 青岛海博生物技术有限公司。
hJ-3型数显恒温磁力搅拌器 国华电器有限公司;SX-500-TOMy高压灭菌锅 日本Tomy公司;SIGMA 3K15离心机 美国Sigma公司;Jy300C型电泳仪 北京君意东方电泳设备有限公司;THZ-C-1型台式全温振荡器 苏州培英实验设备有限公司;CRh-150生化培养箱 上海一恒科技有限公司;yS100型生物显微镜 日本Nikon公司;Sw-CJ-K型双人单面净化工作台苏州华宏净化技术有限公司;S1000TMThermal Cycler美国Bio-Rad公司;JT-B均质器 河南兄弟仪器设备有限公司。
1.2 方法
1.2.1 白鱼前处理及取样
白鱼每尾500~600 g,充氧保活带回实验室,立即冰水休克致死,去鳞,解剖去除内脏,洗净,沥水,分割成5 cm×5 cm大小的鱼块,置于灭菌的500 mL锥形瓶中,放置于25、37 ℃培养箱中直至完全腐败。于超净台中取鲜白鱼、放置3 d和5 d的白鱼样品进行菌落计数。
1.2.2 平板计数及细菌分离
参照hu等[5]实验方法,无菌条件下取白鱼样品(25±1) g于灭菌的匀浆杯中,加入225 mL 0.8%无菌生理盐水,充分研磨后转移到灭菌的500 mL三角瓶中,于20 ℃、200 r/min振摇30 min,静置15 min自然沉淀。上清液用0.8%生理盐水以10 倍梯度稀释,选3 个合适的梯度液,各取0.1 mL的稀释液倾注在不同的选择性培养基上培养1~2 d,以测定样品中不同细菌的数量,每个样品做3 个平行。菌落总数用PCA琼脂培养基进行统计;葡萄球菌和微球菌(Micrococcaceae)用MSA琼脂培养基进行统计;芽孢杆菌(Bacillus)用GTA琼脂培养基进行统计;肠杆菌(Enterobacteriaceae)用VRBDA琼脂培养基进行统计;乳酸菌数用MRSA琼脂培养基进行统计,测定菌落数。 同时,根据菌落的形状、大小和颜色等外观特征,挑取在25 ℃条件下放置5 d的白鱼的细菌筛选培养基上的单菌落进行分离纯化和进一步鉴定。
1.2.3 生化鉴定
对纯化得到的菌株进行形态特征鉴别、革兰氏染色、过氧化氢酶实验、利用葡萄糖产气实验,然后进一步进行生化鉴定,实验参考《常用细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》第9版,用细菌生化微量鉴定管进行。
1.2.4 细菌基因组DNA的提取
将1.2.2节分离得到的细菌菌株接种于液体细菌培养基(0.5%蛋白胨、0.25%酵母粉、0.1%葡萄糖),ph 7.0±0.1中培养至对数生长末期,4 ℃、12 000 r/min离心2 min收集菌体。使用TIANamp Bacteria DNA kit(Cat.#:DP302-02)基因组提取试剂盒抽提基因组DNA。
1.2.5 16S rDNA的扩增、测序及基因登录号的获得
以16S rDNA基因的通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)为引物,聚合酶链式反应(polymerase chain reaction,PCR)扩增菌株的16S rDNA基因。反应体系为50 μL:Premix TaqTM(Ex TaqTMVersion2.0 plus dye, Cat.#:RP902A)25 μL;正、反向引物(10 μmol/L)各1 μL,DNA模板1 μL,加无菌去离子水补至50 μL。PCR反应程序如下:95 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,33 个循环;72 ℃延伸5 min。确定扩增片段长度与目的片段长度相同、无杂带后送至生工生物工程(上海)股份有限公司直接测序,测序引物与扩增引物相同,测序长度为1 500 bp左右。将测得的DNA序列提交至GenBank(http:// www.ncbi.nlm.nih.gov/genbank/)获得基因登录号。
1.2.6 基于16S rDNA基因序列的系统发育树构建
采用DNAMAN 6.0软件对测序所得的16S rDNA基因序列进行两两比对,序列相似度≥99.9%的视为同一株菌,选取其中一条代表序列进行后续分析;采用BLAST Search在线分析,找出各代表序列在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(http://blast.ncbi.nlm.nih.gov)数据库中最近缘种的模式菌株序列、编号及基因登录号;利用MEGA 5.10中的Clustal w程序对16S rDNA基因序列进行多序列比对,采用Neighbor-Joining方法构建系统发育进化树,其中Bootstrap为1 000 个重复。
1.3 统计分析
实验数据运用SPSS 10中的One-way ANOVA进行分析,不同的小写字母代表处理间存在显著性差异(P<0.05)。
2 结果与分析
2.1 新鲜及腐败后的白鱼细菌统计
为研究白鱼腐败后细菌总数及不同类型细菌的数量,本实验将去鳞、去头、去内脏后清洗干净的白鱼分别置于25、37 ℃条件下,在第3天和第5天分别取样。样品经处理后用不同的选择性培养基对细菌进行统计。
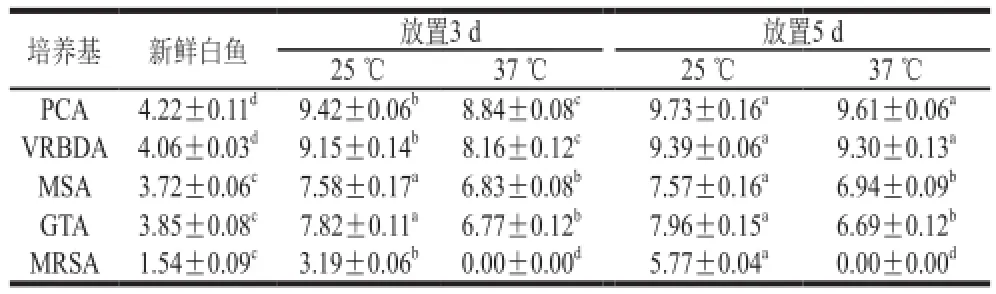
表1 新鲜及腐败后的白鱼细菌数Table 1 Colony counts of fresh and putrid whitefish lg(CFU/g)
如表1所示,新鲜白鱼细菌总数为4.22(lg(CFU/g)),其中肠杆菌(生长于VRBD琼脂培养基上的细菌)数最多达到了4.06 (lg(CFU/g)),构成了新鲜白鱼主要的初始污染菌。3 d后,培养于25 ℃条件下的白鱼细菌总数达到了9.42 (lg(CFU/g)),显著高于37 ℃培养条件下腐败白鱼的细菌总数且优势菌依然为肠杆菌(生长于VRBD琼脂培养基上的细菌)。5 d后,培养于25 ℃条件下的腐败白鱼的细菌总数与第3天相比没有显著性差异,而培养于37 ℃条件下的腐败白鱼的总细菌数相较于第3天增加到将近10 倍,与培养于25 ℃条件下的腐败白鱼的细菌总数相当。这说明与37 ℃的培养条件相比25 ℃更适宜白鱼腐败菌的生长,也更容易导致白鱼的腐败。特别是25 ℃条件下腐败白鱼中的乳酸菌(生长于MRS琼脂培养基上的细菌)数量与新鲜白鱼相比有显著增加,而37 ℃条件下腐败白鱼中却检测不到乳酸菌,这说明新鲜白鱼携带的乳酸菌对温度非常敏感,且更适宜在25 ℃条件下生长。产生以上结果的原因可能是由于白鱼主要生活在中温环境中,其携带的细菌也更加适宜在中温条件下生长。
同时,表1结果表明无论新鲜白鱼还是不同培养条件下的腐败白鱼,肠杆菌都是优势细菌。葡萄球菌和微球菌(生长于MSA琼脂培养基上的细菌)以及芽孢杆菌(生长于GTA琼脂培养基上的细菌)的数量总是比肠杆菌的数量少1~2 个数量级,并不是腐败白鱼的优势细菌。
2.2 分离菌DNA的16S rDNA序列分析
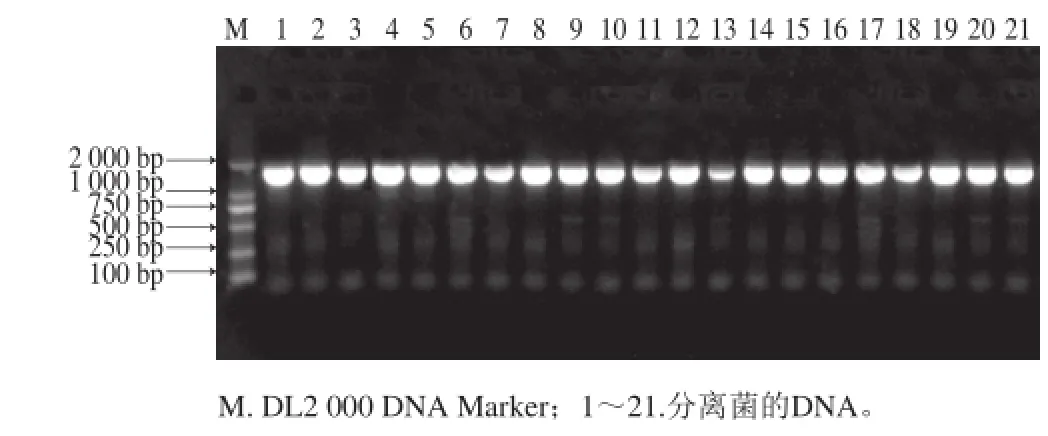
图1 分离菌的16S rDNA扩增产物电泳图Fig.1 Electropherogram of PCR amplification products of 16S rDNA from 21 isolates
从不同的培养基上挑取了21 个单菌落进行纯化。为了对分离菌进行分子生物学鉴定,提取了21 株细菌的基因组DNA,并扩增其16S rDNA部分序列。如图1所示,21 株腐败白鱼分离细菌均能获得单一且与预计大小吻合的扩增条带。

表2 分离菌的16S rDNA序列分析Table 2 Analysis of 16S rDNA sequences from 21 isolates
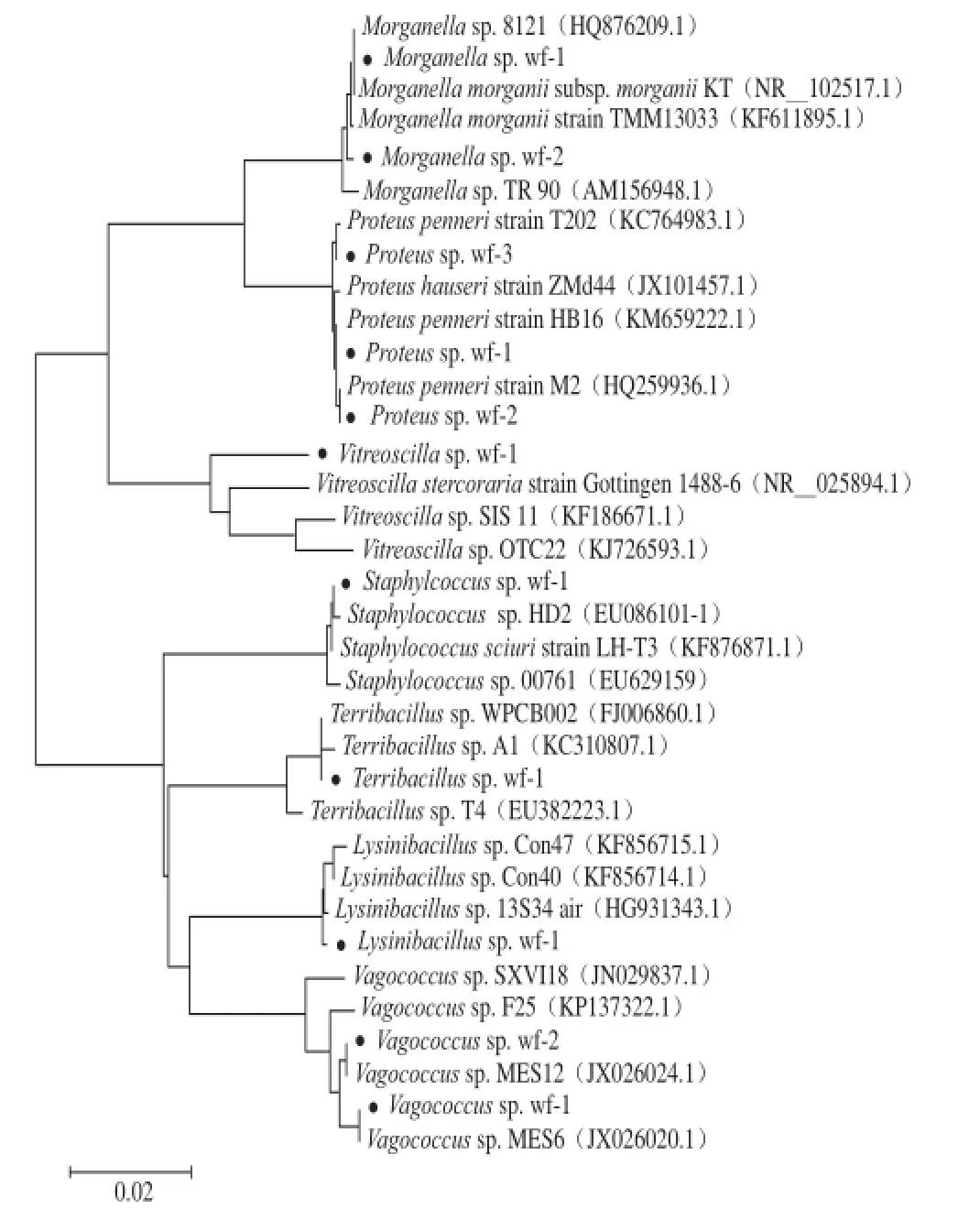
图2 白鱼分离细菌16S rDNA基因序列构建的系统发育树Fig.2 Phylogenetic tree of the strains isolated from whitefish based on 16S rDNA sequences
如表2和图2结果所示,经DNAMAN 6.0 软件进行两两比对分析发现最初分离的21 个菌株实际只有11 株不同的菌株,分属Morganella sp.、Proteus sp.、Vagococcus sp.、Bacillus sp.、Terribacillus sp.、Staphylococcus sp.、Vitreoscilla sp. 7 个不同的属。同时,将测序结果提交至Genbank获得了对应的基因登录号。
在11 株菌中Morganella sp.wf-1、Morganella sp.wf-2、Proteus sp.wf-1、Proteus sp.wf-2、Proteus sp.wf-3、Vagococcus sp.wf-1、Vagococcus sp.wf-2、Terribacillus sp. wf-1、Lysinibacillus sp. wf-1和Staphylococcus sp. wf-1与相似度最高的菌株相似度均达到99%以上,可以确定它们与相似度最高的菌株为同一种类。Vitreoscilla sp. wf-1与分离自人类牙齿菌斑的Vitreoscilla stercoraria strain Gottingen 1488-6相似度最高,然而相似度只有95%。
2.3 分离菌的生化鉴定
对分离得到的11 株细菌进行革兰氏染色、形态观察以及产气实验、h2O2酶活性检测、糖利用实验、氧化酶活性实验、明胶液化实验、h2S产生实验、尿素利用实验和吲哚产生实验,如表3所示,Morganella sp.wf-1和Morganella sp.wf-2符合摩根氏菌的生化特性;Proteus sp.wf-1、Proteus sp.wf-2和Proteus sp.wf-3符合变形杆菌的生化特性,Vitreoscilla sp. wf-1符合透明颤菌的生化特性;Vagococcus sp.wf-1和Vagococcus sp.wf-2符合漫游球菌的生化特性;Terribacillus sp. wf-1和Lysinibacillus sp. wf-1符合芽孢杆菌的生化特性;Staphylococcus sp. wf-1符合松鼠葡萄球菌的生化特性。这一结果与利用16S rDNA鉴定的结果一致。

表3 分离菌的部分生化鉴定结果Table 3 Biochemical tests of 11 bacterial isolates
结合表1~3的结果显示:Proteus sp. wf-1、Proteus sp.wf-2和Proteus sp. wf-3以及Morganella sp. wf-1和Morganella sp. wf-2分离自VRBDA琼脂培养基,而生长于VRBDA琼脂培养基上的细菌构成了腐败白鱼优势细菌,所以Proteus sp. wf-1、Proteus sp. wf-2、Proteus sp. wf-3、Morganella sp. wf-1和Morganella sp. wf-2中的一种或几种细菌可能是白鱼的SSO,这需要进一步实验来进行验证。
3 讨 论
导致水产品腐败的因素很多。总体而言可以划分为内在因素和外在因素[2]。内在因素主要包括水产品较高的水分活度、高蛋白质、含有较高的微生物等;外在因素主要有贮存、运输和加工过程中温度、微生物控制、防腐剂的选择等。其中微生物是导致水产品腐败的根本因素,微生物活动不仅能使水产品发生变质,而且还能合成一些导致消费者过敏的物质,例如生物胺类物质,而组胺是生物胺中对人类健康影响最大的一种[6]。当人体摄入过量的组胺时,会引起头痛、恶心、心悸、血压变化、呼吸紊乱等不适症状,严重时还会危及生命。
本研究结果显示腐败白鱼优势微生物为摩根氏菌(Morganella)和变形杆菌(Proteus)(表1和表3),它们同属于肠杆菌科。摩根氏菌和变形杆菌是鱼类腐败过程中常见的腐败菌,在自然界中分布广泛,主要存在于水、腐败有机物中以及动物肠道中[7-8]。能够代谢氨基酸的微生物在鱼类食品中非常普遍。这类微生物主要是一类能产生氨基酸脱羧酶的微生物,其中以能产生组氨酸脱羧酶的组胺产生菌危害最为严重。
据报道摩根氏菌(Morganella)广泛存在于水产中,具有很强的组胺产生能力,在食品腐败过程中能通过分泌组氨酸脱羧酶催化组氨酸生成组胺,高含量组胺食品常常会使消费者出现过敏中毒症状[9-10]。更严重的是摩根氏菌(Morganella)是一种条件致病菌,会导致人类、爬行动物、海豹以及其他一些动物的感染[11]。此外,本研究分离得到的两株摩根氏菌均为产气菌(表2),而产气菌是导致真空包装产品胀袋的主要原因,所以研究抑制摩根氏菌的方法,对延长白鱼真空产品的货架期具有重要的意义。
变形杆菌(Proteus)也是一种较强组胺产生菌,同时也是一种条件性致病菌[12],其引起的食物中毒是一种常见的细菌食物中毒[13]。其中有的是由于活菌随同食物进入胃肠道,并在小肠中生长繁殖引起感染,引发感染型急性胃肠炎;有的是由于某些变形杆菌属能产生肠毒素,引起毒素型急性胃肠炎;有的是由于能产生较强活性的脱羧酶,将食品中的组氨酸脱酸形成组胺而引起过敏性组胺中毒。除此以外变形杆菌还会引起如呼吸道感染、泌尿道感染、创伤及烧伤感染、肺炎、肠炎、慢性中耳炎、脑膜炎等多种感染。
国内外关于水产品SSO的研究主要集中在假单胞菌(Pseudomonas spp.)与腐败希瓦氏菌(Shewanella putrefaciens),然而,不同水产品及同一水产品在不同条件下的SSO有可能是不一样的[14],因而,有必要对不同的水产品及不同条件下的水产品的SSO进行研究。鉴于本研究中分离得到的摩根氏菌(Morganella)和变形杆菌(Proteus)是腐败白鱼的优势细菌,且它们又是水产品重要的致腐致病菌,因此,摩根氏菌(Morganella)和变形杆菌(Proteus)很有可能就是白鱼的SSO,应当受到足够的重视。
松鼠葡萄球菌是最古老的葡萄球菌之一[15],广泛存在于自然环境中,如宠物、野生动物的皮肤和黏膜表面,沙石,土壤,水及沼泽中,但在水生动物中分离得到的报道较少[16]。在本研究中分离到一株葡萄球菌(Staphylococcus sp. wf-1),经16S rDNA鉴定其与松鼠葡萄球菌(Staphylococcus sciuri strain LH-T3)的相似度最高,达到了99.38%(表2)。作为条件致病菌,在危险因素存在的情况下,松鼠葡萄球菌可以引起心内膜炎,尿路感染,腹膜炎,骨盆炎,脓毒血症休克,眼内炎,最常见的为伤口感染。据统计,在凝固酶阴性的葡萄球菌中,由松鼠葡萄球菌引起的感染约占0.79%~4.3%[17]。因此,虽然松鼠葡萄球菌(Staphylococcus sciuri)并不是腐败白鱼的优势菌,也应受到一定的重视。
漫游球菌(Vagococcus)的模式种是河流漫游球菌(Vagcoccus fluvialis),由于漫游球菌在进化和表型上与肠球菌和乳酸乳球菌非常相似,因此在进行形态学鉴别和生化实验时容易混淆,通过16S rDNA和DNA复性研究发现,漫游球菌是乳酸菌的一个独立株系。目前对漫游球菌的研究较少,对其是否具有传染性和致病性未有定论。近几年有多篇报道研究证明一些河流漫游球菌在抑制鱼类致病菌中起到了一定的作用[18-20]。本研究也分离到2 株漫游球菌(Vagococcus sp.wf-1和Vagococcus sp.wf-2)(表2),虽然,这两株菌在鲜鱼和腐败白鱼中并非优势菌,但是它们可能在活鱼中起到一定的抑制致病菌的作用,这需要做进一步研究。
本研究还分离得到了2 株芽孢杆菌:1 株泰瑞芽孢杆菌(Terribacillus sp. wf-1)和1株赖氨酸芽孢杆菌(Lysinibacillus sp. wf-1)(表2)。泰瑞芽孢杆菌(Terribacillus)和赖氨酸芽孢杆菌(Lysinibacillus)同属于芽孢杆菌科,都是革兰氏阳性杆菌[21-22]。Lysinibacillus广泛存在于水体、动物和植物中,对Lysinibacillus的研究多集中于其对减轻环境污染方面,如Lysinibacillus可以降解除草剂氟磺胺草醚、间甲苯酚和氮苯等物质[23-24],还可以通过对镍的吸附和对六价铬还原减轻对环境的污染[25-26]。另据报道发现某些Lysinibacillus具有抑制食源性致病微生物的作用[22]。因此,对本研究获得的两株芽孢杆菌进行深入研究,发掘这2 株菌的潜在利用价值具有一定的环境和社会效益。
透明颤菌血红蛋白基因(vgb)在发酵菌株中高效表达能够有效解决传统发酵过程中由于氧传递而导致的产率低下和成本高的问题。本研究分离得到了1 株与透明颤菌(Vitreoscilla)相似度最高的细菌Vitreoscilla sp. wf-1,但是其16S rDNA序列与相似度最高的菌株Vitreoscilla stercoraria strain Gottingen 1488-6的相似度只有95.21%(表2),结合生化鉴定结果,最终确定Vitreoscilla sp. wf-1为透明颤菌。
[1] 王仲礼. 鱼类腐败的机理及其防腐保鲜法[J]. 肉品卫生, 1998(7): 16.
[2] 孙承锋, 戴瑞彤, 曲富春, 等. 微生物与肉类食品的腐败[J]. 肉类研究, 2001, 15(1): 32-35.
[3] JOS H J, HUIS I V. Microbial and biochemical spoilage of foods: an overview[J]. International Journal of Food Microbiology, 1996, 33(2): 1-18.
[4] 许振伟, 许钟, 杨宪时, 等. 鱼类腐败菌腐败能力测定方法[J]. 食品科学, 2010, 31(20): 355-359.
[5] HU Y, XIA W, GE C. Characterization of fermented silver carp sausages inoculated with mixed starter culture[J]. LWT-Food Science and Technology, 2008, 41(4): 730-738.
[6] BODMER S, IMARK C, KNEUBÜHL M. Biogenic amines in foods: histamine and food processing[J]. Inflammation Research, 1999, 48(6): 296-300.
[7] 庞君容. 临床样品中124株普通变形杆菌的重新鉴定[J]. 临床检验杂志, 1998(3): 165.
[8] 许玉芬, 褚思瑞, 王亚楠. 1起由摩氏摩根氏菌引起的食物中毒调查[J].预防医学论坛, 2008, 14(4): 364.
[9] 马晓波, 吕晓菊, 母丽媛, 等. 临床分离91株摩氏摩根菌的药敏分析[J].中国抗生素杂志, 2006(8): 501-504.
[10] KIM S H, FIELD K G, CHANG D S, et al. Identification of bacteria crucial to histamine accumulation in pacific mackerel during storage[J]. Journal of Food Protection, 2001, 64(10): 1556-1564.
[11] ZHAO Changguang, TANG Na, WU Yanping, et al. First reported fatal Morganella morganii infections in chickens[J]. Veterinary Microbiology, 2012, 156(3/4): 452-455.
[12] 贾宁, 林茂虎, 陈世平, 等. 产超广谱β-内酰胺酶变形杆菌的检测[J].中华医院感染学杂志, 2003(3): 11-13.
[13] 郑振军, 付淑珍, 张婷. 变形杆菌引发食物中毒的思考[J]. 现代医药卫生, 2005(17): 2396-2397.
[14] 罗庆华. 水产品特定腐败菌研究进展[J]. 食品科学, 2010, 31(23): 468-472.
[15] KLOOS w E, BALLARD D N, wEBSTER J A, et al. Ribotype delineation and description of Staphylococcus sciuri subspecies and their potential as reservoirs of methicillin resistance and staphylolytic enzyme genes[J]. International Journal of Systematic Bacteriology, 1997, 47(2): 313-323.
[16] KATAYAMA Y, ZHANG H Z, HONG D, et al. Jumping the barrier to beta-lactam resistance in Staphylococcus aureus[J]. Journal of Bacteriology, 2003, 185(18): 5465-5472.
[17] STEPANOVIC S, VUKOVICC D, TRAJKOVIC V, et al. Possible virulence factors of Staphylococcus sciuri[J]. FEMS Microbiology Letters, 2001, 199(1): 47-53.
[18] SORROZA L, PADILLA D, ACOSTA F, et al. Characterization of the probiotic strain Vagococcus fluvialis in the protection of European sea bass (Dicentrarchus labrax) against vibriosis by Vibrio anguillarum[J]. Veterinary Microbiology, 2012, 155(2/3/4): 369-373.
[19] ROMáN L, REAL F, PADILLA D, et al. Cytokine expression in headkidney leucocytes of European sea bass (Dicentrarchus labrax L.) after incubation with the probiotic Vagococcus fluvialis L-21[J]. Fish and Shellfish Immunology, 2013, 35(4): 1329-1332.
[20] ROMáN L, REAL F, SORROZA L, et al. The in vitro effect of probiotic Vagococcus fluvialis on the innate immune parameters of Sparus aurata and Dicentrarchus labrax[J]. Fish and Shellfish Immunology, 2012, 33(5): 1071-1075.
[21] ASH C, FARROW J A E, WALLBANKS S, et al. Phylogenetic heterogeneity of the genus Bacillus revealed by comparative analysis of small-subunit-ribosomal RNA sequences[J]. Letters in Applied Microbiology, 2008, 13(4): 202; 206.
[22] AHMED I, YOKOTA A, YAMAZOE A, et al. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov.[J]. International Journal of Systematic and Evolutionary Microbiolog, 2007, 57(Pt 5): 1117-1125.
[23] LIANG Bo, LU Peng, LI Huihui, et al. Biodegradation of fomesafen by strain Lysinibacillus sp. ZB-1 isolated from soil[J]. Chemosphere, 2009, 77(11): 1614-1619.
[24] YAO Haiyan, REN Yuan, DENG Xiuqiong, et al. Dual substrates biodegradation kinetics of m-cresol and pyridine by Lysinibacillus cresolivorans[J]. Journal of Hazardous Materials, 2011, 186: 1136-1140.
[25] PRITHVIRAJ D, DEBOLEENA K, NEELU N, et al. Biosorption of nickel by Lysinibacillus sp. BA2 native to bauxite mine[J]. Ecotoxicology and Environmental Safety, 2014, 107: 260-268.
[26] 廉晶晶. Lysinibacillus sp.Cr-6还原六价铬特性及其在电镀铬污染土壤修复中的应用[D]. 武汉: 中国地质大学, 2013.
Isolation and Identification of Spoilage Organisms in Whitefish
XIA Xiudong1, LIU Xiaoli1, WANG Ying1, LI Ying1, DONG Mingsheng2, ZHOU Jianzhong1,*
(1. Institute of Agricultural Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The growth of spoilage organisms is the main factor causing the spoilage of aquatic products. Colony counting showed that the growth rate of spoilage microorganisms in whitefish was much faster at 25 ℃ than at 37 ℃, and therefore fish spoilage occurred more easily at the lower temperature. Through 16S rDNA sequence analysis, 21 strains isolated from putrid whitefish were identified as 11 different strains belonging to seven different genera: two strains of Morganella sp., three strains of Proteus sp., two strains of Vagococcus sp., one strain of Staphylococcu sp., one strain of Terribacillus sp., one strain of Lysinibacillus sp., one strain of Vitreoscilla sp.. In this study, the strains of Morganella sp. and Proteus sp. were the dominant spoilage bacteria and may be the SSO (specific spoilage organisms) in whitefish.
whitefish; spoilage organisms; isolation; 16S rDNA; identification
TS201.3
A
1002-6630(2015)21-0175-05
10.7506/spkx1002-6630-201521033
2015-06-04
江苏省农业自主创新项目(CX(14)2118)
夏秀东(1985 —),男,博士,研究方向为水产品加工。E-mail:86084056@163.com
*通信作者:周剑忠(1965—),男,研究员,博士,研究方向为食品生物技术。E-mail:zjzluck@126.com
