发酵性丝孢酵母酯酶的稳定性研究
2015-12-26陈洋洋张晓锋侯英敏孙玉梅
陈洋洋, 张晓锋, 侯英敏, 孙玉梅
(大连工业大学 生物工程学院,辽宁 大连 116034)
发酵性丝孢酵母酯酶的稳定性研究
陈洋洋, 张晓锋, 侯英敏, 孙玉梅*
(大连工业大学 生物工程学院,辽宁 大连 116034)
以发酵性丝孢酵母胞壁酯酶为研究对象,研究了其在不同理化条件下的稳定性。结果表明:0 ℃保存24 h,酯酶仍保持81.5%原酶活;在40 ℃完全失活;5 mmol/L K+、Mn2+和Fe2+提高酶活力6.9%以下,5 mmol/L Ca2+、Cu2+分别降低酶活力90.7%和73.3%;1%(质量分数,下同) Tween-40和TritonX-100保持77%以上原酶活,1%Tween-80提高酶活力23.3%,1% 十二烷基磺酸钠(Sodium dodecyl sulfate,SDS)和十六烷基三甲基溴化铵 (Cetyl trimethyl ammonium bromide,CTAB)完全抑制酶活;5%甘油、阿拉伯胶和糊精分别提高酶活力57%、29.6% 和2%,5%可溶性淀粉和牛血清蛋白(Albumin from bovine serum,BSA)分别降低酶活力20.4%和71.5%。发酵性丝孢酵母酯酶热稳定性差,宜10 ℃以下贮存,甘油对其保护作用良好,BSA强烈抑制该酶活性。该酯酶对处理含油脂废水和增强洗涤剂洗涤效果有潜在的应用价值。
发酵性丝孢酵母;酯酶;稳定性
微生物酯酶作为重要的工业酶类,广泛应用于医药、化工、食品等行业[1]。自然界中产酯酶的微生物主要有酵母菌、红曲霉、青霉和细菌等[2]。关于酵母菌产酯酶的研究主要集中在高产酯酶酵母菌株的选育、产酶影响因素及酶学性质等方面[3-4]。发酵性丝孢酵母产油脂能力强,且具有较高的脂肪酶活性[5],目前产酯酶方面的研究较少。研究酯酶的稳定性有助于扩大其应用范围并提高使用效率,目前对酯酶稳定性的研究多集中在温度、金属离子、表面活性剂和有机溶剂对酯酶的影响等方面[6-8]。本研究以发酵性丝孢酵母所产胞壁酯酶为研究对象,探讨了粗酶液中酯酶的热稳定性及贮存温度、金属离子、表面活性剂、有机化合物对粗酶液中酯酶稳定性的影响,以期为开发该菌的工业潜力提供相应的参考。
1 材料与方法
1.1 材料
1.1.1 菌种 发酵性丝孢酵母(Trichosporonfermentans)CICC1368,购自中国食品发酵工业研究院。
1.1.2 培养基 ①固体斜面培养基:葡萄糖2 g,酵母浸粉1 g,蛋白胨1 g,琼脂2 g,去离子水100 mL,pH自然;②液体种子培养基:葡萄糖10 g,蛋白胨0.53 g,酵母膏0.2 g,尿素0.2 g,MgSO40.05 g,去离子水100 mL,pH自然;③发酵培养基:葡萄糖10 g,蛋白胨0.8 g,酵母膏0.5 g,KH2PO40.2 g,植物油1 mL,Tween-80 0.5 mL,去离子水100 mL,pH自然。以上培养基灭菌条件均为121 ℃,15 min。
1.1.3 主要试剂 葡萄糖,食用级;酵母浸粉、蛋白胨、牛血清蛋白(Albumin from bovine serum,BSA),生化试剂;尿素、固蓝B盐、甘油、糊精、阿拉伯胶粉,分析纯;乙酸-α-萘酯、十二烷基磺酸钠(Sodium dodecyl sulfate,SDS)、Tween-40、Tween-80、TritonX-100、十六烷基三甲基溴化铵(Cetyl trimethyl ammonium bromide,CTAB)、可溶性淀粉,化学纯。
1.1.4 主要仪器 722S 分光光度计(上海精密科学仪器有限公司),Eppendorf Centrifuge 5417R 高速冷冻台式离心机(德国Eppendorf生物技术公司),恒温水浴锅(巩义市英峪予华仪器厂),SK-1型快速混匀器(金坛市金城教学仪器厂),超声波细胞破碎仪JY99-2(宁波新芝科器研究所)。
1.2 方法
1.2.1 培养方法 ①菌种活化:将4 ℃冰箱保存的发酵性丝孢酵母(Trichosporonfermentans)CICC1368 菌种接于斜面培养基上,于30 ℃培养48 h;②种子液培养:取2环活化菌株接入种子培养基中,于30 ℃、160 r/min摇床培养24 h;③发酵液培养:将种子液按10%(体积分数)的接种量接入发酵培养基中,于30 ℃、160 r/min摇床培养60 h。
1.2.2 粗酶液制备 发酵液于4 ℃、10 000 r/min离心10 min,收集菌体沉淀。用0.067 mol/L、pH 6.8的磷酸盐缓冲液洗涤菌体,离心收集菌体沉淀,重复3次。取1 g湿菌体与25 mL磷酸盐缓冲液(0.067 mol/L,pH 6.8)的混合液于冰水浴中进行超声波破碎(超声波功率400 W,总时间5 min,工作时间6 s,间隔5 s),细胞破碎液离心后所得上清液即为粗酶液。
1.2.3 酯酶活力测定 采用乙酸-α-萘酯测定酯酶总活力[9]。1 g湿菌体破碎所得粗酶液在40 ℃、pH 6.8的条件下水解4%固蓝B盐溶液5 min,以每分钟释放1 mmol乙酸-α-萘酯为一个酶活力单位。
1.2.4 贮存温度对酯酶稳定性的影响 20 mL新鲜粗酶液分别置于0、4、10 ℃,24、48、60 h 后分别取样测定残余酶活力。以新鲜粗酶液作对照,酶活设为100%。
1.2.5 热稳定性试验 20 mL新鲜粗酶液分别置于0~60 ℃(间隔10 ℃)水浴中保温30 min,取样测定残余酶活力。以新鲜粗酶液作对照,酶活设为100%。
1.2.6 金属离子对酯酶稳定性的影响 将ZnSO4、CaSO4、MnSO4、CuSO4等金属硫酸盐溶液分别置于20 mL新鲜粗酶液中,使各金属离子最终浓度为5 mmol/L。在4 ℃放置20 h后测定残余酶活力。以新鲜粗酶液作对照,酶活设为100%。
1.2.7 表面活性剂对酯酶稳定性的影响 将Tween-40、Tween-80、TritonX-100、SDS和CTAB 分别置于20 mL新鲜粗酶液中,使各表面活性剂质量分数均为1%,于4 ℃放置20 h后测定残余酶活力。以新鲜粗酶液作对照,酶活设为100%。
1.2.8 有机化合物对酯酶稳定性的影响 将甘油、可溶性淀粉、糊精、牛血清蛋白、阿拉伯胶分别加入到20 mL粗酶液中,使各有机化合物质量分数为5%,于4 ℃放置20 h后测定残余酶活力。以新鲜粗酶液作对照,酶活设为100%。
2 结果与分析
2.1 贮存温度对酯酶稳定性的影响
不同贮存条件下酯酶的相对活力见表1。由表1可知,相同温度下,贮存时间越长,酯酶相对活力越低;相同的贮存时间,温度越高,酶相对活力越低。酯酶在0 ℃贮存24 h,相对活力仍可达到81.5%。该酶在10 ℃以下可短时间内贮存。
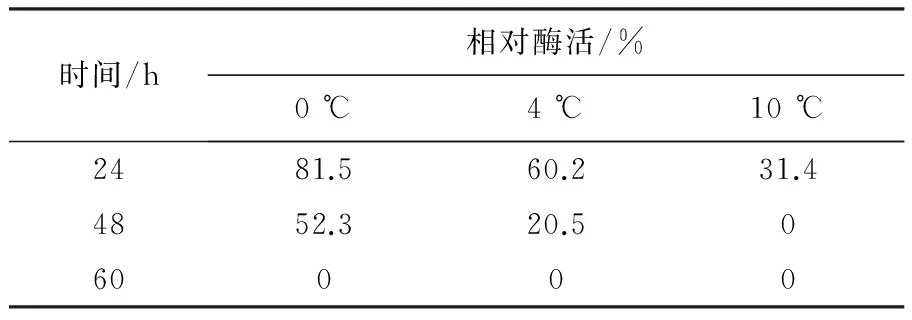
表1 贮存温度对酯酶稳定性的影响
2.2 热稳定性试验
酯酶热稳定性试验结果见图1。发酵性丝孢酵母酯酶活力随保存温度的升高而降低,在0 ~10 ℃范围内稳定性较好,能保持80%以上原酶活力。在20 ℃及以上酶活损失较多。有研究表明,酵母菌S9菌株的酯酶在30~40 ℃仍能保持较高的活性[3-4],而本研究中发酵性丝孢酵母(Trichosporonfermentans) CICC1368的酯酶在40 ℃时便完全失活,热稳定性较差。
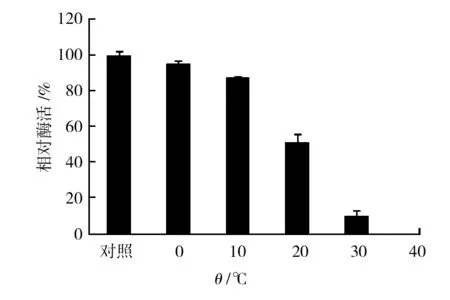
图1 酯酶的热稳定性Fig.1 Thermal stability of esterase
2.3 金属离子对酯酶稳定性的影响
金属离子作用酯酶的结果如图2所示。金属离子浓度为5 mmol/L时,Zn2+、Na+、Mg2+、Pb2+能使酯酶活力保持在原酶活力的70%以上,K+、Mn2+和Fe2+分别使酶活提高6.9%、1.4%、1.8%,Ca2+和Cu2+对酯酶抑制作用强烈,分别使酶活力降低90.7%和74.3%。有研究表明,5 mmol/L的Mg2+、Ca2+和Zn2+能有效促进1株海洋细菌Est B酯酶的活性[7],与本研究结果不一致,说明酶活性中心对金属离子促进剂有选择性。工业废水中常含金属离子,发酵性丝孢酵母的酯酶在浓度高达5 mmol/L的多种金属离子溶液中稳定性较好,而且该酵母可利用豆制品等工业废水生长[10]。因此,可进一步研究将发酵性丝孢酵母及其酯酶应用于工业废水处理。
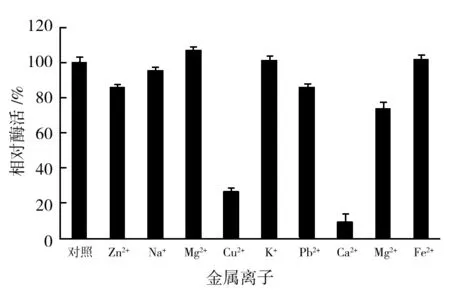
图2 金属离子对酯酶稳定性的影响Fig.2 Effect of metal ions on esterase stability
2.4 表面活性剂对酯酶稳定性的影响
表面活性剂作用酯酶的结果如图3所示。质量分数1%的Tween-40和TritonX-100使酯酶活力保持在原酶活力的77%以上;1%的 Tween-80将酶活力提高了23.3%;1%的SDS和CTAB溶液使酯酶完全失去活性。可见,酯酶在几种非离子型表面活性剂中的稳定性较好,其中Tween-80可显著促进酶活;而在两种离子型表面活性剂中则完全失去活性。有研究表明,离子型表面活性剂对酯酶的活性影响较大,非离子型表面活性剂对酯酶影响较小[11],本研究结果符合这一结论。酶在表面活性剂水溶液中具有较好的稳定性是其能够在洗涤剂领域中应用的前提,发酵性丝孢酵母的酯酶在质量分数1%的非离子型表面活性剂中稳定性较好,特别是在Tween-80中酶活力明显提高,可进一步探讨将这几种表面活性剂与酯酶配合使用,以达到更好的去污效果。
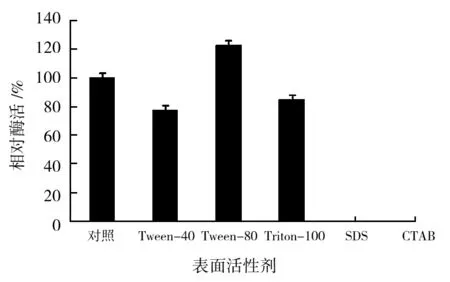
图3 表面活性剂对酯酶稳定性的影响Fig.3 Effect of surfactants on esterase stability
2.5 有机化合物对酯酶稳定性的影响
有机化合物作用酯酶的结果如图4所示。质量分数5%的甘油、阿拉伯胶和糊精分别提高57%、29.6%和2%的酯酶活力;5%的可溶性淀粉和BSA抑制酶活,分别使酯酶活力降低20.4%和71.5%。甘油、阿拉伯胶和糊精均能提高溶液的黏度,增加酶蛋白表面的水化层,从而减少肽链之间的碰撞,避免酶分子聚集,起到提高酶稳定性的作用[12-13]。可溶性淀粉在冷水中不溶解,粗酶液中的淀粉颗粒与酯酶蛋白分子相互碰撞,使酶空间构象改变,酶活力降低[14]。BSA极大地破坏了粗酶液中酯酶的稳定性,可作为酯酶抑制剂。甘油对酯酶稳定性的保护作用显著,且价格低廉,可用作保护剂保护酯酶的稳定性。
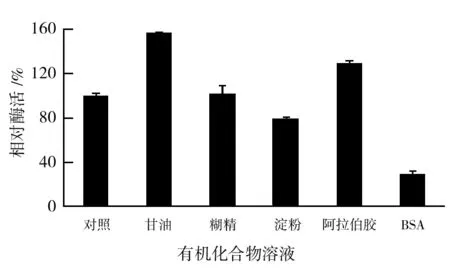
图4 有机化合物对酯酶稳定性的影响Fig.4 Effect of organic compounds on esterase stability
3 讨 论
本研究结果表明,贮藏条件为0 ℃、24 h时,发酵性丝孢酵母(Trichosporonfermentans) CICC1368酯酶的稳定性较好。在40 ℃时完全失活,热稳定性较差。该酶宜在10 ℃以下短时保存。金属离子浓度为5 mmol/L 时,在Ca2+和Cu2+溶液中酯酶活性受到强烈抑制,在K+、Mg2+和Fe2+等金属离子溶液中稳定性较好,可进一步研究该酵母及其酯酶在污水治理方面的作用。在非离子型表面活性剂Tween-80、Tween-40和TritonX-100中酯酶的稳定性较好,在质量分数1% Tween-80中酶活明显提高,说明该酶在洗涤剂领域中具有应用潜力;质量分数5%甘油、阿拉伯胶和糊精可提高酶活,甘油的作用最显著,是良好的酯酶保护剂;质量分数5%可溶性淀粉和BSA显著降低酶活力,BSA可作为酯酶抑制剂。
[1] 侯颖,秦翠丽,宫强,等. 酯酶产生菌的分离与酶学性质研究[J]. 微生物学杂志,2012,32(4):32-39.
[2] 施安辉,周波.酯酶的微生物类群、酯化特性及其应用前景[J]. 中国酿造,2002,(6):14-16.
[3] 宋欣,曲音波,叶寒青,等. 具脂肪酶和酯酶活性酵母菌的选育和酶学性质初步研究[J]. 应用与环境生物学报,1999,5(6):628-631.
[4] 杨淑莲,徐汉虹,廖美德,等. α-氰基-3-苯氧基苄醇乙酸酯立体选择性水解酯酶产生菌的筛选及酶学特性初探[J]. 农药学学报,2005,7(2):140-143.
[5] 孙晓璐,孙玉梅,陈莉,等. 不同酵母菌发酵产油脂及脂肪酶的研究[J]. 粮油加工,2007,(8):80-82.
[6] Seo S, Lee YS, Sang HY, et al. Characterization of novel cold-active esterase from swamp sediment metagenome[J]. World J Microbiol Biotechnol,2014, 30(3):879-886.
[7] Zhang S S, Wu G J, Liu Z X, et al. Characterization of Est B, a novel cold-active and organic solvent-tolerant esterase marine microorganismAlcanivoraxdieseloleiB-5(T)[J].Extremophiles,2014,18(2):251-259.
[8] Wu G J, Wu G B , Zhan T,et al. Characterization of a cold-adapted and salt-tolerant esterase from a psychrotrophic bacteriumPsychrobacterpacificensis[J].Extremophiles, 2013,17 (5):809-819.
[9] 禹邦超,邓辉胜,王旭,等. 多种形式酯酶总活力的混合底物分光光度测定法[J]. 华中师范大学学报,1996,30(1):87-91.
[10]魏群,孙玉梅,李广通. 利用豆制品生产废水培养油脂酵母的研究[J]. 中国酿造,2005,146(5):37-39.
[11]孙国龙,陈丽,黄金,等. 表面活性剂对酶活性的影响研究进展[J]. 西部皮革,2013,35(10):24-29.
[12]吴燕雯,吴瑛,徐斐,等. 提高鸡肝酯酶稳定性的保护剂选择[J]. 食品工业科技,2005,26(6):84-85.
[13]Timasheff S N, Arakawa T. Mechanisms of protein precipitation and stabilization by co-solvents[J]. Journal of Crystal Growth, 1998, 9(3): 9-46.
[14]徐金库,张媛媛,刘均洪. 酶稳定性的研究进展[J]. 化学与生物工程,2004,(3):1-3.
Stabilities of Esterase from Fermentable Filamentous Spore Yeast (Trichosporon fermentans)
CHEN Yang-yang, ZHANG Xiao-feng, HOU Ying-min, SUN Yu-mei
(Coll.ofBio-Engin.,DalianPolytech.Uni.,Dalian116034)
The stabilities of esterase from cell wall of filamentous spore yeast (FSY) (Trichosporonfermentans) were studied in different physical and chemical conditions. The results showed that the esterase remained 81.5% of its initial activity after being stored at 0 ℃ for 24 h and became totally inactive at 40 ℃. K+, Mn2+and Fe2+at 5 mmol/L increased esterase activity by fewer than 6.9%. While Ca2+and Cu2+at 5 mmol/L reduced esterase activities by respectively 90.7% and 73.3%. The residual activity of esterase was kept at more than 77% of original activity in 1% (w/w) Tween-40 and TritonX-100, and increased by 23.3% in 1% (w/w) Tween-80. While in 1% (w/w) SDS (sodium dodecyl sulfate) and CTAB (cetyl trimethyl ammonium bromide) totally inhibited the esterase activity. 5% (w/w) glycerol, Arabic gum, and dextrin could enhance esterase activity, and enhanced the esterase activity by respectively 57%, 29.6%, and 2%. 5% soluble starch and BSA (albumin from bovine serum) decreased esterase activity by respectively 20.43% and 71.5%. The FSY esterase should be stored below 10 ℃ due to its poor thermal stability. Glycerol had good protection effect on the esterase, while BSA had strong inhibition against the esterase. The esterase had potential application values to treat oleo-waste-water and to enhance washing effects of detergent.
Trichosporonfermentans; esterase; stability
辽宁省科技厅自然科学基金项目优秀人才培育专题 (2014026013)
陈洋洋 女,硕士研究生。研究方向为微生物代谢控制发酵。E-mail:sweetyznxm@sina.com
* 通讯作者。女,教授,博士,硕士生导师。研究方向为微生物代谢控制发酵。Tel: 0411-86318692,E-mail:sunyumei62@163.com
2015-01-08;
2015-03-16
Q814.9
A
1005-7021(2015)05-0019-04
10.3969/j.issn.1005-7021.2015.05.004