胰腺实性假乳头状瘤的多层螺旋CT表现
2015-12-26,,*,,
,,*, ,
(1.南华大学附属第二医院放射科,湖南 衡阳 421001;2.南华大学附属第一医院放射科)
·临床经验·
胰腺实性假乳头状瘤的多层螺旋CT表现
彭建春1,李毓红2,方向军1*,郭阳1,唐智明1
(1.南华大学附属第二医院放射科,湖南 衡阳 421001;2.南华大学附属第一医院放射科)
目的总结胰腺实性假乳头状瘤(SPTP)的多层螺旋CT(MSCT)表现,提高对该疾病的认识。方法回顾性分析9例经手术病理证实的SPTP患者的临床资料与多层螺旋CT表现。结果肿块均呈圆形或卵圆形,位于胰头4例,胰体3例,胰颈、胰尾各1例。9例肿块均囊实相间,1例包膜弧线样钙化,2例实质内点状钙化,3例可见新鲜出血;双期增强扫描所有病灶实性部分动脉期明显强化,静脉期渐进性强化,但强化程度低于周围正常胰腺组织,囊性部分无强化,其中2例动脉期肿瘤内见不规则细小血管影,其中胰管扩张者2例。9例肿物病理切面均见出血、坏死及囊变,镜下见特征性假乳头状结构。结论胰腺实性假乳头状瘤的CT表现有一定的特点,能反映病理特征,是术前诊断该疾病的主要方法;多排螺旋CT的重建技术能帮助空间定位。
胰腺; 实性假乳头状瘤; MSCT
胰腺实性假乳头状瘤(solid pseudopapillary tumors of pancreas,SPTP)是一种少见的良性或具有低度恶性潜能的胰腺肿瘤,该肿瘤因其临床症状不典型及影像学报道较少,容易漏诊和误诊。笔者收集经本院手术、病理证实的9例SPTP,回顾性分析其多层螺旋CT表现,旨在加深对这一疾病的认识,提高术前CT诊断符合率。
1 资料与方法
1.1一般资料收集本院2009年1月~2014年6月经手术病理证实的SPTP 9例。9例均为女性,年龄21~42岁,中位年龄29岁。3例患者腹胀、腹痛,2例患者左中上腹扪及包块就诊,4例B超体检发现。患者肿瘤标记物癌胚抗原CEA、CA19-9、CA125检查均为阴性。
1.2检查方法1.2.1 CT检查 9例患者均行CT平扫及双期增强扫描检查。CT使用Philips Brilliance 16层螺旋CT机,扫描范围自膈顶至胰腺钩突下缘。扫描参数:准直器宽度5 mm,螺距0.938,管电压120 KV,管电流250 mAs,重建间隔1 mm。增强扫描使用双桶高压注射器,经肘前静脉注射碘海醇(100 mL∶30 g[1]),注射剂量1.5~2.0 mL/kg,流率3 mL/s,动脉期延迟时间20~25 s,静脉期延迟时间60~65 s。图像均行多平面重建(MPR)处理,阅片由2名高年资腹组诊断医师独立观察、分析并达成共识,对病灶的部位、形态、大小、密度、包膜、囊实性成分、出血、钙化、强化方式及强化程度进行记录并分析。
1.2.2 病理检查 标本经石蜡包埋、切片,行染色及增殖指数Ki-67、CD56、PR、波形蛋白Vimentin、突触素Syn免疫组织化学检查。
2 结 果
2.1 CT表现肿块位于胰头4例,胰体3例,胰颈、胰尾各1例,形态呈圆形或卵圆形,肿瘤最大直径4.3~12.5 mm(6.8±0.7 mm)。平扫肿块呈等、低密度,囊实相间,CT值18~34 HU,1例包膜呈弧线样钙化,2例实质内见点状钙化,3例可见新鲜出血(CT值45~52 HU)。增强扫描肿瘤实性部分动脉期明显强化,CT值74~82 HU,静脉期进行性强化,CT值84~90 HU,强化程度弱于周围胰腺组织,囊性成分均无强化。2例动脉期肿瘤内见不规则细小血管影,2例胰管轻度扩张。肿瘤实性区域多位于肿块边缘。8例包膜完整光滑,1例胰头部肿块包膜局部不完整,并与十二指肠降段分界不清(图1)。
2.2手术及病理2例行胰头肿物及十二指肠切除,1例行胰尾及脾切除,其余行肿块局灶性切除。术中均行肝门区、肠系膜及腹膜后淋巴结清扫,未见淋巴结转移。1例肿瘤浸润性生长,侵犯胰腺组织,包膜血管及十二指肠黏膜下血管均见瘤栓。镜下肿瘤组织由实性区、假乳头区和囊性区以不同比例混合而成。肿瘤细胞形态较一致,呈圆形或椭圆形,常见核沟,核仁不明显,核分裂相罕见。免疫组化:CD56(+)9例、PR(+)7例、Vimentin(+)6例、AAT(+)5例、Syn、NSE灶性弱(+)、Ki-67约2%~5%(+)。
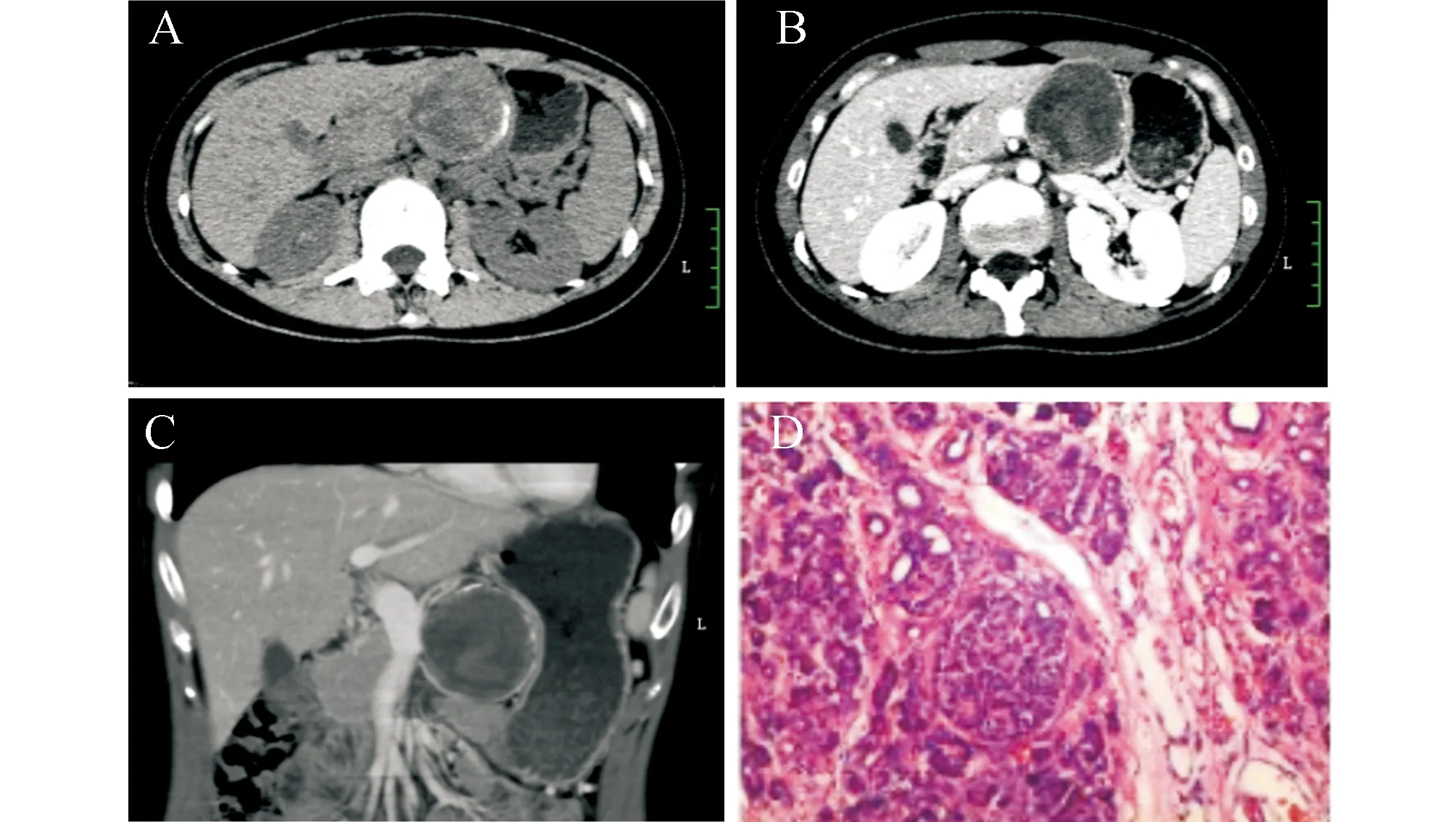
图1 典型病例CT扫描及病理图片 A:胰颈部肿物,平扫囊实相间,内见出血,包膜钙化;B:增强后肿瘤实性部分明显强化,囊性部分无强化,包膜可见强化;C:MRP显示肿瘤空间位置及毗邻;D:显微镜下肿瘤由弥漫分布的圆形细胞构成,瘤细胞大小较一致,异型性不明显,部分区域细胞呈乳头状,乳头轴心及间质可见粘液变及玻璃样变
3 讨 论
3.1 SPTP的临床特点SPTP于1959年由Frantz首先报道,1996年世界卫生组织统一命名为SPTP。SPTP的组织起源及发病机制均不清楚,目前多数学者认为该肿瘤细胞不同于任何一种胰腺细胞,可能起源胰腺胚胎多能干细胞[1-3],本组病例NSE、Syn、Vimentin、AAT等多种阳性表达支持这一学说。SPTP的发病机制目前认为是β-catenin基因第3外显因子突变造成WNT信号通路异常所致,表现为β-catenin和E-cadherin免疫组化的异常表达,同时伴随细胞周期蛋白cyclinD1的过渡表达。本病发病率低,约占胰腺原发肿瘤的1%~6%,发病年龄以20~30岁青年女性多见,偶尔发生于40岁以上的中老年人。本组9例患者全为女性,中位年龄29岁,3例患者年龄大于30岁,年龄最大为42岁,与文献报道相符[4-5]。SPTP患者临床症状不典型,多因腹胀、腹痛、消化不良或触及腹部肿物就诊发现,实验室检查一般无异常发现,肿瘤标志物检测为阴性。本组病例中4例患者体检时偶然发现,3例患者出现腹胀、腹痛,2例患者左中上腹可扪及包块,肿瘤标记物CEA、CA19-9、CA125检查均为阴性。SPTP患者外科手术切除后愈后良好,极少复发及转移,5年生存率达95%以上[6]。
3.2 SPTP的病理特征大体观9例SPTP均呈囊实性,切面多房囊性,囊内容物为咖啡色液体或灰红色絮状物,镜下常有包膜或纤维组织分隔,由实性区、假乳头区和囊性区以不同比例混合组成。肿瘤实性区由大小较一致的肿瘤细胞围绕纤维血管轴心复层排列形成假乳头状结构为其特征性改变(图1D),由于肿瘤间质含大量薄壁、脆弱血管,缺乏有力的支架结构,故易发生出血,出血是该肿瘤的特征之一。免疫组化:肿瘤细胞Vimentin、PR、CD56、NSE、Syn、AAT等多种阳性表达,免疫表型这种兼有胰腺外分泌、内分泌及上皮来源的多样性表达构成了SPTP的一大特点。虽然免疫组化中没有一种抗体是特异性诊断标记,但对抗体的联合检测,对SPTP的诊断及鉴别诊断仍具有重要意义。
3.3 SPTP的MSCT表现及其病理学基础肿瘤可发生于胰腺的任何部位,以胰头部多见,本组病例中有4例发生于胰头,占44.4%;肿瘤一般较大,本组最大直径约12.5 mm,最小约4.3 mm,平均6.8 mm。形态呈圆形或卵圆形,膨胀性生长,肿瘤包膜多完整,与正常胰腺组织及周围血管分界清晰,极少侵犯邻近组织及器官。本组仅1例包膜局部被侵犯,术中见邻近胰腺组织侵犯,肿瘤包膜血管及十二指肠黏膜下血管见瘤栓,病理切片肿瘤细胞学形态尚好,无坏死,未见核分裂,但生物学行为呈浸润性生长,侵犯血管并形成大量瘤栓,考虑为侵袭性实性假乳头状瘤。因此,包膜是否完整可作为CT上肿瘤是否具有侵袭性的依据。肿瘤通常由不同比例的囊实性成分共同组成,少数可表现为完全囊性或完全实性,本组病例均为囊实相间,实性区多位于肿瘤边缘,囊性区多见出血及坏死,本组3例(占33.3%)肿块内可见新鲜出血,呈相对高密度,反映了病理特征。钙化亦是该肿瘤较常见的征象之一,本组2例肿块内见点状钙化灶,1例包膜呈弧线样钙化,其病理基础可能为肿瘤间质或纤维血管轴心易发生黏液样变性及囊性区出血坏死。增强扫描肿瘤实性成分动脉期即明显强化,静脉期进行性强化,强化程度弱于周围正常胰腺组织,这一特点笔者认为可能是由于病变间质内有大量薄壁纤细血管及血窦,内部血流缓慢有关,本组2例动脉期强化肿块内还可见不规则血管影。肿瘤极少累及胆总管,本组病例均无胆管扩张,但有2例胰腺体尾部胰管扩张,可能为胰头部肿块较大,膨胀性生长压迫主胰管所致。MSCT后处理技术MPR能准确定位,多方位显示肿块与胰腺关系,并能多发角度观察肿瘤对邻近组织的压迫、侵犯情况(图1C)。
3.4 SPTP需与下列疾病鉴别(1)胰腺浆液性或粘液性囊腺瘤:均好发于中老年女性,胰腺体尾部多见,微囊型为浆液性囊腺瘤的典型表现,中央放射状瘢痕钙化具有一定特征性;粘液性囊腺瘤一般呈单个或多个大囊,10%~25%可见囊壁或分隔的蛋壳样钙化[7]。(2)胰腺癌:中老年人多见,肿瘤易向胰腺背侧生长,胰头部肿瘤容易侵犯胆总管引起肝内外胆管扩张,增强扫描肿瘤为乏血管肿瘤,强化不明显等为其特点。(3)无功能性胰岛细胞瘤:肿瘤常较大,增强扫描肿瘤强化十分明显,其强化程度均高于周围正常胰腺组织。
[1] Choi JY,Kim MJ,Kim JH,et al.Solid pseudopapillary tumor of the pancreas:typical and atypical manifestations[J].AJR,2006,187(2):178-186.
[2] Martin RC,Klimstra DS,Brennan MF,et al.Solid-pseudopapillary tumor of the pancreas:a surgical enigma[J].Ann Surg Oncol,2002,9(1):35-40.
[3] Kosmahl M,Seada LS,Janig U,et al.Solid-pseudopapillary tumor of the pancreas:its origin revisited[J].Virchows Arch,2000,436(5):473-480.
[4] 丁敏,螘国铮,王晓秋,等.胰腺实性-假乳头状瘤8例临床病理分析[J].临床与实验病理学杂志,2003,19(5):474-475.
[5] 繆飞,展颖,王晓颖,等.胰腺实性-假乳头状瘤的影像与病理诊断分析[J].临床放射学杂志,2004,23(7):589-592.
[6] Huang HL,Shih SC,Chang WH,et al.Solid-pseudopapillarytumor of the pancreas:clinical experience and literature review[J].World J Gastroenterol,2005,11( 9 ):1403-1409.
[7] Sahani DV,Kadavigere R,Saokar A,et al.Cystic pancreatic lesions:a simple imaging-based classification system for guiding management[J].Radiographics,2005,25(6):1471-1484.
10.15972/j.cnki.43-1509/r.2015.03.023
2014-11-13;
2015-01-23
*通讯作者,E-mail:fangxiangjun118@163.com.
R817
A
(此文编辑:蒋湘莲)
