紫杉醇对Caski细胞增殖及APC、DKK-3基因表达的影响
2015-12-26,
,
(南华大学附属南华医院妇产科,湖南 衡阳 421001)
·基础医学·
紫杉醇对Caski细胞增殖及APC、DKK-3基因表达的影响
唐群华,孙晓红*
(南华大学附属南华医院妇产科,湖南 衡阳 421001)
目的研究紫杉醇对Caski细胞增殖及APC、DKK-3基因表达的影响。方法用MTT法、RT-PCR法及甲基化特异性PCR分别检测紫杉醇对人宫颈癌Caski细胞株增殖的影响、APC与DKK-3 mRNA 表达水平、APC与DKK-3启动子甲基化水平。结果≥1 μmol/L紫杉醇能明显抑制人宫颈癌Caski细胞株的增殖 (P<0.05);从5 μmol/L开始,随着紫杉醇给药剂量的增大,Caski细胞APC、DKK-3 mRNA表达水平明显增加 (P<0.05),而Caski细胞APC 、DKK-3启动子甲基化水平显著降低 (P<0.05)。结论紫杉醇能呈剂量依赖性的抑制Caski 细胞的增殖并上调APC、DKK-3 mRNA的表达,这可能与其诱导APC、DKK-3启动子的去甲基化有关。
宫颈癌; 紫杉醇; 启动子甲基化; APC; DKK-3
转移和复发是导致宫颈癌患者死亡的主要原因,以顺铂为基础的化疗是转移性和复发性宫颈癌的治疗标准方案,紫杉醇常与顺铂等铂类抗肿瘤药物联合使用并发挥了重要的作用[1]。但紫杉醇是通过何种信号途径启动抗肿瘤效应的,目前还不十分清楚。最近研究发现,紫杉醇能通过降低乳腺癌MCF-7、MDA-MB-231细胞株中PTPRO基因启动子甲基化水平促进其表达,抑制乳腺癌细胞的增殖[2]。肿瘤抑制基因 APC 及DKK-3 是wnt/β-catenin信号通路的关键组成部分,APC 与 β-catenin的交互作用与宫颈鳞状细胞癌的发生相关,肼屈嗪能够通过 APC 的去甲基化和重表达而抑制宫颈癌细胞的增殖[3]。关于紫杉醇是否通过影响APC 及DKK-3基因启动子甲基化及其表达来抑制宫颈癌肿瘤细胞,目前未见相关报道。本研究通过不同浓度的紫杉醇处理人宫颈癌Caski细胞株后,测定细胞增殖活性的改变,同时检测APC、DKK-3基因表达水平及其启动子甲基化水平的变化,分析表观遗传学修饰在紫杉醇治疗宫颈癌的作用机制,为宫颈癌的防治提供科学的实验依据。
1 材料与方法
1.1宫颈癌细胞株及其培养人宫颈上皮癌Caski细胞系购自武汉大学细胞保藏中心,保存于南华大学肿瘤实验研究所-80 ℃冰箱。将Caski细胞复苏后置于37 ℃、5%CO2、饱和湿度环境的培养箱内,用含10% 胎牛血清的RPMI-1640培养基培养该细胞,每隔24 h换液1次,每隔48~72 h传代1次,显微镜下观察其生长情况。
1.2主要试剂紫杉醇粉剂(生物专用)购自于三维生物科技有限公司;RPMI 1640培养基购自于上海博升生物科技有限公司;噻唑蓝购自于福州迈新生物制品公司;TRIzol购自于美国Invitrogen公司;PBL DNA购自于美国Promega公司;RNase A 购自于美国Sigma公司;蛋白酶K 购自于美国罗氏诊断;所用引物及探针均由Invitrogen公司合成。
1.3 MTT比色法检测不同浓度紫杉醇对人宫颈癌Caski细胞抑制率的影响细胞用不同浓度的紫杉醇 (0、1、5、10、20、40、80、160、 320 μmol/L ) 连续处理72 h,每个处理剂量设置6个复孔,每隔24 h 换1次液。分别在0 h、24 h、48 h和72 h加入MTT,在酶联免疫检测仪 570 nm 波长处测定吸光度值 (OD)。按下面的公式计算:细胞抑制率 (%) =[(A570对照组-A570实验组)/A570对照组] × 100%。
1.4 RT-PCR法测定APC、DKK-3 mRNA表达水平选取处于对数生长期的Caski细胞,按每10 cm2培养面积加1 mL TRIzol裂解细胞,提取细胞RNA,用OD260/OD280 比值来衡量 RNA的纯度。引物如下:APC-上游:5′-GAG ACA GAA TGG AGG TGC TGC-3′;APC-下游:5′-GTA AGA TGA TTG GAA TTA TCT TCT-3′;DKK-3-上游:5′-GTA AGT TTC CCC TCT GGC TTG-3′;DKK-3-下游:5′-AAG CAC CAG ACT GTG AAG CCT-3′;GAPDH-上游:5′-AAC GGA TTT GGT CGT ATT GGG-3′;GAPDH-下游:5′-TTG ATT TTG GAG GGA TCT CGC-3′。APC反应条件:95 ℃ 5 min,35个PCR循环 (95 ℃ 30 s、56 ℃ 60 s、72 ℃ 60 s),72 ℃延伸 7 min;DKK-3反应条件:95 ℃ 5 min,35个PCR循环 (94 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s),72 ℃延伸 7 min。反应产物经琼脂糖凝胶电泳后,进行成像分析,计算目的基因mRNA 与内参 GAPDH mRNA 的光密度比值。
1.5 APC、DKK-3启动子甲基化分析收集处于对数生长期的Caski细胞,加入2 mL 预热的裂解缓冲液,用等体积的酚/氯仿/异戊醇 (1∶1∶0.04) 提取基因组DNA。50 ℃ 处理 16 h 后,DNA与5.5 μL 3 mol/L NaOH 在37 ℃ 一起孵育10 min,随后加入 30 μL新鲜配制的 10 mmol/L对苯二酚和 520 μL 新鲜配制的3.6 mol/L 的亚硫酸氢钠 (pH 5.0)。脱盐等处理后应用 MethyLight quantitative PCR进行扩增并用7500/7500 快速实时 PCR 系统进行荧光定量检测。引物如下[4-6]:
APC-sense:5′- GAA CCA AAA CGC TCC CCAT -3′;APC -antisense: 5′- TTA TAT GTC GGT TAC GTG CGT TTA TAT -3′;probe:5′- CCC GTC GAA AAC CCG CCG ATT A -3′;Dkk-3-sense:5′- GTA AGT TTC CCC TCT GGC TTG-3′;Dkk-3-antisense:5′- AAG CAC CAG ACT GTG AAG CCT-3′;probe:5′- AGG TGT TGT GCA TTT GTT C AG CTC CC -3′;ALU-C4-sense:5′-GGT TAG GTA TAG TGG TTT ATA TTT GTA ATT TTA GTA -3′;ALU-C4 -antisense: 5′- ATT AAC TAA ACT AAT CTT AAA CTC CTA ACC TCA -3;probe:5′- CCT ACC TTA ACC TCC C -3′。经过初始变性 (95 ℃,10 min)、45 个变性循环 (95 ℃,10 min) 以及最后的退火/延伸循环 (60 ℃,1 min)。甲基化比率通过绝对化的 qPCR 定量来测定。在待测样本中靶基因的扩增量被用 Alu-C4 进行标准化,经M.SssI 处理的 DNA 作为甲基化的参考。在特殊位点的甲基化 DNA 的量或甲基化参考比例 (PMR)是通过划分基因来计算的:Alu-C4 的比例为M.SssI 处理的人类基因组 DNA 的Alu-C4 的比例 (假定完全甲基化) 乘以100,即(样本基因/样本Alu-C4)/(SssI处理的样本基因 / SssI处理的样本Alu-C4)×100。
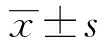
2 结 果
2.1不同浓度紫杉醇对宫颈癌Caski细胞株活性的影响分别检测紫杉醇作用24 h、48 h及72 h后对Caski细胞的抑制率,如表1所示,用1 μmol/L的紫杉醇作用时,24 h、48 h及72 h时点Caski细胞抑制率没有明显的变化 (P>0.05);从5 μmol/L开始,随着紫杉醇给药剂量的增大及紫杉醇处理时间的延长,Caski细胞的抑制率显著增大 (P<0.05);各个剂量组均在72 h处显示对Caski细胞的最大抑制率,其中320 μmol/L紫杉醇在72 h时对Caski细胞的抑制率达到最大(P<0.05)。
表1不同浓度紫杉醇(μmol/L)对宫颈癌Caski细胞作用不同时间的抑制率(%)

紫杉醇浓度24h48h72h000017.32±2.44a7.41±3.05a8.01±2.78ab530.78±2.34a32.13±2.34ab35.48±2.89ab1032.15±3.02a35.78±3.14ab40.18±2.73ab2033.51±2.73a37.55±2.71ab43.43±2.85ab4034.83±2.08a41.43±2.66ab47.68±2.74ab8036.46±2.71a48.61±2.59ab51.68±2.99ab16038.02±3.00a49.27±2.77ab55.34±2.17ab32040.68±2.80a56.85±2.61ab62.27±3.15ab
a:与同时点的前一个剂量组比较,P<0.05;b:与同一剂量组的前一个时点比较,P<0.05
2.2紫杉醇对Caski细胞APC、DKK-3 mRNA表达的影响检测紫杉醇作用72 h后APC、DKK-3 mRNA的表达水平,发现用1 μmol/L的紫杉醇作用时,Caski细胞APC、DKK-3 mRNA表达水平没有明显的变化 (P>0.05);从5 μmol/L开始,随着紫杉醇给药剂量的增大,Caski细胞APC、DKK-3 mRNA表达水平明显增加 (P<0.05),其中,320 μmol/L紫杉醇处理组APC、DKK-3 mRNA水平最高(图1)。

图1 RT-PCR检测紫杉醇对Caski细胞APC、DKK-3 mRNA表达水平的影响. 1~9分别为0、1、5、10、20、40、80、160、320 μmol/L紫杉醇处理组. 与前一个剂量组比较,*:P<0.05
2.3紫杉醇对Caski细胞APC、DKK-3启动子甲基化水平的影响分别检测紫杉醇作用24 h、48 h及72 h后对Caski细胞APC 、DKK-3启动子甲基化水平的影响,如表2所示,用1 μmol/L的紫杉醇作用时,24 h、48 h及72 h时点Caski细胞APC启动子甲基化水平没有明显的变化 (P>0.05),而48 h和72 h时点DKK-3启动子甲基化水平明显低于24 h时点的DKK-3启动子甲基化水平 (P<0.05),48 h和72 h时点间没有明显的差异 (P>0.05);从5 μmol/L开始,随着紫杉醇给药剂量的增大及紫杉醇处理时间的延长,Caski细胞APC、DKK-3启动子甲基化水平显著降低 (P<0.05);各个剂量组Caski细胞APC、DKK-3启动子甲基化水平均在72 h处显示最低 (P<0.05)。
表2不同浓度紫杉醇(μmol/L)对宫颈癌Caski细胞APC、DKK-3启动子甲基化的影响

紫杉醇浓度APC启动子甲基化水平24h48h72hDKK-3启动子甲基化水平24h48h72h0125±3.2128±6.8127±7.1159±2.6155±5.1157±6.61120±2.8a119±8.0a121±8.7a147±8.2a127±2.5ac125±6.6ac590±8.6a80±7.2ab60±7.5ab129±5.7a128±8.0114±8.7ab1080±6.8a60±5.6ab40±4.4ab110±5.8a105±7.3a95±5.4ab2070±7.9a55±8.8ab35±5.4ab87±8.2a95±7.1a75±7.7ab4060±8.9a45±9.2ab30±4.0ab70±5.7a65±4.9ab50±3.9ab8050±6.7a40±6.6ab25±4.2ab51±6.7a47±9.0a40±7.1ab16040±8.2a30±9.1ab20±8.8ab43±4.2a36±4.6ab38±7.132035±6.3a20±7.8ab10±5.5ab35±4.9a21±3.7ab15±4.5ab
与同时点的前一个剂量组比较,a:P< 0.05;与同一剂量组的前一个时点比较,b:P<0.05;与24 h比较,c:P<0.05
3 讨 论
全球每年有50多万女性罹患宫颈癌,国内宫颈癌每年有13.2万新发病例,占世界总数28%[7]。对于宫颈癌患者,目前临床化疗方案以铂类为主,但铂类药物对患者的毒性作用,尤其是肾毒性以及肿瘤细胞的耐药性日益突出。因此,寻找新的毒性及耐药性弱的化疗药物,对于宫颈癌患者的治疗具有重要的现实意义。紫杉醇是一线的抗肿瘤药物。紫杉醇对卵巢癌和乳腺癌细胞有明显的杀伤作用[8-9],在体外有明显的放射增敏作用[10]。紫杉醇可在肺癌细胞中通过下调let-7f的水平而上调血小板反应蛋白-1(TSP-1)的水平,从而达到抗肿瘤效应[11]。Wen等[12]研究发现,紫杉醇脉冲式的治疗有助于克服乳腺癌细胞对于紫杉醇的赖药性,其主要的机制可能与降低肿瘤细胞对已经破坏的线粒体的修复作用有关[12]。有研究发现,通过下调wnt信号通路的LEF1/磷酸化β-catenin的表达,能改善紫杉醇对肾细胞癌的治疗效果。近年来,将紫杉醇与铂类药物联合用于宫颈癌的治疗,取得了较好的效果。但紫杉醇抑制宫颈癌细胞的具体机制还不是十分清楚。
药物对细胞活性的影响是药效学评价最常用的手段。MTT法是测定细胞活性的最经典的实验之一。活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为不溶于水的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,细胞沉积的甲瓒越多,则表示细胞的活力就越强。因此甲瓒生成的多少代表细胞活力的强弱。在本研究中,用1 μmol/L的紫杉醇作用时,24 h、48 h及72 h时点Caski细胞抑制率没有明显的变化;从5 μmol/L开始,随着紫杉醇给药剂量的增大及紫杉醇处理时间的延长,Caski细胞的抑制率显著增大;各个剂量组均在72 h处显示对Caski细胞的抑制率大于处理24 h、48 h的抑制率,其中320 μmol/L紫杉醇在72 h时点对Caski细胞的抑制率达到最大,表明紫杉醇能够对人宫颈癌Caski细胞产生明显的剂量依赖和时间依赖的抑制效应,这种现象在其它抗肿瘤药物实验中也被观察到[3]。
甲基化是研究最为广泛的表观遗传学形式,基于Taqman探针的甲基化特异性PCR是较敏感的甲基化检测方法。APC是一种广泛表达的多功能蛋白,能够与细胞内多种蛋白相互作用,研究最彻底的是其能诱导β-catenin的降解,后者为钙粘合蛋白复合体的亚基及wnt信号通路的关键效应器。当绑定到β-catenin后,APC促进了高保守的丝氨酸和苏氨酸残基的磷酸化而激活蛋白酶体系统来降解β-catenin[13-14]。DKK-3是新近发现的抑癌基因,参与细胞周期的调控,与肿瘤的发生、进展和转归有密切的关系[15]。DKK-3在肝癌、宫颈癌、急性淋巴细胞白血病、胰腺癌和髓母细胞瘤等恶性肿瘤中表达减少[16],而且这种减少与DKK-3的高甲基化状态有关[15]。
肿瘤细胞总体基因组水平的超甲基化能够影响肿瘤细胞对紫杉醇治疗的敏感性[17]。研究显示,APC启动子区域CpG位点的甲基化改变与细胞异常及恶化有关[18-19]。DKK-3基因启动子甲基化及基因表达下降已经在膀胱癌、肺癌等多种肿瘤细胞中发现[20-21]。APC和DKK-3基因均与肿瘤细胞的生长与增殖显著相关,主要是因为APC和DKK-3基因启动子的超甲基化导致APC和DKK-3基因表达缺失引起[22-23]。在宫颈癌中还未发现APC、DKK-3基因启动子甲基化的相关报道。
在本研究中,用1 μmol/L紫杉醇作用时,24 h、48 h及72 h时点Caski细胞APC启动子甲基化水平没有明显的变化;而48 h和72 h时点Caski细胞DKK-3启动子甲基化水平明显低于24 h时点的DKK-3启动子甲基化水平,48 h和72 h时点间没有明显的差异。从5 μmol/L开始,随着紫杉醇给药剂量的增大及紫杉醇处理时间的延长,Caski细胞APC、DKK-3启动子甲基化水平显著降低而随着紫杉醇给药剂量的增高,APC、DKK-3 mRNA表达水平显著升高;各个剂量组Caski细胞APC、DKK-3启动子甲基化水平均在72 h处低于处理24 h、48 h的水平,其中320 μmol/L紫杉醇组处理Caski细胞72 h时APC、DKK-3启动子的甲基化水平最低,而APC、DKK-3 mRNA表达水平最高,表明紫杉醇能够促进APC、DKK-3基因的表达,这种现象可能与其能够呈剂量依赖性的降低宫颈癌Caski细胞APC、DKK-3基因启动子的甲基化水平有关,但其具体机制还需进一步研究。
[1] Miura S,Kagamu H,Sakai T,et,al.Advanced thymic cancer treated with Carboplatin and Paclitaxel in a patient undergoing hemodialysis[J].Intern Med,2015,54(1):55-58.
[2] Xue M,Ge Y,Zhang J,et,al.Fucoidan inhibited 4T1 mouse breast cancer cell growth in vivo and in vitro via downregulation of Wnt/β-catenin signaling[J].Nutr Cancer,2013,65(3):460-468.
[3] Song Y,Zhang C.Hydralazine inhibits human cervical cancer cell growth in vitro in association with APC demethylation and re-expression[J].Cancer Chemother Pharmacol,2009,63(4):605-613.
[4] Weisenberger DJ,Campan M,Long TI,et,al.Analysis of repetitive element DNA methylation by MethyLight[J].Nucleic Acids Res,2005,33(21):6823-6836.
[5] Um TH,Kim H,Oh BK,et,al.Aberrant CpG island hypermethylation in dysplastic nodules and early HCC of hepatitis B virus-related human multistep hepatocarcinogenesis[J].J Hepatol,2011,54(5):939-947.
[6] Ding Z,Qian YB,Zhu LX,et al.Promoter methylation and mRNA expression of DKK-3 and WIF-1 in hepatocellular carcinoma[J].World J Gastroenterol,2009,15(21):2595-2601.
[7] 李霓,郑荣寿,张思维,等.2003~2007年中国宫颈癌发病与死亡分析[J].中国肿瘤,2012,(11):801-804.
[8] Chang B,Kim J,Jeong D,et al.Klotho inhibits the capacity of cell migration and invasion in cervical cancer[J].Oncol Rep,2012,28(3):1022-1028.
[9] Tang S,Yin Q,Su J,et al.Inhibition of metastasis and growth of breast cancer by pH-sensitive poly (β-amino ester) nanoparticles co-delivering two siRNA and paclitaxel[J].Biomaterials,2015,48:1-15.
[10] Neufeld KL.Nuclear APC[J].Adv Exp Med Biol,2009,656:13-29.
[11] Tao WY,Liang XS,Liu Y,et al.Decrease of let-7f in low-dose metronomic Paclitaxel chemotherapy contributed to upregulation of thrombospondin-1 in breast cancer[J].Int J Biol Sci,2015,11(1):48-58.
[12] Wen J,Yeo S,Wang C,et al.Autophagy inhibition re-sensitizes pulse stimulation-selected paclitaxel-resistant triple negative breast cancer cells to chemotherapy-induced apoptosis[J].Breast Cancer Res Treat,2015,149(3):619-629.
[13] Stewart DJ.Wnt signaling pathway in non-small cell lung cancer[J].J Natl Cancer Inst,2014,106(1):djt356.
[14] Kim YM,Kim IH,Nam TJ.Capsosiphon fulvescens glycoprotein inhibits AGS gastric cancer cell proliferation by downregulating Wnt-1 signaling[J].Int J Oncol,2013,43(5):1395-1401.
[15] 胡玲,姜玲,胡姣,等.宫颈脱落细胞 DKK-3 基因甲基化在宫颈癌中的意义[J].检验医学与临床,2015,12(1):110-111.
[16] 李季杨,蒋梦婉,王宏达,等.DKK-3 在上皮卵巢癌中表达的初步探索[J].现代生物医学进展,2015,15(2):308-311.
[17] Zhang X,Li W,Li H,et al.Genomic methylation profiling combined with gene expression microarray reveals the aberrant methylation mechanism involved in nasopharyngeal carcinoma taxol resistance[J].Anticancer Drugs,2012,23(8):856-864.
[18] Erdem B,Küçüky1ld1r1m S,Salar E,et al.Promoter hypermethylation of p16 and APC in gastrointestinal cancer patients[J].Turk J Gastroenterol,2014,25(5):512-517.
[19] Ding Z,Jiang T,Piao Y,et,al.Meta-analysis of the association between APC promoter methylation and colorectal cancer[J].Onco Targets Ther,2015,8:211-222.
[20] Wang H,Fan R,Wang XQ,et al.Methylation of Wnt antagonist genes:a useful prognostic marker for myelodysplastic syndrome[J].Ann Hematol,2013,92(2):199-209.
[21] Veeck J,Dahl E.Targeting the Wnt pathway in cancer:the emerging role of Dickkopf-3[J].Biochim Biophys Acta,2012,1825(1):18-28.
[22] Claes B,Buysschaert I,Lambrechts D.Pharmaco-epigenomics:discovering therapeutic approaches and biomarkers for cancer therapy[J].Heredity (Edinb),2010,105(1):152-160.
[23] Jawanjal P,Salhan S,Dhawan I,et,al.Peptidyl-prolyl isomerase Pin1-mediated abrogation of APC-β-catenin interaction in squamous cell carcinoma of cervix[J].Rom J Morphol Embryol,2014,55(1):83-90.
EffectsofPaclitaxelonCellProliferationandExpressionofAPCandDKK-3inHumanCervicalCancerCaskiCells
TANG Qunhua,SUN Xiaohong
(ObstetricsandGynecologyDepartment,theAffiliatedNanhuaHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo study the effect of paclitaxel on the proliferation of Caski cells and the expression of APC,DKK-3 gene.MethodsMTT colorimetric method,RT-PCR method and methylation specific PCR were used to detect the proliferation effects,the mRNA expression level of APC and DKK-3,APC and DKK-3 promoter methylation level induced by paclitaxel on human cervical carcinoma Caski cell line,respectively.ResultsPaclitaxel significantly inhibited the proliferation of Caski cervical cancer cell line when the concentration of Paclitaxel was more than 1 μmol/L (P<0.05);Starting from concentration of 5 μmol/L,with increasing of paclitaxel dosage,APC and DKK-3 mRNA expression level increased significantly (P<0.05),while APC and DKK-3 promoter methylation level significantly decreased (P<0.05).ConclutionPaclitaxel could dose-dependently inhibit the proliferation of Caski cells through increasing APC and DKK-3 mRNA expression,which may be related with the inhibition of APC and DKK-3 promoter methylation.
cervical cancer; paclitaxel; promoter methylation; APC; DKK-3
10.15972/j.cnki.43-1509/r.2015.03.005
2015-03-01;
2015-04-06
*通讯作者,E-mail:402447821@qq.com.
R737.33
A
(此文编辑:朱雯霞)
