EPO联合BMSCs治疗对大鼠脊髓损伤修复的影响
2015-12-26,,,,
,,,,
(南华大学附属第一医院脊柱外科,湖南 衡阳 421001)
·基础医学·
EPO联合BMSCs治疗对大鼠脊髓损伤修复的影响
谢中,羊明智*,胡文凯,彭立军,刘骞
(南华大学附属第一医院脊柱外科,湖南 衡阳 421001)
目的研究骨髓间充质干细胞(BMSCs)与促红细胞生成素(EPO)联合应用对大鼠脊髓损伤修复的影响。方法将80只SD大鼠随机分成手术对照组(n=15)、EPO治疗组(n=15)、BMSCs治疗组(n=25)和BMSCs联合EPO治疗组(简称联合组、n=25)。造模后第7天EPO组大鼠经腹腔注射EPO,BMSCs组、联合组大鼠则经损伤脊髓局部注射BMSCs和局部注射BMSCs的同时加用EPO腹腔注射。应用双标免疫荧光法检测5-溴-2脱氧尿嘧啶核苷(BrdU)标记的神经元中丝蛋白(NF-M)的表达情况;取脊髓组织作HE染色观察脊髓损伤及恢复程度;用(BBB)法检测大鼠神经功能的恢复情况。结果联合组较BMSCs移植治疗组炎性细胞浸润和组织水肿显著减轻。移植的BMSCs在宿主脊髓中存活,联合组中NF-M阳性细胞数目均比其余组多(P<0.05)。联合组在不同的时间点神经功能BBB评分都较BMSCs组及EPO组高。结论BMSCs移植与EPO腹腔注射是治疗大鼠脊髓损伤的有效方法;BMSCs与EPO联合应用对脊髓损伤修复具有协同作用。
促红细胞生成素; 间质干细胞; 脊髓损伤; 移植; BBB评分; 神经功能恢复
脊髓损伤(spinal cord injury,SCI)是中枢神经系统的一类严重创伤,其高致残率和死亡率成为脊柱外科工作者急需解决的难题。近年来随着神经生物学的飞速发展,细胞移植成为治疗脊髓损伤最有希望的方法之一[1]。从目前的资料来看,BMSCs(Bone mesenchymal stem cell,BMSCs)具有多向分化潜能[2]、极大的可塑性[3]、强大的增殖能力[4]、高度的迁移性等特点[5]成为理想的细胞移植治疗和基因治疗的首选细胞。促红细胞生成素(Erythropoietin,EPO)是一种多功能神经营养因子和保护因子,具有调节中枢神经系统发育、营养神经和保护神经的作用,是一个新的具有广阔发展前景的神经保护剂[6]。本实验通过对Allen’s大鼠脊髓损伤模型局部进行BMSCs移植的同时加用EPO腹腔注射,研究局部移植BMSCs在脊髓损伤修复中的作用,并探讨EPO与BMSCs联合应用对大鼠脊髓损伤修复的影响以及EPO在大鼠体内是否可以诱导BMSCs向神经细胞分化,为治疗脊髓损伤提供理论依据。
1 材料与方法
1.1动物、试剂及仪器80只健康SD青年大鼠,清洁级,体重220±10 g,均购于湖南省人民医院中心实验室。重组促红细胞生成素,2000 IU/支,由沈阳三生制药有限责任公司生产(批号:1001032)。DAB显色剂(武汉博士德生物有限公司),BrdU(广州市锐博生物有限公司),鼠抗神经元中丝蛋白单抗(美国Neomaekers公司),小鼠抗BrdU抗体(武汉博士德生物有限公司),苏木素伊红染液(重庆东方制药厂),YPS-2000系列彩色病理图文分析(德国莱卡公司),ZMN-6802病理组织溶烘仪(常州市华利电子公司),LeicaRM2016切片机(上海来卡仪器),YB-6D生物组织石蜡包买机(湖北省孝感市亚光医用电子技术有限公司)。
1.2分组及给药方法80只SD大鼠随机分为4组:对照组、EPO治疗组、BMSCs治疗组、BMSCs联合EPO治疗组。对照组大鼠于造模后第7天在损伤脊髓局部注射5 μL BMSCs培养液;EPO治疗组于造模后第7天按2 000 lU/kg腹腔注射EPO进行治疗;BMSCs治疗组于造模后第7天在损伤脊髓局部注射5 μL BMSCs悬液进行治疗;BMSCs联合EPO治疗组(简称联合组)于造模后第7天在损伤脊髓局部注入5 μL BMSCs悬液,同时按2 000 lU/kg腹腔注射EPO治疗。对照组、EPO组各15只大鼠,BMSCs组、联合组各25只。
1.3 BMSCs的移植[7]大鼠脊髓损伤模型建立后第7天,把培养液加入5-溴-2脱氧尿嘧啶核苷(BrdU)标记过的第3代BMSCs(由中南大学国家重点遗传学实验室提供),将细胞浓度调至5×104~1×105个/μL的范围内待用。用微量注射器将5 μL经BrdU标记的BMSCs细胞悬液缓慢注入BMSCs组及联合组大鼠损伤脊髓临近区域的灰白质交界处。
1.4行为学检测移植治疗后1天,7天,14天,21天,28天,各组取10只大鼠置于宽阔的地板上,在双盲法的前提下观察其双侧后肢各关节运动的范围和数量,根据双下肢步态是否协调以及运动程度进行运动功能评分(BBB)[8],并作记录,对所得数据进行重复测量的方差分析。
1.5动物取材及阳性细胞的判定和计数对照组、EPO组21天时随机选5只大鼠取标本做常规HE染色及神经元中丝蛋白(neurofilament-M,NF-M)免疫组化,光镜下观察组织病理学的变化。BMSCs组及联合组3天、7天、21天时随机选5只大鼠取标本行Brdu+NF-M双标免疫荧光,另取21天时标本做常规HE染色及NF-M免疫组化。在400倍光镜下,随机计数相应时间点5个视野中Brdu和NF-M双染,NF-M单染阳性细胞,取其平均值。
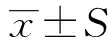
2 结 果
2.1大鼠脊髓损伤行为学检测(BBB评分) 治疗后第7天、14天、21天和28天时,EPO组、BMSCs组及联合组的BBB评分比对照组明显升高,且联合组的神经功能改善明显高于EPO组和BMSCs组,见表1。
表1各组大鼠各个时间点BBB评分表(分)
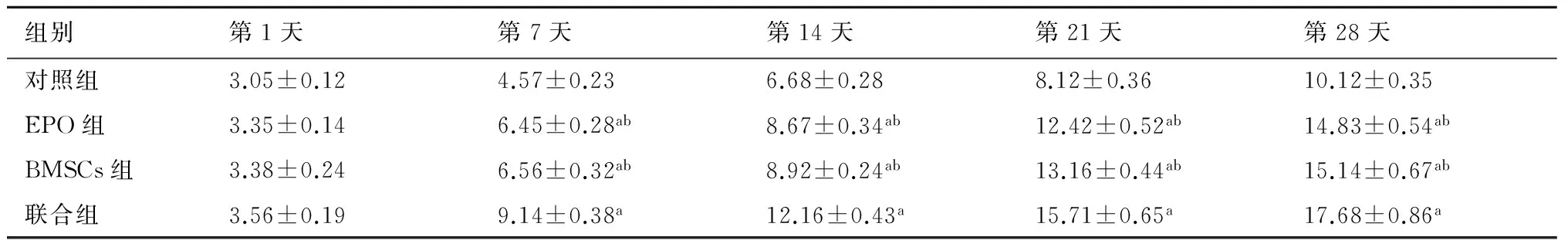
组别第1天第7天第14天第21天第28天对照组3.05±0.124.57±0.236.68±0.288.12±0.3610.12±0.35EPO组3.35±0.146.45±0.28ab8.67±0.34ab12.42±0.52ab14.83±0.54abBMSCs组3.38±0.246.56±0.32ab8.92±0.24ab13.16±0.44ab15.14±0.67ab联合组3.56±0.199.14±0.38a12.16±0.43a15.71±0.65a17.68±0.86a
与对照组比较,a:P﹤0.05;与联合组比较,b:P<0.05
2.2脊髓组织HE染色检查结果移植后21天,手术对照组(图1A)有较多空腔,白质中有许多微囊,神经纤维及细胞坏死,在挫伤处附近形成较多空泡;联合组(图1B)脊髓组织在高倍镜下观察可见脊髓组织中无明显空腔,空泡小而少,色泽较亮,胶质细胞增生活跃,脊髓有许多增生组织填充,损伤脊髓周围能见到较完整的神经细胞;EPO组(图1C)和BMSCs组(图1D)神经纤维及细胞变性、坏死的程度和数量较重。
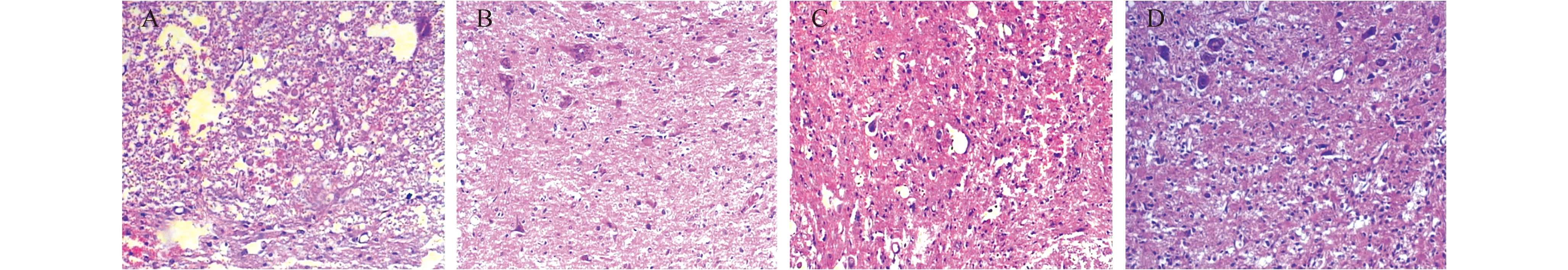
图1 治疗后第21天各组大鼠脊髓组织恢复情况(HE染色×200) A:对照组;B:EPO组;C:BMSCs组;D:联合治疗组
2.3 Brdu与NF-M双标免疫荧光染色结果联合组(图2A)与BMSCs组(图2B)脊髓组织内均可见到BrdU标记的阳性细胞存在,联合组中BrdU标记的阳性细胞数目比BMSCs组多;从移植后的第7天可以检测到BrdU和NF-M双标染色阳性的细胞。联合组(图2C)中BrdU和NF-M双标染色阳性的细胞数较BMSCs组(图2D)多(P<0.05)。
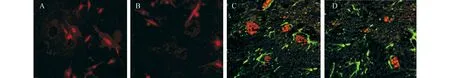
图2 BrdU和NF-M双标染色阳性的细胞分布(免疫荧光×400) A:联合治疗组治疗第3天;B:BMSCs组治疗第3天;C:联合治疗组治疗第7天;D:BMSCs组治疗第7天
2.4 NF-M免疫组化结果对照组(图3A)可见少量免疫反应阳性的神经纤维,较小,也可见少量胶质细胞活跃增生,突起细而短;EPO组(图3B)与BMSCs组(图3D)可见较多的染色阳性的神经纤维,少量长入瘢痕内,胶质细胞增生较对照组多;而EPO加BMSCs联合应用组(图3D)可见大量染色阳性的神经纤维,较多的长入瘢痕内,星形细胞出现明显的功能活跃,肥大,突起增多。治疗组阳性细胞数目较对照组明显增多;联合组阳性细胞数目比EPO组、BMSCs组明显增多(P<0.05)。
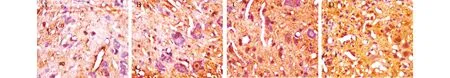
图3 各组治疗后21天NF-M表达情况(DAB×400) A:对照组;B:EPO组;C:BMSCs组;D:联合治疗组
3 讨 论
研究表明BMSCs移植能有效促进损伤脊髓功能的恢复[9-10]。BMSCs保护神经的作用机制可能是:(1)BMSCs可以分泌NGF等神经营养因子,促进神经递质的生成和轴突生长,对受损的神经细胞起保护作用与修复作用[8];(2)移植的BMSCs可作为轴突再生的支架,引导轴突向前生长,抑制瘫痕形成,建立新的突触联系,重建神经通路;(3)BMSc可以促进新生血管的生成与血管重建,改善受损神经的血供,为受损神经提供营养[8];(4)免疫调控作用:BMSc可以通过自身免疫过程,阻止免疫损伤,对神经起保护功能[11];(5)BMSc减轻细胞凋亡水平,激活休眠状态的神经细胞,促进神经恢复[12]。
传统认识中,EPO被认为是一种促进红细胞增殖,纠正贫血的内分泌激素。近来EPO已被实验证实是一种新型的神经保护剂[13]。EPO通过与促红细胞生成素受体结合而发挥其神经保护作用,其作用机制有以下几点:(1)EPO在早期可以维持损伤脊髓的血供,并可以促进局部血管的生成,提高损伤脊髓对缺血、缺氧的耐受性[14];(2)EPO可以通过减少神经细胞的凋亡,减少神经功能缺失,并能抑制局部的炎症反应,为脊髓的恢复创造有利的局部内环境[15];(3)EPO是一种神经营养因子,可以促进神经系统的发育,增加神经元的生成[16]。研究表明NF-M在神经细胞的氧化应激后表达发生明显的改变,可通过稳定细胞骨架和抑制轴突回缩而促进轴突延长,起到促进神经功能恢复的作用[17]。
本实验中治疗后第21天,对照组较多空腔,神经纤维及细胞变性坏死。联合组脊髓组织脊髓组织中无明显空腔,脊髓有许多增生组织填充,损伤脊髓周围能见到较完整的神经细胞;联合组可见更多的NF-M阳性细胞,明显多于EPO、BMSCs单独治疗组。再结合各组的BBB评分与组织学观察可见联合组神经损伤凋亡明显减轻,神经轴突再生显著增多,神经功能明显好转;机制可能为EPO与BMSCs表达的EPO受体结合后动员BMSCs进入损伤区;此外,EPO为移植的BMSCs创造有利于生存的局部内环境,促进BMSCs分化为神经元细胞,替代死亡的神经细胞,分泌大量的NF-M稳定细胞骨架,促进轴突再生、再通,促进神经功能恢复。EPO调节局部血管,维持供血及供氧,两者共用具有协调作用。
总之,脊髓损伤的再生修复是一个多因素参与的复杂过程,是一个世界性的难题。原因之一是因为缺乏合适的微环境,限制了损伤神经轴突的再生。EPO能改善损伤局部的微环境,抑制细胞凋亡,有利于移植的BMSCs在体内存活、分化增加,促进神经系统的发育。EPO与BMSCs联合移植后,增加了存活细胞及分化为神经元细胞的数量,替代变形凋亡的神经元细胞,促进轴突的再生与再通,促进神经功能的恢复。EPO与BMSCs联合治疗具有协同效应。
[1] Ruff CA,Wilcox JT,Fehlings MG.Cell-based transplantation strategies to promote plasticity following spinal cord injury[J].Exp Neurol,2012,235( 1):78-90.
[2] Satija NK,Sharma D,Afrin F,et al.High throughput transcriptome profiling of lithium stimulated human mesenchymal stem cells reveals priming towards osteoblastic lineage[J].PLoS One,2013,8(1):55-64.
[3] Egusa H,Kobayashi,Matsumoto T,et al.Application of cyclic strain for accelerated skeletal myogenic differentiation of mouse bone marrow-derived mesenchymal stromal cells with cell alignment[J].Tissue Eng Part A,2013,19(5-6):770-782.
[4] Jacobs SA,Roobrouck VD,Verfaillie CM,et al.Immunological characteristics of human mesenchymal stem cells and multipotent adult progenitor cells[J].Immunol Cell Biol,2013,91(1):32-39.
[5] Fekete N,Rojewski MT,Fürst D,et al.GMP-compliant isolation and large-scale expansion of bone marrow-derived MSC[J].PLoS One,2012,7(8):43-55.
[6]Ehrenreich H,Bartels C,sargin D,et a1.Recombinant human erythropoietin in the treatment of human brain disease:focus On cognition[J].Ren Nutr,2008,1(8):146-153.
[7] Ruan Z,Huang H,Sun JH.et al.AIIogeneic bone marrow mesenchymal stem cells transplantation for spinal cord injury in rats[J].Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu,2010,14(36):6729-6732.
[8] Uccelli A,Benvenuto F,Laroni A,et al.Neuroprotective features of mesenchymal stem cells[J].Best Pract Res Clin Haematol,2011,24(1):59-64.
[9] 高平,孙占胜,王伯珉,等.骨髓间充质干细胞诱导成神经元样细胞移植治疗脊髓损伤[J].中国组织工程研究,2013,17(23):4256-4263.
[10] Nakajima H,Uchida K,Guerrero AR,et al.Transplantation of mesenchymal stem cells promotes an alternative pathway of macrophage activation and functional recovery after spinal cord injury[J].Neurotrauma,2012,29(8):1614-1625.
[11] Cho DI,Kim MR, Jeong HY, et al.Mesenchymal stem cells reciprocally regulate the M1 /M2 balance in mouse bone marrow-derived macrophages[J].Exp Mol Med,2014,46:30-35.
[12] Pisati F,Bossolasco P,Meregalli M,et al.Iduction of neuro-troPhin expression via human adult mesenchymal stem cells:imPlieation for cell therapy in neuro degenerative diseases [J].Cell TransPlant,2007,61(1):41-55.
[13] 金宝,张育才,崔云.促红细胞生成素对发育期小鼠脑损伤后脑源性神经营养因子和酪氨酸受体激酶B 表达的影响[J].上海交通大学学报: 医学版,2012,32( 1):14-20.
[14] Taupin P.BrdU immunohistochemistry for studying adultneurogenesis:paradigms,pitfalls,limitations,and validation[J].Brain Res Rev,2007,53(1):198-214.
[15] Nakano M,Satoh K,Fukumoto Y,et al.Important role of erythropoietin receptor to promote VEGF expression and angiogenesis in peripheral ischemia in mice[J].Circ Res,2007,100( 5):662-669.
[16] Wu X,Zhou C,Du F,et al.Ginkgolide B preconditioning on astrocytes-promotes neuronal survival in ischemic injury via up-regulating erythropoietin secretion[J].Neurochem Int,2013,62 ( 2 ):157-164.
[17] Chiasson K,Lahaie-Collins V,Bournival J,et al.Oxidative stress and 17-alpha-and 17-beta-estradiol modulate neurofilaments differently[J].Mol Neurosci,2006,30(3):297-310.
10.15972/j.cnki.43-1509/r.2015.03.006
2015-01-29;
2015-05-02
*通讯作者,E-mail:Mingzhiyang@126.com
744
A
(此文编辑:蒋湘莲)
