猪肉类罐头食品中总DNA提取方法的比较*
2015-12-25杨彤晖孟镇钟其顶仇凯安丽艳李志军
杨彤晖,孟镇,钟其顶,仇凯,安丽艳,李志军
1(中国食品发酵工业研究院,北京,100015) 2(全国食品发酵标准化中心,北京,100015)
近年来,肉制品的掺假事件层出不迭,其中尤以低值肉类掺入冒充高值肉类最为严重。肉制品的真实性鉴别已经成为行业内关注的热点问题之一。目前,动物源性成分鉴别方法主要有蛋白质鉴别[酶联免疫吸附(ELISA),等电聚焦(IEF),高效液相色谱(HPLC)等][1-3]和分子学鉴别[聚合酶链式反应(PCR),DNA 杂交等][4-5]等。由于 DNA 较蛋白质而言耐热性强,不依赖于组织和细胞的类型,具有更高的种间多态性等优点,基于以物种间基因差异为基础的分子生物学鉴别方法已成为食品中动物源成分鉴别的主要方法[6]。
对于深加工肉制品,如罐头制品、肉干、肉骨粉等,由于经过了繁杂的前处理和长时间的高温加工,使得DNA严重降解[7]。从这些深加工食品中提取足够数量和质量的DNA是进行动物源分子学鉴别的基础和关键。
目前,常用的DNA提取方法有SDS法,异硫氰酸胍法,CTAB法和试剂盒法[8]。本研究比较了EE101-02 DNA提取试剂盒、SDS法、CTAB法和异硫氰酸胍法对猪肉罐头食品DNA的提取效果,并指出了适用于分子生物学研究的猪肉类罐头食品中总DNA提取的有效方法。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
7种猪肉类罐头食品(表1),从超市购买的鲜猪肉样品作为阳性对照。

表1 猪肉类罐头样品Table 1 Canned pork samples
1.1.2 试剂
EE101-02 DNA提取试剂盒(easyPure genomic DNA提取试剂盒型,型号EE101-02,北京全式金生物技术有限公司);异硫氰酸胍法裂解液[5 mol/L GuSCN,0.05 mol/L Tris-HCl(pH 8.0),1.3%Triton-X 100,0.02 mol/L EDTA(pH 8.0)];CTAB 法裂解液[1%CTAB,0.05 mol/L Tris-HCl(pH 8.0),0.7 mol/L NaCl,0.01 mol/L EDTA(pH 8.0)];SDS 法裂解液[1%SDS,0.05 mol/L Tris-HCl(pH 8.0),0.1 mol/L EDTA(pH 8.0)];蛋白酶 K(20 mg/mL);V(三氯甲烷)∶V(异戊醇)=24∶1;TE 缓冲液(0.01 mol/L Tris,0.001 mol/L EDTA,pH 8.0);异丙醇;无水乙醇。
1.2 仪器与设备
3K15型高速冷冻离心机(德国Sigma公司);Tgradient PCR扩增仪(德国Biometra公司);DYY-8C型高压电泳仪(北京六一仪器厂);CV-1000型凝胶成像系统(法国VILBER LOURMAT公司)。
1.3 DNA提取方法
1.3.1 样品前处理
分别取2g鲜猪肉和猪肉类罐头样品于10 mL离心管中,加入6 mL的无菌去离子水,上下颠倒充分混匀,9 000 g室温离心5 min并弃去上清液。再加入6 mL的三氯甲烷,9 000 g室温离心5 min并弃去上清液。然后再用无菌去离子水清洗样品1次。
1.3.2 EE101-02 DNA提取试剂盒提取DNA
按照试剂盒说明书操作进行。
1.3.3 异硫氰酸胍法
参考邵碧英[9],何建文[10]的研究,并进行适当修改。称取50 mg样品于1.5 mL离心管中,加入200 μL TE,混匀;加入 400 μL裂解液,室温放置30 min后,加400 μL V(三氯甲烷)∶V(异戊醇)=24∶1溶液,混匀;10 000 g室温离心5 min,取上清液,加0.8倍体积异丙醇,室温沉淀1 h;10 000 g室温离心5 min,弃上清液;体积分数70%乙醇洗涤1次,晾干;加入50 μL TE缓冲液,溶解沉淀。
1.3.4 CTAB法
参考 GB/T 21101-2007[11],并进行适当修改。称取50 mg样品于1.5 mL离心管中,加入600 μL CTAB裂解液,65℃ 温育30 min,每隔10 min振荡混匀1次;10 000 g室温离心5 min,吸取上清液至新离心管中,加400 μL V(三氯甲烷)∶V(异戊醇)=24∶1溶液,充分混匀;10 000 g室温离心5 min,吸取上清液至一新离心管中,加0.8倍体积异丙醇,室温下沉淀1h;10 000 g室温离心10 min,弃上清液;70%乙醇洗涤1次,晾干;加入50 μL TE缓冲液,溶解沉淀。
1.3.5 SDS法
参考Kitano T的研究[12],并进行适当修改。称取50 mg样品于1.5 mL离心管中,加入600 μL裂解液,并加入20 μL 5 mg/mL蛋白酶 K;55℃12 h水浴;在冰上放置30 min,10 000 g室温离心10 min;转移上清液至一新离心管中,加400 μL V(三氯甲烷)∶V(异戊醇)=24∶1溶液,充分混匀;10 000 g室温离心5 min,吸取上清液至一新离心管中,加0.8倍体积异丙醇,室温下沉淀1h;10 000 g室温离心10 min,弃上清液;70%乙醇洗涤1次,晾干;加入50 μL TE缓冲液,溶解沉淀。
1.4 PCR检测
以4种方法提取的总 DNA为模板,参考文献[13-15],根据猪线粒体基因组(mtDNA)细胞色素b(Cytochrome b,Cyt b)基因和16S rRNA基因,选取通用引物(表2)进行PCR反应。每组反应做2个平行试验。PCR反应采用25 μL体系:10×PCR buffer 2.5 μL,dNTP(2.5 mmol/L)2 μL,20pmol/uL 引物各1 μL,模板 DNA 2 μL,Taq DNA Polymerase 0.3 μL(1.5U),MgSO4(50 mmol/L)1 μL,ddH2O 补足体积。扩增条件为:94℃ 3 min,94℃ 30s,相应退火温度(表2)30s,72 ℃ 30s,35 个循环,72 ℃ 5 min。扩增产物采用2%琼脂糖凝胶电泳检测。

表2 通用引物序列及扩增产物大小Table 2 The sequences and products size of universal primers
2 结果与分析
使用表2中3对引物对4种方法提取的DNA进行PCR扩增,扩增产物的琼脂糖凝胶电泳图如图1~图3所示。
从图1、图2可以看出,对于鲜猪肉和7种罐头样品,异硫氰酸胍法提取的DNA,均能利用引物扩增出244 bp和376 bp的片段,且条带整齐明亮。相比较,EE101-02 DNA提取试剂盒提取的DNA,只有部分罐头样品的DNA可以利用引物扩增出目的片段,且条带暗淡微弱。对于CTAB法和SDS法提取的DNA,有少数罐头样品的DNA不能利用引物扩增出244 bp和376 bp的目的片段。
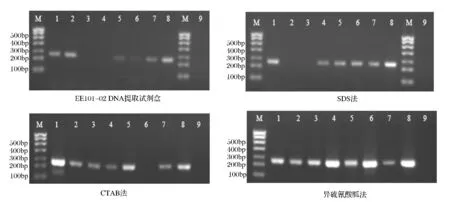
图1 使用引物L2513/H2714(244 bp)扩增4种方法提取DNA结果Fig.1 Amplification results of primer L2513/H2714(244 bp)

图2 使用引物L14181/H15149(376 bp)扩增4种方法提取DNA结果Fig.2 Amplification results of primer L14181/H15149(376 bp)
从图3可以看出,对于4种方法提取7种猪肉类罐头的DNA,利用引物mcb398/mcb869进行PCR扩增,大部分样品电泳未见大小为472 bp的目的片段。而对于鲜猪肉,4种方法提取的DNA均能扩增出目的片段。这是由于罐头加工过程中,高温高压使DNA断裂、降解,不易扩增到大片段基因。但是对于云腿大片罐头,CTAB法、SDS法和异硫氰酸胍法提取的DNA均可以扩增出472 bp的目的片段,这是因为云腿大片罐头的杀菌条件是95℃下加热100 min[16],较低的杀菌温度减少了DNA的破坏。
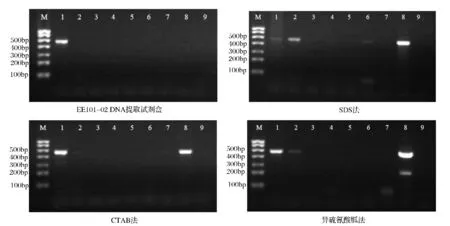
图3 使用引物mcb398/mcb869(472 bp)扩增4种方法提取DNA结果Fig.3 Amplification results of primer mcb398/mcb869(472 bp)
表3汇总了不同方法提取样品DNA的PCR扩增结果。可以看出,对于同一样品,不同方法提取DNA的效果差异明显。
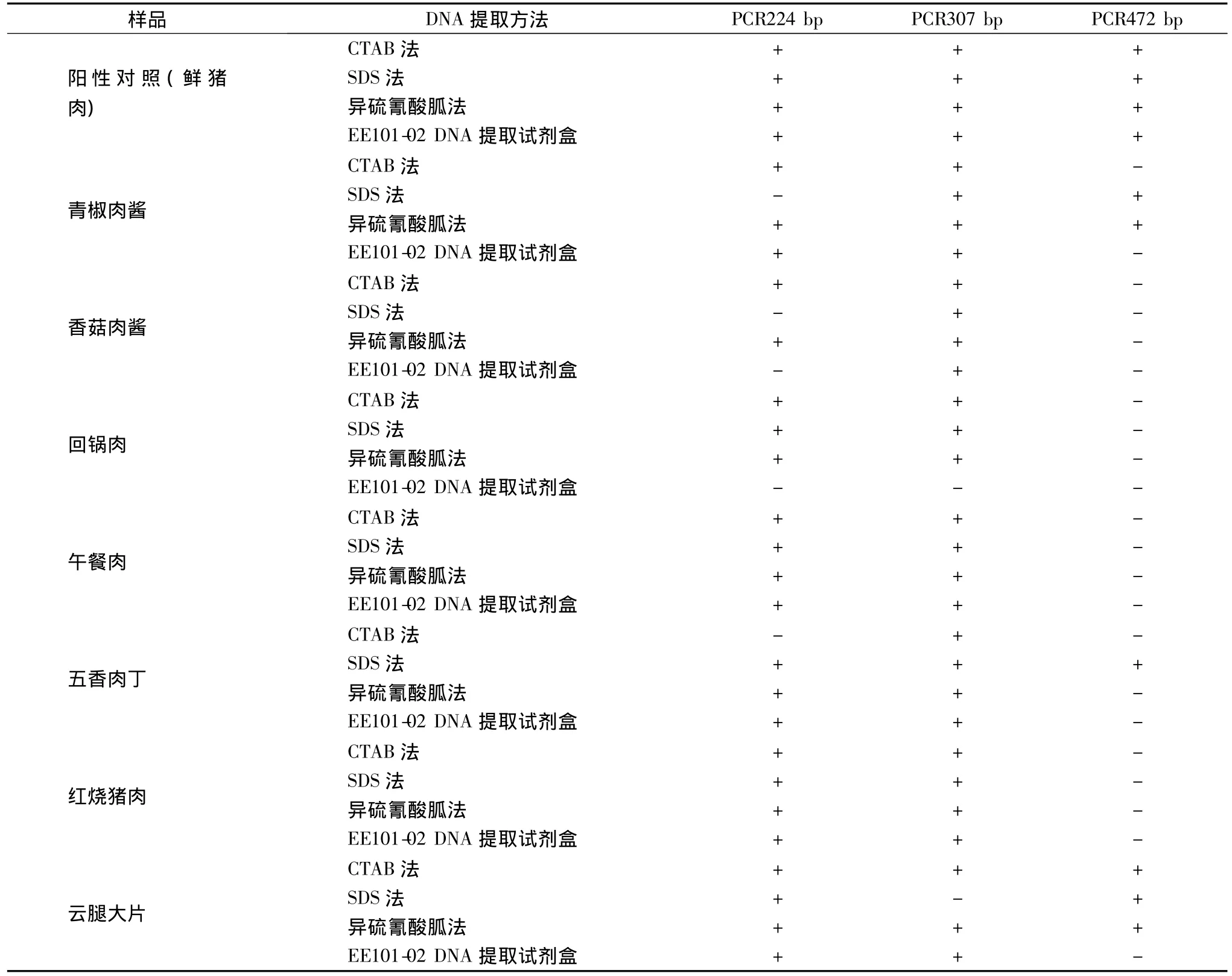
表3 四种方法提取各样品总DNA PCR情况汇总Table 3 Amplification results of the total DNA extracted by four methods
表4列出了4种方法提取DNA的原理及其操作所需时间。综上,对于猪肉类罐头产品,异硫氰酸胍法提取DNA的质量最好,可以满足后续PCR试验的要求,且操作简便,花费时间短。

表4 四种方法提取DNA的原理及操作时间Table 4 The principle and time of four DNA extraction methods
对以上样品利用L14181/H15149扩增其Cyt b部分序列,扩增PCR产物送至上海生工生物公司进行测序。将测序结果与Genbank中参考序列比对,结果显示7种罐头样品与猪(Sus scrofa)(GenBank登录号:NC_000845.1)的相似度为98%。表明所用7种猪肉类罐头含有猪源性成分。
3 讨论
提取质量合格的DNA是利用分子生物学方法鉴别肉制品动物源成分的第一步,也是关键的一步。特别是对于肉类罐头食品,由于加工过程中添加了调味料,并经过长时间的高温高压杀菌过程,其DNA破坏程度要比一般加工食品更为严重[7,17-18]。动物细胞中,每个细胞中有数百个线粒体,每个线粒体包含多份拷贝的DNA,在数量上远超核DNA,另外,线粒体DNA长度远短于核DNA,这些特点使线粒体DNA适用于加工食品的分析[19]。本研究中,从所选7种猪肉类罐头产品中都可以扩增出最高376 bp的线粒体基因片段,但是当目的片段增大到472 bp时,只有3种罐头样品可以扩增出目的片段。
在DNA提取过程中,目前应用最多的DNA提纯方法仍然是传统的酚三氯甲烷抽提法,主要是利用苯酚使蛋白质变性,使蛋白质溶于酚相,DNA溶于水相。但是使用苯酚有非常大的缺点。苯酚属高毒类,对皮肤和黏膜有强烈的腐蚀性,能经皮肤和黏膜吸收而造成中毒。而且由于实验使用的苯酚为商品酚,易被氧化产生醌、二酸,可破坏核酸的二酯键,并引起DNA链的交联[20]。在本试验中,DNA的纯化舍弃苯酚,直接采用三氯甲烷异戊醇体系,减少了操作时间,并降低了试验给操作人员带来的安全风险。试验结果表明,使用三氯甲烷异戊醇体系仍可以从猪肉类罐头这种深加工食品中提纯合格质量的DNA。
4 结论
为了能在DNA受损严重的罐头食品中提取到片段较大、质量较好的DNA,使用PCR片段大小梯度扩增手段对4种方法的提取DNA效果进行比较。试验结果显示,异硫氰酸胍法在4种方法中提取DNA的效果最好,且操作简便,不需要水浴,提取时间短,成本低廉,可以满足后续PCR试验的要求。
[1] 刘万臣,唐晓敏,崔建华,等.应用等电聚焦电泳鉴别动物肉种类的研究[J].兽医大学学报,1993(2):177-178.
[2] Toorop R,Murch S J,Ball R O.Development of a rapid and accurate method for separation and quantification of myofibrillar proteins in meat[J].Food Research International,1997,30(8):619-627.
[3] Ayob M K,Ragab A A,Allen J C,et al.An improved,rapid,ELISA technique for detection of pork in meat products[J].Journal of the Science of Food and Agriculture,1989,49(1):103-116.
[4] Buntjer J B,Lamine A,Haagsma N,et al.Species identification by oligonucleotide hybridisation:the influence of processing of meat products[J].Journal of the Science of Food and Agriculture,1999,79(1):53-57.
[5] 陈颖,吴亚君.基因检测技术在食品物种鉴定中的应用[J].色谱,2011(7):594-600.
[6] 李文静,李燕俊.分子学方法鉴定肉制品种属来源的研究进展[J].国外医学:卫生学分册,2009(3):151-158.
[7] Besbes N,Fattouch S,Sadok S.Comparison of methods in the recovery and amplificability of DNA from fresh and processed sardine and anchovy muscle tissues[J].Food Chemistry,2011,129(2):665-671.
[8] 张丽,杨莲茹,吴绍强.核酸提取方法的研究进展[J].中国动物检疫,2011(12):75-78.
[9] 邵碧英,陈文炳,郑腾,等.动物产品中牛、羊源性成分多重PCR检测方法的建立[J].畜牧与兽医,2004,36(3):7-9.
[10] 何建文,韩建林,罗玉柱.利用不同方法从深加工牦牛肉产品中提取基因组DNA效果的比较[J].生物技术通报,2010(10):162-167.
[11] GB/T 21101-2007.动物源性饲料中猪源性成分定性检测方法 PCR方法[S].
[12] Besbes N,Fattouch S,Sadok S.Differential detection of small pelagic fish in Tunisian canned products by PCRRFLP:An efficient tool to control the label information[J].Food Control,2012,25(1):260-264.
[13] Kitano T,Umetsu K,Tian W,et al.Two universal primer sets for species identification among vertebrates[J].International Journal of Legal Medicine,2007,121(5):423-427.
[14] Kocher T D,Thomas W K,Meyer A,et al.Dynamics of mitochondrial DNA evolution in animals:amplification and sequencing with conserved primers[J].Proceedings of the National Academy of Sciences,1989,86(16):6 196-6 200.
[15] Verma S K,Singh L.Novel universal primers establish identity of an enormous number of animal species for forensic application[J].Molecular Ecology Notes,2003,3(1):28-31.
[16] 杨邦英.罐头工业手册[M].北京:中国轻工业出版社,2002.
[17] Chapela M I A J,Sotelo C G,P E Rez-Mart I N R I,et al.Comparison of DNA extraction methods from muscle of canned tuna for species identification[J].Food Control,2007,18(10):1 211-1 215.
[18] Mackie I M,Pryde S E,Gonzales-Sotelo C,et al.Challenges in the identification of species of canned fish[J].Trends in Food Science & Technology,1999,10(1):9-14.
[19] Jocelyn E Krebs,Elliott S Goldstein,Stephen T Kilpatrick.Lewin基因X[M].北京:科学出版社,2013.
[20] 鲍毅新,孙波,张龙龙,等.对动物组织DNA提取方法的改进及PCR检测[J].浙江师范大学学报:自然科学版,2009(3):317-321.
