木糖异构酶酿酒酵母孢子“微胶囊”的构建及酶学性质分析*
2015-12-25李毅李子杰中西秀树高晓冬
李毅,李子杰,中西秀树,高晓冬
(江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡,214122)
酿酒酵母二倍体细胞在氮源缺乏且非发酵性碳源存在下,停止营养生长同时启动“产孢程序”,形成单倍体孢子[1-2]。与酿酒酵母营养细胞细胞壁相比,孢子壁包含有4种不同结构,从内到外依次为甘露糖层、β-葡聚糖层、壳聚糖层和二酪氨酸层。酿酒酵母孢子是一种休眠细胞,孢子壁所特有的二酪氨酸层和壳聚糖层结构,尤其是二酪氨酸层,赋予孢子能够抵御多种环境压力的特性[2-5]。基因DIT1参与二酪氨酸在胞质中的合成反应即催化L-酪氨酸形成二酪氨酸,敲除DIT1基因将导致二酪氨酸层不能形成,因而dit1Δ孢子不含有二酪氨酸层[4]。osw2Δ孢子虽然具有二酪氨酸层,但是表现出乙醚敏感性,可能是由于OSW2基因的缺失导致二酪氨酸层的网状结构大小发生改变[6]。
D-木糖异构酶(XI,EC 5.3.1.5)是木糖代谢的关键酶,在工业上催化葡萄糖(木糖)到果糖(木酮糖)的转化。为了赋予酵母代谢木糖的能力,多种来源的XI在酵母中进行表达,但目前只有来源于Clostridium phytofermentans、Piromyces sp.strain E2、Thermus thermophilus、Orpinomyces、Clostridium cellulovorans的几种XI具有生物活性[7-11]。但是,本文中将来源于 Clostridium phytofermentans和 Clostridium cellulovorans密码子优化后的xylA基因以及直接从Thermus thermophilus扩增的xylA基因在酿酒酵母细胞中表达,只有来源于Thermus thermophilus的基因检测到对D-葡萄糖的催化活性。嗜热菌Thermus thermophilus来源的XI首次在酿酒酵母实现了活性表达,在85℃具有催化D-葡萄糖生成D-果糖的最高活性[11]。该酶的研究应用主要集中两个领域:一方面在分子基础上的改造,降低其最佳催化温度,利于酿酒酵母中异源表达发酵木糖生产酒精[12-13];另一方面,作为一种嗜热酶的模型,对其耐热机理方面进行研究[14]。酿酒酵母孢子“微胶囊”这一全新固定化酶技术是根据酿酒酵母在产孢前孢子膜形成过程中,改变了分泌蛋白的分泌途径,使得高尔基体囊泡运输到前孢子膜,从而使蛋白定位在前孢子膜间隙中,在孢子壁组装和前孢子膜外膜裂解过程中蛋白会被包埋在孢子壁中[2,15]。
本研究拟利用酿酒酵母孢子“微胶囊”这一全新固定化酶技术将来源于嗜热细菌Thermus thermophilus HB8的D-木糖异构酶以分泌形式表达固定到孢子壁上壳聚糖和二酪氨酸之间的周质间隙,并以游离表达的XI作为对照,研究其酶学性质。
1 材料与方法
1.1 菌株和质粒
酿酒酵母AN120野生型菌株,osw2Δ缺陷型菌株,dit1Δ缺陷型菌株以及质粒相关信息见表1。
1.2 培养基
LB培养基:酵母浸出粉10 g,胰蛋白胨10 g,NaCl 10 g,琼脂粉20 g(固体),加水定容至1 L,121℃高压灭菌20 min。
YPD培养基:酵母浸出粉10 g,蛋白胨20 g,加水至900 mL,121℃高压灭菌20 min,使用前加入100 mL单独灭菌的200 g/L葡萄糖。
SD-Trp培养基:无氨基酵母氮源(YNB)6.7 g,琼脂粉20 g(固体培养基),加水至900 mL,121℃高压灭菌20 min,使用前分别加入100 mL单独灭菌的200 g/L的葡萄糖和2 g缺少色氨酸(Trp)的氨基酸混合物。
YPA培养基:酵母浸出粉10 g,蛋白胨20 g,醋酸钾20 g,加水定容至1 L,121℃高压灭菌20 min。
产孢培养基:醋酸钾20 g,加水定容至1 L,121℃高压灭菌20 min。
1.3 质粒构建
为了使带有SPR1基因的分泌信号肽序列(ss)的木糖异构酶基因xylA在TEF2基因强启动子TEF作用下以分泌形式表达,构建表达载体pRS424-TEFpr-ssxylA如下:以pRS424-TEFpr-ss-GFP为模板,HXO-153和xylA-R1为引物,PCR扩增得到信号肽序列ss片段。以纯化后的ss和xylA-R2为引物,T.thermophilus HB8的基因组为模板,PCR扩增得到ss-xylA片段。用SpeI和EcoRI限制性内切酶分别对ss-xylA片段和载体pRS424-TEFpr进行双酶切,16℃过夜连接,将连接产物转化大肠杆菌DH5α感受态细胞,涂布LB氨苄抗性平板,得到阳性单克隆。为了构建带有3×HA标签的重组质粒 pRS424-TEFpr-ss-xylA-3HA,先以 HA-F和HA-R为引物,pFA6a-3HA-His3MX6为模板,PCR扩增得到3×HA片段,然后再以3×HA片段和HXO153为引物,PRS424-TEFpro-ss-xylA为模板,PCR扩增得到ss-xylA-3HA片段。将得到的ss-xylA-3HA片段和载体pRS424-TEFpr分别用SpeI和EcoRI双酶切,将连接产物转化大肠杆菌DH5α感受态细胞,涂布LB氨苄抗性平板,得到阳性单克隆。为构建重组质粒pRS424-TEFpr-ss-GFP-xylA,以xylA-F2和xylA-R2为引物PCR扩增得到xylA片段,用PstI和EcoRI对xylA片段双酶切后连接到pRS424-TEFpr-ss-GFP上。为构建重组质粒pET28a-xylA得到游离表达的XI纯酶,以xylA-F1和xylA-R2为引物,T.thermophilus HB8的基因组为模板,PCR扩增得到xylA片段,经NdeI和EcoRI双酶切后连接到表达载体pET-28a上。

表1 本研究中所用的菌株和质粒Table 1 Strains and plasmids used in this study

表2 本研究中的引物Table 2 Primers used in this study
1.4 木糖异构酶在大肠杆菌BL21(DE3)中的表达和纯化
将重组质粒pET28a-xylA转化大肠杆菌BL21(DE3),挑取正确转化子到含有卡那霉素的LB培养基中过夜培养。将2 mL培养液转接到卡那霉素终浓度为50 μg/mL的100 mL LB培养基中,37℃培养,待OD600约为0.8时,加入IPTG至终浓度0.1 mmol/L,于16℃诱导表达20 h。将细胞收集之后用10 mL平衡缓冲液(pH 7.5,50 mmol/L Tris-HCl,100 mmol/L NaCl,10 mmol/L咪唑)重悬,置于冰上超声破碎,12 000 g离心30 min收集上清液,利用镍亲和层析柱纯化上清中的XI。首先用平衡缓冲液平衡柱子,然后上样使上清液以约1 mL/min的流速流过镍柱。上样完毕后先用平衡缓冲液洗掉以较小吸附力结合在柱子上的杂蛋白,然后用洗脱缓冲液(pH 7.5,50 mmol/L Tris-HCl,100 mmol/L NaCl,500 mmol/L 咪唑)洗脱、收集目的蛋白,并用超滤管进行脱盐和浓缩,取样进行SDS-PAGE检测,蛋白浓度用BCA蛋白试剂盒检测。
1.5 木糖异构酶在酿酒酵母孢子上的表达、固定及孢子纯化
将重组质粒pRS424-TEFpr-ss-xylA分别转化酿酒酵母AN120野生型菌株、osw2Δ和dit1Δ缺陷型菌株,将酵母阳性转化子转接到5 mL SD-Trp液体培养基,30℃过夜培养后将1 mL培养液转接到50 mL YPA培养基,30℃下摇床培养12 h,8 000 g离心1 min收集菌体,用无菌水洗涤2次后将菌体重悬在50 mL 2%的醋酸钾培养基中,30℃下摇床培养24 h产孢。为了确保单个孢子能够从子囊壳中释放出来,将上述培养好的子囊孢子进行酶处理和超声破碎。具体过程如下:8 000 g离心1 min收集子囊孢子,然后用1×PBS缓冲液洗涤孢子并重悬在相同缓冲液中,充分混匀后加入lyticase(625 U/g湿细胞),30℃处理30 min后8 000 g离心1 min收集处理过的细胞,弃掉上层清液,细胞沉淀用1×PBS缓冲液洗涤2次,重悬于相同缓冲液中,充分混匀,超声破碎获得单个孢子。将破碎后的孢子悬浮液用Percoll密度梯度离心的方法进行纯化,各梯度的配比如下:(1)80%Percoll,10%0.5%Triton-X,10%2.5 mol/L 蔗糖;(2)70%Percoll,20%0.5%Triton-X,10%2.5 mol/L 蔗糖;(3)60%Percoll,30%0.5%Triton-X,10%2.5 mol/L 蔗糖;(4)50%Percoll,40%0.5%Triton-X,10%2.5 mol/L蔗糖。将不同浓度梯度的Percoll溶液按照从高浓度到低浓度依次加入到离心管中,最后加入孢子悬浮液,15 000 g离心30 min,孢子和碎片分层,孢子将会位于离心管的底部,将上层液体和细胞碎片除去得到纯化的孢子[17]。将纯化的孢子用无菌水洗涤2遍后,进行真空冷冻干燥得到孢子粉末。
1.6 荧光分析木糖异构酶在不同孢子壁上的定位
为了进一步验证XI是否表达在孢子壁上,将XI与绿色荧光蛋白GFP融合表达,在荧光显微镜下观察XI在孢子壁上的定位。将重组质粒pRS424-TEF-pr-ss-GFP-xylA分别转化酿酒酵母AN120野生型菌株,osw2Δ和dit1Δ缺陷型菌株,产孢过程同1.5,在尼康荧光倒置显微镜下,使用100×油镜观察,图像利用NIS-Element AR软件分析。
1.7 蛋白免疫印迹分析木糖异构酶在不同孢子壁上的表达
将重组质粒pRS424-TEFpr-ss-xylA-3HA转化酿酒酵母AN120野生型菌株,osw2Δ和dit1Δ缺陷型菌株,孢子的制备过程同1.5。将孢子重悬在8 mol/L尿素中,冰上超声破碎1 h,使孢子上的蛋白全部溶解在尿素中,12 000 g离心10 min,取上清用BCA蛋白浓度试剂盒测定蛋白浓度。以YPA培养基培养后的营养细胞作为对照,细胞破碎处理过程同孢子。最后取50 μg蛋白进行SDS-PAGE电泳检测,按照滤纸、PVDF膜、凝胶、滤纸由下到上的顺序叠放于电转仪(1.0 A,25 V,30 min),电转完成后用5%的脱脂牛奶封闭PVDF膜3 h并用TBST缓冲液(150 mmol/L NaCl、10 mmol/L Tris-HCl(pH 8.0)、体积分数0.05%的吐温)洗膜3次,然后用含有一抗(Rabbit anti-HA,1∶4 000稀释)的牛奶室温下孵育3 h。用TBST缓冲液洗膜3次后,用含有二抗(Goat anti-rabbit IgG HRP,1∶4 000稀释)的牛奶室温下孵育3 h。TBST清洗3次后,用ECL显色试剂盒对其进行显色。
1.8 木糖异构酶酶学性质测定
XI的酶活测定在1.5 mL的体系中进行,反应体系为100 mmol Tris-HCl缓冲液(pH 7.0)、2 g/L D-葡萄糖、10 mmol/L MnCl2。向反应体系中加入10 mg孢子(或3 μg游离酶)起始反应,在85℃下反应5 h后,沸水浴10 min终止反应。XI的酶活用高效液相色谱(HPLC)(HITACHI chromaster)进行分析,检测条件为:Bio-Rad Aminex HPX-87H色谱柱(300 mm×7.8 mm),流动相为5 mmol/L H2SO4,流速为0.5 mL/min,柱温60℃,5450示差检测器。为了测定pH对XI酶活的影响,使用两种缓冲液在85℃、不同pH条件下测定酶活。2种缓冲液分别为醋酸缓冲液(100 mmol/L,pH 5.0 和 6.0)、Tris-HCl缓冲液(100 mmol/L,pH 7.0,8.0和9.0)。为了测定温度对XI酶活的影响,反应体系以100 mmol/L Tris-HCl(pH 7.0)作为缓冲液在不同温度下(60~95℃)测定酶活。酶活的相对活性定义为最大酶活的百分比。为了测定孢子微胶囊固定XI的重复利用性,分别称取10 mg冻干的3种孢子(野生型、osw2Δ和dit1Δ),按上述测定酶法的方法测定转化率,当反应结束后离心收集孢子,用超纯水洗涤2次后进行下一次转化率测定,共测定5次。
2 结果与讨论
2.1 木糖异构酶在大肠杆菌BL21(DE3)中的表达和纯化
为了比较XI游离酶和孢子“微胶囊”XI固定化酶的酶学特性,首先在大肠杆菌BL21(DE3)中表达并纯化了游离的XI。为了纯化方便,在XI的N端设计了6×His的标签。从SDS-PAGE上来看,纯化得到的木糖异构酶分子质量在40 kDa左右(图1),与预测的大小43.9 kDa相近,并且纯度达到90%以上。

图1 SDS-PAGE检测木糖异构酶的表达与纯化Fig.1 SDS-PAGE analysis of XI expression and purification
2.2 荧光分析木糖异构酶在不同孢子壁上的定位
为了更加直观地观察XI在孢子壁上的表达和定位,将XI与GFP进行融合表达,通过GFP的荧光定位来确定XI的位置。从图2中可以看到,对于野生型孢子和osw2Δ孢子来说,能够清晰地看到GFP绿色荧光信号可以完好地包裹在未破子囊壁的孢子壁上,说明XI成功地表达在孢子壁上。相对于野生型孢子和osw2Δ孢子,dit1Δ孢子由于二酪氨酸层的缺失导致GFP信号强度稍弱,但仍可以观察到融合蛋白表达定位到孢子壁上。

图2 GFP标记的XI在孢子上的定位Fig.2 Localization of GFP-XI fusion protein in yeast spores
2.3 蛋白免疫印迹分析木糖异构酶在不同孢子壁上的表达水平
为了研究XI在不同类型孢子(营养细胞作为对照)的表达水平差异,将带有3×HA标签的XI在相应孢子中表达。从图3中可知,相对于营养型细胞,孢子可以明显包埋固定更多量的酶。野生型孢子和osw2Δ孢子表现出相对于dit1Δ更高的酶固定量,这与在dit1Δ孢子中表达的GFP-XI融合蛋白荧光信号较弱相一致,说明二酪氨酸层的存在可以在一定程度上能够阻止酶的泄漏表达。

图3 不同类型细胞的蛋白免疫印迹Fig.3 Western Blot of different cells
2.4 孢子“微胶囊”木糖异构酶酶学性质测定
尽管从GFP的荧光定位和western blot 结果可以确定XI成功地固定在孢子细胞壁上,但是由于细菌来源的蛋白表达、修饰不同于酿酒酵母,因此需要直接测定酶活来确定XI在孢子上是否具有催化活性。从图4 HPLC检测结果可以清楚地看到,底物D-葡萄糖在野生型孢子固定化酶的催化作用下可以转化为D-果糖。

图4 HPLC检测固定在孢子上的XI的催化反应Fig.4 HPLC analysis of the reaction of XI immobilized on spores
由于3种孢子孢子壁结构的不同以及高温反应条件下有降低固定效率的可能,因此以重复利用性为标准来确定固定化酶的稳定性。虽然dit1Δ孢子上的酶量低于野生型和 osw2Δ缺陷型(图3),但是dit1Δ孢子在第1次使用时表现出最高活性(图5)。然而,dit1Δ孢子在第2次及多次使用后酶活下降迅速,可能是高温破坏了酶与孢子的结合或者使结合不牢固的酶从孢子上脱离下来。相比较,虽然野生型和osw2Δ孢子由于二酪氨酸层的存在有效地阻止了酶的释放,但是该层的存在在一定程度上影响了底物和酶的接触。
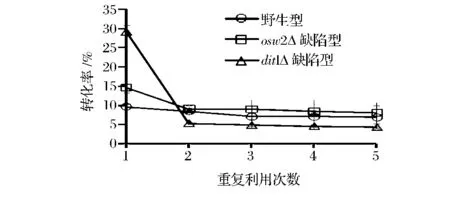
图5 XI在不同孢子上固定后的重复利用能力Fig.5 The reusabilities of XI immobilized on different spores
为了进一步了解XI固定在野生型和osw2Δ孢子上的酶学特性,分别检测了pH和温度对酶活的影响。首先,在不同pH条件下反应时,由图6可以看到,孢子固定化酶和游离酶的最适pH值均为pH 7.0,对于野生型和osw2Δ孢子虽然没有较大的pH耐受性差别,但孢子固定化酶相对于游离酶表现出范围较广的pH耐受性。同时,在不同温度条件下反应时,从图7可以看到,孢子固定化酶和游离酶的最适温度为85℃。值得注意的是,野生型和osw2Δ孢子固定化酶在95℃高温下的相对酶活都能达到最高酶活的60%。综合考虑,孢子壁中二酪氨酸层的存在,一方面能有效地阻止酶的释放,另一方面又可以提高酶对高温的耐受性。另外,根据osw2Δ孢子表现出来的酶学性质,改变二酪氨酸层的疏松程度还可以提高酶和底物的结合能力。
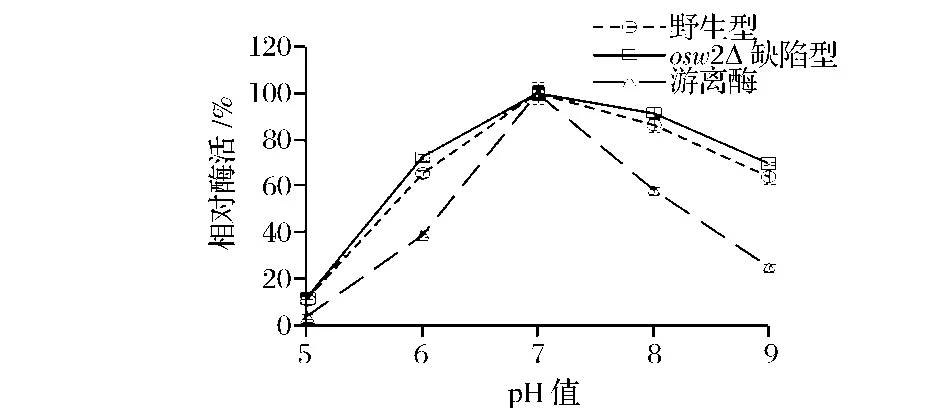
图6 pH对XI酶活的影响Fig.6 The effect of pH on the activity of XI

图7 温度对XI酶活的影响Fig.7 The effect of temperture on the activity of XI
3 结语
孢子“微胶囊”是一种新的酶固定化技术,通过分子生物学的方法使酶包埋在孢子壳聚糖层与二酪氨酸层之间,避免了蛋白纯化和体外固定化等操作,并具有较好的重复使用性。因此,在医药、保健及食品等方面具有广泛的应用价值。本研究中,木糖异构酶作为一种嗜热酶,由于其较高的反应温度,有效地避免了孢子在底物D-葡萄糖条件下萌发的可能,同时作为稀有糖D-阿洛酮糖合成的第一步,在接下来的工作中可以与第二步D-阿洛酮糖-3-差向异构酶结合,实现从相对低廉的底物D-葡萄糖向D-阿洛酮糖的转化。另外,发掘与孢子萌发相关的基因,避免孢子在应用过程中的萌发,以及深入研究与二酪氨酸层结构相关的基因,改变二酪氨酸层的疏松程度,在此基础上探索二酪氨酸层对酶的保护作用以及对底物分子的通透性,对于孢子“微胶囊”固定化酶系统的开发与利用具有重要意义。
[1] Neiman A M.Ascospore formation in the yeast Saccharomyces cerevisiae[J].Microbiol Mol Biol Rev,2005,69(4):565-584.
[2] Neiman A M.Sporulation in the budding yeast Saccharomyces cerevisiae[J].Genetics,2011,189(3):737-765.
[3] Briza P,Breitenbach M,Ellinger A,et al.Isolation of two developmentally regulated genes involved in spore wall maturation in Saccharomyces cerevisiae[J].Genes Dev,1990,4(10):1 775-1 789.
[4] Briza P,Winkler G,Kalchhauser H,et al.Dityrosine is a prominent component of the yeast ascospore wall.A proof of its structure[J].J Biol Chem,1986,261(9):4 288-4 294.
[5] Pammer M,Briza P,Ellinger A,et al.DIT101(CSD2,CAL1),a cell cycle-regulated yeast gene required for synthesis of chitin in cell walls and chitosan in spore walls[J].Yeast,1992,8(12):1 089-1 099.
[6] Shi L,Li Z,Tachikawa H,et al.Microencapsulation of enzymes using yeast spores[J].Appl Environ Microbiol,2014,80(15):4 502-4 510.
[7] Brat D,Boles E,Wiedemann B.Functional expression of a bacterial xylose isomerase in Saccharomyces cerevisiae[J].Appl Environ Microbiol,2009,75(8):2 304-2 311.
[8] Kuyper M,Harhangi H R,Stave A K,et al.High-level functional expression of a fungal xylose isomerase:the key to efficient ethanolic fermentation of xylose by Saccharomyces cerevisiae?[J].FEMS Yeast Res,2003,4(1):69-78
[9] Madhavan A,Tamalampudi S,Ushida K,et al.Xylose isomerase from polycentric fungus Orpinomyces:gene sequencing,cloning,and expression in Saccharomyces cerevisiae for bioconversion of xylose to ethanol[J].Appl Microbiol Biotechnol,2009,82(6):1 067-1 078.
[10] Ota M,Sakuragi H,Morisaka H,et al.Display of Clostridium cellulovorans xylose isomerase on the cell surface of Saccharomyces cerevisiae and its direct application to xylose fermentation[J].Biotechnol Prog,2013,29(2):346-351.
[11] Walfridsson M,Bao X,Anderlund M,et al.Ethanolic fermentation of xylose with Saccharomyces cerevisiae harboring the Thermus thermophilus xylA gene,which expresses an active xylose(glucose)isomerase[J].Appl Environ Microbiol,1996,62(12):4 648-4 651.
[12] Lönn A,Gardonyi M,van Zyl W,et al.Cold adaptation of xylose isomerase from Thermus thermophilus through random PCR mutagenesis[J].European Journal of Biochemistry,2002,269(1):157-163.
[13] Karhumaa K,Hahn-Hägerdal B,Gorwa-Grauslund M F.Investigation of limiting metabolic steps in the utilization of xylose by recombinant Saccharomyces cerevisiae using metabolic engineering[J].Yeast,2005,22(5):359-368.
[14] Chang C,Park B C,Lee D S,et al.Crystal structures of thermostable xylose isomerases from Thermus caldophilus and Thermus thermophilus:possible structural determinants of thermostability[J].Journal of molecular biology,1999,288(4):623-634.
[15] Suda Y,Rodriguez R K,Coluccio A E,et al.A screen for spore wall permeability mutants identifies a secreted protease required for proper spore wall assembly[J].PloS one,2009,4(9):e7 184.
[16] Zhang H,Tachikawa H,Gao X-D,et al.Applied uses of yeast spores as chitosan beads[J].Appl Environ Microbiol,2014,80(16):5 098-5 105.
[17] Kloimwieder A,Winston F.A screen for germination mutants in Saccharomyces cerevisiae[J].G3(Bethesda),2011,1(2):143-149.
