芜菁水溶性多糖的结构分析*
2015-12-25李雅双刘杰包瑛刘春兰
李雅双,刘杰,包瑛,刘春兰
1(中央民族大学生命与环境科学学院,北京,100081)2(北京市食品环境与健康工程技术研究中心,北京,100081)
近年来,对植物多糖的研究逐渐受到人们的重视。芜菁(Brassica rapa L.)是我国少数民族地区常见的医食两用植物,种子或根为其药用部分[1]。目前,对芜菁多糖的研究报道较少。不同品种,不同产地多糖含量的测定结果显示,产地可能对糖的代谢产生一定的影响[2]。目前对芜菁多糖结构研究的报道主要集中在芜菁多糖的单糖组成分析,对芜菁多糖结构进一步解析的报道不多。对于芜菁多糖活性的研究也主要集中在芜菁粗多糖抗氧化[3]、抗疲劳[4]、抗肿瘤[5]、降血糖[6]、抗癌变等方面的活性。新疆芜菁多糖的小鼠灌胃降血糖实验表明,芜菁多糖的剂量在400 mg/kg体重时,具有明显的降血糖作用[7];芜菁多糖的清除自由基实验表明,芜菁多糖及其纯化组分具有一定的抗氧化能力和还原能力,且对自由基的清除作用随浓度的升高增强,具有一定的量效关系。
研究表明十字花科蔬菜可预防多种癌症的发生,这可能与广泛存在于十字花科植物中的多糖及硫代葡糖糖苷等化学成分有关,如Lewis一致性肿瘤模型对恰玛古儿多糖体内抗肿瘤的初步研究[7]结果表明,恰玛古儿多糖高剂量组肿瘤生长抑瘤率为55%,配合环磷酞胺联合用药组抑瘤率为71%。本文利用化学、物理、生物学等方法,研究了十字花科芜菁水溶性多糖的结构及生物活性。
1 材料和方法
1.1 实验材料
实验材料为十字花科芸苔属芜菁(Brassica rapa L.)的干燥块根,产于河北廊坊。
1.2 仪器和试剂
UV-Jasco53型紫外分光光度计、GC-2014型毛细管气相色谱仪,日本岛津;Bruker Avance 600 MHz核磁共振谱仪,德国布鲁克;Nicolet Magna-IR 750傅里叶变换红外光谱仪,日本日立;QQQ7000气相色谱-质谱联用仪,美国Agilent公司;BS224S电子天平,德国赛多利斯科学仪器有限公司;HL-2S恒流泵,上海青浦沪西仪器厂;FC-95A馏分自动收集器,上海青浦沪西仪器厂;DCY-12G可调式氮吹仪,青岛海科仪器有限公司;KDY-9820型凯式定氮仪,北京瑞邦兴业;高效液相色谱仪、RI2041视差折光检测器,德国KNAUER;柱温箱,天津瑞迪弘欣科贸有限公司。
鼠李糖、木糖、阿拉伯糖、果糖、葡萄糖、甘露糖、半乳醛酸糖、半乳糖(BR,上海国药集团产品);氢氧化钠、乙醇、乙醚、乙酸酐、碳酸钡、水杨酸、苯酚、三氟乙酸、CaCl2(AR,国药集团产品);正丁醇、H2SO4、甲醇、CHCl3、乙二醇、NaIO4、NaIO3、邻苯二甲酸、CaCl2、NH3·H2O、H3BO3、HCl(AR,北京化工厂产品);KBH4、甲苯、KI、冰乙酸、P2O5(AR,北京化学试剂公司产品);吡啶、I2、CuSO4、二氯甲烷、NaHCO3(AR,天津光复研究所产品);SepharoseCL-4B、DEAE-52、Sepha-dex G-100、Dextran 标准品(BR,MW50 000,20 000,40 000,70 000,100 000和2 000 000)(GE公司Pharmacia产品);透析袋(韩国Biosharp分装进口产品);蛋白酶(德国默克公司)。
1.3 实验方法
1.3.1 芜菁水溶性多糖的提取
取经乙醇回流脱脂,抽滤、风干后的芜菁粉末100 g,置于烧杯中,加3 000 mL的蒸馏水,80℃热水浸提2.5 h,抽滤。合并滤液,浓缩至1/3体积,离心、醇沉,沉淀于真空干燥器中干燥得芜菁粗多糖(WJc)[8]。
1.3.2 芜菁水溶性多糖的WJdp4-b的制备
将芜菁粗多糖配成2%的水溶液,经淀粉酶、链酶蛋白酶和Seveage法联合脱蛋白[9],用pH=2.5的酸性乙醇分级[10],得 WJdp4级分,取 30 mg WJdp4溶于3 mL超纯水,经DEAE-52(2.5 cm×60 cm)分离纯化,分别用超纯水、0.1、0.3、0.5、1.0、2.0 mol/L 的NaCl洗脱,每管收3.0 mL。苯酚-硫酸法显色,根据绘洗脱曲线收集,透析,浓缩,干燥。取所收集部分30 mg溶于3 mL 0.1 mol/L的NaCl中继续用Sephadex G-100(2.5 cm×60 cm)纯化,0.1 mol/L的NaCl洗脱。苯酚硫酸法检测多糖的分布情况,收集峰形较好的部分,浓缩,透析,加4倍体积的无水乙醇醇沉,常规干燥得级分WJdp4-b。
1.3.3 芜菁多糖纯度的鉴定、分子质量的测定
SephroseCL-4B(1.5 cm×90 cm)柱层析:取5 mg WJdp4-b溶于0.5 mL洗脱液上样,0.1 mol/L NaCl溶液洗脱,流速0.75 mL/min,每管2 mL收集,苯酚-硫酸法检测。
以Dextran T-series标准品(分子质量为5 000,20 000,40 000,70 000,100 000和2 000 000)及待测纯化芜菁多糖进行高效液相检测。横坐标为各标准糖的保留时间,纵坐标为分子质量的对数值,作出标准曲线。计算芜菁纯化多糖的相对分子质量。
分别用100%、10%的甲醇和0.1 mol/L NaNO3溶液(所用溶液均过滤膜,超生除气泡)清洗系统30 min。装柱,待基线平稳后上样,选择合适的浓度,用流动相溶解标准品和待测样品。根据所获标准曲线计算样品的分子量。
条件:OHpak SB-805HQ series凝胶柱(分子质量﹤4 ×106,8 mm ×300 mm);柱温,38 ℃;流动相,0.1 mol/L NaNO3;流速,0.8 mL/min;进样量,20 μL。
1.3.4 单糖组成分析
纸层析(PC)确定 WJdp4-b的单糖组成。称取WJdp4-b1 mg,加入 2 mol/L H2SO41.0 mL,封管,110℃下水解6 h,冷却后加入BaCO3中和,点样于层析纸(15 cm×35 cm)上。展开12 h后晾干,反复3次,均匀的喷上显色剂,置110℃烘箱内加热10~15 min后显色。标准糖样在相同条件下进行纸层析。
展开剂:V(乙酸)∶V(正丁醇)∶V(水)=1∶4∶5,待混合相分离后,取上层正丁醇溶液。
显色剂:苯胺-邻苯二甲酸正丁醇饱和水溶液。
WJdp4-b进行水解、还原、乙酰化处理后进行GC分析,测得各组分单糖的组成[11]。色谱条件:Rtx-225毛细管柱(30 m×0.32 mm×0.25 μm);柱温:100℃→230℃,程序升温5℃/min,保留时间30 min;载气:氢气;线速为48 cm/s,分流比10∶1;检测器:FID。
1.3.5 结构分析
1.3.5.1 红外光谱分析及核磁图谱分析
称取 1 mg WJdp4-b、10 mg KBr,混合研磨压片,SPECORD IR 型红外光谱仪在400~4000 cm-1内扫描[12]。
1.3.5.2 部分酸水解
纯化后的WJdp4-b25 mg加入0.1 mol/L的TFA 10 mL,100℃水解2 h,氮气吹干除去TFA,超纯水溶解,超纯水中透析48 h。袋内部分用3倍体积的乙醇醇沉,醇沉部分常规干燥,上清部分蒸干;袋外部分除去透析液,干燥,待进行GC分析[13-15]。
1.3.5.3 高碘酸氧化和Smith降解
准确称取25 mg WJdp4-b样品按[16]进行高碘酸氧化、Smith降解,透析,透析后对袋内外的产物进行GC分析。
1.3.5.4 甲基化分析
真空干燥的WJdp4-b2 mg溶解于二甲基亚砜溶液(60℃减压蒸馏)中。加入NaOH-DMSO和碘甲烷各0.2 mL[17],重复3次,IR检测无羟基峰为止。
甲基化的糖样残渣,进行与GC分析相同的水解、还原和乙酰化反应,得可气化的衍生物,待气相色谱-质谱(GC-MS)分析。
他进入客厅,见卧室门从里面锁死,便从窗户爬进卧室,发现薛教授已经死在床上。房间内一切如常,锁孔上还插着一把钥匙。钥匙上留下的拇指、食指指纹同薛教授的指纹一致,看起来像是他反锁门后自杀的。
条件:DB-5 column(30 m×0.25 mm×0.25 m),程序升温80~200℃(5℃/min),到215℃(2℃/min)最后升温到270℃(20℃/min),保留5 min。
1.4 WJdp4-b的降血糖活性筛选
Balb/c3T3细胞检测液洗2次,种于96孔板,37℃、5%CO2孵育一定时间后。加样品或Insulin(终浓度30nM,阳性对照),37℃、5%CO2孵育。按葡萄糖氧化酶法进行上清中的葡萄糖含量测定,促葡萄糖吸收按下列公式计算。
葡萄糖促吸收率/%=[(空白对照OD405-样品OD405)/(空白对照OD405-本底OD405)]×100
2 结果与分析
2.1 芜菁水溶性多糖的提取及分离纯化
芜菁块根粉末经体积分数95%乙醇回流脱脂、抽滤、挥干溶剂,热水浸提醇沉得芜菁水溶性粗多糖WJc。WJc脱淀粉脱蛋白后得WJdp,酸性乙醇分级得WJdp4。
WJdp4经DEAE-52(2.5 cm × 90 cm)柱层析,苯酚-硫酸法检测,收集0.1 mol/L NaCl梯度洗脱部分,将所收集部分经Sephadex G-100(2.5 cm×60 cm)柱层析,苯酚-硫酸法检测,收集,得WJdp4-b。
2.2 芜菁水溶性多糖的纯度鉴定
WJdp4-b经Sepharose CL-4B(1.5 cm × 90 cm)柱层析,苯酚-硫酸法检测得单一对称峰,HPLC检测为单一对称峰(图1、图2)。高效液相法测纯化多糖的分子质量,横坐标为各标准品HPLC的保留时间,纵坐标为标准品的分子质量对数,得回归方程y=-0.713 5x+13.262,R2=0.995 3计算得芜菁纯化多糖WJdp4-b的相对分子质量约为10 840。

图1 WJdp4-b的Sepharose CL-4B柱层析谱图Fig.1 Chromatogram of WJdp4-bon Sepharose CL-4B
2.3 芜菁水溶性多糖的组成分析
WJdp4-b经PC和GC分析,显示WJdp4-b的单糖组成为鼠李糖(Rha)、阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc),相对摩尔比为 1.0∶1.0∶10∶9.0(与标准单糖图比对)。艾克拜尔江·阿巴斯[18]用传统的水提醇沉方法所获得的新疆芜菁多糖经DEAE-52柱层析,分得7个组分,各组分多糖的GCMS分析结果显示,均由鼠李糖、木糖、阿拉伯糖、果糖、葡萄糖和核糖6种单糖组成。谢月[19]等芜将菁块根中的水溶性多糖进行纯化分得3个组分,其单糖组成情况为:BRP1-1由阿拉伯糖和葡萄糖组成;BRP2-1由阿拉伯糖、半乳糖、葡萄糖组成;BRP3-1由阿拉伯糖、鼠李糖、半乳糖和葡萄糖组成。说明产地可能对芜菁多糖的单糖组成产生影响。
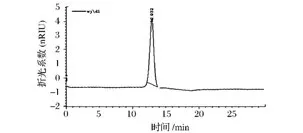
图2 WJdp4-b的高效液相凝胶色谱图Fig.2 HPLC of WJdp4-b
2.4 芜菁水溶性多糖的结构解析
2.4.1 红外光谱分析
多糖WJdp4-b在红外光谱仪400~4 000 cm-1扫描,结果见图3。

图3 WJdp4-b的红外谱图Fig.3 IR spectrum of WJdp4-b
3 600~3 200,3 000~2 800和1 400~1 000 cm-1的吸收峰分别代表O-H、C-H伸缩振动和C-H弯曲振动[20],3 423.10 cm-1代表多糖的O-H伸缩振动吸收峰,2 932.11 cm-1是C-H的伸缩振动吸收峰。1 200~1 000cm-1的吸收峰表明含有吡喃糖环,WJdp4-b在1 038.84 cm-1处有吸收峰,表明WJdp4-b含有吡喃糖。1 415.54 cm-1为C-O伸缩振动吸收峰[21],1 617.60 cm-1为结合水吸收峰[22]。850 cm-1与890 cm-1处分别为α和β型糖苷键的吸收峰,根据所得的红外图谱,在850 cm-1与890 cm-1处有吸收峰,说明WJdp4-b含有α和β两种糖苷键[23]。
2.4.2 部分酸水解
部分酸水解的原理是根据有些多糖的支链比多糖的主链容易被酸水解[13],且由呋喃环连接的糖苷键比吡喃环链接的糖苷键较容易被酸水解,或者如果多糖链中含有糖醛酸或者糖醛酸较密集,也能抵抗酸水解[24]。WJdp4-b经部分酸水解后透析,得到袋内部分进行醇沉,得到上清WJdp4-b-1和醇沉WJdp4-b-2两部分,以及袋外的部分WJdp4-b-3,将得到的3部分进行GC分析(图4~图6),分析结果见表1。

图4 部分酸水解上清部分气相色谱图Fig.4 GC spectrum of WJdp4-b-1

图5 部分酸水解醇沉部分气相色谱图Fig.5 GC spectrum of WJdp4-b-2
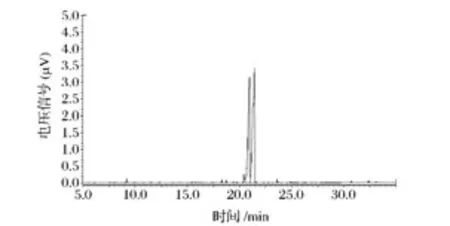
图6 部分酸水解袋外部分气相色谱图Fig.6 GC spectrum of WJdp4-b-3

表1 多糖WJdp4-b部分酸水解Table 1 Partial acid hydrolysis of WJdp4-b
从表1可以看出,袋内沉淀部分主要检测出Man和Glc,所以WJdp4-b在部分酸水解时,Man和Glc几乎没有被水解掉,因而从部分酸水解的结果可以看出,Man和Glc可能位于WJdp4-b的主链上。袋外检测到Rha和 Ara,说明分子的分支部分可能由Rha和Ara组成。
2.4.3 高碘酸氧化和Smith降解
WJdp4-b进行高碘酸氧化,经紫外光谱在223 nm检测反应完全后,测得每摩尔己糖消耗1.201 1 moL IO4-,大于释放甲酸量(0.432 2 moL)的2倍,表明其除1→(末端)及1→6糖基外,尚有可被高碘酸氧化但不产生甲酸的 1→2,1→2、6,1→4,1→4、6糖基,可氧化糖基占76.88%,不可氧化糖基占20.12%。
高碘酸氧化后的产物经Smith降解,经GC分析,测得透析袋内含有 Man、Glc,推测 WJdp4-b的 Man、Glc存在不与高碘酸反应的键型,因此推测Man、Glc含有1→3,1→2、3,1→2、4,1→3、4,1→3、6,1→2、3、4键型。
在袋外部分检出赤藓醇,表明Man、Glc可能存在1→4,1→4、6 键型;检出甘油,说明 Man、Glc可能存在 1→,1→2,1→6,1→2、6 键型,也可能是 Rha、Ara存在吡喃型的1→、1→4键型,或呋喃型的1→、1→5 键型[27]。
2.4.4 甲基化分析
确定糖苷键的位置,对甲基化的多糖WJdp4-b经水解、还原、乙酰化后的产物作气相色谱-质谱分析,结果列于表2和图7。根据甲基化产物可知WJdp4-b主链由Glc构成,Glc主要以(1→3)糖苷键连接,且在6位处有分支,平均每17个糖残基有12个分枝,支链由Ara、Man、Glc构成,连接方式为:Ara以1→4或1→5连接,Man以1→3,1→6连接,Glc以1→4连接;Rha和Glc构成了末端。
2.4.5 核磁图谱分析WJdp4-b
以Bruker Avance 600 MHz核磁共振谱仪检测,得1H NMR谱图(图8),一般情况下。WJdp4-b在4.6~5.5 ppm 间有 δ4.62、5.01、5.17、5.32 ppm 4 个信号[25],说明 WJdp4-b由 4 种单糖组成,这与 GC 的分析结果一致。α型吡喃糖H-1质子化学位移大于4.95 ppm,β型吡喃糖H-1质子化学位移小于4.95 ppm[25],说明 WJdp4-b存在 α 和 β 两种糖苷键,这与红外的分析结果一致。
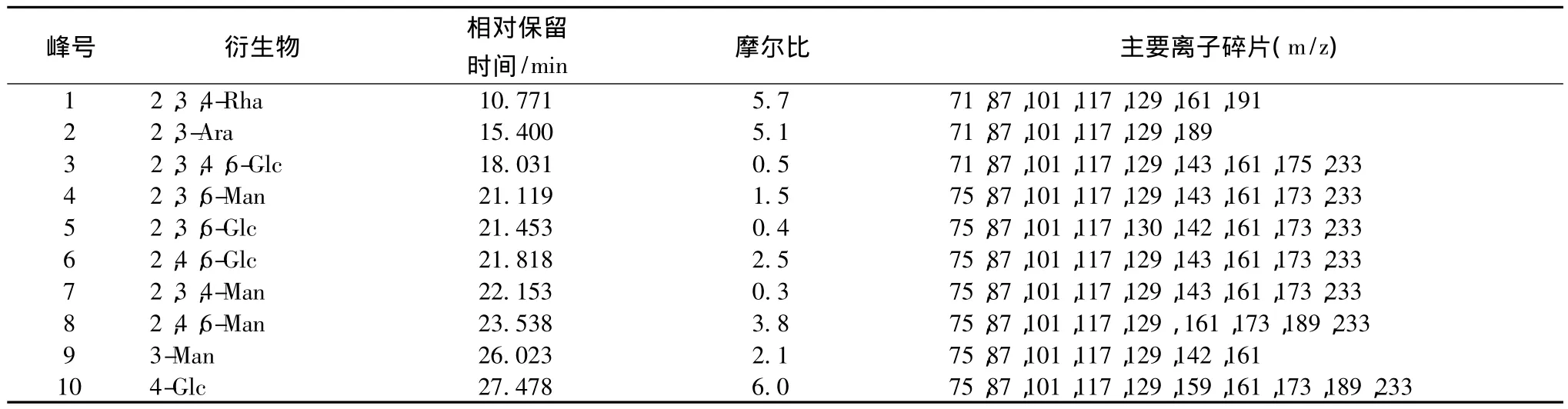
表2 WJdp4-b甲基化产物GC-MS结果分析Table 2 Methylation and GC-MS analysis of WJdp4-b
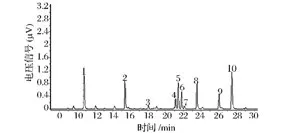
图7 WJdp4-b甲基化产物GC-MS谱图Fig.7 GC spectrum of methylated WJdp4-b
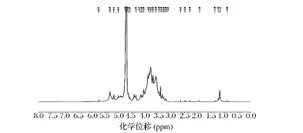
图8 多糖WJdp4-b的1H-NMR图Fig.8 1H-NMR spectrum of WJdp4-b
由13C NMR谱图(图 9)在 95~101ppm有103.39、100.00、99.74、98.56ppm 四个碳信号,小于101 ppm的吸收峰为α型吡喃糖,大于101 ppm的吸收峰为β型吡喃糖[26],这与红外和氢谱的分析结果一致。WJdp4-b的13C NMR谱在δ78.00~85.00 ppm有4个信号分别是 84.39,82.05,81.31,80.25,可以肯定C2、C3、C4中某一个碳上有取代。δ67.00 ~70.00 ppm有2个碳信号,说明6位C发生取代。84.39 ppm处有碳信号,表明发生了C3取代。这与高碘酸氧化和Smith降解的结果一致。WJdp4-b在δ160~180 ppm处无碳信号,说明WJdp4-b中无糖醛酸[27]。
2.5 WJdp4-b的降血糖活性
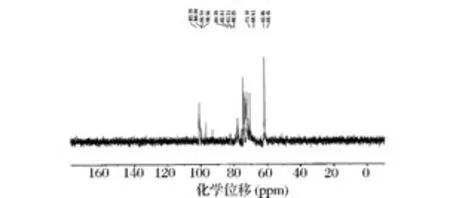
图9 多糖WJdp4-b的13C-NMR图Fig.9 13C-NMR spectrum of WJdp4-b
选择葡萄糖消耗筛选模型测定WJdp4-b的降血糖情况。WJdp4-b的浓度为30 nmol/L,所测得样品的葡萄糖促进吸收率为46.35%,阳性对照胰岛素的促进吸收率为57%(胰岛素的浓度为30 nmol/L)。WJdp4-b的促进吸收率接近于胰岛素,说明WJdp4-b对Balb/c3T3细胞的葡糖消耗有促进作用,芜菁多糖在降血糖方面可能具有胰岛素或胰岛素生长因子的作用。
3 结论
芜菁多糖经提取分离纯化得均一多糖WJdp4-b,分子质量约为10 840,经GC、IR、NMR、部分酸水解、高碘酸氧化和 Smith降解、甲基化分析,得多糖WJdp4-b为有分支结构,主链主要由Glc的(1→3)糖苷键连接,支链由Ara、Man、Glc构成,其中Ara以1→4或1→5连接,Man以1→3、1→6连接,Glc的1→4的连接构成,Rha和Glc构成了末端。WJdp4-b是多分支结构复杂的中性多糖。且降血糖的初步筛选实验表明,芜菁多糖具有一定的降血糖活性,但是对于芜菁降血糖活性的开发还需要进一步的实验研究。
[1] 杨永昌.藏药志[M].西宁:青海人民出版社出版,1991:95.
[2] 李雅双,连路宁,阿西娜,等.芜菁有效成分及生物活性的研究现状[J].时珍国医国药,2013,24(9)2 437-2 441.
[3] 李巧娟,肖春霞,张洪亮.维药恰玛古的研究现状[J].新疆中医药,2010,28(6):81-83.
[4] 刘艺.合阳蔓菁化学成分及药理活性研究[D].西安:陕西科技大学.2011,3-5.
[5] 候宝林.维药恰麻古儿多糖抗氧化及抗肿瘤作用的实验研究[D].乌鲁木齐:新疆医科大学,2010:4-8.
[6] 艾克拜尔江·阿巴斯,李冠,王静.新疆芜菁多糖降血糖作用的研究[J].新疆农业科学,2011,48(3):471-479.
[7] 候宝林.维药恰玛古儿.多糖抗氧化剂抗肿瘤作用的实验研究[D].乌鲁木齐:新疆医科大学,2010:29-34.
[8] 李雅双,连路宁,刘杰,等.芜菁多糖提取工艺及清除自由基活性的研究[J].食品与发酵工业,2014,40(5):235-240.
[9] 黄文书,杨海燕,李焕荣,等.枸杞多糖的脱色工艺[J].食品研究与开发,2008,29(3):95-98.
[10] 杨德,周明,程薇.灵芝多糖提取纯化及抗氧化研[J].湖北农业科学,2010,49(11):2 883-2 886.
[11] 徐桂云,陈汝贤.用毛细管气相色谱法测定多糖中单糖的组成[J].分析测试学报,2000,19(3):71-73.
[12] HUANG Sheng-quan,LI Jin-wei,LI Yu-qiang,et al.Purification and structural characterization of a new watersoluble neutral polysaccharide GLP-F1-1 from Ganoderma lucidum[J].International Journal of Biological Macromolecules 2011,48:165-169.
[13] LI Nai-sheng,YAN Chun-yan,HUA De-hong,et al.Isolation,purification,and structural characterization of a novel polysaccharide from Ganoderma capense[J].International Journal of Biological Macromolecules,2013,57:285-290.
[14] YANG Li-yan,WANG Zhong-fu,HUANG Lin-juan.Isolation and structural characterization of a polysaccharide FCAP1 from the fruit of Cornus officinalis[J].Carbohydrate Research,2010(345):1 909-1 913.
[15] SUN Yong-xu,LIANG Hai-tao,ZHANG Xian-tao,et al.Structural elucidation and immunological activity of a polysaccharide from the fruiting body of Armillaria mellea[J].Bioresource Technology,2009,100:1 860-1 863.
[16] LI Qiang,XIE Yang,SU Jian-wei,et al.Isolation and structural characterization of a neutral polysaccharide from the stems of Dendrobium densiflorum[J].International Journal of Biological Macromolecules,2012(50):1 207-1 211.
[17] Kalyan,Rao Anumula,Paul B Taylor.A comprehensive procedure for preparation of partially methylated alditol acetates from glycoprotein carbohydrates[J].Analytical Biochemistry,1992,203(1):101-108.
[18] 艾克拜尔江·阿巴斯,李冠,王静.新疆芜菁多糖降血糖作用的研究[J].新疆农业科学,2011,48(3):471.
[19] XIE Yue,JIANG Si-ping,SU Dong-hai,et al.Composition analysis and anti-hypoxia activity of polysaccharide from Brassica rapa L.[J].International Journal of Biological Macromolecules,2010,47:528-530.
[20] CHANG S C,HSU B Y,Chen B H.Structural characterization of polysaccharides from Zizyphus jujuba and evaluation of antioxidant activity[J].International Journal of Biological Macromolecules,2010(47):445-453.
[21] SONG Yi,DU Bing-jian,ZHOU Ting,et al.Optimization of extraction process by response surface methodology and preliminary structural analysis of polysaccharides from defatted peanut(Arachis hypogaea)cakes[J].Carbohydrate Research,2011,346:305-310.
[22] Kambiz Jahanbin,Ahmad Reza Gohari,Sohrab Moini,et al.Isolation,structural characterization and antioxidant activity of a new water-soluble polysaccharide from Acanthophyllum bracteatum roots[J].International Journal of Biological Macromolecules,2011,49:567-572.
[23] 康学军,曲见松,顾忠泽.白芷多糖的分析[J].分析化学,2006,12(5):34-38.
[24] WU Yan,AI Lian-zhong,WU Jin-hong,et al.Structural analysis of a pectic polysaccharide from boat-fruited sterculia seeds[J].International Journal of Biological Macromolecules,2013,56:76-82.
[25] 刘玉红,王凤山.核磁共振波谱法在多糖结构分析中的应用[J].食品与药品,2007,9(8):39-43.
[26] LI Jin-wei,AI Lian-zhong,YANG Qin,et al.Isolation and structural characterization of a polysaccharide from fruits of Zizyphus jujuba cv.Junzao[j].International Journal of Biological Macromolecules,2013,55:83-87.
[27] 张惟杰.复合多糖生化技术[M].杭州:浙江大学出版社,1999:94.
