植物乳杆菌NCU116菌剂的喷雾干燥制备*
2015-12-25熊涛廖良坤黄涛邓耀军
熊涛,廖良坤,黄涛,邓耀军
(南昌大学食品科学与技术国家重点实验室,江西南昌,330047)
乳酸菌(lactic acid bacteria)是一类对宿主有益的革兰氏阳性益生菌[1],能通过调节肠道菌群平衡和增强肠道黏膜抵御病原菌的入侵来发挥益生功能[2]。人们获取益生菌的途径主要是食用益生菌发酵的食品或服用含有益生菌活菌的药剂,益生菌制品的生产需要高质量的菌剂作保障。目前,国际上益生菌剂的生产方式主要为冷冻干燥,然而冷冻干燥耗时长,耗能高,产量小,使得冷冻干燥的菌剂生产成本高。喷雾干燥是将物料经喷嘴雾化成小液滴,在干燥塔中经过热交换和质交换,使物料快速干燥的一种方法[3]。由于喷雾干燥的高速率及其连续性特性,适于大规模的工业化生产[4]。自1914年 Rogers应用喷雾干燥生产出菌剂以来,国内外关于喷雾干燥制备菌剂的研究越来越多,但通过喷雾干燥制备菌剂的应用仍然没有大的突破,喷雾干燥制备乳酸菌剂尚在试验阶段,目前世界上还没有公司利用喷雾干燥技术规模化生产乳酸菌菌剂。喷雾干燥过程将菌体置于高温、高渗、氧化等严苛的环境下,使得菌体遭受到严重的损伤或大量死亡,而加入保护剂通常能大大提高菌体的存活率。喷雾干燥制备的菌剂的优良与否与乳酸菌的特异性和保护剂的种类有着密切的联系[5],因此,研究乳酸菌的喷雾干燥技术对其应用有着重要意义。随着研究的不断深入,乳酸菌喷雾干燥技术从最初的条件优化进入到对细胞结构和基因表达的研究,如高温对菌体的主要损伤部位的研究[6],喷雾干燥过程中细胞膜的损伤[7]、菌体性能的变化[8]以及耐热基因的研究[9]等。
目前,我国已经在发酵产业方面有了很大的发展,但是国内商业化的发酵剂生产厂家仍然极少,国内的发酵剂市场一直被国外公司垄断,发酵产品生产企业只能依靠进口发酵剂,这极大地制约了我国发酵产业的发展,本研究在拥有自主知识产权的高性能植物乳杆菌 NCU116的基础上,探索植物乳杆菌NCU116高浓度菌剂的喷雾干燥制备技术,以期为我国发酵剂的工业化生产提供技术支撑。
1 材料与方法
1.1 菌种与培养基
植物乳杆菌NCU116(Lactobacillus plantarum NCU116),由南昌大学食品科学与技术国家重点实验室保藏。
MRS培养基的制备参考文献[10]制备。
1.2 试剂与仪器
脱脂乳(食品级),海藻糖(食品级),谷氨酸钠(食品级),碘化丙啶(PI),美国Sigma公司;羧基荧光素乙二酸酯(CFDA),美国Sigma公司。
B-290小型喷雾干燥仪,瑞士步琪公司;BD FACSCalibur流式细胞仪,美国BD公司;XL-30-E型环境扫描电子显微镜(SEM),荷兰 Philips公司;DSC-204F1型差示扫描量热仪(DSC),德国NETZSCH公司;Anke LXJ-IIB型离心机,上海安亭科学仪器厂;DNP-9272型生化培养箱,上海精宏实验设备有限公司。
1.3 菌种活化培养、收集
将冷冻干燥的菌剂接入MRS液体培养基中,37℃培养16 h后,将种子液按体积分数1%的量接入到MRS液体培养基中培养18 h至对数末期,4 500 r/min离心10 min,用0.01 mol/L的PBS冲洗2次,收集菌泥。
1.4 物料制备
配制保护剂,按要求将各保护剂溶解于蒸馏水中,90℃水浴30 min,冷却后将得到的菌泥重悬于保护剂中,混合均匀,进行喷雾干燥。
1.5 喷雾干燥
1.5.1 保护剂优化
选取脱脂乳、海藻糖、麦芽糊精、谷氨酸钠、阿拉伯胶、明胶进行单因素试验,并选取保护效果好的3种保护剂进行3因素3水平正交试验设计,得到喷雾干燥复配保护剂,喷雾条件为:进风温度135℃,物料流量240 mL/h,菌含量(3~5)×109CFU/mL。
1.5.2 喷雾参数优化
选取喷雾干燥可变参数:进风温度、物料流量以及菌含量为工艺参数,以存活率和活菌数为响应因子,设计3因素3水平CCD响应面试验。
1.6 细胞膜完整性
利用CFDA和PI对细胞进行双染,CFDA可以穿透所有细胞膜,在细胞内酯酶的作用下分解出荧光基团,完整的细胞膜可将荧光基团截留在细胞内,在494 nm的激发光下发射出绿色荧光,而PI仅能穿透损伤的细胞膜,与DNA结合,在535 nm的激发光下发射出红色荧光,通过荧光强度分析细胞膜受损与未受损细胞的量。具体操作如下:将喷雾干燥菌剂0.1 g溶于10 mL PBS中,洗涤后于4 500 r/min离心10 min收集菌泥,重悬于PBS中,加入CFDA使其质量浓度为20 μg/mL,37℃避光孵育15 min后4 500 r/min离心10 min,用PBS冲洗2次除去多余的 CFDA,再加入PI,使其质量浓度为1.2 μg/mL,4℃孵育10 min,冲洗2次除去多余染料,用流式细胞仪进行检测,收取10 000个菌体分别计算各荧光强度[11-12],以不添加保护剂进行喷雾干燥的菌剂作为空白对照组。
1.7 环境扫描电镜检测
利用环境扫描电子显微镜(SEM)观察喷雾干燥后菌剂的微观形态,取少量喷雾干燥样品撒在粘有导电的胶性物质样品台上,置于电子显微镜样品室中,电压为10 kV,选择合适的放大倍数对样品进行扫描观察并拍照。
1.8 玻璃化转变温度
利用差示扫描量热仪(DSC)测量喷雾干燥后菌剂的玻璃化转变温度,取10 mg喷雾干燥样品置于铝盘中,另取一个空铝盘作为参照。对样品进行程序升温,温度范围为30℃至180℃,升温速度为10℃/min。
1.9 存储稳定性
将喷雾干燥菌剂真空密封于铝箔袋中,存储于-20、4、25℃环境下,每隔10 d测定其菌数变化,共检测60 d。
1.10 活菌计数
用MRS固体培养基进行平板涂布计数,将1 mL喷雾前的物料溶于9 mL 0.01 mol/L的PBS中或喷雾后的菌剂0.1 g溶于9.9 mL 0.01 mol/L的PBS中,振荡混匀、梯度稀释、涂布。将涂布平板放于37℃恒温培养48 h后进行菌落计数,单位为CFU/mL或CFU/g。
1.11 数据处理
每个实验重复3次,正交试验设计分析使用Spass20.0软件,CCD响应面采用Design-expert8.0.6设计分析,响应面、DSC曲线及存储稳定性实验数据采用Origin9.0作图,存储稳定性利用Spass20.0进行One-way ANOVA中的Tukey-HSD检验(P<0.01)。
2 结果与分析
2.1 喷雾干燥结果
2.1.1 喷雾干燥保护剂优化结果
脱脂乳、海藻糖、麦芽糊精、谷氨酸钠、阿拉伯胶、明胶是常用的喷雾干燥保护剂,图1为6种保护剂在不同浓度下对NCU116的保护效果。由图1可知,当脱脂乳、海藻糖、麦芽糊精、阿拉伯胶、明胶质量分数为10%时,各保护剂的保护效果最好,NCU116的存活率分别为:43.9%、16.3%、4.6%、10.6%、6.9%;当谷氨酸钠的质量分数为5%时,保护效果最好,菌体存活率为:29.6%。故选取保护效果较好的保护剂:脱脂乳、海藻糖、谷氨酸钠,进行正交试验设计,选取最佳复配保护剂。正交试验设计及结果如表1所示。

图1 单因素试验结果Fig.1 One factor experiment results
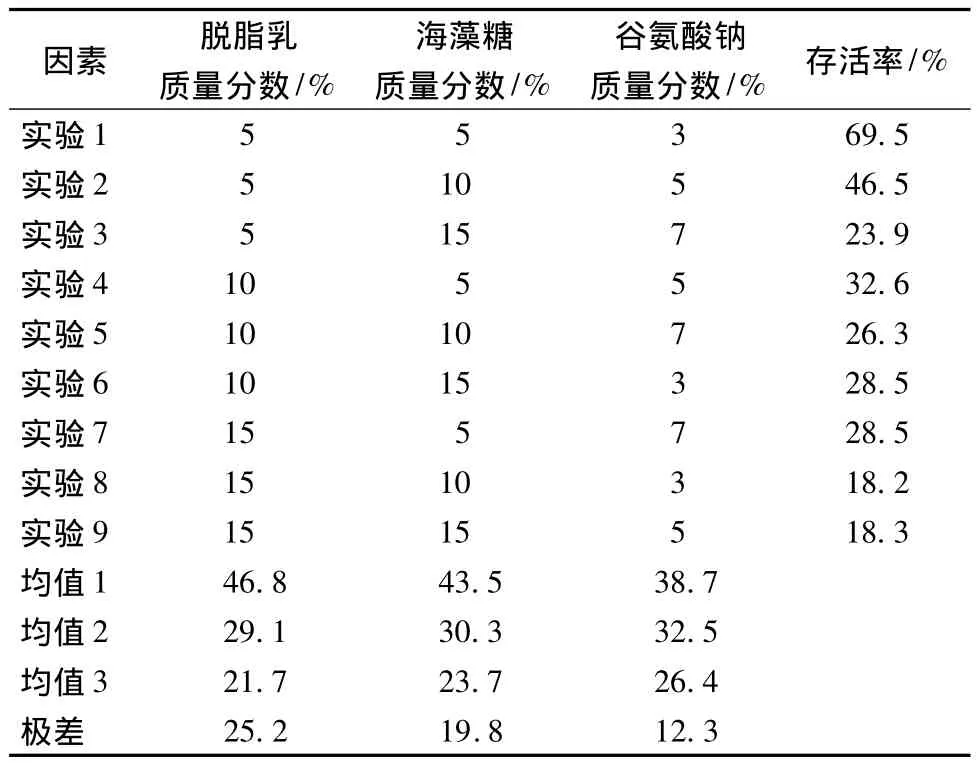
表1 正交试验及结果Table 1 Orthogonal experiment and results
Carlise[13]认为,脱脂乳能通过水取代作用保护细胞膜蛋白质在高温过程中不发生变性。海藻糖是一种二糖,具有较高的玻璃化转变温度,Jimmy[14]研究认为,海藻糖通过水取代作用和玻璃态机制维持细胞膜的稳定性并降低细胞膜脂质的相转变温度,从而使细胞膜在高温脱水的过程中不发生相转变而处于流动态。Sunny[15]研究表明,谷氨酸钠可以通过抗氧化作用保护细胞膜在高温过程中不被氧化。
有研究表明[16],保护剂能大大提高喷雾干燥过程中乳酸菌的存活率,然而,单一保护剂不能达到最佳保护效果,而通过各种保护剂复配,可以提高保护效果,由表1可见,通过保护剂复配,可使NCU116的存活率提高20% ~35%,当脱脂乳质量分数为5%,海藻糖为5%,谷氨酸钠为3%时,保护效果最佳,喷雾干燥后NCU166的存活率达到69.5%,大大提高了喷雾干燥菌剂的存活率,保护剂效果:脱脂乳 >海藻糖 >谷氨酸钠。
2.1.2 喷雾干燥条件优化结果
喷雾干燥参数对菌剂的存活率有重要的影响,有研究认为,高温是喷雾过程中造成菌体死亡最重要的原因[17],因此进风温度对乳酸菌的存活率有非常重要的作用;研究表明物料流量和菌含量对乳酸菌的存活率也有重要的影响。响应面设计及结果如表2所示。
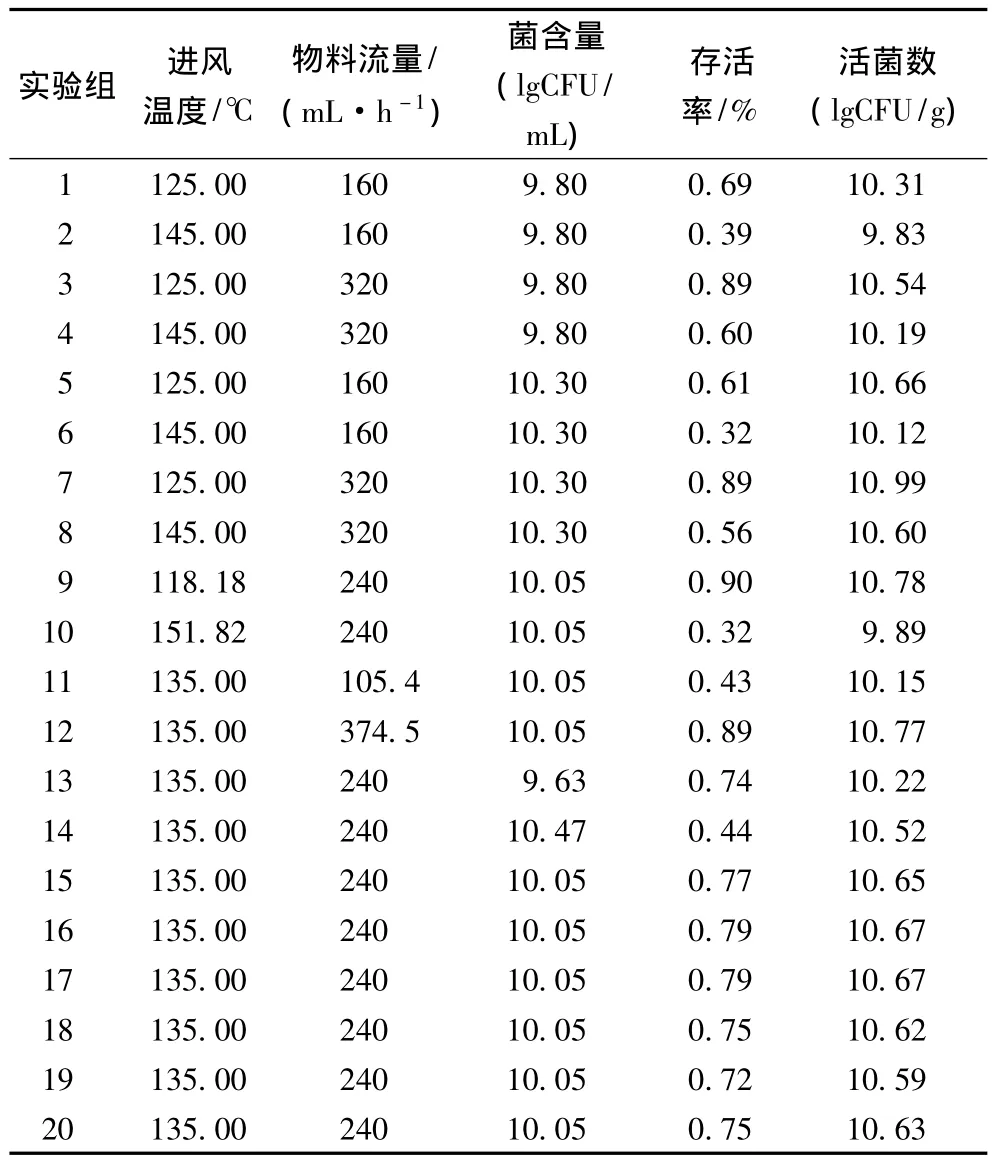
表2 响应面及结果Table 2 Response surface and results

图2 进风温度和物料流量对存活率的影响Fig.2 Response surface plot showing the interaction of inlet temperature and material flow on survival rate of L.plantarum NCU116

图3 进风温度和菌含量对存活率的影响Fig.3 Response surface plot showing the interaction of inlet temperature and microbial contents on survival rate of L.plantarum NCU116

图4 物料流量和菌含量对存活率的影响Fig.4 Response surface plot showing the interaction of material flow and microbial contents on survival rate of L.plantarum NCU116

图5 进风温度和物料流量对活菌数的影响Fig.5 Response surface plot showing the interaction of inlet temperature and material flow on viable counts of L.plantarum NCU116
喷雾干燥过程中的高温会对菌体结构如细胞膜、核糖体、核酸、蛋白质等造成破坏,致使细胞死亡;通过加大喷雾干燥物料流量,可使单位量的物料受热减少,降低其中菌体的损伤;当增加物料中的菌含量时,保护剂对菌体的相对保护作用降低,导致菌体损伤加剧。如图2~4所示,喷雾干燥菌剂的存活率随着进风温度的升高而降低,随物料中菌含量的增加,NCU116存活率先增加再降低,随物料流量的增加而升高。由图5~7可见,产品的活菌数随物料中菌含量和物料流量的增加而增加,随进风温度升高而减少。通过Design-expert软件分析,得到喷雾干燥的最佳参数为:进风温度125℃,物料流量320 mL/h,菌含量为10.25 lgCFU/mL,经过喷雾干燥后,NCU116存活率为89.95%,活菌数达到10.96 lgCFU/g,通过验证,表明实验值与预测值相吻合。
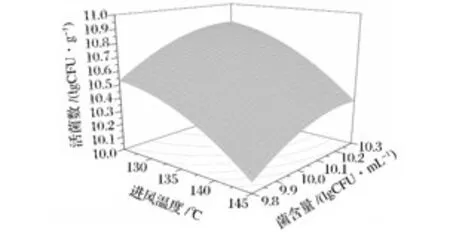
图6 进风温度和菌含量对活菌数的影响Fig.6 Response surface plot showing the interaction of inlet temperature and microbial contents on viable counts of L.plantarum NCU116
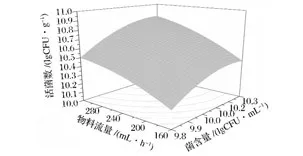
图7 物料流量和菌含量对活菌数的影响Fig.7 Response surface plot showing the interaction of material flow and microbial contents on viable counts of L.plantarum NCU116
2.2 细胞膜完整性
研究表明,喷雾干燥过程中的高温造成的细胞死亡与细胞膜的完整性相关,细胞膜的损伤造成细胞内容物的外泄,导致细胞死亡[18]。流式细胞仪检测结果如图8所示。
如图8-B所示,不添加保护剂时,Q4区域仅有1.12%,Q1区域为69.80%,表明绝大部分细胞的细胞膜在喷雾干燥的过程中受到高温损伤;当使用复配保护剂后,流式细胞检测如图8-C所示,Q4区域的量显著增加,达到49.75%,而Q1区域的量仅为7.80%,表明复配保护剂降低了喷雾干燥过程中高温对细胞膜的损伤,复配保护剂对菌体的保护作用明显。李宝坤[19]研究表明,在冷冻干燥制备乳酸菌菌剂的过程中加入保护剂后,细胞膜的损伤明显减少,这与喷雾干燥制备菌剂的结果相同,说明无论是喷雾干燥的方式还是以冷冻干燥的方式制备菌剂,选取适当的保护剂对细胞结构的完整性都有重要的作用。
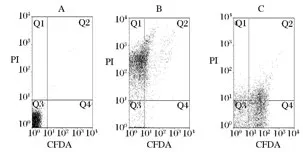
图8 流式细胞图Fig.8 Flow cytometric fluorescence dot plot
2.3 SEM检测
如图9所示,SEM观察到的微观结构显示复配保护剂对菌体的包埋效果良好,微粒呈现球形和不同的颗粒大小,由于水分的蒸发,颗粒表面有典型的凹陷和褶皱,外表面未出现裂纹,这对保护微球内部菌体免受高温损伤及防止存储过程中细胞膜脂质的过氧化有重要的作用,菌剂颗粒大小为10~18 μm。这一结构特性与冷冻干燥制备的菌剂微观结构有非常明显的差异,在喷雾干燥过程中雾滴由于高温的作用使水分迅速蒸发,使得菌剂的颗粒呈现球形并出现褶皱;在冷冻干燥过程中,水由冰晶直接升华而失去水分,菌剂微观结构呈现出块状并具有许多孔洞[20],因此冷冻干燥制备的菌剂表现出易吸水的特性,而喷雾干燥制备的菌剂吸水性较弱。

图9 喷雾干燥菌剂SEM图Fig.9 SEM pictogram of spray drying starter culture
2.4 玻璃化转变温度
菌剂在存储中的稳定性与菌剂的状态有密切的联系,有研究表明,当菌剂处于玻璃态时,分子流动性被抑制,细胞膜的氧化和化学反应降低,减缓细胞在存储过程中的死亡[21]。
图10为最佳喷雾干燥条件下制备的菌剂的DSC曲线,由曲线可知,喷雾干燥制备的菌剂 Tg为79.50℃,说明在常温下,菌剂处于玻璃态,这对保持NCU116菌剂的稳定性有非常重要的作用。

图10 喷雾干燥菌剂DSC扫描图Fig.10 DSC thermograph of spray drying starter culture
2.5 存储稳定性
高质量的菌剂不仅要求得到的产品活菌含量高,还需要在存储过程中保持活力稳定[22],因而需要找到最佳的存储条件。图11为不同温度条件下,菌剂的活菌数随存储时间的变化。

图11 不同温度存储活菌数变化Fig.11 Viable counts change in different storage temperature
由图11可知,在不同温度下存储时,菌剂活菌数变化差异明显,当存储于-20℃时,菌剂的稳定性良好,经过60 d,菌数下降了0.52个对数值;存储于4℃时,经过60 d,菌数下降了1个对数值;在25℃条件下存储时,菌数下降明显,经过60 d,活菌数降低了2.31个对数值。虽然菌剂在所有存储温度下都处于玻璃态,但不同存储温度下的稳定性呈现显著差异(P<0.01),表明菌剂的稳定性不仅与是否处于玻璃态有关,还与存储温度有密切的联系,处于玻璃态是确保菌体被固定在玻璃态基质中,更低的温度对NCU116菌剂保持其稳定性也具有非常重要的作用。低温可以降低酶的活性和减缓化学反应的发生,这对保持菌剂的稳定性有利。Thomas[23]研究发现,冷冻干燥制备的菌剂存储稳定性也随着温度的升高而降低,在4℃存储60 d后,活菌数下降了1个对数值,而在25℃存储60 d后,活菌数下降了2个对数值,这与本文通过喷雾干燥制备的菌剂存储稳定性结果相近。这一结果表明通过喷雾干燥制备的菌剂与通过冷冻干燥制备的菌剂在不同温度下的存储稳定性基本一致。
3 结论
本文探究了植物乳杆菌NCU116菌剂喷雾干燥制备的最佳工艺条件,最佳保护剂为:脱脂乳质量分数为5%、海藻糖为5%,谷氨酸钠为3%;最佳喷雾条件为:进风温度125℃,物料流量320 mL/h,菌含量10.25 lg CFU/mL,此时,喷雾干燥后NCU116存活率为89.95%,活菌数达到10.96 lg CFU/g。通过流式细胞术检测喷雾干燥菌剂的细胞膜完整性,添加保护剂后,细胞膜的损伤显著降低;在最佳条件下制备的NCU116菌剂微观形态、结构良好,在存储温度下都处于玻璃态,但存储过程中菌剂稳定性差异较大,在-20℃存储时,菌剂稳定性较好。本文通过系统研究喷雾干燥制备植物乳杆菌NCU116菌剂的工艺条件及其菌剂特性,并制备出高浓度的植物乳杆菌NCU116菌剂,将为益生菌更广泛的应用及国内发酵剂市场的发展提供理论支持,对利用喷雾干燥技术大规模生产益生菌剂有重要的指导作用。
[1] Sarim K,MENG W,Darry M,et al.Agent selection and protective effects during single droplet drying of bacteria[J].Food Chemistry,2015,166(2):206-214.
[2] Carlise B,Fritzen F,Elane S,et al.Microencapsulation of Bifidobacteria by spray drying in the presence of probiotics[J].Food Research International,2012,45(3):306-312.
[3] Keshani S,Daud W,Nourouzi M,et al.Spray drying:An overview on wall deposition,process and modeling[J].Journal of Food Engineering,2015,146(4):152-162.
[4] Schuck P,Dolivet A,Méjean S,et al.Spray drying of dairy bacteria:New opportunities to improve the viability of bacteria powders[J].International Dairy Journal,2013,31(1):12-17.
[5] Peighambardoust S,Tafti A,Hesari J.Application of spray drying for preservation of lactic acid starter cultures:a review[J].Trends in Food Science & Technology,2011,22(3):215-224.
[6] Teixeira P,Castro H,Mohacsi C,et al.Identification of sites of injury in Lactobacillus bulgaricus during heat stress[J].Journal of Applied Microbiology,1997,83(1):219-226.
[7] Jimmy P,Heidy M,den Besten,et al.Inactivation of Lactobacillus plantarum WCFS1 during spray drying and storage assessed with complementary viability determination methods[J].Food Research International,2014,64(5):212-217.
[8] Fabiane P,De castro C,Carina D,et al.Bifidobacterium Bb-12 microencapsulated by spray drying with whey:Survival under simulated gastrointestinal conditions,tolerance to NaCl and viability during storage[J].Journal of Food Engineering,2012,113(3):186-193.
[9] Maria D,Raffaella D,Claude H,et al.Heat shock Response in Lactobacillus plantarum[J].Applied and Environment Microbiology,2004,70(3):1 336-1 346.
[10] 熊涛,宋苏华,黄锦卿,等.植物乳杆菌NCU116在模拟人体消化环境中的耐受力[J].食品科学,2011,32(11):114-117.
[11] Medeiros A,Thomazini M,Urbano M,et al.Structural characterisation and cell viability of a spray dried probiotic yoghurt produced with goats'milk and Bifidobacterium animalis subsp.lactis(BI-07)[J].International Dairy Journal,2014,39(1):71-77.
[12] Salar-BEhzadi S,WU shengqian,Toegel S,et al.Impact of heat treatment and spray drying on cellular properties and culturability of Bifidobacterium bifidum BB-12[J].Food Research International,2013,54(8):93-101.
[13] Carlise B,Fritzen-Freire,Elane S,et al.Microencapsulation of Bifidobacteria by spray drying in the presence of prebiotics[J].Food Research International,2012,45(6):306-312.
[14] Jimmy P,Martijn B,CHEN S W,et al.Interactions between formulation and spray drying conditions related to survival of Lactobacillus plantarum WCFS1[J].Food Research International,2014,56(9):9-17.
[15] Sunny E O,Knoor R D.The protective effect of monosodium glutamate on survival of Lactobacillus rhamnosus GG and Lactobacillus rhamnosus E-97800(E800)strains during spray-drying and storage in trehalose containing powders[J].International Dairy Journal,2009,19(3):209-214.
[16] Nan Fu,Xiao D C.Towards a maximal cell survival in convective thermal drying processes[J].Food Research International,2011,44(1):1127-1149.
[17] Jimmy P,Ludmila B,Martijn B,et al.Dehydration and thermal inactivation of Lactobacillus plantarum WCFS1:Comparing single droplet drying to spray and freeze drying[J].Food Research International,2013,54(2):1 351-1 359.
[18] Ananta E,Volkert M,Knorr D,et al.Cellular injuries and storage stability of spray dried Lactobacillus rhamnosus GG[J].International Dairy Journal,2005,15(1):399-409.
[19] 李宝坤.乳酸菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡:江南大学,2011:29-31.
[20] Devastotra P,Shantanu D,Geoff J,et al.Stability of probiotic Lactobacillus paracasei during storage as affected by the drying method[J].International Dairy Journal,2014,39(6):1-7.
[21] Stephanie P,Stephanie C,Ines D,et al.Critical water activity and amorphous state for optimal preservation of lyophilised lactic acid bacteria[J].Food Chemistry,2012,132(2):1 690-1 705.
[22] Tripathi M K,Giri S K.Probiotic functional foods:Survival of probiotics during processing and storage[J].Journal of Functional Foods,2014,9(5):225-241.
[23] Thomas H,Petra F,Ulrich K,et al.Influence of caseinbased microencapsulation on freeze-drying and storage of probiotic cells[J].Journal of Food Engineering,2010,98(2):309-316.
