动物源性食品中大环内酯类药物前处理及检测方法研究进展*
2015-12-25周伟娥张元李伟青李绍辉蒋受军李红娜郑阳张峰
周伟娥,张元,李伟青,李绍辉,蒋受军,李红娜,郑阳,张峰
1(中国检验检疫科学研究院 食品所,北京,100176)
2(广西中医药大学药学院,广西 南宁,530299)
3(广西药品不良反应监测中心,广西南宁,530022)
随着生活水平的提高,畜牧业的发展,兽药的使用越来越广泛。畜禽使用兽药后,兽药及其毒性代谢物易蓄积于动物体内,并随着食物链的传递,进入人体,蓄积于体内的兽药残留会威胁人类健康,因此食品中兽药残留的问题日益受到关注[1-2]。
大环内酯类抗生素作为兽药中重要一员,在临床及兽药领域均得到广泛使用[3-5]。该类药物不可逆的结合到细菌核糖体50S亚基上,阻断转肽及mRNA位移,选择性抑制蛋白质合成,从而发挥抗菌作用[6]。该药常用于治疗上呼吸道感染、泌尿道感染和畜禽胃肠道感染等,少量使用能促进畜禽生长[7-9]。但该药毒副作用多见,易造成胃肠道反应,肝肾损伤、耳蜗神经受损、严重者可导致各种慢性中毒或“三致”等危害[10]。为保障食品安全,欧盟委员会和我国农业部235号公告都对食用性组织中大环内酯类药物的最大残留限量作出了规定,如表1示。因此,建立高效、简便的检测分析方法以严格控制动物源性食品中大环内酯类药物残留是极其必要的。
截至目前,动物源性食品中大环内酯类药物残留检测方法研究较多,本文综述了国内外近10年的动物源性食品中大环内酯类药物残留检测技术相关文献,拟为进一步研究和开发快速、简便、高通量方法提供依据。
1 大环内酯类抗生素残留检测研究现状
目前在pudmed数据库中,以macrolide为检索词,一共检索出92 789篇,近5年约占20%,determination of macrolide为检索词,一共检出29 690篇(约占总数的32%),近5年约占了22%,如图1所示。而在中国知网数据库中,以大环内酯为全文检索,一共检索出18 939篇,近5年约占47%,其中以大环内酯残留检测为全文检索,一共检索出文献1 411篇(约占总数的7.5%),近5年约占50%,如图2所示。总体来说,近10年国内外对大环内酯类抗生素的研究都有明显的上升,近5年国内外有关大环内酯类药物研究的文献比例都较高,而近5年内我国对于大环内酯的残留检测研究比例比国外少得多,所以需要进一步加大对食品中大环内酯类药物的残留检测以保证食品安全,需要深入研究食品中大环内酯类药物的残留检测技术。
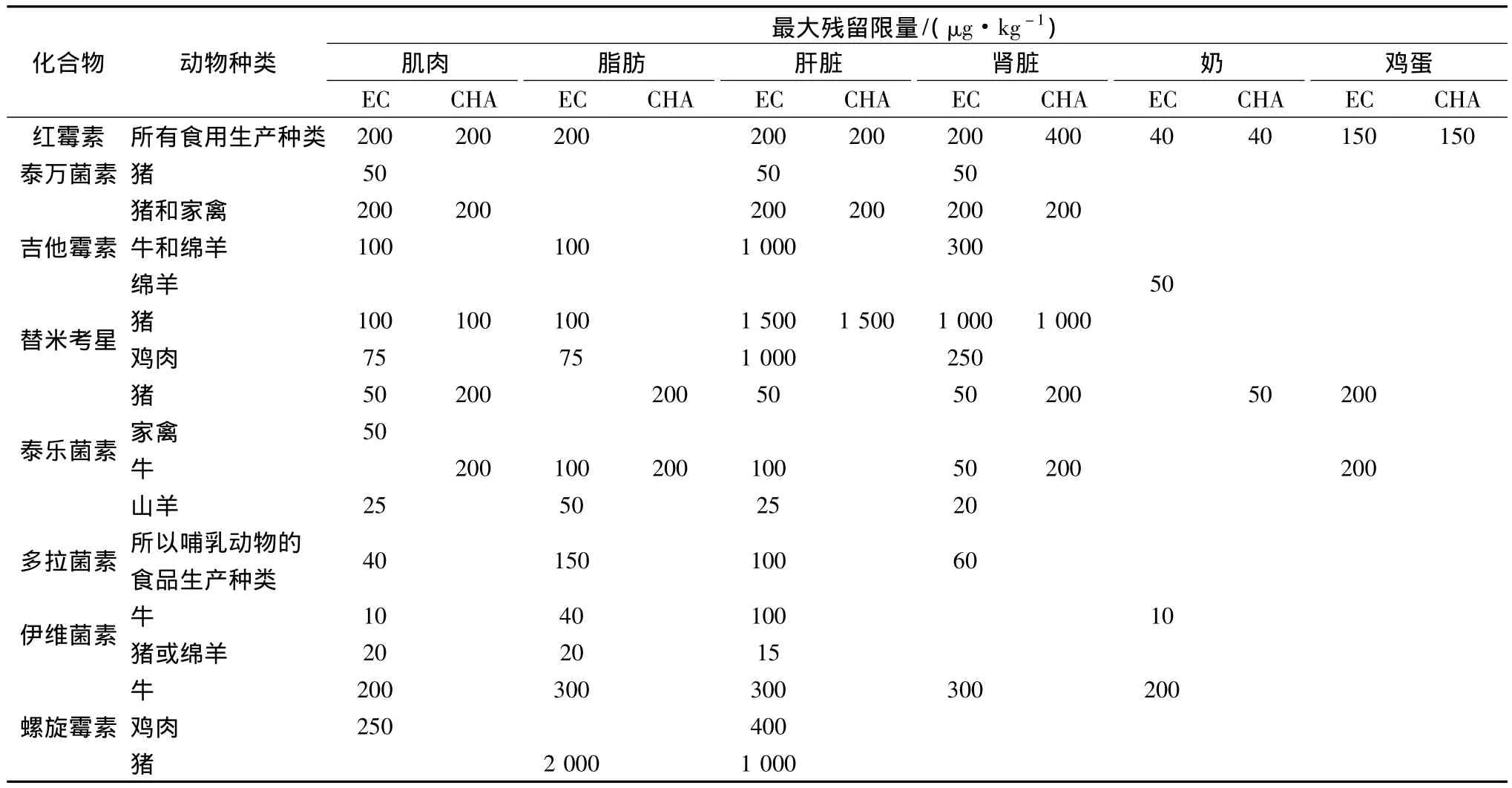
表1 欧盟委员会(EC)和我国(CHA)农业部235号公告中大环内酯类药物在食用组织中的最大残留限量规定Table 1 The maximum residue limit in edible tissue were regulated by European Commissio and China

图1 Pudmed数据库文献统计情况Fig.1 Pudmed database literature statistics
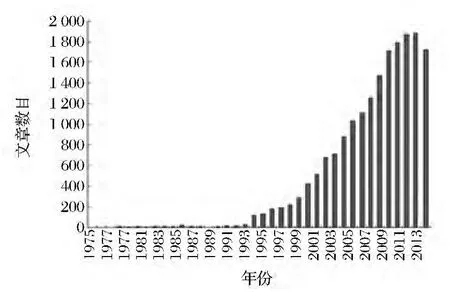
图2 中国知网数据库文献统计情况Fig.2 CNKI database literature statistics
2 药物理化性质
大环内酯类药物基本化学结构是由14~16元大内酯环与1~3个去氧氨基糖或者二甲氨基糖通过羟基缩合成的碱性苷。该药多数为弱碱性亲酯类化合物,一般易溶于极性有机溶剂如甲醇、乙腈等,微溶于水和弱极性溶剂[14]。该药氨基糖结构的叔胺基在酸性溶液中可离子化,使其在酸性溶液中有一定的溶解度,但其在强酸强碱中稳定性较差。当溶液pH <4.0时,大环内酯类药物的糖苷键可能水解,当溶液pH >9时,内酯环易开裂,因此一般采用偏中性(pH 6~8)的极性有机溶液中溶解[15-16]。
3 前处理方法
大环内酯类抗生素在各种动物源性食品中均有残留,如肉类、内脏、动物奶及其制品、禽蛋和蜂蜜等[17-20]。样品前处理是为了在各种复杂食品基质中最大限度的提取、分离、净化和富集药物,以便于仪器检测[21]。但由于食品中大环内酯类药物的残留水平较低,基质复杂,干扰物质多,加大了净化的难度[22-23],所以需要寻找一个选择性强、操作简单、回收率高而稳定的前处理方法,以解决食品中大环内酯类药物残留检测问题。目前,大环内酯类抗生素前处理方法可分为传统前处理方法和新型前处理方法。传统前处理方法包括溶剂萃取或液液萃取等方式。新型技术前处理方法包括固相萃取、加压液体萃取、中空纤维液相微萃取、基质固相分散萃取等。前处理方法各有优缺点,需要根据研究的样品性质和待测物性质选择合适的前处理方法。
3.1 传统前处理方法
大环内酯类抗生素的传统前处理方法是溶剂提取或液液萃取[24-25]。溶剂提取一般过程是将样品匀浆处理后,选择极性有机溶剂萃取,在提取过程中,为了提高萃取效率,水浴、超声、微波或振荡等辅助措施均常被采用[26-27],如林洁等[28]采用体积分数20%甲醇水溶液提取蜂蜜中的10种大环内酯类抗生素,用2 mmol/L乙酸铵水溶液调节溶液pH值,利用涡旋、超声、水浴等辅助提取,回收率可达94% ~115%。甲醇和乙腈是大环内酯类药物最常用的提取溶剂[25,29]。刘晔等[30]在猪肝中比较了甲醇、乙腈、甲醇-水、甲醇-偏磷酸等提取溶液,发现甲醇对4种大环内酯类药物的提取效率最高。苏秀华等[31]在水产品中考察了乙腈、甲醇、酸化乙腈、偏磷酸-甲醇和乙酸乙酯等提取溶剂,发现乙腈对替米考星的提取效率最高。由于大环内酯类抗生素在酸性条件下有质子化倾向,容易向水相转移,有学者认为酸化溶剂更有利于提取,张园等[32]在水产品中对比了甲醇、乙腈和1%的酸化乙腈溶液,认为酸化乙腈溶液对泰乐菌素的提取效率最高。也有学者在碱性条件下提取[33-35],但回收率不理想,限制了其的使用,徐锦忠等[35]用NaCO3/NaHCO3缓冲液提取蜂蜜中8种大环内酯类抗生素,回收率达60% ~130%。
食品中多含有脂肪和蛋白质等杂质,因此在检测前需要进行除脂、沉淀蛋白等除杂过程[36-37],液液萃取是一种常见的大环内酯类药物净化方式。液液萃取法主要基于被测物与杂质在不同溶剂间的分配系数不同而实现提取分离净化。正己烷是常用的萃取溶剂之一[38-39]。张崇威等[40]采用 V(乙腈)∶V(水)=15∶2提取,正己烷液液萃取净化,UPLC-MS/MS检测猪肉、鸡肉和鸡蛋中7种兽药残留(包括3种大环内酯类抗生素),3种大环内酯类抗生素的检测限为0.5 μg/kg,回收率达80% ~100%。传统前处理方法不需要特殊仪器设备,仪器成本低,操作简单,但是繁琐费时,有机溶剂消耗量大,不利于安全环保,且共萃取杂质较多,增加了净化的工作量和难度。
3.2 高新技术前处理方法
3.2.1 固相萃取法(SPE法)
固相萃取(SPE)是大环内酯类药物残留检测中最为常用的一种前处理方法[29-34]。其利用固体吸附剂将液体样品中的目标化合物吸附,尽量少吸附或不吸附样品基质及干扰化合物,再通过洗脱液将目标物洗脱收集而达到分离纯化和富集的目的。根据固相萃取柱的作用机制可分为正相柱、反相柱、离子交换柱、吸附柱和混合柱如Bond Elut Plexa和Oasis HLB等。而大环内酯类抗生素残留样品均可用上述5种固相萃取柱净化[29-34],其中用的比较广泛的是C18柱和HLB柱[41-42]。固相萃取法一般与溶剂萃取相结合运用。Mi等[42]用体积分数70%的乙腈溶液提取鱼肉或虾肉中7种大环内酯类抗生素的残留,并加入硅藻土吸附杂质,加入NaCl利于分层,还用正己烷除去脂肪后再用HLB柱净化,回收率达68% ~85%。林维宣等[43]采用甲醇提取肠衣中7种大环内酯类药物残留量,水浴减压浓缩后用磷酸盐缓冲液复溶,复溶液用固相萃取柱净化,实验对比了 C18、Oasis(HLB)和MCX的净化效果,结果显示Oasis(HLB)回收率较理想,可达70.9% ~98.4%。该法操作简便,快速,减少不必要的工序,净化效果比液液萃取提高很多,且便于自动化。
3.2.2 加压液体萃取(PLE)
加压溶剂萃取通过提高萃取温度和压力,大大降低范德华力、氢键、偶极等作用,从而减弱基质对分析成分的吸附作用,提高对分析成分的溶解能力。该方法具有萃取迅速、自动化程度高,萃取剂使用较少,经济环保等优势,在食品中大环内酯残留测定中多有应用[44-46],如 Houda等[47]采用 PLE 法萃取鱼和肉中 7种大环内酯的残留,回收率达77%以上,效果令人满意。
3.2.3 中空纤维液相微萃取(HF-LPME)
HF-LPME是近年发展而来集采样、萃取、浓缩于一体的前处理新技术。具有操作简便、易于实现自动化,可与GC和HPLC联用等优点,可应用于药物的检测[47-48],此法也可应用于食品中大环内酯的残留检测。刘志梅等[49]用聚丙烯中空纤维在磁力搅拌器作用下对pH=8.5的牛奶样品溶液进行萃取,氮吹干后用乙腈溶解后色谱分析,3种大环内酯类药物回收率达79% ~105.3%,整个过程简便、快速。但HFLPME应用于动物源性食品中大环内酯类药物残留的相关研究较少,还有待进一步的比较研究。
3.2.4 基质固相分散萃取技术(MSPDE)
基质固相分散萃取(MSPDE)是在SPE的基础上发展而来。其原理是试样与SPE分散剂填料一起研磨混合均匀成半固态混合物,装入空的SPE柱,再用溶剂淋洗除杂,然后收集含有待测组分的洗脱液,供检测用。由于其净化所需的样品和溶剂量都较少,操作简便快捷,能与其他萃取方法相结合,在食品中大环内酯药物残留检测中有所应用。Mayor等[50]采用MSPDE测定绵羊奶中7种大环内酯药物残留,回收率达74%~97%。
3.2.5 其他前处理方法
支撑液膜萃取是一种新型萃取技术,利用膜溶剂在惰性的多孔液膜支撑体上形成支撑液膜对样品进行分离和净化。液膜可承受较大压力,具有高选择、高分离能力、高通量和有机溶剂用量少等优点。Msagati等[51]在2004年首次利用支撑液膜萃取技术分离3种大环内酯类药物。除此之外,QuEChERS方法是集提取、分离、净化于一体的方法,最初应用于农产品中,也逐渐应用于兽药残留中[52],而在食品中大环内酯类药物应用较少。目前,胡凤杨等[53]利用QuECh-ERS技术处理蔬菜中的大环内酯类药物,回收率在51.6% ~98.7%。
4 检测分析方法
4.1 微生物法
在抗生素检测中,微生物法属于经典的含量检测方法。微生物法是根据抗生素对该药敏感微生物的抑菌圈大小与抗生素浓度呈线性相关来定量检测的。如黄晓蓉等[54]应用微生物法筛查肉类、水产品和蛋内大环内酯类抗生素。但是微生物法选择不同的生产菌种,不同的生产厂家,易造成组分比例不同,使得微生物效价的测定差别加大,难以满足准确定性定量的要求,而逐渐被取代。
4.2 薄层色谱法(TLC法)
TLC法利用薄层板和各种有机溶剂在固液吸附色谱过程中将样品组分分离和显色,用薄层扫描法测定含量。该法可以通过变换不同的溶剂、显色剂和检测方式测定批量样品,成本低,设备与操作简单。Petz等[55]用pH=8.5的乙腈水溶液提取动物组织、奶、和蛋中的4种大环内酯后用TLC分离鉴定。但是TLC法分离能力较差,对复杂样品的的鉴定能力不足,灵敏度较低,不利于准确定量分析而逐渐减少应用。
4.3 紫外分光光度法(UV法)
紫外分光光度法是根据被测物质在特定波长内有吸收,其吸光度与浓度成正比的定律,对该物质进行定性定量。部分大环内酯类药物如螺旋霉素、吉他霉素、替米考星等含有α,β-不饱和酮,在200~300 nm处有紫外吸收的光谱特征,可以应用紫外分光光度法检测。UV法仪器成本低,操作简单,如 Riedl等[56]用甲醇提取样品中纳他霉素,用UV法测定其含量。但是其检测结果容易受样品中杂质的影响,对前处理的要求高,只适合检测较纯的物质,所以目前在大环内酯类中没能广泛使用。
4.4 毛细管电泳-电化学检测方法(CE-ECL)
毛细管电泳(CE)是利用高压电场在毛细管中将少量样品进行快速、高效分离分析,但检测灵敏度较低,而电化学检测灵敏度高,线性范围宽,克服了CE的弱点,两者的结合能够高分离能力高灵敏度的测定复杂样品,因此在测定大环内酯药物中受到青睐[57-59],如史艳梅[60]采用 CE-ECL 测定牛奶中 3 种大环内酯药物,检测限为3.2×10-7mol/L,但是多数大环内酯类抗生素的氧化电位较高,易受到流动相和样品基质中还原性物质的干扰,因而电化学检测器不易推广。
4.5 气相色谱法(GC)和气相色谱-质谱联用(GCMS)
气相色谱法具有灵敏度高、专属性好等特点,适用于挥发性高、热稳定性较好、极性较高的化合物。若大环内酯类要应用GC法测定,需要将其衍生化,让其适合GC定量检测,如Keigo等[61]将吉他霉素、螺旋霉素和泰乐菌素衍生化后用GC-MS测定其含量。寻找衍生化方法过程漫长且衍生化步骤繁杂,所以无疑限制大环内酯类抗生素的GC法和GC-MS法的应用。
4.6 高效液相色谱法(HPLC法)
高效液相色谱法是利用被测组分在2项中吸附或分配系数的微小差异而达到分离的目的,加上与紫外-可见检测器或荧光检测器相结合,能够同时准确的检测大量的组分。该法具有灵敏度高、重现性好、检测速度快,线性范围宽等特点,同时能够克服GC法缺点,适合分析沸点高、热稳定性较差、分子质量大的化合物。大环内酯类抗生素大多难于气化或衍生,且相当一部分具有紫外吸收,所以该法广泛应用于食品中大环内酯类药物残留检测。邢丽红等[62]采用高效液相色谱-荧光检测法测定鲈鱼组织中阿维菌素、伊维菌素。Masakazu等[63]采用0.3%V(偏磷酸)∶V(甲醇溶液)=7∶3提取,ElutSCX(500 mg)固相萃取柱净化,高效液相色谱-紫外检测法测定肉中5种大环内酯类药物残留,检测限可达0.05 μg/g,检测快速、准确、重现性好,但是还不能完全满足低残留的检测需要。
4.7 液相色谱-质谱联用技术(LC-MS和 LC-MS/MS)
与HPLC法相比,LC-MS的检测器是质谱检测器。质谱遵循带电粒子磁场或电场中的运动规律,利用化合物的质荷比实现分离和利用丰度比实现定量,集高分离能力、高灵敏度、高分辨率于一体,是目前认为最佳的分析方法用于动物性食品中大环内酯类药物的检测[64-66]。Tao等[65]用 LC-MS 同时测定肉中17种大环内酯药物残留,线性范围在2~400 μg/kg之间,检出限在0.55 μg/kg,回收率在75%以上。刘永涛等[27]用 LC-MS/MS测定水产品中5种大环内酯,检测限达1.0 μg/kg,在 1 ~ 100 μg/kg 的线性范围,回收率达67.52% ~108.89%,分离与检测都取得良好效果,适合食品中大环内酯药物残留的痕量检测。但是质谱分析的仪器比较昂贵,对操作人员要求较高,在基层检测中还有待进一步推广。
5 展望
在过去的10年,无论是在畜禽还是水产等动物源性食品中,大环内酯类药物不同的前处理方法和检测方法都相应被开发出,而研究的重点和热点主要集中在前处理方法的开发。但是截止到目前,动物性食品中大环内酯类抗生素残留检测的前处理开发的方法主要集中于SPE,而在其他兽药残留中常用的方法如固相微萃取技术、液相微萃取技术、QuEChERs方法等[67-69]在动物性食品中大环内酯类药物中研究较少,有待进一步开发。目前,分析检测研究趋势是向高分离度、高准确度、高灵敏度、高分辨率发展,食品中大环内酯类药物残留检测也主要应用高效液相色谱-串联质谱仪测定。高分辨飞行时间质谱或轨道阱质谱仪具有较强大的多残留筛查能力,有待进一步的应用。处理装置小,处理速度快,操作简单化,样品和有机溶剂用量少,对待测成分的选择性和回收率高,易于自动化的前处理方法与高分离度、高准确度、高灵敏度、高分辨率的分析仪器的相结合应用必将得到更大的发展,以满足兽药残留检测的需要。
[1] Huimin W,Yanfei T,Dongmei C,et al.Development and validation of a multi-residue screening method for veterinary drugs,their metabolites and pesticides in meat using liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta,2009,637(1/2):68-78.
[2] Fidel T,Milagro R.Methods for rapid detection of chemical and veterinary drug residues in animal food[J].Trends in Food Science & Technology,2006,17(9):482-489.
[3] Michael J,Arthur P.Macrolides for acute lung injury[J].Chest,2012,141(5):1 153-1 159.
[4] Tanga Y Y,Lua H F,Lin H Y,et al.Multiclass analysis of 23 veterinary drugs in milk by ultraperformance liquid chromatography-electrospray tandem mass spectrometry[J].Journal of Chromatography B,2012,(881/882):12-19.
[5] Mariu J,Gonz'alez H,Ursula V,et al.Sample preparation strategy for the simultaneous determination of macrolide antibiotics in animal feedingstuffs by liquid chromatography with electrochemical detection(HPLC-ECD)[J].Journal of Pharmaceutical and Biomedical Analysis,2007,43(5):1 628-1 637.
[6] Pascal V,Carlo C.Mechanism of Action of Streptogramins and Macrolides[J].Drugs,1996,15(1):20-30.
[7] WU Jian-bing,QIAN Yong-sheng,ZHANG Chuan-lan,et al.Application of graphene-based solid-phase extraction coupled with ultra high-performance liquid chromatographytandem mass spectrometry for determination of macrolides in fish tissues[J].Food Analytical Methods,2013,6(5):1 448-1 457.
[8] Zarogoulidis P,Papanas N,Kioumis I,et al.Macrolides:from in vitro anti-inflammatory and immunomodula-tory properties to clinical practice in respiratory diseases[J].European Journal of Clinical Pharmacology,2012,68(5):479-503.
[9] Hyeun B K,Klaudyna B,Bryan A,et al.Microbial shifts in the swine distal gut in response to the treatment with antimicrobial growth promoter,tylosin[J].PNAS,2012,109(8):15 485-15 490.
[10] Professor P P,Teresita M,Enrico M,etal.Adverse Effects of Macrolide Antibacterials[J].Drug Safety ,1993,9(5):346-364.
[14] Višnja S,Sanja K,Ivica M,et al.Modeling Cellular Pharmacokinetics of 14-and 15-Membered Macrolides with Physicochemical Properties[J].Journal of medicinal Chemistry,2011,54(3):719-733.
[15] Yasuo N,Shigeru I,Tsuguchika Y,et al.Physicochemical properties and stability in the acidic solution of a new macrolide antibiotic,clarithromycin,in comparison with erthyomycin[J].Chemical and Pharmaceutical Bulletin,1992,40(3):725-728.
[16] 朱世超,钱卓真,吴成业,等.水产品中7种大环内酯类抗生素残留量的HPLC-MS/MS测定法[J].南方水产科学,2012,8(1):54-60.
[17] Perry A,Martos,Fiona J,et al.Multiclass,multiresidue drug analysis,including aminoglycosides,in animal tissue using liquid chromatography coupled to tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry,2010,58(10):5 932-5 944.
[18] Bernardete F S,Rosana G F,Mararlene U P,et al.Simultaneous determination of polyether ionophores,macrolides and lincosamides in hen eggs by liquid chromatogra-phy-electrospray ionization tandem mass spectrometry using a simple solvent extraction[J].Analytica Chimica Acta,2010,682(1):82-92.
[19] Thomas S T,Donald K,Jane C,et al.Determination of lincomycin and tylosin residues in honey by liquid chromatography/tandem mass spectrometry[J].Rapid Commun.Mass Spectrom.2005,19(3):309-316.
[20] 田苗,林维宣,董伟峰,等.高效液相色谱法测定猪肠衣中大环内酯类抗生素残留量的研究[J].食品研究与开发,2011,32(7):117-119.
[21] 赵东豪,贺利民,聂建荣,等.HPLC-MS/MS检测猪肉中六种大环内酯类抗生素[J].分析试验室,2009,28(1):117-119.
[22] 谢文,丁慧瑛,奚君阳,等.蜂王浆产品中5种大环内酯类抗生素残留量的高效液相色谱-质谱/质谱检测方法[J].色谱,2007,25(3):404-407.
[23] WANG Jian.Determination of five macrolide antibiotic residues in honey by LC-ESI-MS and LC-ESI-MS/MS[J].Journal of Agricultural and Food Chemistry,2004,52(2):171-181.
[24] Dubois M,Fluchard D,Sior E,et al.Identification and quantification of five macrolide antibiotics in several tissues,eggs and milk by liquidchro matography-electrospray tandem mass spectrometry[J].Journal of Chromatography B,2001,753:189-202.
[25] 张敬平,刘晔,戴军,等.HPLC-ESI-MS法测定鸡肝中的大环内酯类抗生素[J].食品工业科技,2009,30(2):292-295.
[26] 王凤美,陈军辉,林黎明,等.UPLC-MS/MS法对动物源性食品中12种大环内酯类抗生素残留的测定[J].分析测试学报,2008,28(7):784-788.
[27] 刘永涛,刘振红,丁运敏,等.HPLC-MS/MS同时测定水产品中喹烯酮、喹乙醇和5种大环内酯类抗生素残留[J].分析试验室,2010,29(8):44-47.
[28] 林洁,曹建明,蔡欣欣,等.超高效液相色谱三重四极杆质谱法快速测定蜂蜜中12种大环内酯和林可酰胺类药物残留[J].中国卫生检验杂志,2010,20(5):959-962.
[29] 陈莹,陈辉,林谷园,等.超高效液相色谱串联质谱法对鳗鱼中大环内酯类、喹诺酮类和磺胺类兽药残留量的同时测定[J].分析测试学报,2008,27(5):538-541.
[30] 刘晔,王洪新,戴军,等.固相萃取-高效液相色谱法测定猪肝中的大环内酯类抗生素[J].食品与发酵工业,2008,34(5):162-165.
[31] 苏秀华,吴成业,钱卓真,等.水产品中替米考星残留量检测的条件优化[J].南方水产,2010,6(3):12-18.
[32] 张园,吴成业,赵春晖,等.液相色谱值质谱联用法测定水产品中泰乐菌素残留方法研究[J].南方水产科学,2013,9(2):58-62.
[33] 周萍,徐权华,胡苏萍,等.高效液相色谱-串联质谱法同时测定蜂王浆中林可霉素和大环内酯类药物残留量[J].中国蜂业中旬刊(学术),2011,62(10):79-84.
[34] 杨方,李耀平,方宇,等.高效液相色谱法同时检测水产品中螺旋霉素和泰乐菌素药物残留[J].理化检验,2007,43(4):272-274.
[35] 徐锦忠,吴宗贤,杨雯筌,等.液相色谱-电喷雾串联质谱测定蜂蜜中8种大环内酯类药物残留[J].分析化学,2007,35(2):166-170.
[36] 谢丽琪,岳振峰,唐少冰,等.高效液相色谱串联质谱法测定牛奶中林可酰胺类和大环内酯类抗生素残留量的研究[J].分析试验室,2008,27(3):5-8.
[37] 岳振峰,陈小霞,谢丽琪,等.高效液相色谱串联质谱法测定动物组织中林可酰胺类和大环内酯类抗生素残留[J].分析化学,2007,35(9):1 290-1 294.
[38] 赵红梅,马玉龙,谢丽,等.高效液相色谱法检测泰乐菌素残留[J].化学与生物工程,2010,27(5):86-88.
[39] 王炼,黎源倩,张礼春,等.超高效液相色谱同时测定奶粉和牛奶中β-内酰胺、喹诺酮和大环内酯类抗生素的残留[J].分析试验室,2011,30(6):23-27.
[40] 张崇威,班付国,宋志超,等.超高效液相色谱-串联质谱法测定动物源食品中7种药物残留[J].中国兽药杂志,2014,48(8):51-54.
[41] 赵东豪,贺利民,聂建荣,等.HPLC-MS/MS检测猪肉中六种大环内酯类抗生素[J].分析试验室,2009,28(1):117-119.
[42] Mi R J,Hee J L,Tae S L,et al.Simultaneous determination of macrolide residues in fish and shrimp by liquid chromatography-tandem mass spectrometry[J].Food Science and Biotechnology ,2011,20(3):823-827.
[43] 林维宣,陈溪,张宁,等.LC-MS/MS测定肠衣中7种大环内酯类抗生素残留量[J].食品研究与开发,2012,33(9):123-128.
[44] 厉文辉,史亚,高立红,等.加速溶剂萃取-高效液相色谱-串联质谱法同时检测鱼肉中喹诺酮、磺胺与大环内酯类抗生素[J].分析测试学报,2010,29(10):987-992.
[45] Cristina J,Juan C M,Jordi M,et al.Determination of macrolide and lincosamide antibiotics by pressuised liquid extraction and liquid chromatography-tandem mass spectrometry in meat and milk[J].Food Control,2010,21:1 703-1 709.
[46] Houda B,Francesc B,Gullermina F,et al.Determination of macrolide antibiotics in meat and fish using pressurized liquid extraction and liquid chromatography-mass spectrometry[J].Journal of Chromatography A,2008,1208(1-2):83-89.
[47] 杨秀敏,王志,王春,等.中空纤维液相微萃取-高效液相色谱法测定水中残留的氨基甲酸酯类农药[J].色谱,2007,25(3):362-366.
[48] 朱莉萍,朱涛,马运平,等.中空纤维膜液相微萃取-气相色谱质谱法快速测定蔬菜汁中15种邻苯二甲酸酯[J].分析化学,2013,41(7):1 019-1 024.
[49] 刘志梅,陈永艳,杨秀敏,等.中空纤维液相微萃取-高效液相色谱法测定牛奶中3种大环内酯类抗生素残留[J].中国食品学报,2009,9(1):183-189.
[50] Mayor M A,Garcinuno R M,Fern P,et al.Liquid chromatography-UV diode-array detection method for multi-residue determination of macrolideantibiotics in sheep’s milk[J].Journal of Chromatography A,2006,1122:76-83.
[51] Msagatical M,Titus A.The use of supported liquid membranes in extraction of macrolides in biomatrices[J].Microchim.Acta,2004,148(3/4):199-214.
[52] 卜明楠,石志红,康健,等.QuEChERS结合 LC-MS/MS同时测定虾肉中72种兽药残留[J].分析测试学报,2012,31(5):552-558.
[53] 胡凤杨,贺利民,沈祥广,等.QuEChERS前处理方法结合LC-MS/MS测定蔬菜中26种抗生素残留[C].2013年中国畜牧兽医学会兽医药理毒理学分会第十二次学术讨论会论文集,2013:197-198.
[54] 黄晓蓉,郑晶,吴谦,等.食品中多种抗生素残留的微生物筛检方法研究[J].食品科学,2007,28(8):418-421.
[55] Petz M ,Solly R ,Lymburn M,et al.Thin-layer chromatographic determination of erythromycin and other macrolide antibiotics in livestock products[J].Association of Official Analytical Chemists ,1987,70(4):691-697.
[56] Riedl R,Luf W,Brandl E.The spectrophotometric determination of natamycin in cheese[J].Z.Lebensm.Unters.Forsch,1984,179(5):394-398.
[57] 田志仁,秦卫东.毛细管电泳用于抗生素的分离检测[J].北京师范大学学报:自然科学版,2009,45(3):254-258.
[58] 任超超,犹卫,高作宁,等.泰乐菌素的电化学测定方法[J].中国兽医杂志,2010,46(4):87-88.
[59] 史艳梅,刘转莉,田伟,等.毛细管电泳电化学发光检测大环内酯类抗生素及应用研究[J].分析化学,2009,37(z1):454.
[60] 史艳梅.毛细管电泳电化学发光灵敏检测大环内酯类抗生素及其应用研究[D].信阳:信阳师范学院,2010.
[61] Keigo T,Isamu U,Takuro S.Gas chromatographic-mass spectrometric determination of macrolide antibiotics in beef and pork using single ion monitoring[J].Journal of Chromatography,1987,391(1):207-217.
[62] 邢丽红,冷凯良,翟毓秀,等.鲈鱼组织中阿维菌素、伊维菌素残留的高效液相色谱荧光检测法研究[J].海洋水产研究,2008,29(4):52-57.
[63] Masakazu H,Koichi S,Rie I,et al.Simultaneous determination of five macrolide antibiotics in meat by high-performance liquid chromatography[J].Journal of Chromatography A,1998,812(1/2):295-302.
[64] 王敏,林维宣,郭德华,等.高效液相色谱-串联质谱法同时检测动物性食品中多种大环内酯类药物[J].分析测试学报,2007,26(5):675-678.
[65] Leslie C D.Performance characterization of a quantitative liquid chromatography-tandem mass spectrometric method for 12 macrolide and lincosamide antibiotics in salmon,shrimp and tilapia[J].Journal of Chromatography B,2014,967:203-210.
[66] TAO Yao-fei,YU Gang,CHEN Dong-mei,et al.Determination of 17 macrolide antibiotic and avermectins residues in meat with accelerated solvent extraction by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography B,2012,897(1):64-71.
[67] CHEN Kuan-yu,Thomas C Y,Sarah Y C.Determination of macrolide antibiotics using dispersive liquid-liquid microextraction followed by surface-assisted laser desorption/Ionization mass spectrometry[J].Journal of The American Society for Mass Spectrometry,2012,23(6):1 157-1 160.
[68] 罗辉泰,黄晓兰,吴惠勤,等.QuEChERS/液相色谱-串联质谱法同时测定鱼肉中30种激素类及氯霉素类药物残留[J].分析测试学报,2011,30(12):1 329-1 337.
[69] 包锦渊,迟晓峰,董琦,等.分散液相微萃取-高效液相色谱法测定蜂蜜中的磺胺类抗生素[J].光谱实验室,2012,29(3):1 934-1 937.
