NH4+对合成气乙醇发酵过程的影响及其酶学机理*
2015-12-25张炎达王风芹彭一丁谢慧宋安东
张炎达,王风芹,彭一丁,谢慧,宋安东
(河南农业大学生命科学学院,农业部农业微生物酶工程重点实验室,河南郑州,450002)
全球能源消耗预计到2030年将增加57%,化石燃料的大规模使用同时还带来诸多的能源紧缺、环境压力加剧和燃料价格大幅度上涨等问题[1],这就使得各国政府急切寻求一种可持续环保的再生绿色能源,其中生物燃料乙醇得到了世界广泛关注[2]。合成气乙醇发酵是目前公认的一种极具潜力和竞争力的生物燃料乙醇生产技术[3],该技术具有原料来源广泛、生物催化特异性高、能耗低、耐毒性强和H2∶CO的无限制比率等优点[4]。合成气是由气化原材料,如农林业废弃物和生活有机废物等各种生物质材料、工业废气、次品煤和天然气等[5-6]经气化装置在高温下含有水蒸气和氧的条件下裂解为富含H2、CO和CO2三种主要成分的混合气体,另外还包括其他组分,如:NH3、CH4、NOx、N2、C2H2、C2H4、C6H6、C2H6、SO2和焦油等[7],但根据原料和气化设备不同,合成气的组分和比列略有差异[8-9]。
合成气厌氧乙醇发酵微生物目前的种类及数量较少,且乙醇发酵产量较低,如C.ljungdahlii和C.autoethanogenum等[10],而国内还未有新菌的报道。Wood-Ljungdahl途径是该类菌体的唯一代谢路径,且氢化酶(H2ase,hydrogenase)、一氧化碳脱氢酶(CODH,carbon monoxide dehydrogenase)、乙醇脱氢酶(ADH,alcohol dehydrogenase)和乙酸激酶(ACK,acetate kinase)为其四大关键酶,而H2ase为还原力代谢的必需酶[3,7],H2ase活性的高低与 CO 利用效率的大小成正相关。在合成气乙醇发酵中,合成气杂质气体多对发酵产生有害影响,如Asma Ahmed等人[11]发现,微量的焦油和NO能抑制发酵和促进菌体休眠。同时,NO抑制合成气发酵菌C.carboxidivorans的 H2ase活性而阻碍 H2利用[12]。XU 等[13]还得出合成气中的NH3为H2ase的非竞争抑制剂的结论。研究发现,杂质气体NH3极易溶解于发酵培养基内,能快速转化为NH4+且其浓度不断累积[14],同时杂质NH3还会腐蚀设备,工业上常利用湿式洗涤技术进行脱氨处理[15],因而NH3对未来合成气乙醇发酵工业化影响较大。相比,有关合成气杂质气体NH3对合成气乙醇发酵过程的影响还未有报道,且NH3对发酵代谢关键酶的作用也未有研究,为此,本文系统研究了不同初始浓度的NH4+(NH4Cl)对菌株A-fm4,C.ljungdahlii和 C.autoethanogenum DSM10061利用生物质合成气发酵乙醇的影响,并进一步测定菌株在菌体生长期和乙醇发酵期内4种关键酶的活性变化。以期研究NH3对合成气乙醇发酵的影响和作用机理,为未来合成气乙醇发酵工业化发展提供参考依据。另外,实验中进行了菌株耐铵能力的研究,便于为日后耐铵菌株驯化提供菌种材料,希望获得能够利用含NH3粗合成气组分发酵的优良菌株。
1 材料与方法
1.1 菌株
菌株 A-fm4富集自羊驼的新鲜粪便[16];菌株Closlridium ljungdahlii和Closlridium autoethanogenum DSM10061均购自德国微生物菌种保藏中心(DSMZ)。
1.2 生物质合成气
实验用合成气按照玉米秸秆气化气组分配制,成分及比例如下:CO 85.5%,H210%,CO24.5%。购于河南源正科技发展有限公司。
1.3 培养基及配制方法
种子培养基(g/L)[17]:NaCl 0.80,NH4Cl 1.00,KCl 0.10,MgSO4·7H2O 0.20,CaCl20.04,KH2PO40.20,NaHCO31.00,酵母膏 1.00,MES[2-(N-吗啡啉)乙磺酸]5.00,L-盐酸半胱氨酸0.40,木糖5.00。添加微量元素溶液10 mL和维生素溶液10mL,pH 5.75。
发酵培养基(g/L)[17]:NH4Cl 1.00,NaCl 1.00,MgSO40.15,KH2PO40.10,CaCl20.04,胰蛋白胨2.00,酵母膏0.30,L-盐酸半胱氨酸0.20,MES 10.00,矿质元素溶液10 mL,维生素溶液10 mL,pH 7.0。
实验中发酵培养基初始NH4+浓度设置了6个梯度,分别为 0X、0.5X、1X、2X、4X 和 8X,因杂质气体NH3极易溶解于发酵培养基内,且能够快速转化为NH4+使得 NH4+浓度不断累积[14],所以实验中利用NH4+的浓度进行研究,即,将原发酵培养基的NH4Cl浓度标记为1 X。
维生素溶液均采用0.22 μm的滤膜过滤除菌,待接种后添加至培养基内。
上述所有培养基均准确配制,每80 mL培养液分装至200 mL厌氧培养瓶内(发酵培养基为每60 mL培养液分装至300 mL厌氧培养瓶内),再转入厌氧培养箱内添加刃天青0.5 mg/L,静置直至瓶内颜色由粉色转为无色时分别盖上瓶塞,于121℃灭菌20 min(灭菌过程中瓶塞插入针头)。灭菌后立刻拔去针头且移至厌氧培养箱内,待温度降至约37℃时进行后续实验。
1.4 合成气厌氧乙醇发酵
菌种活化参考文献[16],将对数期的各菌种子液按10%接种量转接至含有60 mL发酵培养液的厌氧培养瓶中,用注射器向厌氧瓶内加入240 mL合成气(以上操作均在厌氧培养箱内完成)。37℃,150 r/min摇床发酵7 d,每24 h取样测OD600值及乙醇含量。
1.5 产物测定及计算方法
1.5.1 乙醇和乙酸含量测定
将1.5 mL发酵液于4℃,8 000 r/min离心10 min,上清液用于两者浓度的测量。测定条件为:FID检测器,柱子为30 m ×0.32 mm ×0.3 μm HP-FFAP,氮气作为载气,起始3 min流速为1.9 mL/min,再以0.5 mL/min 升至 4 mL/min,分流比 50∶1,柱箱起始温度40℃,保持1.5 min后以40℃/min达到210℃并保持2 min,色谱进样口和检测器的温度分别为200℃和250℃。
1.5.2 细胞干重和指标计算
根据OD值及其对应的细胞干重(DCW)可获得发酵菌株的干重(y,g/L)与OD值(x)关系回归方程式。
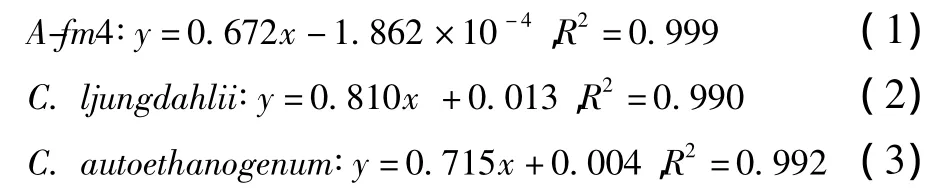
1.6 关键酶活性测定
关键酶H2ase、CODH和ADH活性测定方法分别参考文献[18];关键酶ACK活性测定方法参考文献[19]和[20],稍有改进。反应为:H2ase活性反应体系具体包含:0.4 mL 1 mol/L Tris-HCl(pH=7.5),0.2 mL 0.04 mol/L甲基紫精,0.2 mL 0.04 mol/L二硫苏糖醇,0.1 mL体积分数为5%的Triton-X100,2 mL脱气去离子水;CODH活性反应体系具体包含:0.8 mL 0.5 mol/L Tris-HCl(pH=6.8),0.2 mL 0.04 mol/L甲基紫精(MV),0.2 mL 0.04 mol/L二硫苏糖醇,0.1 mL体积分数为5%的Triton-X100,1.2 mL脱气去离子水。ADH活性反应体系具体包含:0.4 mL 1 mol/L Tris-Hcl(pH=7.5),0.12 mL 0.01 M NADH,0.4 mL 0.1 M 乙醛,0.5 mL 0.08 mol/L 二硫苏糖醇,0.1 mL体积分数为5%的Triton-X100,1.5 mL脱气去离子水;ACK活性反应体系具体包含:0.145 mL 1 mol/L Tris-HCl(pH=7.5),0.1 mL 2 mol/L乙酸钾,0.25 mL 0.08 mol/L二硫苏糖醇,0.1 mL体积分数为5%的Triton-X100,0.1 mL 0.1 mol/L MgCl2,0.1 mL 0.1 mol/L ATP,0.2 mL 3.5 mol/L 中性NH4OH-HCl,2 mL脱气去离子水。且二硫苏糖醇溶液现配现用。
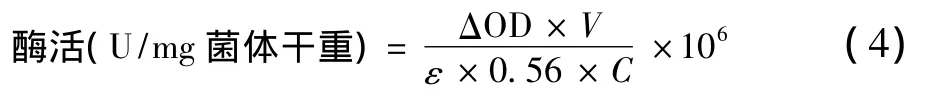
式中:△OD为吸收值每分钟降低的变化值,min-1;V为反应体系的体积,mL;E为摩尔消光系数,103L/(mol·cm);0.56为96孔板的光程,cm;C为测定中所加入菌体干物质量,g;106为摩尔转化为微摩尔的系数。酶活单位:单位干菌体每分钟还原1 μmol MV(1e-1还原)。
1.7 NH4+对菌株生长半抑制浓度
NH4+对发酵菌株生长半抑制浓度(Ki)的计算参考文献[21],通过对比不同发酵菌株的Ki值大小来衡量菌株的NH4+耐受能力强弱。
1.8 统计分析方法
为比较在不同初始NH4+浓度下对菌株发酵乙醇产量及其各发酵参数的影响,同时分析比较对两时期4种关键酶活性水平的差异,实验分别采用了方差分析和t值检验,以上各统计分析均由软件SPSS16.0完成。
2 结果与讨论
2.1 初始N H4+浓度对合成气发酵菌株生长的影响
不同梯度浓度NH4+对发酵菌株的生长影响见图1。菌株 A-fm4、C.ljungdahlii和 C.autoethanogenum的生物量分别在NH4+浓度0.5X、0X和0X于发酵4 d、1 d和2 d达到最大,菌体量分别为:0.045,0.166和0.097 g/L。菌株 A-fm4和 C.autoethanogenum DSM10061的生长过程受NH4+影响明显,NH4+对菌株C.ljungdahlii的影响主要表现在生长稳定期及以后,且随NH4+梯度浓度增大对菌株生长量和生长速率具有抑制能力。
由此可知,合成气发酵菌株对无机氮源的利用有限,发酵液内NH4+累积浓度高于9.35 mmol/L时生长受到不同程度的抑制作用。据报道,Escherichia coli已作为一种模式生物进行研究细菌对NH4+的吸收和排除是经过一种高K+亲和性的K+-NH4+交换系统(Kdp)[22],其中 Buurman 等[23]对 E.coli在高浓度NH4+环境中代谢活动的研究发现在高浓度NH4+条件下需要一种额外转运系统,即Kdp,来负责NH4+的摄入和泵出维持胞内外NH4+正常梯度及胞内pH的稳定,且高浓度NH4+使得菌体对能量的利用效率显著降低。同样,叶贵子等[21]对产琥珀酸放线杆菌的研究也得到相似结果。虽然目前还未见针对合成气厌氧发酵菌在Kdp系统与能量效率方面的确切报道,但可推测在本实验发酵菌体细胞内也存在类似机制。另外,数据显示K+的水合半径为5.32,近于NH4+的5.37,NH4+对K+在细胞膜同一载体上可竞争同一结合部位,这一竞争会破坏K+对细胞正常的生理功能,且随NH4+浓度的增大不断显著,进而导致对菌体的生长抑制。

图1 不同梯度NH4+浓度下发酵菌生长曲线Fig.1 Growth curve of organisms at different concentrations of NH4+
2.2 初始NH4+浓度对合成气发酵乙醇特性的影响
菌株 A-fm4、C.autoethanogenum DSM10061和C.ljungdahlii的乙醇产量均在NH4+浓度0X下于发酵5 d、2 d和3 d达到最大,其乙醇量分别为124.56,137.71和137.67 mg/L(图2)。其中,菌群A-fm4的乙醇发酵受NH4+浓度影响最大,其次为菌株C.autoethanogenum DSM10061,再次是菌株 C.ljungdahlii。NH4+浓度高于0.5X(9.35 mmol/L)时开始减缓菌株乙醇发酵速率,当浓度高于4X(74.8 mmol/L)其抑制作用更显著,因此不存在或低浓度NH4+会促进乙醇发酵,高浓度NH4+能降低乙醇发酵能力。

图2 不同梯度NH4+浓度下乙醇产量Fig.2 Ethanol production fermented at different concentrations of NH4+
2.3 初始N H4+浓度对合成气发酵乙酸特性的影响
图3为不同梯度浓度NH4+对合成气发酵菌株发酵乙酸特性的影响。菌株A-fm4、C.autoethanogenum DSM10061和C.ljungdahlii的乙酸产量分别在NH4+浓度2X、2X和0X或2X下于发酵5 d、4 d和3 d或4 d达到最大,乙酸量分别为218.19,302.72和304.80或304.95 mg/L。相比菌株A-fm4和C.autoethanogenum,菌株C.ljungdahlii乙酸发酵受 NH4+影响较弱,另外,NH4+浓度0.5X~4X(9.35~74.8 mmol/L)能不同程度地促进菌株A-fm4、C.autoethanogenum DSM10061和C.ljungdahlii乙酸发酵速率。结果表明,NH4Cl浓度在18.7~74.8 mmol/L会促进乙酸的发酵,浓度为149.6 mmol/L抑制乙酸发酵。

图3 不同梯度NH4+浓度下乙酸产量Fig.3 Acetate production fermented at different concentrations of NH4+
综合分析发酵菌株在不同梯度NH4+环境内的发酵情况可得:低浓度NH4+利于乙醇和乙酸发酵,高浓度NH4+对乙醇和乙酸均表现出抑制作用。当NH4+浓度高于9.35 mmol/L时,乙醇发酵随浓度的增大而抑制显著,NH4+浓度为18.7~74.8 mmol/L时会促进乙酸的发酵。发酵培养液内不含NH4+时利于更多的代谢流流向乙醇,促进乙醇且减弱乙酸发酵。
2.4 初始NH4+浓度对合成气发酵代谢关键酶活性的影响
不同初始NH4+浓度对合成气厌氧发酵菌株发酵代谢途径关键酶活性变化的影响结果见图4。H2ase和CODH酶活水平随NH4+浓度增大而抑制极显著(P<0.01),生长期酶活水平高于发酵期,NH4+浓度低于2X(37.4 mmol/L)促进菌株A-fm4该酶的高水平维持(A1~C1,A2~C2);除菌株 C.ljungdahlii外(B3),NH4+浓度大于2X(37.4 mmol/L)时ADH酶活大小受到抑制作用,其中菌株A-fm4生长期酶活水平大于发酵期,两时期酶活均受NH4+影响显著(A3),菌株C.autoethanogenum DSM10061生长期酶活水平受NH4+影响,而发酵期 ADH酶活大小趋于稳定(C3)。相比,菌株C.ljungdahlii两时期ADH酶活均受NH4+影响较小;对于ACK,菌株A-fm4和C.ljungdahlii在低浓度和高浓度NH4+下其活性水平均受抑制,NH4+浓度1X~2X(18.7 mmol/L~37.4 mmol/L)可促进ACK活性,且生长期酶活水平一般高于发酵期(A4和B4),而菌株C.autoethanogenum DSM10061在NH4+浓度低于2X(37.4 mmol/L)时可维持较高活性水平,高浓度NH4+抑制酶活(C4)。因此,低浓度NH4+可促进关键酶活性,高浓度NH4+具有抑制作用,且生长期酶活水平较大于发酵期的值。
Wood-Ljungdahl代谢途径中H2ase和CODH可分别通过催化氧化H2和CO产生还原力和质子,其中H2ase为代谢过程中还原力获得的必需酶,H2ase活性水平会直接影响到 CO的利用效率,高活性H2ase可弱化由CO经CODH产生还原力的途径,促进CO作为碳源和能源,而H2ase低活性时其结果相反[1]。由上述结果可知,NH4+浓度能影响 H2ase和CODH的活性大小,而对H2ase的活性影响显著,因此从酶学层面上可解释NH4+浓度大于2X时逐渐抑制发酵菌株的生长,而低浓度或不存在NH4+可促进菌体的生长(图1)。另外,NH4+对H2ase和CODH的抑制机制可理解如下,即,NH3和NH4+在发酵液中快速转化,NH3易通过细胞膜进入胞内,继续电离NH4+[24],改变胞浆内外的原有正常NH4+梯度,使得H2ase和CODH暴露于更多NH4+环境内,自由NH4+的增多影响到酶结构域的电位变化导致其活性降低,NH4+浓度越高抑制酶活作用越强。研究证明,H2ase和CODH常依附于胞膜内侧[25],鉴于高浓度NH4+会对其抑制及NH3易出入细胞膜的能力,可假设在菌株发酵中存在于菌体胞内的H2ase和CODH受NH4+抑制浓度可能为37.4 mmol/L。ADH是 Wood-Ljungdahl中乙醇代谢的关键酶,实验中菌株 A-fm4的ADH酶活受NH4+浓度影响显著,当NH4+浓度在2X以内时该酶活性维持较高水平(图4-A3),进而促进乙醇发酵(图2-A)。对于该菌群,理论上ADH酶活应在发酵期达到较高水平,实际上发酵期获得最大乙醇产量但其活性降低,可能的解释是ADH活性虽在后期降低,但足以满足合成乙醇所必须的酶活大小,或是在发酵期ADH随着发酵环境的改变ADH活性降低,但在菌体内的表达量却在增加来满足乙醇代谢[18]。针对菌株 C.ljungdahlii和 C.autoethanogenum DSM10061,ADH的活性受NH4+影响小,酶活水平相当,具有一定的耐受能力,有学者[26]对菌体C.ljungdahlli内参基因稳定性及重要基因表达量的研究发现,与乙醇合成相关的重要基因aor2在不同碳源内的表达量稳定,这可提示本实验两菌株在不同浓度NH4+发酵环境中该基因或ADH相关重要基因也存在类似稳定表达的能力进而使得ADH活性水平稳定,只是对于C.autoethanogenum DSM10061这种稳定表达在乙醇发酵期得到主要体现。另外,菌株C.ljungdahlii和C.autoethanogenum DSM10061在乙醇发酵期的ADH虽具有一定的耐受性(图4-B3,B4),但乙醇产量却低于低NH4+浓度(小于2X)的发酵乙醇产量,关键问题是在较高NH4+浓度下H2ase活性受到抑制,进而在代谢流中用于乙醇代谢的还原力减少导致乙醇合成降低。
合成气厌氧发酵的乙酸发酵离不开关键酶ACK,实验发现,NH4+浓度在18.7~37.4 mmol/L可促进其活性,相继乙酸产量增加(图3)。室温下,乙酸解离常数pKa为4.75,在菌体胞浆的偏中性中其主要以 Ac-和 H+存在,因此在1X和2X下胞内NH4+的电离利于胞浆正常pH范围的稳定,减少大量乙酸在胞内对酶促反应的抑制,随分子乙酸由细胞调节机制[27]不断移出胞内使发酵液内乙酸浓度不断增加。基于0X下促进乙醇而降低乙酸发酵,因此当不存在NH4+时利于更多的代谢流流向乙醇。
2.5 发酵菌株对NH4+的耐受能力对比
由表1知,NH4+对不同种类发酵菌的生长抑制程度不同,3种发酵出发菌中仅菌株A-fm4对NH4+最为敏感,其 Ki值为 123.61 mmol/L。相比,菌株 C.ljungdahlii和 C.autoethanogenum DSM10061的 Ki值分别为208.13 mmol/L和240.37 mmol/L,耐NH4+能力较强,这或许为未来该菌直接利用含氨气的粗制合成气发酵乙醇提供重要启示。同时菌株C.ljungdahlii和C.autoethanogenum DSM10061可为未来工业菌株耐铵驯化提供菌种材料,耐铵菌种的使用利于合成气厌氧乙醇发酵的工业化进程,为降低粗制合成气脱氨设备的资金投入甚至删减脱氨工艺工序都具有重要意义。

表1 NH4+对发酵菌株的半抑制常数(Ki)Table 1 Ammnia half-inhibitin constant(Ki)for fermentation microorganisms
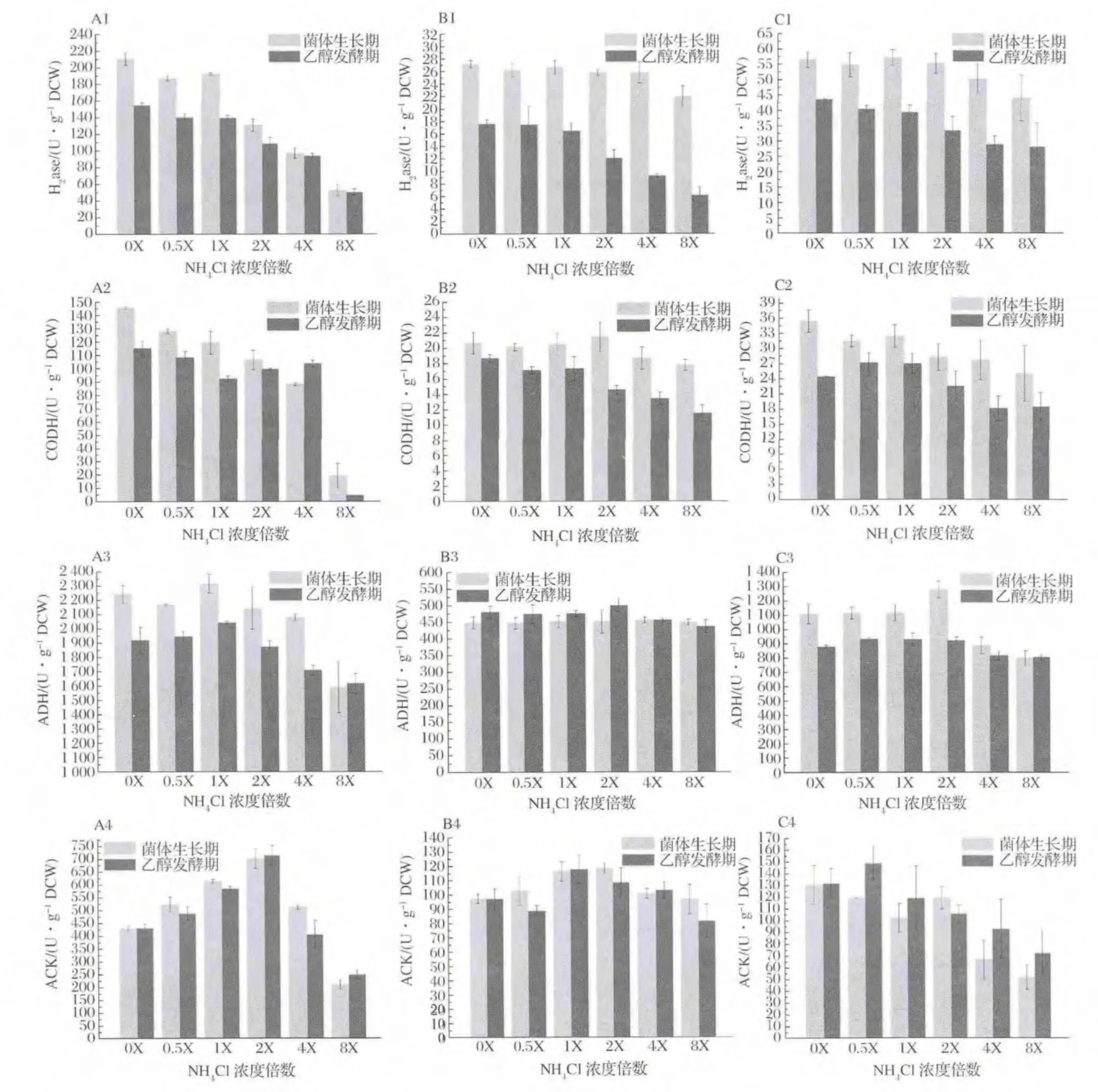
图4 NH4+对菌株发酵过程中两时期关键酶活性的影响Fig.4 The activity of key enzymes existed in growth period and ethanol fermentation period at different concentrations of NH4+
3 结论
(1)发酵培养基内不同初始浓度的NH4+对菌株A-fm4,C.ljungdahlii和 C.autoethanogenum DSM10061发酵过程中的生长影响显著,其中对菌株C.ljungdahlii的影响主要表现在生长稳定期及以后。结果表明,菌株 A-fm4、C.ljungdahlii和 C.autoethanogenum DSM10061分别在NH4+浓度0.5X、0X和0X下获得最大生物量,分别为0.045,0.166和0.097 g/L。当NH4+浓度高于9.35 mmol/L时,随NH4+梯度浓度增大对菌株生长量和生长速率具有抑制能作用。
(2)综合分析合成气发酵过程可知:低浓度NH4+利于乙醇和乙酸发酵,高浓度NH4+对乙醇和乙酸均表现出抑制作用。当NH4+浓度高于9.35 mmol/L时,乙醇发酵随浓度的增大而抑制显著,NH4+浓度为18.7~74.8 mmol/L时会促进乙酸的发酵。发酵培养液内不含NH4+时利于更多的代谢流流向乙醇,促进乙醇且减弱乙酸发酵。
(3)关键酶 H2ase,CODH,ADH和 ACK均受高浓度(149.6 mmol/L)NH4+抑制,且菌体生长期的酶活水平一般高于发酵期,H2ase和CODH随NH4+浓度升高而酶活下降极显著,H2ase活性的高低显著影响发酵过程中还原力的供给,直接影响菌体生长和乙醇发酵。除菌株A-fm4外,菌株C.ljungdahlii和C.autoethanogenum DSM10061的ADH受NH4+影响较小,推测该酶在胞内具有稳定表达机制。NH4+浓度1X~2X(18.7~37.4 mmol/L)可促进ACK活性,且不存在NH4+时也会降低该酶活性。
(4)菌株 C.ljungdahlii和 C.autoethanogenum DSM10061的Ki值分别为208.13 mmol/L和240.37 mmol/L,耐铵能力较强,可为未来耐铵菌种的驯化提供菌种材料,为将来降低脱氨设备资金投入和减少合成气净化的复杂工序提供技术准备。
[1] Latif H,Zeidan A A,Nielsen A T,et al.Trash to treasure:production of biofuels and commodity chemicals via syngas fermenting microorganisms[J].Current Opinion in Biotechnology,2014,27:79-87.
[2] Vohra M,Manwar J,Manmode R,et al.Bioethanol production:Feedstock and current technologies[J].Journal of Environmental Chemical Engineering,2014,2(1):573-584.
[3] Bengelsdorf F R,Straub M,Dürre P.Bacterial synthesis gas(syngas)fermentation[J].Environmental Technology,2013,34(13):1 639-1 651.
[4] Henstra A M,Sipma J,Rinzema A,et al.Microbiology of synthesis gas fermentation for biofuel production[J].Current Opinion in Biotechnology,2007,18(3):200-206.
[5] Kirkels A F,Verbong G P.Biomass gasification:Still promising?A 30-year global overview[J].Renewable and Sustainable Energy Reviews,2011,15(1):471-481.
[6] Phillips J,Klasson K,Clausen E,et al.Biological production of ethanol from coal synthesis gas[J].Applied Biochemistry and Biotechnology,1993,39(1):559-571.
[7] Abubackar H N,Veiga M C,Kennes C.Biological conversion of carbon monoxide:rich syngas or waste gases to bioethanol[J].Biofuels,Bioproducts and Biorefining,2011,5(1):93-114.
[8] Somerville C,Youngs H,Taylor C,et al.Feedstocks for lignocellulosic biofuels[J].Science(Washington),2010,790(329):790-792.
[9] Rollins M L,Reardon L,Nichols D,et al.National Energy Technology Lab.,Pittsburgh,PA(US);National Energy Technology Lab.,Morgantown,WV(US),2002.
[10] Cotter J L,Chinn M S,Grunden A M.Influence of process parameters on growth of Clostridium ljungdahlii and Clostridium autoethanogenum on synthesis gas[J].Enzyme and Microbial Technology,2009,44(5):281-288.
[11] Ahmed A,Cateni B G,Huhnke R L,et al.Effects of biomass-generated producer gas constituents on cell growth,product distribution and hydrogenase activity of Clostridium carboxidivorans P7T[J].Biomass and Bioenergy,2006,30(7):665-672.
[12] Ahmed A,Lewis R S.Fermentation of biomass-generated synthesis gas:Effects of nitric oxide[J].Biotechnology and Bioengineering,2007,97(5):1 080-1 086.
[13] XU D,Lewis R S.Syngas fermentation to biofuels:Effects of ammonia impurity in raw syngas on hydrogenase activity[J].Biomass and Bioenergy,2012,45:303-310.
[14] CHEN S,LING J,Blancheton J-P.Nitrification kinetics of biofilm as affected by water quality factors[J].Aquacultural Engineering,2006,34(3):179-197.
[15] Daniell J,Köpke M,Simpson S D.Commercial biomass syngas fermentation[J].Energies,2012,12(5):5 372-5 417.
[16] 宋安东,冯新军,王风芹,等.合成气发酵制取乙醇微生物的对比[J].生物工程学报,2013,29(3):242-249.
[17] 王风芹,张炎达,谢慧,等.生物质气化气发酵生产乙醇优良菌株的筛选[J].农业工程学报,2015,31(7):221-226.
[18] Ukpong M N,Atiyeh H K,De Lorme M J,et al.Physiological response of Clostridium carboxidivorans during conversion of synthesis gas to solvents in a gas‐fed bioreactor[J].Biotechnology and Bioengineering,2012,109(11):2 720-2 728.
[19] Aceti D J,Ferry J G.Purification and characterization of acetate kinase from acetate-grown Methanosarcina thermophila.Evidence for regulation of synthesis[J].Journal of Biological Chemistry,1988,263(30):15 444-15 448.
[20] Sridhar J Eiteman M A,Wiegel J W.Elucidation of enzymes in fermentation pathways used by Clostridium thermosuccinogenes growing on inulin[J].Applied and Environmental Microbiology,2000,66(1):246-251.
[21] 叶贵子,姜岷,陈可泉,等.耐铵型产琥珀酸放线杆菌的选育及铵离子对其生长代谢的影响[J].生物工程学报,2010,26(2):183-188.
[22] Marinus M,Neidhardt F,Curtiss I,et al.Escherichia coli and Salmonella:cellular and molecular biology[J].Escherichia coli and Salmonella:Cellular and Molecular Biology,1996,2:1 579-1 601.
[23] Buurman E T,De Mattos M J T,Neijssel O M.Futile cycling of ammonium ions via the high affinity potassium uptake system(Kdp)of Escherichia coli[J].Archives of Microbiology,1991,155(4):391-395.
[24] Khademi S,O'connell J,Remis J,et al.Mechanism of ammonia transport by Amt/MEP/Rh:structure of AmtB at 1.35 Å[J].Science,2004,305(5 690):1 587-1 594.
[25] Bagyinka C,Kovács K L,Rak E.Localization of hydrogenase in Thiocapsa roseopersicina photosynthetic membrane[J].Biochemical Journal,1982,202(1):255-258.
[26] 刘娟娟.Clostridium ljungdahlii内参基因稳定性评价及其在重要基因相对表达量研究中的应用[D].重庆:西南大学,2013:41-50.
[27] Russell J.Another explanation for the toxicity of fermentation acids at low pH:anion accumulation versus uncoupling[J].Journal of Applied Bacteriology,1992,73(5):363-370.
