欧李红色素在复杂体系中的抗氧化作用*
2015-12-25左玉冯丽霞朱瑞涛张彩凤谢文磊
左玉,冯丽霞,朱瑞涛,张彩凤,谢文磊
1(太原师范学院 化学系,山西太原,030031)2(河南工业大学化学化工学院,河南郑州,45001)
欧李是一种营养价值较高的水果,含有多种维生素、微量元素和氨基酸[1],在食品、医药、饮料等加工业方面有很大的发展前景[2-3]。欧李果含有大量的花青素,即欧李红色素,为黄酮类花色苷化合物[4-5]。
本研究用水溶性的偶氮化合物AAPH热分解生成的自由基引发脂质氧化,通过硫氰酸铁法(FCT)和硫代巴比妥酸反应物法(TBARS)检测脂质的氧化进程,研究欧李红色素在用大豆磷脂脂质体模拟非均相生物体系和用非离子表面活性剂Tween 20稳定的葵花油水包油乳状液模拟非均相食品体系中的抗氧化活性,同时也研究VC或VE的加入对欧李红色素抗氧化活性的影响,以期明确欧李红色素在复杂体系下的抗氧化行为及其协同作用。
1 材料与方法
1.1 材料与试剂
欧李红色素:欧李果肉以酸性乙醇溶液浸提,浸提液45℃浴温真空浓缩,浓缩浸提液以AB-8大空吸附树脂吸附,乙醇洗脱,洗脱液经浓缩干燥得欧李红色素结晶。
大豆磷脂,黑龙江前进油厂;葵花籽油,天津嘉里粮油工业有限公司;Tween 20,上海三浦化学试剂公司;AAPH[2,2-偶氮(2-脒基丙烷)盐酸],ALDRICH化学试剂公司;抗坏血酸(VC),洛阳化学试剂厂;α-生育酚(VE)、叔丁基对苯二酚(TBHQ)(纯度 >97%),Sigma公司;FeCl2·4H2O(含量 > 99.7%),天津双船化学试剂厂;2-硫代巴比妥酸(TBA),中国医药(集团)上海化学试剂公司;三氯乙酸(TCA),上海化学试剂采购供应站;NH4SCN(含量 >98.5%)、Na2HPO4、NaH2PO4、NaCl、CHCl3、无水乙醇,洛阳化学试剂厂。试剂均为分析纯,实验用水为二次蒸馏水。
1.2 仪器与设备
722S型分光光度计、KQ-100超声波清洗仪、旋转蒸发器RE-52C、SHZ-DA(Ⅲ)循环水式真空泵,巩义市英裕予华仪器厂;SHZ-C水浴恒温振荡器,江苏省金坛市华锋仪器有限公司;80-1型离心沉淀机、TL80-2型医用离心机,江苏姜堰市天力医疗器械有限公司;101-2S型电热恒温鼓风干燥箱,上海路达实验仪器厂;微量加样器(10~100 μL),上海青花仪器厂;微量加样器(100~500 μL),上海求精生化试剂仪器有限公司;BS224S万分之一电子天平,北京赛多利斯仪器系统有限公司。
1.3 实验方法
1.3.1 总酚含量的测定
按Folin-Ciocalteu法[6]进行测定,以原儿茶酸为标准物。取0.500 0 g没食子酸,用10 mL乙醇溶解,再用蒸馏水定容至100 mL。然后,分别移取0、1.0、2.0、3.0、5.0、10.0 mL用乙醇溶解的没食子酸溶液,置于100 mL容量瓶中,用蒸馏水定容。此溶液为标准溶液。从不同浓度的标准溶液中分别移取1.0 mL,置于100 mL容量瓶中,再在6个容量瓶中分别加入60 mL蒸馏水和5 mL Folin-Ciocalteu试剂,混合均匀。在0.5~8.0 min内,加入15 mL 20%Na2CO3溶液,用蒸馏水定容至100 mL。将上述标准溶液于20℃下在暗处放置2 h后,在765 nm波长下测定吸光值,绘制标准曲线。回归方程为:y=7.187 5 x-0.009 1,R2=0.999 7。
取0.25 mg/mL欧李红色素0.5 mL,按标准曲线法测量其酚含量。
1.3.2 大豆磷脂脂质体的制备
按薄膜法[7]进行,称取10.0 g大豆磷脂,用三氯甲烷溶解定容至250 mL(40 mg/mL),储存于冰箱中备用。再量取10.0 mL大豆磷脂的三氯甲烷溶液于100 mL圆底烧瓶中,45℃减压蒸去三氯甲烷,加入含有水溶性抗氧化剂欧李红色素的磷酸盐缓冲溶液(pH为7.4),使总体积为50 mL。将混合液剧烈摇动,并在超声波振荡器中振荡20 min,制备脂质体,脂质体溶液呈乳白色不透明状。
1.3.3 葵花油水包油乳状液的制备
乳状液的制备参考 Yen等[8]和 Chang等[9]的工作,具体操作如下:称取5.0 g葵花油置于100 mL圆底烧瓶中,依次加入25 mL含20 mg/mL Tween 20的磷酸盐缓冲溶液、含有水溶性抗氧化剂欧李红色素的磷酸盐缓冲溶液,再添加磷酸盐缓冲溶液,使总体积为50 mL。将混合液剧烈摇动,并在超声波振荡器中振荡20 min,形成乳白色不透明乳状液。
1.3.4 脂质的氧化
本研究采用水溶性偶氮化合物AAPH作为引发剂,加速大豆磷脂脂质体和葵花油乳状液的氧化。
向大豆磷脂脂质体分散液中加入5 mg/mL AAPH 0.5 mL,或葵花油水包油乳状液中加入5 mg/mL AAPH 1.0 mL后,置于转速约为175 r/min的水浴恒温振荡器中,恒温37℃发生氧化反应。在脂质体中抗氧化剂的添加量分别为0.001 6 mg/mL(欧李红色素的质量为0.08 mg,下同)、0.004 mg/mL(0.2 mg)、0.008 mg/mL(0.4 mg)(浓度相当于磷脂质量的0.02%、0.05%、0.10%),在乳状液中欧李红色素的添加量分别为0.02 mg/mL(1 mg)、0.05 mg/mL(2.5 mg)、0.10 mg/mL(5 mg)(浓度相当于油重的0.02%、0.05%、0.10%),考查不同浓度欧李红色素在大豆磷脂脂质体和葵花油乳状液中作为抗氧化剂的作用和效果。需要说明的是,在上述2种非均相体系中所使用的欧李红色素的添加量均能使其显示出较好的抗氧化性,且浓度之间有一定的数量关系,易于了解欧李红色素的抗氧化作用随浓度变化的变化趋势和规律。然后每隔1.5 h定时取样进行分析,用FTC法和TBARS法检测脂质的氧化进度,同时做空白实验(即在大豆磷脂脂质体和葵花油乳状液中不加欧李红色素)。每组实验均作双份平行样,重复做3次,结果以平均值表示。
1.3.5 抗氧化活性的测定
1.3.5.1 硫氰酸铁法(FTC法)
FCT法可测定脂质氧化的初级产物脂质过氧化物,其原理是:脂质氧化产生的过氧化物能将Fe2+氧化成Fe3+,Fe3+与NH4SCN反应,形成红色的硫氰酸铁络合物,在500 nm处有最大吸收,高的吸光度值表示脂质氧化的程度高。本实验采用 Mitsuda等人[10-11]的方法:每隔1.5 h取0.1 mL反应液,加入体积分数75%乙醇4.7 mL与30%NH4SCN 0.1 mL,再加入0.02 mol/L的FeCl2/3.5%HCl溶液0.1 mL,在室温下反应3 min,于500 nm处测量吸光度。吸光度值与过氧化物的量符合朗伯-比尔定律。
1.3.5.2 硫代巴比妥酸反应物法(TBARS法)
采用Kosugi等人的方法测定脂质过氧化物降解产生的丙二醛MDA[12],并稍有改动。每隔1.5 h取0.5 mL反应液,加入2.8 mg/mL的 TBA 2 mL、0.2 mg/mL的TCA 2 mL和0.8 mg/mL的TBHQ 1 mL(TBHQ的加入是为了防止脂质过氧化产物与TBA共热时分解生成可与TBA反应,而使氧化反应终止的物质)。将混合溶液置于沸水浴中加热20 min,用自来水冷却10 min,加入2 mL氯仿,离心10 min(3 000 r/min)。取上清液在532 nm处测其吸光度。
1.4 抑制率的计算

其中:A空白和A样品分别为t时间空白试验和对应时间点被测样品的吸光度。
1.5 数据处理与分析
每次实验至少平行进行3次,采用Origin 8.0和Microsoft Excel数据分析软件对实验数据进行计算和相关统计学分析,并以平均值±标准偏差表示,采用单因素方差分析(ANOVA)。对各组数据采用方差分析,P<0.05有统计学意义。
2 结果与讨论
2.1 大豆磷脂和葵花油的脂肪酸组成(表1、表2)
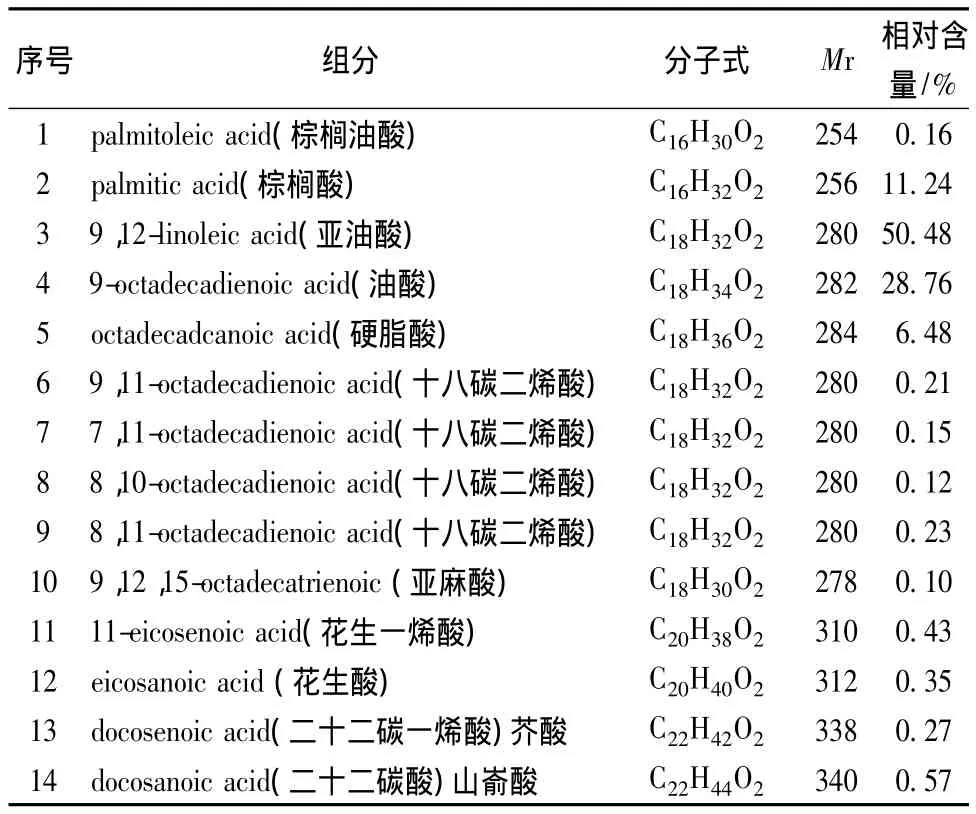
表1 葵花油的主要脂肪酸组成Table 1 The main composition of fatty acid in sunflower oil

表2 大豆磷脂的主要脂肪酸构成Table 2 The main composition of fatty acid in soybean phosphatidylcholine
2.2 不同浓度欧李红色素对复杂体系中脂质氧化的影响
2.2.1 大豆磷脂脂质体
图1为在大豆磷脂脂质体中添加不同浓度的欧李红色素后对脂质氧化过程中过氧化物和丙二醛的变化情况。不同浓度欧李红色素对大豆磷脂脂质体的氧化均具有明显的抑制作用,不同浓度欧李红色素的抗氧化活性不同,其抗氧化活性顺序为0.001 6 mg/mL>0.00 4 mg/mL>0.008 mg/mL,说明在实验浓度范围内随着浓度增加抗氧化活性下降。

图1 不同浓度欧李红色素在大豆磷脂脂质体中对脂质过氧化物(FTC)(A)和MDA生成量的影响(TBARS)(B)Fig.1 Effect of different concentrations of the red pigments of Cerasus humilis on oxidative stability in soybean PC liposome in the presence of 15 μmol/L AAPH at 37℃:(A)lipids peroxides;(B)TBARS.A control was without sample
通过计算抑制率,浓度为0.001 6、0.004和0.008 mg/mL的欧李红色素抑制脂质过氧化物的能力分别为18.89%、15.21%、11.52%(P <0.05,以下均相同),抑制 TBARS的生成的能力分别为36.21%、33.62%、31.90%。以上数据显示,这种因浓度不同而引起的抗氧化活性差异对抑制氧化后期产物的生成要比抑制过氧化物的生成大。
2.2.2 葵花油水包油乳状液
图2为欧李红色素在葵花油乳状液中抑制脂质氧化的情况。不难看出,欧李红色素在一定程度上阻止了葵花油乳状液的氧化,并且抗氧化活性随其浓度的升高而降低,即抗氧化活性顺序为0.02 mg/mL>0.05 mg/mL>0.10 mg/mL,与脂质体具有相似的抗氧化规律。
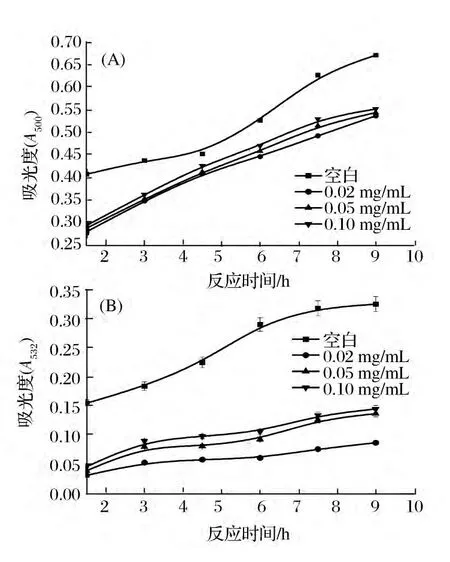
图2 不同浓度欧李红色素在葵花油乳状液中对脂质过氧化物(FTC)(A)和MDA生成量的影响(TBARS)(B)Fig.2 Effect of different concentrations of the red pigments of Cerasus humilis on oxidative stability in sunflower oil-in-water emulsions stabilized by Tween-20 in the presence of 30 μM AAPH at 37 ℃:(A)lipids peroxides;(B)TBARS.A control was without sample
反应初期,FTC法和TBARS法的吸光度值均增加较快,但随着反应的进行,吸光度增加的趋势逐渐减慢,说明欧李红色素的消耗随时间的增加逐渐加快,其抑制脂质氧化的能力下降。通过公式计算抑制率,浓度为0.02、0.05和0.10 mg/mL的欧李红色素抑制脂质过氧化物的能力分别为19.97%、18.93%、17.73%,抑制TBARS的生成的能力分别为73.23%、57.85%、55.38%。
以上实验结果说明欧李红色素作为抗氧化剂加入到大豆磷脂脂质体和葵花油乳状液后,具有很好的抗氧化作用,可作为天然抗氧化剂使用。
多项研究表明,黄酮类花色苷是一种具有抗辐射、抗炎和抗癌等重要生理和生物学功能的抗氧化剂和自由基捕获剂[13]。花青素还能与VC和VE等抗氧化剂之间产生协同效应,具有增效剂的作用。
用标准曲线法测量欧李红色素的酚含量为(16.51±0.8)mg/g干重,表明了其抗氧化活性可能是存在酚羟基之原因。酚类化合物与脂质自由基反应后形成的自由基稳定性较高,其原因是未成对的电子可以在苯环上离域分布。
根据Arit等人[14]的报道,花色苷或其他黄酮类物质的抗脂质氧化机理主要是花青素分子中的多个酚羟基可以作为氢供体,对多种活性氧和自由基均具有清除作用,生成活性较低的原花色素自由基,打断自由基的链反应,减少自由基的产生。
2.3 不同浓度欧李红色素和VC对复杂体系中脂质氧化的影响
人们在筛选抗氧化剂的过程中,发现在一些生物抗氧化剂里添加VC、VE或BHT、BHA等,其所形成的抗氧化剂复合体的抗氧化效果往往强于单一抗氧化剂的抗氧化效果,这种作用称为协同作用。
本实验研究欧李红色素与VC或VE共同作用时所形成的复合抗氧化剂的抗氧化活性,所得数据采用加和法和直接比较法进行分析。2种方法说明如下:(1)加和法使用的公式为Y=P(x1+x2)-(Px1+Px2),Y为复合抗氧化剂的抑制率和单一组分在相同浓度下抑制率总和的差值。Y>0,说明组分间存在正协同作用,简称协同作用;Y<0,说明组分间存在负协同作用,称为无协同作用。(2)直接比较法。若欧李红色素与VC或VE形成的复合抗氧化剂的抑制率大于等浓度的欧李红色素或VC或VE的抑制率,则表明组分间存在协同作用,反之则为无协同作用[15]。
2.3.1 大豆磷脂脂质体
图3为欧李红色素与VC加入大豆磷脂脂质体中用FTC法和TBARS法测得的磷脂氧化行为。在FTC法中(图3-A),加入0.001 6 mg/mL VC的复合抗氧化剂的吸光度值较高于单一欧李红色素和VC的值,说明了2种抗氧化剂共同使用的抗氧化效果不如单一欧李红色素和VC。抑制率如下:0.001 6 mg/mL VC+0.001 6 mg/mL 色素,11.29%;0.001 6 mg/mL VC+0.008 mg/mL色素,11.06%,均低于0.001 6 mg/mL VC、0.001 6 mg/mL 色素、0.008 mg/mL 色素的抑制率(分别为21.89%、18.89%、11.52%),表明了0.001 6 mg/mL VC降低了欧李红色素的抗氧化能力,显示一定的助氧化作用。TBARS法测得(图3-B),0.001 6 mg/mL VC、0.001 6 mg/mL 色素、0.008 mg/mL色素、0.001 6 mg/mL VC+0.001 6 mg/mL色素和0.001 6 mg/mL VC+0.008 mg/mL色素的抑制率分别为58.62%、36.21%、31.90%、50.09%和41.38%,均低于0.001 6 mg/mL VC的抑制率(58.62%),说明复合抗氧化机剂不显示协同作用。但通过比较发现,欧李红色素与0.001 6 mg/mL VC共同作用时,抑制大豆磷脂脂质体氧化的能力比欧李红色素单独作用时略微增强。

图3 不同浓度欧李红色素和VC在大豆磷脂脂质体中对脂质过氧化物(FTC)(A)和MDA生成量的影响(TBARS)(B)Fig.3 Interaction of the red pigments of Cerasus humilis and ascorbic acid on oxidative stability in soybean PC liposome in the presence of 15 μM AAPH at 37℃:(A)lipids peroxides;(B)TBARS
通过对大豆磷脂脂质体中抗氧化行为的研究,发现VC的加入并没有明显改善欧李红色素的抗氧化能力。由于VC是较好的水溶性抗氧化剂,而欧李红色素在水中的溶解度小于VC,使得VC更易发挥其抗氧化作用,所以VC与欧李红色素共同作用没有VC单独使用时的抗氧化效果最好。
2.3.2 葵花油水包油乳状液
图4-A为在葵花油乳状液中加入色素、VC及其复合物后脂质的氧化曲线。可以看出,当欧李红色素和VC的浓度均为0.02 mg/mL时,2种抗氧化剂的抗氧化作用差异非常显著,VC的抗氧化能力明显高于欧李红色素。色素、VC及其复合物抗氧化性能大小顺序为:0.02 mg/mL VC(抑制率为82.12%,下同)>0.02 mg/mL色素 +0.02 mg/mL VC(24.29%)>0.10 mg/mL色素 +0.02 mg/mL VC(22.50%)>0.02 mg/mL色素 (19.97%)>0.10 mg/mL色素(17.73%)。该实验结果说明了加入VC后,复合物的抗氧化活性增加,但这种水溶性抗氧化剂没有显示协同抗氧化作用。由图4-A还可看出,在欧李红色素中加入VC后所表现出的随浓度变化规律与未加入相同,即随色素浓度升高,抑制率下降。
用TBARS法检测到的结果与FTC法明显不同,欧李红色素与VC对葵花油乳状液后期氧化物的抑制能力差异不大。由图4-B可看出,色素、VC及其复合物抗氧化性能的大小顺序为0.02 mg/mL色素>0.02 mg/mL VC>0.02 mg/mL色素+0.02 mg/mL VC>0.10 mg/mL色素>0.10 mg/mL色素+0.02 mg/mL VC,抑 制率 依 次 为 73.23%、67.08%、60.62%、55.38%和43.08%,说明了VC的加入并没有改善欧李红色素的抗氧化活性,反而使得复合抗氧化剂的抑制率低于单一抗氧化剂的抑制率,即显示负协同作用。

图4 不同浓度欧李红色素和VC在葵花油乳状液中对脂质过氧化物(FTC)(A)和MDA生成量的影响(TBARS)(B)Fig.4 Interaction of the red pigments of Cerasus humilis and ascorbic acid on oxidative stability in sunflower oil-in-water stabilized by Tween-20 in the presence of 30 μM AAPH at 37 ℃:(A)lipids peroxides;(B)TBARS
2.4 不同浓度欧李红色素和VE对复杂相体系中脂质氧化的影响
2.4.1 大豆磷脂脂质体
考察了VE、欧李红色素及其不同配比复合物对大豆磷脂脂质体氧化的过氧化物生成量的影响,实验结果见图5-A。从图5-A可看出,加入0.001 6 mg/mL VE的复合抗氧化剂的吸光度值较高于单一欧李红色素和VE的值,说明了2种抗氧化剂共同使用的抗氧化效果不如单一欧李红色素和VE。抑制率如下:0.001 6 mg/mL VE+0.001 6 mg/mL色素,10.60%;0.001 6 mg/mL VE+0.008 mg/mL色素,11.29%,均低于 0.001 6 mg/mL VE、0.001 6 mg/mL色素、0.008 mg/mL色素的抑制率(分别为32.72%、18.89%、11.52%),说明加入VE后使色素的抗氧化活性降低,因而也就不存在它们之间的协同作用。
图5-B是用TBARS法测定的VE、欧李红色素及其不同配比复合物对大豆磷脂脂质体后期氧化产物生成量的影响。0.001 6 mg/mL VE、0.001 6 mg/mL色素、0.008 mg/mL色素、0.001 6 mg/mL VE+0.001 6 mg/mL色素和0.001 6 mg/mL VE+0.008 mg/mL色素的抑制率分别为 66.38%、36.21%、31.90%、58.62%和62.93%。可以看出,复合抗氧化剂的抗氧化活性不如相应浓度VE的抗氧化活性高,但比相应浓度的色素抗氧化活性高,VE和色素没有协同作用。图7-B表明,在大豆磷脂脂质体中,VE、色素及其复合物抑制后期过氧化产物丙二醛生成的活性比抑制过氧化物生成的活性高。

图5 不同浓度欧李红色素和VE在大豆磷脂脂质体中对脂质过氧化物(FTC)(A)和对MDA生成量的影响(TBARS)(B)Fig.5 Interaction of the red pigments of Cerasus humilis and α-tocopherol on oxidative stability in soybean liposome in the presence of 15 μmol/L AAPH at 37 ℃:(A)lipids peroxides;(B)TBARS
2.4.2 葵花油水包油乳状液
图6为欧李红色素与VE加入葵花油乳状液中用FTC法和TBARS法测得的抗氧化行为,FTC法测定结果表明(图6-A)当浓度均为0.02 mg/mL时,欧李红色素和VE的抗氧化活性差异非常显著,VE氧化能力明显高于同浓度的色素。色素、VE及其复合物抗氧化性能的大小顺序为0.02 mg/mL VE>0.02 mg/mL色素+0.02 mg/mL VE>0.10 mg/mL色素+0.02 mg/mL VE>0.02 mg/mL色素>0.10 mg/mL色素,抑制率依次为69.15%、28.32%、21.91%、19.97%和17.73%。用加和法考察其协同作用,Y1=P(0.02mg/mL色素+0.02mg/mL VE)-(P0.02mg/mL色素+P0.02mg/mL VE)=28.32%-(19.97%+69.15%)=-60.80% <<0,Y2= P(0.10mg/mL色素+0.02mg/mL VE)- (P0.10mg/mL色素+P0.02mg/mLVE)=21.91%-(17.73%+69.15%)=-64.97% <<0,表明复合抗氧化剂没有协同作用。虽然复合抗氧化剂的抗氧化活性比相应浓度的欧李红色素高,但却低于相应浓度的VE的抗氧化活性。

图6 不同浓度欧李红色素和VE在葵花油乳状液中对脂质过氧化物(FTC)(A)和对MDA生成量的影响(TBARS)(B)Fig.6 Interaction of the red pigments of Cerasus humilis and α-tocopherol on oxidative stability in sunflower oil-inwater emulsion stabilized by Tween-20 in the presence of 30 μmol/L AAPH at 37℃:(A)lipids peroxides;(B)TBARS
用TBARS法检测到的结果与FTC法不同,同浓度的欧李红色素与VE的抗氧化能力差异不大。由图6-B可看出,色素、VE及其复合物抗氧化性能的大小顺序为0.02 mg/mL色素 >0.02 mg/mL VE>0.02 mg/mL色素+0.02 mg/mL VE>0.10 mg/mL色素>0.10 mg/mL色素 +0.02 mg/mL VE,抑制率依次 为 73.23%、69.85%、62.15%、55.38% 和52.00%,说明色素和VE没有抑制后期过氧化生成的协同作用。
3 结论
在大豆磷脂脂质体和葵花油乳状液中,用FTC法和TBARS法测得的不同浓度欧李红色素均具有抗氧化活性,但在不同体系中其抗氧化活性并不相同,随着欧李红色素浓度增加抗氧化活性下降。通过考察2种抗氧化剂的协同作用,发现各种不同浓度的欧李红色素与VC或VE共同作用时均不显示协同增效作用。在大豆磷脂脂质体中,FTC法测得VC或VE的加入使2种浓度欧李红色素抗氧化能力下降,TBARS法测得VC或VE的加入使2种浓度欧李红色素抗氧化能力明显提高;同时,VC的加入使复合抗氧化剂的抗氧化活性随其中欧李红色素浓度的增加而降低,VE的加入使复合抗氧化剂的抗氧化活性随其中欧李红色素浓度的增加而增加。在葵花油乳状液中,FTC法测得VC或VE的加入使2种浓度欧李红色素抗氧化能力略微提高,TBARS法测得VC或VE的加入使2种浓度欧李红色素抗氧化能力明显降低,2种方法均显示随着欧李红色素浓度增加复合抗氧化剂的抗氧化活性下降,说明欧李红色素作为一种抗氧化剂具有较好的应用前景。
[1] 朱华.欧李果酒的初步研究[J].酿酒科技,2004(4):96-98.
[2] 李金峰,秦旭峰,刘正魁,等.欧李的开发价值及经济效益分析[J].山西水土保持科技,2005(3):42-43.
[3] 王勇.新型抗旱灌木经济林树种——欧李[J].山西林业,2000(4):26-27.
[4] 卢奎,李建伟,毕红霞,等.欧李红色素的性质和应用[J].食品科学,2004,25(12):78-81.
[5] 毕红霞,陈玮,薛勇,等.欧李红色素的光谱特性研究[J].郑州工程学院学报,2003,24(2):48-50.
[6] Hollman,P C,Katan,M B.Health effects and bioavailability of dietary flavonols.[J].Free Radical Research,1999,31:75-80.
[7] Aihua Z,Qiang G,Quanguo H,et al.Interaction of malachite green with lecithin liposomes[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2003,224(1-3):75-82.
[8] YEN W J,CHANG L W,Duh P D.Antioxidant activity of peanut seed testa and its antioxidative component,ethyl protocatechuate[J].LWT-Food Science and Technology,2005,38(3):193-200.
[9] CHANG L W,YEN W J,HUANG S C,et al.Antioxidant activity of sesame coat[J].Food Chemistry,2002,78(3):347-354.
[10] Mitsuda H,Yasumoto K,Iwami K.Antioxidative action of indole compounds during the autoxidation of linoleic acid[J].Nippon Eigo Shokur you Ga-kkaishi,1966,19(3):210-214.
[11] CHEN H M,Muramoto K,Yamauchi F.Structural Analysis of Antioxidative Peptides from Soybean.beta.-Conglycinin [J].Journal of Agricultural and Food Chemistry,1995,43(3):574-578.
[12] Kosugi H,Kojima T,Kikugawa K.Thiobarbituric acid-reactive substances from peroxidized lipids [J].Lipids,1989,24(10):873-881.
[13] Tamura H,Yamagami A.Antioxidative activity of monoacylated anthocyanins isolated from Muscat Bailey a Grape[J].Journal of Agricultural and Food Chemistry,1994,42(8):1 612-1 615.
[14] Arora A,Muraleedharan G N,Gale M,et al.Structure-activity relationship for antioxidant activities of a series of flavonoids in a liposomal System[J].Free Radical Biology and Medicine,1998,24(9):1 355-1 363.
[15] 左玉,李鹏鸽,谢文磊.胆固醇在复杂体系中的抗氧化作用[J].食品与发酵工业,2014,40(8):100-108.
