通气量对酿酒酵母GGSF16高浓度乙醇发酵的影响*
2015-12-25蒋凯伍时华赵东玲张健黄翠姬
蒋凯,伍时华,赵东玲,张健,黄翠姬
(广西科技大学生物与化学工程学院,广西 柳州,545006)
在高浓度乙醇发酵条件下,酵母细胞受到多种环境因素(高渗透压、乙醇、代谢产物)的影响[1],出现酵母细胞生长缓慢、发酵强度低、发酵效率不高等现象。从20世纪80年代起,人们逐渐认识到高浓度乙醇发酵过程中保持适当溶解氧的重要性[2]。在发酵过程中,通入适当的氧气能够促进酵母细胞生长[3],有利于酵母细胞合成脂类物质(固醇和不饱和脂肪酸)[4],提高酵母细胞的活性和乙醇耐受性[5],解除代谢产物(CO2)对酵母细胞的抑制[6]。然而,通入过量的氧气虽然有利于乙醇的积累,但是会使乙醇产率降低[7]。
本文研究通气量对酿酒酵母GGSF16高浓度乙醇发酵的影响。探讨了不同通气量条件对酵母细胞生长、葡萄糖消耗和乙醇生成等参数的影响,旨在选择最适的通气量,为研究高浓度乙醇发酵打下基础。
1 材料与方法
1.1 材料
1.1.1 菌株
酿酒酵母GGSF16(Saccharomyces cerevisiae GGSF16):广西科技大学发酵工程研究所保藏。
1.1.2 培养基
一级种子培养基(g/L):葡萄糖20,酵母浸膏10,蛋白胨20,自然pH,装液量为100 mL/250 mL三角瓶,115℃蒸汽灭菌30 min。
二级种子培养基(g/L):葡萄糖40,酵母浸膏10,蛋白胨20,自然pH,装液量为200 mL/500 mL三角瓶,115℃蒸汽灭菌30 min。
发酵培养基(g/L):葡萄糖260,酵母浸膏10,蛋白胨20,自然pH,115℃蒸汽灭菌30 min。
1.1.3 种子培养方法
取1环斜面菌体接入一级种子培养基中,32℃,摇床160 r/min条件下培养12 h后,4 000 r/min离心10 min,弃上清液并加入无菌水,制成10倍浓缩种子菌悬液,置于4℃冰箱保存。取置于4℃冰箱内液体菌种2 mL,接种至二级种子培养基中,32℃,摇床160 r/min条件下培养6 h后,4 000 r/min离心10 min,弃上清液并加入无菌水,制成10倍浓缩种子菌悬液。
1.1.4 5 L罐发酵方法
将40 mL种子菌悬液接入含4 L发酵培养基的5 L发酵罐(B.Braun)中,初始酵母干重为1.2 g/L。发酵过程中,保持搅拌转速为200 r/min,自然pH,温度为 32 ℃,进行不同通气量(0、40、80、160、300 mL/min)发酵。
1.2 分析方法
从发酵0 h开始,每隔3 h取1次样,发酵到6 h后,每隔6 h取1次样。取发酵液1 mL,在4℃下,12 000 r/min离心3 min。用移液枪移取上清液,置于-60℃冰箱(用以测葡萄糖浓度和乙醇浓度),加入与移取上清液等量的去离子水制备成菌悬液,置于4℃冰箱(用于测定生物量和细胞存活率)。
1.2.1 生物量的测定
将酵母菌悬液稀释适当倍数后,用可见光分光光度计于波长600 nm处测定吸光度。利用吸光度与生物量干重之间的关系计算得到生物量干重。标准曲线:
y=0.423 4x+0.651 8,R2=0.995 5(x:吸光度;y:酵母细胞干重)
1.2.2 葡萄糖含量的测定
取上清液适当稀释后,使用SBA-40生物传感分析仪测定。
1.2.3 乙醇含量的测定
取上清液适当稀释后,采用天美GC7890Ⅱ气相色谱仪(FID检测器),以外标法分析乙醇浓度。色谱分析条件:30.0 m×320 μm×0.25 μm毛细管柱,氮气为载气,柱温恒温控制为70℃,进样口温度为190℃,检测器温度为220℃。
1.2.4 细胞活性的测定
亚甲基蓝染色法[7]。
1.3 计算方法
发酵强度[g/(L·h)]=乙醇生成量(g/L)/发酵时间(h)
乙醇产率(g/g)=乙醇生成量(g/L)/葡萄糖消耗量(g/L)
酵母细胞产率(g/g)=酵母细胞量(g/L)/葡萄糖消耗量(g/L)
发酵效率/%=乙醇产率(g/g)/0.515(g/g)
葡萄糖消耗速率[g/(L·h)]=(S2-S1)/(t2-t1)
乙醇生成速率[g/(L·h)]=(E2-E1)/(t2-t1)
比生长速率(h-1)=(lnX2-lnX1)/(t2-t1)
比葡萄糖消耗速率[g葡萄糖/(g细胞·L·h)]=葡萄糖消耗速率/Xavg
比乙醇生成速率[g乙醇/(g细胞·L·h)]=乙醇生成速率/Xavg
其中 S,E,X,t,Xavg分别为葡萄糖质量浓度(g/L),乙醇质量浓度(g/L),细胞干重(g/L),时间(h),t1到t2之间的细胞干重平均值。
1.4 曲线下面积分析
酵母细胞生长和葡萄糖消耗曲线运用GraphPad Prism 5软件进行绘制,并分别获得酵母细胞生长和葡萄糖消耗曲线下面积(area under the fermentation curve/AUC),记做细胞AUC和葡萄糖AUC。
2 结果与分析
2.1 通气量条件对酵母细胞生长和存活率的影响
如图1所示,在不同通气量条件下(0、40、80、160、300 mL/min),酵母细胞的生长趋势基本保持一致,0~18 h为延滞期和对数生长期,18 h后为对数生长后期和稳定期。发酵0~3 h,酵母细胞量不随通气量的变化而改变。然而,发酵3 h后,通气条件对酵母细胞生长的影响显著。通气条件下的最大菌体量明显高于厌氧条件,比厌氧条件分别多95.6%,104%,107%,117%。这是因为发酵0~3 h时间段,发酵液中的溶氧量足以维持酵母细胞的生长,随着酵母细胞量的不断增加,细胞对氧的需求旺盛,由于没有额外提供氧气,发酵后期酵母细胞生长受到抑制[3]。另外,为了更全面地说明通气条件对酵母细胞的生长具有促进作用,采用曲线下面积法进行整体评价[8]。细胞生长曲线下面积越大,说明酵母细胞生长越好。由图1可以看出,发酵30 h后,酵母细胞生长趋于稳定,因此计算30 h前酵母细胞生长曲线下面积进行比较。从表1可知,在不同通气量条件下,通气量越大细胞AUC越大,进一步说明通气有利于酵母细胞生长。

图1 不同通气量条件下细胞生长发酵过程曲线Fig.1 Profiles of biomass growth during the fermentation process under different aeration rates

表1 不同通气量条件下细胞生长曲线下面积Table 1 Area under growth curves under different aeration rates
如图2所示,酵母细胞的比生长速率呈现先升高后逐渐降低的趋势。当乙醇浓度为10 g/L左右时(发酵6 h),达到酵母细胞的最大比生长速率,其受通气量的影响较大。当通气量为300 mL/min时最大比生长速率最大(0.29 h-1),厌氧条件下最大比生长速率最小(0.2 h-1)。随着发酵的进行,乙醇浓度不断增加,比生长速率不断减小。厌氧发酵条件下,比生长速率下降最快,当乙醇浓度高于105 g/L左右时,厌氧条件下的比生长速率为负值,而通气条件下的比生长速率依然保持相对较高的水平。说明通氧可以提高酵母细胞对乙醇的耐受性,此现象与Hyeon Beom Seo 等[5]研究相似。

图2 不同通气量条件下比生长速率发酵过程曲线Fig.2 Profiles of specific growth rate during the fermentation process under different aeration rates
如图3所示,在整个发酵过程中,通气条件下的酵母细胞存活率保持较高的水平并且基本保持不变。然而,厌氧条件下仅仅在发酵前期保持高存活率,随着乙醇浓度的增加出现逐渐下降趋势,尤其是发酵后期酵母细胞的存活率非常低。可能因为通气条件下,酵母细胞大量合成脂类物质保护其细胞膜的完整性[4]。

图3 不同通气量条件下细胞存活率发酵过程曲线Fig.3 Profiles of cell viability during the fermentation process under different aeration rates
2.2 不同通气量条件对葡萄糖消耗的影响
如图4所示,在通气条件下,酵母细胞完全消耗葡萄糖需要30 h,与厌氧条件相比(54 h),大大缩短了葡萄糖的消耗时间,此现象与 Yen Han Lin等[9]一致。曲线下面积法可以整体地评价耗糖的快慢[10],葡萄糖曲线下面积越小,说明耗糖越快。从表2可知,葡萄糖AUC160最小,葡萄糖AUC0最大,表明厌氧条件下耗糖最慢,通气量为160 mL/min条件下耗糖最快,继续增加通气量不利于葡萄糖的消耗。
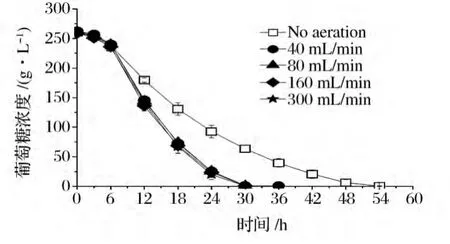
图4 不同通气量条件下葡萄糖消耗发酵过程曲线Fig.4 Profiles of glucose consumption during the fermentation process under different aeration rates

表2 不同通气量条件下葡萄糖消耗曲线下面积Table 2 Area under glucose consumption curves under different aeration rates
如图5所示,发酵0~6 h,不同通气量下,葡萄糖消耗速率相差不大。发酵6~24 h,通气条件下葡萄糖消耗速率明显高于厌氧条件下葡萄糖消耗速率。其中,发酵6~12 h,葡萄糖消耗速率达到最大值,因为该时间段酵母处在对数生长期,发酵活力比较强,葡萄糖消耗速率分别为 9.75,15.73,15.95,16.67,15.58 g/(L·h)。发酵12 h后乙醇浓度不断增加,对酵母细胞具有毒害作用,并且酵母细胞生长趋于稳定,葡萄糖消耗速率出现逐渐下降趋势。发酵24~30 h时间段,厌氧条件下葡萄糖消耗速率高于通气条件下葡萄糖消耗速率,主要因为通气条件葡萄糖消耗完全,而厌氧条件下还有充足的葡萄糖供酵母细胞利用。另外,葡萄糖消耗速率与酵母细胞量有直接的关系,为了更深入地了解不同通气量条件对葡萄糖消耗的影响,计算发酵过程中比葡萄糖消耗速率[g葡萄糖/(g细胞·L·h)],见图6。由图5可知,发酵6~12 h时间段,葡萄糖消耗速率达到最大值,并且通气条件下葡萄糖消耗速率明显高于厌氧条件下葡萄糖消耗速率。然而,在该时间段,比葡萄糖消耗速率相差不大,达到2.2 g葡萄糖/(g细胞·L·h)左右。发酵12 h后,比葡萄糖消耗速率出现逐渐下降趋势,但厌氧条件下比葡萄糖消耗速率远远高于通气条件下比葡萄糖消耗速率。说明通气条件使单位质量的酵母细胞消耗葡萄糖的能力降低。
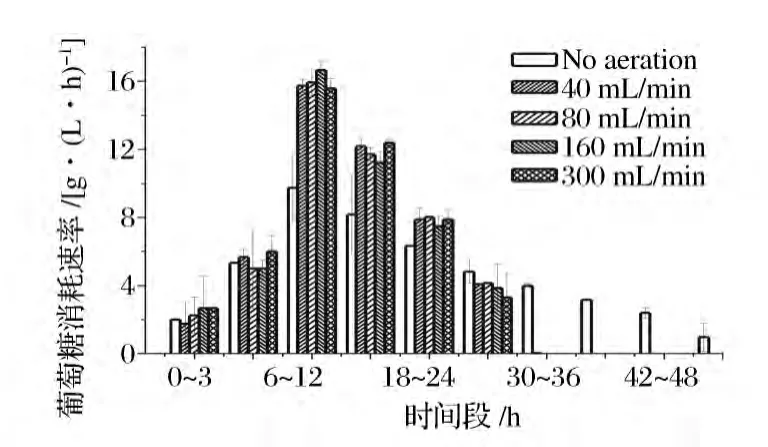
图5 不同通气量条件下葡萄糖消耗速率发酵过程曲线Fig.5 Profiles of glucose uptake rate during the fermentation process under different aeration rates

图6 不同通气量条件下比葡萄糖消耗速率发酵过程曲线Fig.6 Profiles of specific glucose uptake rate during the fermentation process under different aeration rates
2.3 不同通气量条件对乙醇生成的影响
对于乙醇的生成,见图7,在厌氧条件下乙醇产量最高(124.8 g/L),增加通气量乙醇产量反而降低。分析葡萄糖消耗与乙醇生成之间的关系,发现乙醇生成速率与葡萄糖消耗速率总体趋势基本一致,见图8。发酵6~12 h时间段,乙醇生成速率达到最大值,通气条件下乙醇生成速率明显高于厌氧条件下乙醇生成速率。然而,当通气量在0,40 mL/min时,酵母细胞生成乙醇受到延滞。尤其是当通气量为40 mL/min时,延滞作用非常明显,完全消耗葡萄糖所需的时间为30 h,完全生成乙醇所需的时间为36 h。这可能是因为40 mL/min的通气量不足以维持酵母细胞正常代谢。有研究表明,在缺氧环境中,酵母细胞内会积累大量的活性氧(reactive oxygen species,ROS)。ROS是指氧的某些衍生物如超氧负离子、羟自由基和过氧化氢等,过量的ROS能够使生物大分子如DNA、蛋白质、脂类发生过氧化链式反应,造成细胞结构的损伤,影响生理活性[11]。

图7 不同通气量条件下乙醇发酵过程曲线Fig.7 Profiles of ethanol production during the fermentation process under different aeration rates
乙醇生成速率与酵母细胞量有直接的关系,为了更深入地了解不同通气量条件对乙醇生成的影响,计算发酵过程中比乙醇生成速率[g乙醇/(g细胞·L·h)],见图9。由图8可知,发酵6~12 h时间段,乙醇生成速率达到最大值,并且通气条件下乙醇生成速率明显高于厌氧条件下乙醇生成速率。然而,厌氧条件下比乙醇生成速率最大,达到1.05 g乙醇/(g细胞·L·h)左右。发酵12 h后,比乙醇生成速率出现逐渐下降趋势,但厌氧条件下比乙醇生成速率远远高于通气条件下比乙醇生成速率。说明通气条件使单位质量的酵母细胞生成乙醇的能力降低[12]。

图8 不同通气量条件下乙醇生成速率发酵过程曲线Fig.8 Profiles of ethanol production rate during the fermentation process under different aeration rates
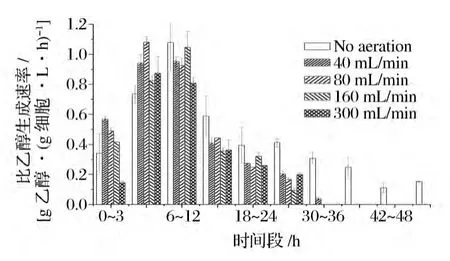
图9 不同通气量条件下比乙醇生成速率发酵过程曲线Fig.9 Profiles of specific ethanol production rate during the fermentation process under different aeration rates
2.4 不同通气量条件下的乙醇发酵参数
表3显示了不同通气量条件下的乙醇发酵参数。可见,随着通气量的增加,发酵时间明显缩短,而酵母细胞量和酵母细胞产率呈现逐渐增加趋势。但是,终点乙醇浓度和乙醇产率呈现不断降低趋势,另外,发酵强度呈现先升高后降低的趋势。从中可以说明发酵过程中通入适量氧有助于缩短发酵时间,提高发酵强度,但过量通气可能会导致酵母大量繁殖,或者进行好氧发酵生成CO2和H2O,从而降低乙醇产率和发酵效率。
3 讨论与小结
本文研究了在260 g/L葡萄糖为底物的高浓度乙醇发酵过程中,不同通气量条件对酵母细胞生长,葡萄糖消耗和乙醇生成等参数的影响。研究表明,不同通气量条件下,酵母细胞的生成与葡萄糖的消耗以及乙醇的生成三者关系密切,三者彼此影响和作用。在通气条件下,酵母细胞得以大量繁殖,酵母细胞存活率高并且乙醇耐受能力强。从而大量葡萄糖被酵母用于自身的生长繁殖和脂类物质的生成,影响乙醇的产量。由表3可以看出酵母细胞产率随通气量的增大而增大,此结果与Alfenore[7]研究一致。不同通气量条件下,酵母细胞间的差异性直接影响葡萄糖的消耗和乙醇的生成。与厌氧条件相比,大大缩短了发酵时间,以及提高了发酵强度。然而,在通气条件下,乙醇产量降低并且单位质量的酵母细胞消耗葡萄糖和生成乙醇的能力也降低。Ghaly等[13]以乳糖为底物,利用假丝酵母进行酒精发酵,发现最适的微通氧速率和初糖浓度分别为0.1 vvm和150 g/L。如果提高通氧速率,更多的底物被用于酵母细胞的增殖,导致乙醇的产量降低。孜力汗等[14]研究发现,增大通气量同样会使乙醇产量降低。因为在此状态下,生物量、甘油生成和乙醇夹带损失皆为最高,严重分流了碳原子流向乙醇。对于单位质量的酵母细胞消耗葡萄糖和生成乙醇的能力降低情况,有学者分析如下[15],糖酵解过程中,磷酸果糖激酶(PFK)催化生成的FDP(1,6-二磷酸果糖)很容易被分解,使得菌体内的FDP含量降低,从而使PFK的活性降低。PFK又受ATP反馈抑制和柠檬酸的抑制,柠檬酸是TCA循环的成员之一,伴随糖代谢的进行,细胞内柠檬酸的量在通气条件下比厌氧条件下要多。因此伴随PFK活性降低,6-磷酸果糖积累,而且因己糖异构酶的活性升高,使6-磷酸葡萄糖糖在细胞内积累的量增多,其结果使得催化葡萄糖磷酸化的磷酸己糖酶(HK)活性降低,故使得葡萄糖的消耗受到抑制。此外,在通气条件下,发酵所必须的NADH转人线粒体,并在线粒体内进行氧化,供给细胞生长所需的能量,从而因细胞质内的NADH缺少,使得乙醇脱氢酶(ADH)不起作用,故使生成乙醇的能力降低。

表3 不同通气量条件下的乙醇发酵参数Table 3 Effect of aeration on fermentation parameters
Lin等[9]研究发现,以葡萄糖为底物的高浓度乙醇发酵过程中,选择以对数期进行通气(0.82 L/min)。Chang等[16]研究发现,结合有氧和厌氧进行补料分批发酵,可以既提高微生物的生长量又达到高乙醇产量。在初始通氧阶段,将葡萄糖浓度维持在一个较低水平进行酵母的大量增殖;在厌氧阶段,将葡萄糖浓度补充到一个较高的水平进行高浓度乙醇发酵。从而消除发酵后期通气对酵母细胞代谢的影响。
因此,通入适当的空气是高浓度乙醇发酵的一个重要控制参数,能够缩短发酵时间,增加酵母细胞量,提高酵母细胞的活性和乙醇耐受性。然而,乙醇产量与单位质量的酵母细胞消耗葡萄糖和生成乙醇的能力降低。综合考虑,本文最适通气量为80 mL/min,终点乙醇浓度为117.9 g/L,发酵强度为3.93 g/(L·h),乙醇产率为0.452 g/g(发酵效率87.8%)。
[1] Elena P,Gabriela R,Traian H.Current approaches to efficient biotechnological production of ethanol[J].Innovative Romanian Food Biotechnology,2009,4:1-11.
[2] Dewey D Y Ryu,Y J Kim,J H Kim.Effect of air supplement on the performance of continuous ethanol fermentation system[J].Biotechnology and Bioengineering,1984,26(1):12-16.
[3] 何向飞,张梁,石贵阳.利用溶氧控制策略进行高密度和高强度乙醇发酵的初步研究[J].食品与发酵工业,2008,34(1):20-23.
[4] Caroline F-B,Veronique D,Eric R,et al.Oxygen addition and sterol synthesis in Saccharomyces cerevisiae during enological fermentation[J].Journal of Bioscience and Bioengineering,2002,93(2):176-182.
[5] Hyeon Beom Seo,Ji Hyeon Yeon,Myung Hoon Jeong,et al.Aeration alleviates ethanol inhibition and glycerol production during fed-batch ethanol fermentation[J].Biotechnology and Bioprocess Engineering,2009,14(5):599-605.
[6] Keisuke Nagahisa,Toshiharu Nakajima,Katsunori Yoshikawa,et al.DNA microarray analysis on Saccharomyces cerevisiae under high carbon dioxide concentration in fermentation process[J].Biotechnology and Bioprocess Engineering,2005,10(5):451-461.
[7] Alfenore S,Cameleyre X,Benbadis L,et al.Aeration strategy:a need for very high ethanol performance in Saccharomyces cerevisiae fed-batch process[J].Applied Microbiology and Biotechnology,2004,63(5):537-542.
[8] F NoeArroyo-Lopez,AmparoQuerol,EladioBarrio.Application of a substrate inhibition model to estimate the effect of fructose concentration on the growth of diverse Saccharomyces cerevisiae strains[J].Journal of Industrial Microbiology and Biotechnology,2009,36(5):663-669.
[9] Yen Han Lin,Wan ShanChien,Kow-Jen Duan,et al.Effect of aeration timing and interval during very-high-gravity ethanol fermentation[J].Process Biochemistry,2011,46(4):1 025-1 028.
[10] 左松,伍时华,张健,等.不同时间添加氮源对酵母GJ2008果糖与葡萄糖利用的影响[J].食品与发酵工业,2014,40(4):18-22.
[11] Wolff SP,Garner A,Dean R T.Free radicals,lipids and protein degradation[J].Trends in Biochemical Sciences,1986,11(1):27-31.
[12] Hyeon Beom Seo,Seung Seop Kim,Hyeon Yogn Lee,et al.High-level production of ethanol during fed-batch ethanol fermentation with a controlled aeration rate and nonsterile glucose powder feeding of Saccharomyces cerevisiae[J].Biotechnology and Bioprocess Engineering,2009,14(5):591-598.
[13] Ghaly A E,AAEI-Taweel.Effect of micro-aeration on the growth of Candida Pseudotropicalis and production of ethanol during batch fermentation of cheese whey[J].Bioresource Technology,1995,52(3):203-217.
[14] 孜力汗,刘晨光,王娜,等.多种通气策略下的高浓度乙醇生产[J].中国生物工程杂志,2013,33(6):86-92.
[15] 管斌,马美范,王鸿棋,等.部分通氧对酒精连续发酵的影响[J].中国酿造,1999(2):22-24.
[16] Der Ming Chang,Tzu Hsing Wang,Lung Chien,et al.Improved operating policy utilizing aerobic operation for fermentation process to produce bio-ethanol[J].Biochemical Engineering Journal,2012,68:178-189.
