磁性F3O4-苯丙氨酸解氨酶仿生固定化及其催化性能研究*
2015-12-25岳姝刘容麟冯玉晓端冲赵雅敏李林波崔建东
岳姝,刘容麟,冯玉晓,端冲,赵雅敏,李林波,崔建东
(河北科技大学,生物科学与工程学院,河北省发酵工程技术研究中心,河北石家庄,050018)
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)是酶法生产L-苯丙氨酸和治疗苯丙酮尿症的关键酶[1],存在于各种植物和少数微生物中,具有广泛的医药和工业应用价值[2]。但在应用过程中,该酶表现出不稳定、易失活的问题。酶固定化技术能改善酶的稳定性和催化性能[3-5]。
仿生硅化固定化酶是近年来国内外固定化酶研究的热点,该技术具有制备条件温和、操作简单、酶固定化效率和酶活保留率高等优点。目前已经被成功应用在氨基酸氧化酶[3]、脂肪酶[4]、碳酸酐酶[6]等多种酶的固定化。但该方法也存在一些缺点,如形成的固定化酶颗粒小、难以回收重复利用。磁性纳米颗粒具有强的磁响应、纳米级的尺寸、较大的比表面积,是一种理想的酶固定化材料。但传统的磁性纳米颗粒固定化酶一般需要对纳米颗粒表面进行功能基团修饰,操作条件苛刻,而且制备出的固定化酶活性损失大,影响了固定化酶的催化效率[7]。
本研究以PAL酶蛋白作为自诱导剂,以正硅酸甲酯(TMOS)为硅前驱体,在诱导生成纳米氧化硅的同时将PAL和磁性纳米颗粒共包埋在氧化硅颗粒中,制备出磁性仿生氧化硅固定化酶,该固定化酶既保证了酶分子的原位包埋固定,避免了共价固定产生的酶构象改变的缺点,同时又引入磁性纳米颗粒,使固定化酶能利用磁场简单的回收重复利用,是一种将磁性纳米颗粒与仿生硅化有效结合的固定化酶方法。
1 材料与方法
1.1 材料与仪器
粘红酵母(Rhodotorula gluinis),中国工业微生物菌种保藏管理中心(CICC32913);正硅酸甲酯(TMOS)和异硫氰酸荧光素(FITC),阿拉丁试剂(上海)有限公司;其他试剂均为市售分析纯。
S-4800-Ⅰ型场发射扫描电子显微镜,日本HITACHI;JEM-2100透射电子显微镜,日本JEOL;IX51倒置荧光显微镜,美国OLYMPUS;752型紫外分光光度计,上海光谱仪器有限公司;TGL-16C型离心机,上海安亭科学仪器厂;HC-3018型高速离心机,安徽中科中佳科学仪器有限公司;85-1B磁力搅拌器,巩义市予华仪器有限责任公司;FD-27真空冷冻干燥机,北京德天佑科技发展有限公司。
1.2 实验方法
1.2.1 PAL的提取
将粘红酵母接种在发酵培养基(葡萄糖5 g/L,蛋白胨10 g/L,NaCl 5 g/L,KH2PO40.5 g/L,(NH4)2HPO41 g/L,L-苯丙氨酸 0.5 g/L,pH5.5)中,于 28 ℃,150 r/min下发酵培养21 h,培养后的粘红酵母利用玻璃珠破碎和凝胶过滤提取PAL酶[8]。PAL比酶活为0.86 U/mL。
1.2.2 磁性纳米颗粒的制备
采用化学共沉淀法[7]制备磁性纳米颗粒,1.25 g FeCl2·4H2O和3.40 g FeCl3·6H2O溶解到100 mL去离子水中,在60℃下,加入6 mL 25%NH3·6H2O剧烈搅拌30~40 min。使用磁铁沉淀磁性颗粒,用去离子水洗涤3次后,超声1 h后备用。
1.2.3 仿生硅化固定化苯丙氨酸解氨酶
取0.152 g TMOS与1 mmol/L HCl溶液混合,振荡10 min,制得浓度为1 mol/L TMOS水解液。取5 mL PAL酶样品(溶解在25 mmol/L磷酸盐,pH 7.0)与1 mL质量浓度为20 mg/mL磁性纳米颗粒充分混匀后,加入2 mL浓度为0.8 mol/L TMOS水解液,混合5 min后,固定化酶用磁铁回收,得到的沉淀物用去离子水洗涤3次,即得固定化PAL。
1.2.4 固定化PAL的形态观察
固定化PAL样品经真空冷冻干燥后,在真空条件下喷铂金后利用电子扫描显微镜(电子发射电压60~100 kV)和透射电镜(电子发射电压200 kV)检测。利用50 mg异硫氰酸荧光素(FITC)溶于8 mL二甲基亚砜(DMSO),加入100 mL溶有1 g酶的磷酸钠缓冲液(0.2 mol/L,pH 8.0),室温下避光搅拌溶解2 h。加入无水乙醇(与溶液的量大约等量即可)沉淀标记好的蛋白,离心除去多余的FITC。沉淀需要清洗3次。标记好FITC的PAL酶用于固定化,用荧光倒置显微镜观察固定化酶。
1.2.5 酶活测定方法
以紫外分光光度法测定PAL的酶活[9]。酶促反应液包括一定量的酶样品,2.5 mL 50 mmol/L L-苯丙氨酸和2 mL 25 mmol/L Tris-HCl,pH 8.8,反应在30 ℃振荡保温10 min,然后加入0.2 mL 6 mol/L HCl终止反应。10 000×g离心5 min,取上清液在278 nm下测吸光值。固定化酶的酶活测定与游离酶相似,不同在于酶促反应终止后用磁铁回收沉淀。根据反式肉桂酸标准曲线计算酶活。酶活力单位定义:每分钟催化L-苯丙氨酸生成1 μmol反式肉桂酸的酶量为1个酶活力单位。
1.2.6 酶活回收率

1.2.7 统计分析
所有实验重复进行3次,利用SAS软件(v8.0)进行统计分析。
1.2.8 实验设计
1.2.8.1 固定化PAL制备条件优化
利用单因素实验考察了TMOS质量浓度(2,4,6,8,10 mg/mL)、粗酶量(1,3,5,7,9 mL,0.86 U/mL)、磁性纳米颗粒质量浓度 (10,20,30,40,50 mg/mL)对固定化PAL的影响。
1.2.8.2 固定化PAL的稳定性考察
对于温度稳定性,将游离酶和固定化PAL分别置于60℃下处理15,30,45和60 min后,分别检测酶活。对于pH稳定性,将游离酶和固定化PAL分别置于pH为2,5,8和11的缓冲液中处理60 min后,检测酶活。对于变性剂稳定性,将游离酶和固定化PAL分别置于2%SDS,40%乙醇和6 mol/L尿素中处理30 min,检测酶活。对于储存稳定性,将游离酶和固定化PAL分别保存在25 mmol/L磷酸盐(pH 7.0)中,于25℃放置1,6。12和18 d,并在相对应的储存时间检测酶活。
1.2.8.3 固定化PAL的重复使用性考察
重复使用稳定性实验:将一定量的固定化PAL在30℃条件下催化底物L-苯丙氨酸生成反式肉桂酸,反应15 min后,磁场分离出固定化酶,用Tris-HCl(pH 8.8)缓冲液洗涤后,在固定化酶中加入新的底物进行第2轮转化,依此分批催化,每次催化反应后分别检测固定化酶剩余的酶活。直到检测不到酶活为止。
2 结果与讨论
2.1 固定化PAL制备条件优化
2.1.1 反式肉桂酸标准曲线制备
标准曲线方程:Y=14.083X-0.562 1,R2=0.999 9,由此计算酶活。
2.1.2 TMOS水解液浓度对固定化酶的影响

图1 TMOS水解液浓度对酶活回收率的影响Fig.1 Effects of TMOS concentration on activity recovery
从图1可以得出,TMOS水解液浓度对固定化PAL酶活有较大的影响,固定化酶的酶活回收率随着TMOS浓度的增加而增加,当TMOS水解液浓度为0.8 mol/L时,酶活回收率最高,但当TMOS水解液浓度超过0.8 mol/L,酶活回收率开始下降。这可能是由于反应体系中TMOS浓度过大时,剩余的TMOS不能被PAL酶蛋白催化聚合形成氧化硅,导致对PAL的包埋率下降,使酶活回收率降低[4]。
2.1.3 酶蛋白数量对固定化酶的影响
由图2可以看出,随着酶蛋白数量增加,固定化酶的酶活也在增加,当酶蛋白量达到5 mL(0.86 U/mL)时,酶活回收率达到最高,而随着酶蛋白量的继续增加,酶活回收率基本不再变化。这可能是由于TMOS硅前体的量一定,只能沉淀一定量的硅胶对酶进行包埋,而过剩的酶不能被包埋在硅胶中,从而使酶活回收率保持不变。
2.1.4 磁性纳米颗粒质量浓度对固定化酶的影响
从图3可知,当磁性纳米颗粒质量浓度在20 mg/mL时,固定化酶的酶活回收率最大,但当磁性纳米颗粒浓度继续增加,固定化酶的酶活回收率反而下降。这是由于当TMOS量一定时,过多的磁性纳米颗粒与酶分子竞争TMOS的空间,减少了酶分子在硅胶中包埋的数量,导致固定化酶酶活有所下降。
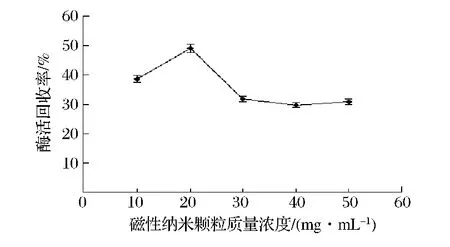
图3 酶量对固定化酶酶活的影响Fig.3 Effects of nanopaticles concentration on activity
通过上述固定化酶制备条件的优化,最终获得的制备条件是2 mL浓度为0.8mol/L正硅酸甲酯水解液、1 mL浓度为20 mg/mL的磁性纳米颗粒和酶添加量5 mL(0.86 U/mL),在此条件下所得固定化酶的最大酶活回收率是52%。以前我们曾用交联酶聚体(CLEAs)方法对PAL进行固定化,结果最大酶活回收率是25%[10],而用本方法制备的固定化酶酶活回收率是CLEAs方法的2.1倍。表明该方法是一种提高酶固定化效率的有效方法。
2.2 固定化PAL的形态观察
图4是扫描电镜观察的固定化PAL的图片。可以看出,在500 nm标尺下,固定化酶的颗粒非常小,形态不规则,分布不均匀,且结构较为疏松(图4a),这种结构有利于酶促反应过程中底物和产物的传递。透射电镜表明,磁性纳米颗粒已经被成功的包埋在硅胶中(箭头所指为包埋的磁性纳米颗粒)(图4b)。荧光图片显示,标记有FITC的酶蛋白在硅胶中发出绿光(图4c),表明酶蛋白已经被成功包埋在硅胶中。

图4 固定化酶的形态Fig.4 Morphology of immobilized PAL
2.3 固定化PAL催化稳定性
2.3.1 固定化PAL温度稳定性
固定化PAL的温度稳定性结果如图5所示。结果表明,与游离酶相比,固定化酶具有更高的耐受高温的能力,在60℃下处理45 min时,游离酶基本损失了大部分的酶活,而固定化酶还能保持30%左右的酶活,当处理1 h后,游离酶几乎丧失了所有酶活,而固定化酶却还能保留20%以上的酶活,说明当酶分子被包埋在仿生氧化硅中后,酶分子的天然空间构象得以保持[11],特别是由于有氧化硅的外层保护下,温度的传递速度减缓,保护了硅胶内的酶分子,使高的温度不能直接作用于酶分子,降低了酶的失活速率。
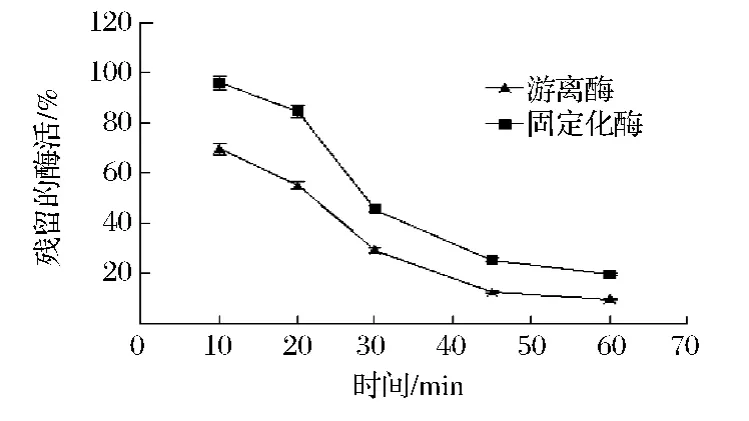
图5 固定化PAL的温度稳定性Fig.5 Thermostability of encapsulated PAL
2.3.2 固定化酶pH稳定性
固定化酶pH的稳定性结果如图6所示。与游离酶相比,固定化酶在pH 2~5时表现出较高的耐受性,但趋向于强碱条件时,固定化酶活损失较大,而游离酶却能保留较高的酶活,在pH是11的条件下处理30 min,游离酶能保留42%的酶活,而固定化酶仅能保持13%的酶活。表明游离的PAL具有较强的耐受强碱的能力,但固定化所形成的硅胶在强碱条件下易分解[3],导致包埋在硅胶中的PAL分子泄漏到溶液中,从而使固定化酶中的PAL数量减少,表现为固定化酶的酶活残留率下降。

图6 固定化PAL的pH稳定性Fig.6 pH-stability of encapsulated PAL
2.3.3 固定化酶变性剂稳定性
固定化酶对变性剂的稳定性结果如图7所示。结果表明,在变性剂作用下,游离酶和固定化酶都有不同程度的失活,但固定化酶表现出对变性剂更高的耐受性,特别是当用6 mol/L尿素处理30 min后,游离酶基本失活,只能残留4%的酶活,但固定化酶还能留持24%的酶活。固定化酶对变性剂的耐受可能是由于游离的酶分子被包埋在仿生氧化硅载体中,氧化硅载体阻碍了变性剂与酶分子的直接接触,使酶分子的活性结构得以保持,导致酶活被保留下来[13-14]。
2.3.4 固定化酶储存稳定性

图7 固定化PAL的变性剂稳定性Fig.7 Encapsulated PAL against denaturants
固定化酶的储存稳定性是评价固定化酶应用价值的重要指标[15]。固定化PAL储存稳定性结果如图8所示。在储存过程中,游离酶和固定化酶酶活都有所下降,但固定化酶储存稳定性要显著好于游离酶,在储存到第18天,游离酶已经基本失活,但固定化酶还能保留38%的酶活。说明PAL经过仿生硅化固定化后储存稳定性有显著改善。

图8 固定化PAL的储存稳定性Fig.8 Storage stability of encapsulated PAL
2.4 固定化PAL重复使用性
固定化酶的重复使用稳定性结果如图9所示。结果表明,经过仿生硅化包埋的PAL具有一定的重复使用稳定性,连续重复使用7次后固定化酶还能保留近20%的酶活,但是,无磁性纳米颗粒的仿生硅固定化PAL在使用到第7轮时,固定化酶基本检测不到酶活[16],表明磁性纳米颗粒的加入有助于固定化酶的重复使用。但重复使用的效果还是不明显,这可能是由于在反复回收过程中,包埋在硅胶中的PAL有一定的泄露,导致酶活损失。
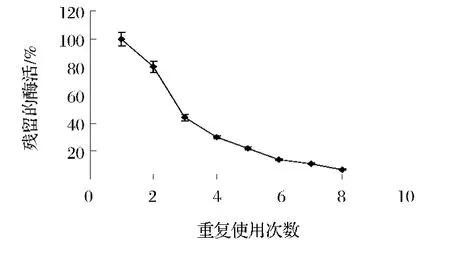
图9 固定化酶重复使用稳定性Fig.9 Recycling stability of encapsulated PAL
3 结论
本研究首次利用仿生硅化过程将PAL酶和磁性纳米颗粒共同包埋在硅胶中,所得磁性固定化酶的最佳制备条件是:2 mL浓度为0.8 mol/L正硅酸甲酯水解液、1 mL质量浓度为20 mg/mL的磁性纳米颗粒和酶添加量5 mL(0.86 U/mL)时,所得固定化酶的最大酶活回收率是52%。与游离酶相比,固定化酶表现出较好的温度、pH、变性剂和储存稳定性,此外,固定化酶还具有一定的重复使用稳定性,在连续重复使用7批次后,固定化酶还能保持初始酶活的近20%。上述结果表明这种固定化酶方法在工业应用中具有较好的实用前景。
[1] 贺立红,张进标,宾金华.苯丙氨酸解氨酶的研究进展[J].食品科技,2006(7):31-34.
[2] 崔建东,李艳,牟德华.苯丙氨酸解氨酶(PAL)的研究进展[J].食品工业科技,2008,29(7):306-308.
[3] Kuan I C,Wu J Ch,Lee Sh L,et al.Stabilization of D-amino acid oxidase from Rhodosporidium toruloides by encapsulation in polyallylamine-mediated biomimetic silica[J].Biochemical Engineering Journal,2010,49(3):408-413.
[4] 王静云,马翠丽,包永明.脂肪酶仿生固定化及性质[J].分子催化,2011,25(4):341-347.
[5] CUI J D,ZHANG S,SUN L M.Cross-linked enzyme aggregates of phenylalanine ammonia lyase:novel biocatalysts for synthesis of L-phenylalanine[J].Applied Biochemistry and Biotechnology,2012,167(4):835-844.
[6] Forsyth C,Yip T W S,Siddharth V,et al.CO2sequestration by enzyme immobilized onto bioinspired silica[J].Chemical Communications,2013,49(31):3 191-3 193.
[7] CUI J D,CUI L L,ZHANG S P,et al.Hybrid magnetic cross-linked enzyme aggregates of phenylalanine ammonia lyase from Rhodotorula glutinis[J].PLoS ONE,2014,9(5):e97221.
[8] 江柯.粘红酵母(Rhodotorula glutinis)CIBAS A1401苯丙氨酸解氨酶(PAL)的分离纯化与性质研究[D].成都:四川大学,2004.
[9] 李连连,崔建东.以大孔硅胶为载体的苯丙氨酸解氨酶交联酶聚体的制备及性质研究[J].食品工业科技,2014,35(11):160-165.
[10] 孙立梅,李连连,崔建东.牛血清白蛋白辅助交联对苯丙氨酸解氨酶交联酶聚体影响的研究[J].食品工业科技,2013,34(13):66-69.
[11] WANG J Y,MA C L,BAO Y M,et al.Lipase entrapment in protamine-induced bio-zirconia particles:characterization and application to the resolution of(R,S)-1-phenylethanol[J].Enzyme and Microbial Technology,2012,51(1):40-46.
[12] Kroger N,Lorenz S,Brinner E.Self-assembly of highly phosphorylated silaffins and their function in biosilica morphogenesis[J].Science,2002,298:584-586.
[13] 李林.仿生氧化硅凝胶固定化D-葡萄糖醛酸苷酶的研究[D].天津:天津大学,2008.
[14] ZHOU Y L,WANG C,JIANG Y J,et al.Immobilization of papain in biosilica matrix and its catalytic property [J].Chinese Journal of Chemical Engineering,2013,21(6):670-675.
[15] 张羽飞.仿生固定化酶制备及其催化特性研究[D].天津:天津大学,2008.
[16] CUI JD,LIANG L H,HAN C,et al.Stabilization of phenylalanine ammonia lyase from Rhodotorula glutinis by encapsulation in polyethyleneimine-mediated biomimetic silica[J].Applied Biochemistry and Biotechnology,2015,DOI:10.1007/s12010-015-1624-0.
