离子液体体系的萃取行为及其在乏燃料后处理中的应用前景
2015-12-25刘海望陈庆德沈兴海
刘海望,杨 涛,陈庆德,沈兴海
北京大学 化学与分子工程学院,放射化学与辐射化学重点学科实验室,北京分子科学国家实验室,北京 100871
能源问题是人类生存急需关注的问题,随着常规化石能源等不可再生能源的逐渐消耗,及其带来环境污染问题的加重,人们逐渐意识到绿色环保、高效清洁能源的重要性。与其他能源相比,核能有很多优点,如经济、高效、无污染等。世界上很多国家均在不断完善其核电系统,在确保安全的情况下实现核能快速可持续发展。
在核电快速发展中,不可避免地会遇到乏燃料的后处理问题。如何合理地将乏燃料进行后处理是核电可持续发展的重要问题,目前核燃料后处理循环主要分为一次通过循环(once-through cycle)和闭式核燃料循环(closed fuel cycle)两种方式。一次通过循环是指将卸载出来的乏燃料简单处理后进行深层地质处置。闭式核燃料循环是指对卸出来的乏燃料进行化学处理,提取出有用的锕系元素以及部分长寿命裂片元素,然后再将剩余部分进行处置。一次通过循环法虽然相对比较经济,但是可能会对周围环境有着长期威胁,而且需要处置的乏燃料体积较大。闭式核燃料循环法能够在一定程度上解决上述问题,因此得到世界上各国研究者的认可。
目前世界上最常用的后处理流程为PUREX流程,在乏燃料后处理中,会用到很多萃取用稀释剂,如煤油、长碳链醇以及其他挥发性有机化合物(VOCs),这些挥发性有机化合物一方面对周围环境和人体有危害,另一方面在放射性元素的工业处理过程中也存在一定易燃性和放射性危险。为了解决这些有机稀释剂带来的安全问题,近些年来离子液体作为稀释剂应用于萃取方面得到人们的密切关注。
1 离子液体简介
离子液体(IL),是一种由阴阳离子构成、在室温下呈现液态的有机盐类化合物,又称室温离子液体。Walden等[1]在1914年报道了第一个在室温下为液态的离子液体(硝酸乙基胺)。随后,Hurley等[2]利用AlCl3和烷基吡啶制备了第一个含铝离子液体,并将其应用于电镀中。但是氯化铝类离子液体因在空气和水中不稳定而限制了其实际应用。随着20世纪末一些对空气和水均很稳定的离子液体,如1-烷基-3-甲基咪唑四氟硼酸盐(CnmimBF4)、1-烷基-3-甲基咪唑六氟磷酸盐(CnmimPF6)和1-烷基-3-甲基咪唑双三氟甲烷磺酰亚胺盐(CnmimNTf2)等被合成出来,有关离子液体在催化、有机合成、电化学以及萃取分离等各个领域中的应用得到了广泛研究。
根据不同阴阳离子组合搭配,离子液体有很多种类,可以根据需要合成不同性质的离子液体。根据阳离子可以主要分为以下几类:咪唑类(Cnmim+)、吡啶类(CnBPy+)、季铵盐类)和季磷盐类)等。常见的阴离子主要有:卤素阴离子(X-)、六氟磷酸阴离子()、四氟硼酸阴离子()、双氰基胺阴离子(dca-)以及双三氟甲基磺酰亚胺阴离子()等。
相对于传统有机溶剂,离子液体具有许多非常突出的优点:(1)化学稳定性和热稳定性较高,不可燃;(2)蒸汽压低;(3)电化学窗口宽,电导率高;(4)溶解能力强,对于很多有机、无机分子具有很好的溶解能力;(5)理化性质可根据其阴阳离子组成进行调节,通过设计不同阴阳离子,合成不同极性的离子液体。正是由于这些特有的性质,离子液体成为一种绿色友好的理想溶剂,被应用于多个领域。
2 离子液体在乏燃料后处理中的应用
在乏燃料后处理领域,离子液体体系因其高萃取效率、高选择性和很好的辐射稳定性而得到国内外学者的密切关注,各国已经多次召开相关学术会议来研讨其在乏燃料后处理中应用的可行性。目前,已有一些综述文章[3-13]总结了离子液体在各种放射性元素萃取分离中的应用,例如:Sun等[3]以碱金属和碱土金属(如Sr和Cs)、锕系元素(如U和Pu等)、镧系元素(如La和Eu等)和裂片元素(如Tc和Zr等)等为主线,系统总结了它们在离子液体中的萃取行为。本课题组近几年来对离子液体体系萃取U、Th、Sr、Cs等放射性元素进行了系统的研究[14-28]。本文针对咪唑类、季铵盐类、季磷盐类和功能化离子液体应用于放射性元素萃取中的一些关键问题(如萃取效率、萃取选择性、萃取机理、反萃和辐照稳定性等)进行总结,希望能够对离子液体在乏燃料后处理中的应用进行合理评估与展望。其中,关于离子液体辐照稳定性的研究,翟茂林组[29-30]最近系统地综述了国内外的研究进展,本文将不再赘述。
萃取中用到的常见离子液体和萃取剂结构式示于图1和图2。
2.1 萃取效率
1)咪唑类离子液体
(1)三丁基磷酸酯(TBP)和辛基(苯基)-N,N-二异丁基胺甲酰基甲基氧化膦(CMPO)作为萃取剂
TBP和CMPO作为PUREX流程和TRUEX流程的主要萃取剂,被广泛应用于乏燃料后处理中。关于TBP和CMPO在咪唑类离子液体中萃取乏燃料后处理相关放射性元素已有不少报导[22,31-44]。
由于PUREX流程的广泛应用,TBP在离子液体中萃取铀酰成为了研究者非常关注的内容之一。Giridhar等[33]系统研究了TBP在C4mimPF6中萃取硝酸介质中的。TBP-C4mimPF6萃取的分配比随着硝酸浓度增加而增加,在硝酸浓度为0.01~4mol/L时,TBP-C4mimPF6与TBP-正十二烷体系萃取效率相当。但是与TBP-正十二烷体系相比,TBP-C4mimPF6体系在硝酸浓度大于4mol/L时,萃取效率仍会随着硝酸浓度增加而继续增加。Dietz等[36]研究了TBP在类离子液体CnmimNTf2(n=5,8,10)中萃取硝酸介质中。研究发现,随着水相硝酸浓度的变化,不同碳链离子液体中萃取效率有着不同的变化趋势。在低硝酸浓度下,短碳链离子液体萃取体系有着较高的萃取效率,萃取分配比为10左右,而在高酸度下,这三种离子液体萃取效率相差很小。Giridhar等[37]具体分析了1.1mol/L TBP-C4mimNTf2萃取的酸效应,测量了萃取进入有机相中水和酸的含量。Billard等[41]系统研究了TBP在C4mimNTf2中萃取的机理,确定了萃取效率与萃取剂TBP和硝酸浓度的关系(图3)。在高酸度下,不同碳链离子液体中萃取分配比与硝酸浓度之间的关系曲线基本一致。而在低酸度下,短碳链离子液体体系的萃取效率会显著高于长碳链离子液体体系。短碳链离子液体体系的萃取分配比随着硝酸浓度逐渐增加经历一个先下降后上升的过程。作者通过紫外可见光谱对萃取后的离子液体相进行了表征,研究结果表明,在低酸度下萃取通过阳离子交换机理进行,高酸度下则通过阴离子[UO2(NO3)3(TBP)m]-与NTf-2进行交换的机理进行。
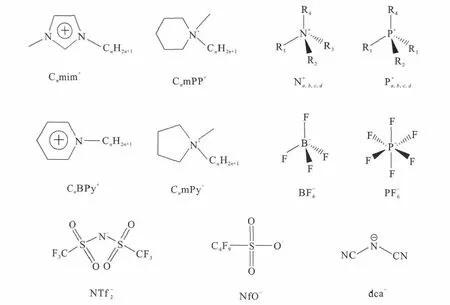
图1 萃取中常用离子液体的阳离子和阴离子结构式Fig.1 Structures of cations and anions of common ionic liquids used in extraction

图2 离子液体萃取体系常用萃取剂的结构式Fig.2 Structures of common extractants in the extraction system of ionic liquid
CMPO也是乏燃料后处理中常用的萃取剂,其在离子液体中萃取锕系和镧系元素已有部分报导。Visser等[31]利用CMPO和TBP作为萃取剂,研究其在正十二烷、C4mimNTf2和C8mimNTf2中萃取硝酸铀酰。研究发现,与正十二烷相比,离子液体体系具有更高的萃取效率,而且萃合物也具有不同配位环境。扩展X射线吸收精细结构(EXAFS)数据表明萃取后正十二烷中铀酰配合物的配位构型为六角双锥型,配合物以UO2(NO3)2(CMPO)2的形式存在;而在离子液体中铀酰离子赤道平面的配位数近似为4.5,萃合物以UO2(NO3)(CMPO)+的形式存在。由于CMPO在常规溶剂中也能很好地萃取镧系元素,Nakashima等[34]研究了CMPO在C4mimPF6和C4mimNTf2中萃取镧系元素。离子液体作为稀释剂显著地提高了萃取效率,10mmol/L CMPO在C4mimPF6中就能对0.1mmol/L Eu3+达到近100%的萃取效率。通过采用硝酸和螯合试剂乙二胺四乙酸(EDTA)、二乙基三胺五乙酸(DTPA)等能够将金属离子定量反萃[35]。

图3 铀酰的萃取分配比与初始加入的HNO3浓度的关系曲线[41]Fig.3 Variation of extraction efficiency of the uranyl as a function of c(HNO3)aq,init[41]
Lohithakshan等[38]研究了CMPO在C8mimPF6中萃取Pu4+。结果表明,萃取通过阳离子交换机理进行。进入离子液体的萃取物种为[Pu(NO3)-(CMPO)x]3+,其中x随着实验条件的改变而从1变化到2。Rout等[39]在硝酸介质中利用CMPO和TBP在C4mimNTf2中萃取Am3+。研究了萃取过程中的分配比与各种参数(如硝酸浓度、CMPO浓度、NaNO3浓度和温度等)的关系。研究发现CMPO在C4mimNTf2中萃取Am3+呈现很高的萃取分配比,斜率分析数据表明萃取过程中形成1∶3(Am∶CMPO)的配合物。
(2)酰胺类萃取剂
与常规含磷类萃取剂不一样,只含有C、H、O、N四种元素的酰胺类萃取剂在焚烧后不留固体残渣,可以简化相应的后处理过程,因而日益受到青睐。在离子液体萃取体系中,已经有了一些采用酰胺类萃取剂对乏燃料后处理中金属元素进行萃取的研究[45-58]。
Rout等[58]利用二(2-乙基己基)磷酸酯(D2EHPA)和二(2-乙基己基)二苷酰胺酸(HDEHDGA)研究了在离子液体C8mimNTf2中对Eu3+和Am3+的萃取,深入考察了硝酸、D2EHPA、HDEHDGA和DTPA的浓度对萃取的影响。在pH>3.5时,两种萃取剂对Eu和Am的萃取分配比均能达到1 000以上。Shen等[47]合成并表征了N,N,N′,N′-四丁基-3-氧杂戊二酰胺(TBDA)和N,N,N′,N′-二甲基二丁基-3-氧杂戊二酰胺(MBDA),并以它们作为萃取剂研究了在CnmimPF6(n=4,6,8)中萃取。在相同条件下离子液体中的萃取效率高于氯仿体系。萃取数据的拟合表明和萃取剂以1∶2的比例萃入离子液体中。同时他们也以TBDA和MBDA作为萃取剂研究了在CnmimPF6(n=4,6,8)中萃取Th4+,发现与氯仿体系相比,低硝酸浓度下离子液体萃取体系具有更高的萃取效率[48]。利用斜率分析法和紫外可见光谱进一步研究其萃取机理,结果表明,Th4+与萃取剂MBDA以1∶2的配比形成阳离子配合物进入离子液体中。
Rout等[52]利用N,N-二甲基-N,N-二辛基-2-(2-己基乙氧基)丙二酰胺(DMDOHEMA)在C4mimNTf2中萃取、Pu4+和Am3+。离子液体碳链长度增长会降低萃取分配比,对于和Pu4+,金属离子和萃取剂会形成1∶2的萃合物;对于Am3+,则会形成1∶3的结构。Patil等[54]利用N,N′-二甲基-N,N′-二丁基-2-十四烷基丙二酰胺(DMDBTDMA)和DMDOHEMA在不同离子液体中萃取锕系元素Am3+、、NpO2+、和Pu4+。Pathak等[59]将二-2-己基异丁酰胺溶解在不同离子液体CnmimNTf2(n=4,6,8)中,研究了对、Pu4+和NpO2+的萃取。
酰胺夹醚类萃取剂由于具有多个结合位点而广受关注。Panja等[50]利用N,N,N′,N′-四正辛基-3-氧杂戊二酰胺(TODGA)作为萃取剂研究其在C4mimNTf2、C6mimNTf2和C8mimNTf2中萃取分离一系列锕系元素,如Am3+、Pu4+和。与传统稀释剂正十二烷相比,TODGA在离子液体中对所有锕系元素均具有很高的萃取效率,在低酸度下TODGA对Am和Pu的萃取分配比能够达到103量级(图4)。在低酸度条件下,金属离子的萃取分配比会随着水相酸度增加而降低。离子液体中萃取机理也与传统有机稀释剂中有所差别,主要为阳离子交换机理。离子液体碳链长度对萃取的影响也充分证明了这一点。

图4 硝酸浓度对TODGA(1.0×102 mol/L)在C8mimNTf2中萃取锕系元素的影响[50]Fig.4 Effect of feed nitric acid concentration on the extraction of actinides using TODGA(1.0×102 mol/L)in C8mimNTf2[50]
(3)冠醚类萃取剂
在乏燃料后处理中,Sr和Cs是两种重要的高放射性裂片元素。以离子液体为稀释剂,采用冠醚类萃取剂对Sr2+、Cs+进行萃取分离是目前的研究热点之一[14-15,20,60-82]。
Dai等[60]利用二环己基-18-冠6(DCH18C6)作为萃取剂,研究在离子液体中萃取水相中的Sr2+。结果发现,在C2mimNTf2中Sr2+的萃取效率比相同条件下甲苯做溶剂时的效率高出了近4个数量级。Visser等[61]利用18-冠-6、DCH18C6以及4,4’-(5’)-二叔丁基环己基并-18-冠-6(Dtb18C6)为萃取剂,在CnmimPF6(n=4,6,8)中研究了其对Na+、Cs+和Sr2+的萃取。Dtb18C6在离子液体中对Sr2+有着较高的萃取效率,随着离子液体咪唑环上碳链的增长,萃取效率逐渐下降。为了进一步研究不同取代冠醚对Sr2+萃取的影响,Luo等[66]在咪唑类离子液体中,采用DCH18C6、氮杂冠醚和咪唑阳离子取代的氮杂冠醚作为萃取剂来萃取Sr2+,研究表明,咪唑阳离子取代的氮杂冠醚既可以做溶剂又可以做萃取剂,但是萃取效率不如另外两种。DCH18C6对Sr2+的萃取效率稍高,但是其选择性比氮杂冠醚差。在C4mimNTf2中,辛基取代的氮杂冠醚萃取效率最高。
本课题组[14]利用DCH18C6在离子液体CnmimPF6和CnmimNTf2中研究了其对Sr2+的萃取。DCH18C6在离子液体中的萃取效率要高于正辛醇体系,分配比达到103数量级。离子液体萃取体系的萃取效率与离子液体结构有关;酸和盐的加入会降低萃取效率,因而可以用稀酸和盐溶液进行反萃。进一步采用杯芳冠醚异丙基杯[4]冠-6(BPC6)在CnmimPF6和CnmimNTf2中研究其对Cs+的萃取,并考察了各种因素,如盐浓度、辐照等对萃取的影响[15]。研究结果表明,在离子液体中BPC6比BOBcalixC6有更高的溶解度,其对Cs+的萃取分配比达到103量级(图5)。通过紫外可见光谱测量水相C4mim+的含量,证明了离子液体相中C4mim+与水相中的Cs+或BPC6·Cs+进行交换促进了萃取,提高了该体系的萃取效率。

图5 萃取效率与在CnmimNTf2中BPC6浓度的关系曲线[15]Fig.5 Relationship between E(Cs)and the concentration of BPC6in CnmimNTf2[15]
(4)其他萃取剂
除了上述萃取剂外,还有很多常见萃取剂已用于离子液体体系萃取分离乏燃料中关键元素[25,83-112]。
膦酸和磷氧类萃取剂由于其高效萃取效率,常用于镧系和锕系元素的萃取。本课题组[25]采用三丁基氧化膦(TBPO)作为萃取剂,研究了其在CnmimNTf2中萃取的行为。研究发现TBPO在CnmimNTf2中对有着很高的萃取效率,50mmol/L的TBPO就能对10mmol/L达到近100%的萃取效率。离子液体碳链长度对的萃取效率影响不大。Cocalia等[84]研究了二烷基膦酸(Cyanex 272)在离子液体C10mimNTf2中 萃 取和Am3+、Nd3+、Eu3+。结果表明,离子液体-水体系和正十二烷-水体系对金属离子的萃取分配比相近。EXAFS和紫外-可见光谱测量结果证明,在离子液体和正十二烷中金属离子的配位环境相同,两个萃取剂形成萃取剂二聚体,铀酰离子以两个萃取剂二聚体进行配位,而三价金属(如Am3+和Eu3+等)是以三个萃取剂二聚体来配位(图6)。
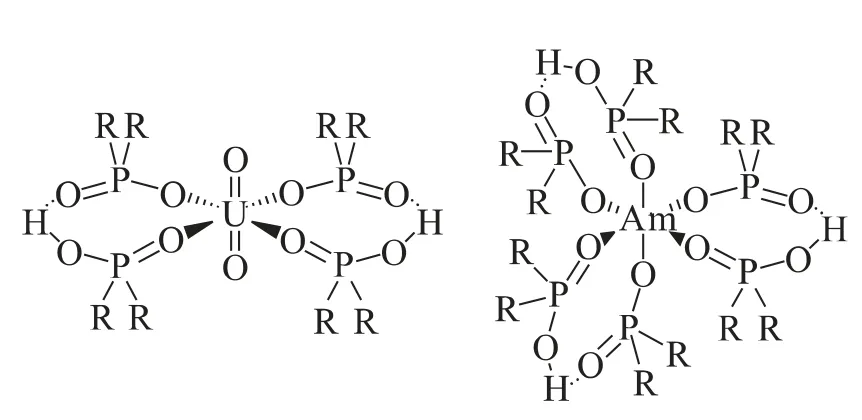
图6 Cyanex 272与和Am3+的配位结构[84]Fig.6 Coordination structure ofand Am3+with Cyanex 272[84]
Yoon等[97]研究了D2EHPA在离子液体和常规有机溶剂(C2mimPF6、C4mimPF6、C4mpyPF6和正己烷)中萃取五种镧系元素(Ce、Nd、Sm、Dy和Yb)。对比不同浓度的D2EHPA、HNO3和不同温度对萃取效率的影响,发现离子液体碳链长度减小会使得离子液体萃取体系的分配比增加。通常情况下咪唑类离子液体相对于吡啶类离子液体来说对镧系的萃取分配比要高。Sun等[99]主要研究了ILs在TALSPEAK流程中的应用。他采用了8种咪唑类离子液体CnmimNTf2(n=4,6,8,10)、CnmimBETI(全氟烷基磺酰亚胺盐,BETI,n=4、6、8、10)和1种吡啶类离子液体C4mpyNTf2作为稀释剂,以D2EHPA作为萃取剂,从水溶液中萃取分离镧系元素。结果发现,在离子液体中,用D2EHPA作为萃取剂对一些稀土元素有着显著提高的萃取效率和选择性。
Sun等[89]在C8mimPF6中,以支链三烷基氧化膦(Cyanex 925)作为萃取剂从Y、La、Yb中分离Sc3+。萃合物中配体和金属离子的配比通过lg D(Sc)对lg c(Cyanex 925)曲线的线性拟合确定,Cyanex 925对Sc3+的负载量进一步证明了Cyanex 925与Sc3+的剂量关系接近3∶1。
噻吩甲酰三氟丙酮(HTTA)作为一类重要的二酮类螯合萃取剂在萃取铀酰和镧系元素中有着广泛的应用。Raut等[111]研究了HTTA在不同离子液体CnmimNTf2(n=4、6、8)中萃取铀酰离子。在低pH下,萃取主要按照阳离子交换机理进行,当水相pH增加时(pH>4),萃取以中性复合物萃取机理为主。主要的萃取物种有1∶1型UO2(TTA)+、1∶2型UO2(TTA)2和1∶3型UO2(TTA)2(HTTA)。在C6mimNTf2和C8mimNTf2萃取体系中,主要存在1∶3型萃取物种。Jensen等[100]用HTTA作为萃取剂,研究了HTTA在离子液体C4mimNfO中萃取镧系元素。与C4mimNTf2体系不同,C4mimNfO体系中形成的配合物配比随着萃取剂浓度和溶液酸度的变化从1∶1、1∶2到1∶3不断变化。随着萃取剂浓度的增加,不断形成1∶2和1∶3的Ln∶TTA配合物。而在C4mimNTf2体系中主要形成1∶4的配合物。
2)季铵盐和季磷盐类离子液体
季铵盐和季磷盐类离子液体是一类以季铵盐、季磷盐或其衍生物作为阳离子、等做为阴离子的离子液体。目前已经有部分研究工作采用这一类离子液体作为稀释剂研究相关元素的萃取行为[79,94,113-118]。
Stepinski等[79]用季膦盐离子液体P6,6,6,14NTf2作为稀释剂研究了其对的萃取。他们也研究了P6,6,6,14NTf2协同DCH18C6在二甲苯中对进行萃取,水相中Na+与DCH18C6形成Na-DCH18C6+,然后结合一个进入有机相。本课题组[27]也以不同离子液体(咪唑类、季铵盐类和季磷盐类离子液体等)作为萃取剂研究了其对的萃取,发现N6,4,4,4NTf2对和的萃取效率最高,纯N6,4,4,4NTf2对10mmol/L的萃取效率能达到80%以上。该体系的萃取机理为阴离子交换机理,通过与的交换促进萃取。
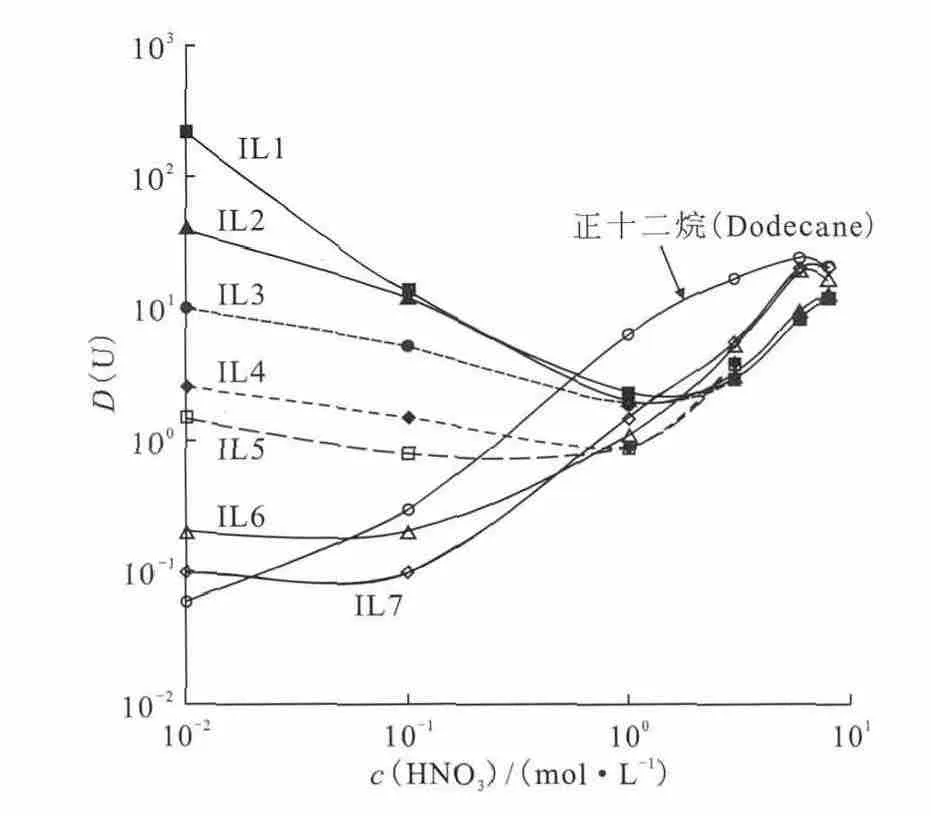
图7 TBP(1.2mol/L)在离子液体和正十二烷中萃取铀酰的分配比D(U)与硝酸浓度的关系曲线[114]Fig.7 Dependence of D(U)on c(HNO3)at constant TBP concentration(1.2mol/L)in ionic liquids and dodecane[114]
对于稀土元素在季磷盐类离子液体中的萃取也有报导。Liu等[119]将季磷盐阳离子与膦酸阴离子形成的离子液体——Cyphos IL 104用作一种新型的萃取剂在不同稀释剂中进行稀土的萃取分离研究。研究发现,酸化的Cyphos IL 104(HNO3-Cyphos IL 104)在有机稀释剂中具有很高的溶解度,并且比三烷基膦酸(Cyanex 272)具有更高的萃取效率。
3)功能化离子液体
(1)含P O功能基团
P O键是锕系元素和镧系元素的有效络合基团,能够有效萃取锕系和镧系元素,因此一些课题组将含磷基团接到离子液体上,从而实现对相关核素的有效萃取[120-125]。
Ouadi等[120]合成了三个基于季铵盐阳离子和膦酰功能基团的新型疏水性功能化离子液体(TSILs),并将这些离子液体应用于的萃取。结果表明,该功能化离子液体对有着很高的萃取分配比。萃取中功能化离子液体中的P O基团能够与进行结合,促进萃取。增加水相硝酸浓度能够增加的分配比。
也有研究者将CMPO类的功能团接到咪唑离子液体上,比如Odinets等[121]合成了一系列在咪唑阳离子上接有二苯基胺基甲酰甲基氧膦基团的功能化离子液体。在中性介质中,这些配体会通过P O和C O键与EuCl3或者Eu(NO3)3形成ML2型配合物,这种配合物的配位模式与常见的CMPO配合物类似。Mohapatra等[125]合成了接枝有CMPO基团的功能化离子液体(CMPO-based TSILs),并研究了其在CnmimNTf2中对锕系和镧系元素的萃取(图8)。该功能化离子液体在短碳链离子液体C4mimNTf2中对Am的分配比在低酸度下能够达到1 000,随着离子液体碳链长度增长,分配比有所降低,但也均能保证分配比在20以上,表明该离子液体萃取体系对Am有着较高的萃取效率。
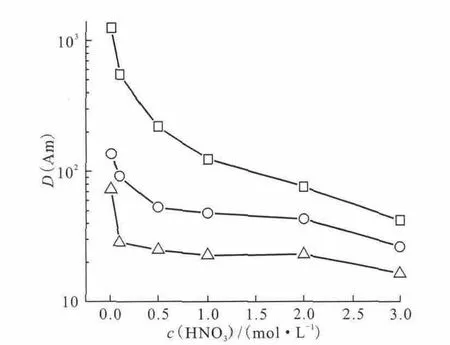
图8 功能化离子液体对Am3+的萃取分配比与硝酸浓度的关系曲线[125]Fig.8 Dependence of Am3+extraction on the concentration of nitric acid by TSIL[125]
Turanov等[81]合成了一类CMPO功能团与氮杂冠醚功能团相结合的萃取剂,研究发现氮杂冠醚与两个双齿CMPO功能团相结合形成的萃取剂比结合一个功能双齿基团的萃取效率要高[82]。Vicente等[124]合成了一系列新颖的氧化膦官能团的离子液体,并研究了其作为镧系元素萃取剂的应用。通过控制氧化膦官能团与咪唑阳离子之间的碳链长度控制其对金属离子的络合能力,增加氧化膦官能团与咪唑阳离子之间的空间单元数会使得氧化膦与金属离子的键合能力增加。这些新颖的离子液体在镧系、锕系和过渡金属离子的萃取分离中具有潜在的应用。
(2)酰胺类基团
酰胺基团作为另一种有效的萃取功能团,近些年来也被用于合成相关功能化离子液体,并对金属离子进行萃取分离[116,126-128]。
Bonnaffe等[49]利用N,N′-二甲基-N,N′-二丁基-丙二酰胺(DMDBMA)和接枝有丙二酰胺功能团的功能化离子液体(FIL-MA)作为萃取剂,研究了其在C4mimNTf2中萃取。研究表明DMDBMA和FIL-MA萃取过程中的机理有所差异。在低酸度下,DMDBMA萃取体系通过与2个H+交换实现萃取,而FIL-MA萃取体系通过与C4mim+和H+的交换来实现。在高硝酸浓度下,两种萃取剂均由[UO2(NO3)3]-与交换实现的萃取。
Sengupta等[53]利用三脚架型TODGA(TDGA)和TODGA在三种离子液体C4mimNTf2、C6mimNTf2和C8mimNTf2中研究对Am3+的萃取。与TODGA相比,T-DGA能够显示出对Am3+更高的萃取效率。分配比D(Am)会随着离子液体碳链长度的增长而降低,这与离子液体在水溶液中的溶解度有关。除了Am3+,作者还研究了该离子液体体系对Pu4+、、Eu3+、Sr2+和Cs+的萃取。采用0.5mol/L EDTA和DTPA的碳酸胍溶液能够将99%以上的金属离子进行反萃。斜率分析表明,Am3+与T-DGA形成1∶1的配合物。时间分辨激光荧光光谱结果表明T-DGA-C4mimNTf2萃取体系形成的配合物中不包含内核水分子。
(3)其他基团
Ouadi等[129]合成了两个含有羟基苄胺基团的功能化离子液体(TSILs)。这些化合物均是将羟基苄胺基团接到咪唑取代物上。研究表明,不论是纯离子液体还是稀释后的离子液体均能够有效地萃取Am3+。同时在加酸条件下能够将Am3+有效地从离子液体相中进行回收。
有关双功能团类离子液体也引起了研究者们的兴趣,Sun等[130]合成了一种双功能团离子液体[A336][CA-100](A336:三辛基甲基铵盐;CA-100:2-邻壬基苯氧基乙酸根),并将该离子液体浸渍吸附在XAD-7树脂上,用于稀土分离[131]。他们同时研究了烷基氧膦化合物(Cyanex 925)在[A336][NO3]中 分 离Sc[115]。萃取实验发现,[A336][NO3]体系中的萃取分配比远远大于C8mimPF6体系。与常见的离子液体萃取体系很难反萃不同,Cyanex 925-[A336][NO3]萃取体系分配比受酸度影响较大,因此可以通过调节pH能够达到很好的反萃效果。Yang等[132]又研究了新型的双功能团离子液体[A336][P204]和[A336][P507](P507:2-乙基己基膦酸单-2-乙基己基酯)在高浓度的Al(NO3)3存在下从荧光粉模拟溶液中萃取稀土元素。研究发现[A336][P204]和[A336][P507]与一些常规的中性有机磷类萃取剂萃取过程很类似。当从模拟的废弃荧光粉体系中萃取Re(Ⅲ)时,在体系中加入异丙醇作为改性剂能够消除三相。
2.2 萃取选择性
萃取选择性是萃取中至关重要的问题之一,萃取体系的选择性好坏决定了其能否实际应用。目前离子液体萃取体系的选择性问题已经有了一些研究。
本课题组以Sr、Cs、Zr、Cr、Re、Ru、Ni和Nd为竞争离子研究了CMPO在CnmimNTf2体系中萃取的选择性问题[23]。研究发现,水相硝酸浓度以及离子液体碳链长度均会对的分配比和萃取选择性有影响。TBP、CMPO在离子液体中对有着更高的萃取分配比和更好的萃取选择性。所选的离子中,仅有Zr4+、和Cs+存在竞争,其中(模拟)和Cs+是被离子液体本身萃取,Zr4+只是在高酸度下有干扰。相对于TBP萃取体系,CMPO萃取体系因对有着更好的萃取选择性(图9)而具有很好的应用前景。
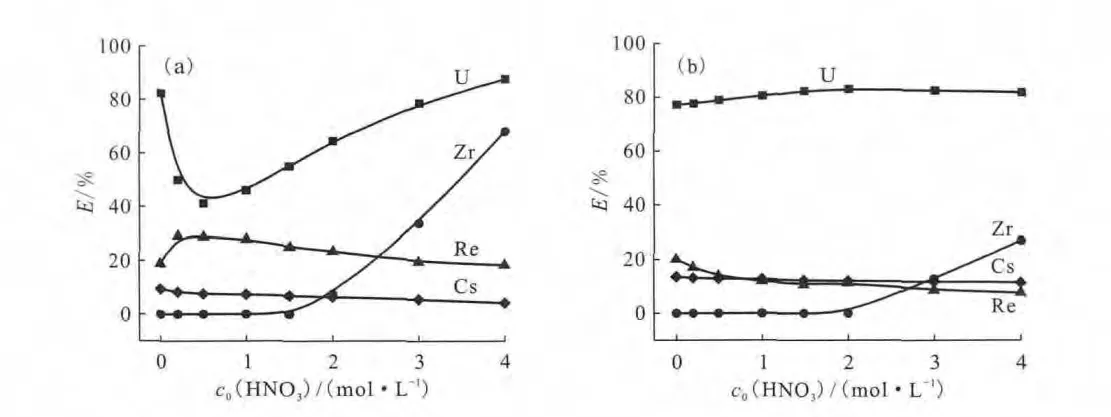
图9 TBP-C4mimNTf2(1.1mol/L)(a)、CMPO-C4mimNTf2(0.02mol/L)(b)萃取模拟废液后金属离子的萃取效率与硝酸浓度的关系[23]Fig.9 Extraction efficiency of metal ions depending on the concentration of the adding HNO3 in the extraction of SLW by TBP-C4mimNTf2(1.1mol/L)(a)and CMPO-C4mimNTf2(0.02mol/L)(b)[23]
Kubota等[46]在CnmimNTf2(n=4、8、12)体系中采用一种新型萃取剂2-N,N′-二辛基氨基-2-氧代乙氧基乙酸(DODGAA)来萃取稀土元素。研究发现,该体系能够定量从含Zn2+体系中选择性萃取Y3+和Eu3+。该体系的反萃可以通过加入硝酸溶液得以实现。Rout等[58]合成并表征了新型萃取剂HDEHDGA,并对D2EHPA和HDEHDGA在离子液体C8mimNTf2中萃取152,154Eu3+和241Am3+进行了研究。发现离子液体相中的萃取剂和水相中的DTPA对金属离子络合能力的差异使得镧系和锕系元素能够有效地分离。Rout等[52]利用DMDOHEMA在室温离子液体C4mimNTf2中萃取、Pu4+和Am3+。萃取选择性结果表明,锕系元素对其他裂片元素的分离因子大于1 000。
有关Sr和Cs在离子液体中的选择性萃取也是一个研究热点。Luo等[66]在咪唑类离子液体中,采用DCH18C6、氮杂冠醚和咪唑阳离子取代的氮杂冠醚作为萃取剂来萃取Sr2+。作者研究了Sr2+对Na+、K+和Cs+等离子的萃取选择性。DCH18C6对Sr2+的萃取效率稍高,但是其选择性比氮杂冠醚差。通过改变萃取剂和离子液体的组合,可以实现不同离子的选择性。在离子液体中,杯芳冠醚类化合物能够有效地萃取Cs+。Luo等[67]利用杯芳冠醚杯[4]芳烃二(叔辛基苯并-冠-6)(BOBcalixC6)在离子液体中对Cs+进行萃取。发现,Na+和Sr2+对Cs+不构成竞争,可以忽略其影响,但是K+的干扰比常规溶剂要强。
针对乏燃料后处理中锕系元素的萃取选择性是另一个研究热点。Rout等[116,123]合成并表征了一种新型的功能化离子液体,即N,N-二辛基-2-(3-甲基咪唑)乙酰胺双三氟甲基磺酰胺(DOAImNTf2),研究其在室温离子液体CnmimNTf2中萃取、Pu4+和Am3+。Pu4+的分配比随着水相硝酸浓度增加而降低,在4~5mol/L时达到最低值,然后继续上升。与Pu4+相比和Am3+的萃取分配比受硝酸浓度影响较小。在DOAImNTf2-C4mimNTf2中,Pu4+相对于其他锕系元素具有很高的分离因子。Sengupta等[126]利用TODGA和接枝有戊二酰胺(DGA)基团的杯芳烃(C4DGA)作为萃取剂,系统研究了其对于Am3+的萃取。不同金属离子的萃取分配比具有以下顺序:75(Am3+)>30.7(Pu4+)>3.9(NpO2+)>1.19(Pu4+)>0.52()>0.12(Cs+)>0.024(Sr2+)。萃合物的计量比实验表明形成1∶2(M∶L)的萃合物。与正十二烷萃取体系相比,离子液体体系提高了萃取效率,同时也提高了从Pu4+、和Am3+混合体系中选择性提取Am3+的分离因子。
Rout等[133]合成了三辛基甲基铵二(2-乙基己基)膦酸盐([A336][DEHP])并将其用于萃取Am3+、和Pu4+。Am3+和的萃取分配比随着硝酸浓度增加而降低,而Pu4+的分配比先上升后下降。萃取分配比顺序为:Pu4+>>Am3+,表明修饰萃取剂能够实现选择性萃取Pu4+。Sengupta等[127]将3-氧杂戊二酰胺接枝到咪唑阳离子上,合成了DGA-功能化离子液体(DGA-TSIL),并研究了其对锕系元素的萃取。结果表明三价锕系元素的萃取分配比比四价锕系元素的分配比高一个数量级,同时比六价锕系元素高两个数量级。Sasaki等[134]利用功能化离子 液 体[Hbet][NTf2]和[TMPA][NTf2](Hbet:甜菜碱;TMPA:N,N,N-三甲基-N-丙基季铵盐)作为稀释剂研究了它们对于硝酸体系中的萃取。在低酸度下,该体系能够从Na+和Al3+溶液中选择性地萃取出。
2.3 萃取机理
1)三种萃取机理
与传统有机溶剂萃取体系相比,离子液体体系有着更加复杂的萃取机理。目前,主要有三种机理:阳离子交换机理、阴离子交换机理以及中性复合物机理。
文献[63-64]以DCH18C6为萃取剂,在CnmimNTf2中研究Sr2+的萃取,并首次提出阳离子交换机理。在C5mimNTf2中,酸度提高,萃取效率下降。检测两相中阴离子浓度表明离子液体中的阴离子不足以平衡Sr2+的电荷,说明该萃取体系为阳离子交换机理(式(1))。而在C10mimNTf2中,酸度提高,萃取效率变化同正辛醇体系类似,呈现上升趋势,阴离子的检测结果表明萃取后离子液体中的浓度足以平衡Sr2+的正电荷,因此认为该体系为中性复合物机理(式(2))。在C6mimNTf2和C8mimNTf2中,两种萃取机理同时存在。

Jensen等[83]在C4mimNTf2中利用HTTA来萃取三价镧系元素Ln3+,通过log曲线法和EXAFS手段研究了其萃取机理,证明了该萃取过程为Ln和之间的阴离子交换机理。
Dietz等[36]以TBP-CnmimNTf2(n=5、8、10)萃取时,发现TBP-离子液体体系萃取充分地体现了离子液体的阳离子交换机理、中性复合物萃取机理和阴离子交换机理。在短碳链离子液体C5mimNTf2中,萃取机理随硝酸浓度的增加逐渐由阳离子交换机理转变为中性复合物机理,而在长碳链离子液体C10mimNTf2中,高酸度和低酸度的条件下萃取机理均为中性复合物机理。
Billard等[41]研究了TBP-C4mimNTf2萃取体系对的萃取,认为该体系随着硝酸浓度变化萃取机理由阳离子交换机理转变为阴离子交换机理,但是不存在中性复合物萃取机理。Bell等[114]在季铵盐类离子液体中采用TBP萃取,并进一步研究了其萃取机理。随着加入硝酸浓度的变化,萃取机理中包含了阳离子交换机理、中性复合物机理以及阴离子交换机理。
除了上述几种机理外,文献[93]中还报导了一种反相胶束的萃取机理,这是因为作者采用的萃取剂N1923具有很强的表面活性,容易在离子液体中形成反相胶束。
本课题组[20,27]系统研究了DCH18C6在CnmimNTf2中萃取Sr2+和Cs+的萃取机理,萃取过程中CnmimNTf2的解离平衡与萃取过程的阳离子交换紧密相关。水相加入咪唑阳离子会使得CnmimNTf2的解离平衡发生移动,因此进一步影响萃取过程中的阳离子交换过程,最终使得萃取平衡发生移动,降低萃取率,而水相加入则会有相反的效果(图10)。该研究使得人们对于萃取过程溶解和交换平衡有着更深入的理解。本课题组[25,28]采用常用萃取剂TBPO和TOPO等三烷基氧化膦研究了其在CnmimNTf2中萃取和Eu3+,并深入研究了萃取过程中的萃取机理,通过定量比较离子液体中进入量,电喷雾质谱(ESI-MS)和紫外光谱表征确定了TBPO-CnmimNTf2中萃取机理的差异性。萃取中存在两种萃合物,即UO2(TBPO)3(NO3)+和UO2,其中UO2(TBPO)3(NO3)+的比例从C2mimNTf2体系到C8mimNTf2体系逐渐增加。
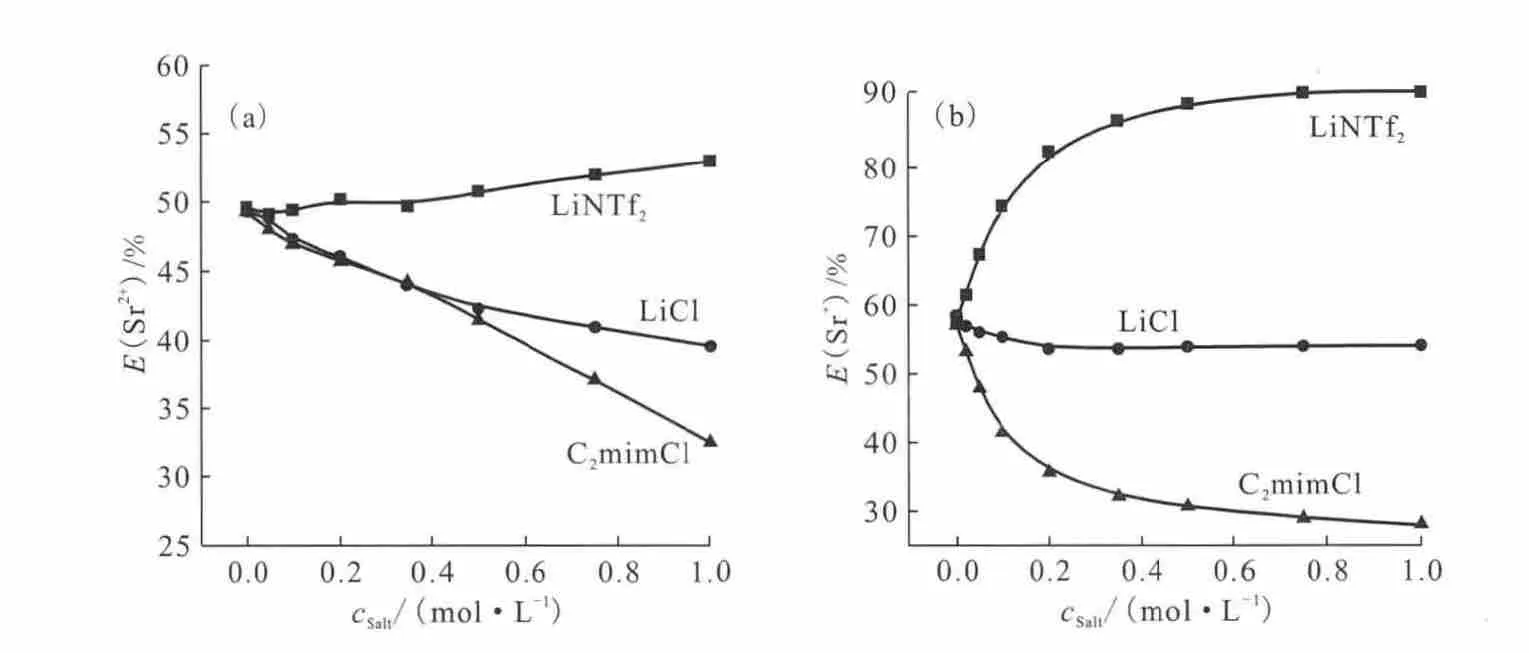
图10 LiNTf2、LiCl和C2mimCl对萃取的影响[20]Fig.10 Influence of LiNTf2,LiCl and C2mimCl on the extraction[20]
2)萃取三相
Rout等[43]利用C4mimNTf2替代正十二烷作为稀释剂研究了0.2mol/L CMPO-1.2mol/L TBP萃取三价镧系和锕系元素。发现在离子液体中加入TBP能够有效阻止三相形成,LOC(limiting organic concentration)得到较大地增加。在正十二烷体系中Eu3+的LOC约为9g/L,而在0.2mol/L CMPO-1.2mol/L TBP/C4mimNTf2体系中有机相能够负载近40g/L Eu(Ⅲ)且不出现三相。离子液体中萃取物种的Eu∶CMPO计量比依赖于金属离子的负载量,从示踪水平下的1∶3到高金属负载量下的1∶1。若该离子液体体系中不加TBP,则会在相界面处形成一种固态沉淀物质;当加入的TBP浓度达到0.2mol/L时,沉淀就会消失。这表明,TBP的存在能够有效地抑制三相的形成。
Rout等[42]利用CMPO和TBP在室温离子液体CnmimNTf2(n=4、6、8)中萃取硝酸介质中的Eu。结果发现,利用C4mimNTf2作为稀释剂对Eu进行萃取时能够得到较高的分配比。Eu(Ⅲ)-CMPO配合物的计量比在1mol/L HNO3时为1∶3,而在5mol/L HNO3时为1∶2。增加咪唑环上碳链的长度会降低对Eu3+的分配比。同时发现在有机相中装载15g/L金属离子时仍然没有三相形成。
本课题组[28]深入研究了TBPO和TOPO在CnmimNTf2中萃取和Eu3+的三相问题。发现TOPO-C2mimNTf2和TOPO-C4mimNTf2体系萃取UO2(NO3)2时会出现三相,随着离子液体碳链增长,三相逐渐消失,而TBPO萃取UO2(NO3)2的萃合物可以很好地溶解在所有离子液体中。对于Eu3+的萃取,也发现在TOPO-C4mimNTf2体系中会出现第三相,离子液体碳链长度增加,三相消失。萃取过程中三相形成与萃合物在离子液体中的溶解度有关,由于短碳链离子液体的极性相对较大,而此时萃合物在极性较大的离子液体中的溶解度较小,因此萃合物以第三相的形式析出在两相之间,长碳链离子液体则能很好地溶解萃合物。TBPO由于具有较短的碳链,因此配合物的极性较大,能够与不同碳链长度的离子液体进行匹配,因此没有出现三相。
3)协同效应
离子液体萃取体系中存在萃取剂与离子液体之间和不同萃取剂之间两种类型的协同效应。
对于萃取剂和离子液体之间的协同效应,本课题组进行了初步探索[17,27-28]。BPC6在离子液体中萃取Cs+时,离子液体的阴离子与萃取剂可能存在协同作用,萃取过程中形成的配合物中会与Cs+进行配位,促进萃取。合成的晶体结构也进一步佐证了萃合物中与Cs+的配位结构(图11)。表明萃取剂BPC6与离子液体的阴离子在对Cs+萃取时可能存在协同作用。TOPO和TBPO在离子液体中萃取Eu3+时,则会形成结构为Eu(TOPO)4(NO3)NTf2和Eu(TBPO)4(NO3)NTf2的萃合物。其中,只是以反离子的形式存在,并没有与Eu配位。合成的配合物Eu(TPhPO)4(NO3)2NTf2的晶体结构也进一步佐证了萃合物的结构。说明了此时离子液体阴离子与萃取剂没有类似的协同效应。现有的结果表明,离子液体是否与萃取剂存在协同效应通常和离子液体阴离子与金属离子的配位作用有关。

图11 配合物[Cs+·BPC6]的结构示意图[17]Fig.11 Structure of complex·BPC6][17]
大部分协同效应研究集中在不同萃取剂之间的协同效应上。Stepinski等[69]在冠醚萃取Sr2+体系中加入了TBP后,发现TBP和冠醚具有协同效应,同时离子液体碳链长度的变化会影响协同效应的强弱。Hirayama等[76]采用HTTA和18C6作为萃取剂,研究了它们在C4mimNTf2中萃取镧系元素的协同效应。结果表明,La3+以La(TTA)2(18C6)+和La(TTA)(18C6)2+的 形式被HTTA和18C6协同萃取进入离子液体相。
为进一步改善氮杂冠醚体系的萃取,Shimojo等[77]合成了β-二酮修饰的双氮杂冠醚,并研究了其在离子液体中对Sr2+的萃取。该萃取剂具有分子内协同作用,因此具有更高的萃取效率,并且易于反萃。
Okamura等[96]在C4mimNTf2体系中研究了18冠6的衍生物(18冠6、二环己基18冠6和二苯并18冠6)与HTTA萃取三价镧系元素的协同作用。HTTA与冠醚在离子液体中的协同萃取提高了对轻镧系元素的萃取效率,而对重镧系元素的萃取效率几乎不改变。冠醚类萃取剂的协同萃取作用可能是因为萃取物种从中性或者阴离子物种转变成了阳离子三元配合物种Ln(TTA)2(CE)+和Ln(TTA)(CE)2+。同时协同效应的产生也与镧系元素尺寸与冠醚的空腔相匹配有关。
2.4 反萃
相比于传统有机溶剂萃取金属离子,离子液体萃取更加高效而且绿色环保。但是如何实现从离子液体中有效反萃金属离子一直是很重要的问题[135]。目前关于离子液体萃取体系的反萃研究主要分为三大类:液-液反萃、电化学反萃和超临界CO2反萃。
1)液-液反萃
液-液反萃是最常使用的反萃方法,常用的液-液反萃方法分为:(1)调节溶液酸度;(2)加入与离子液体相同的离子;(3)加入络合剂。
调节溶液酸度为最常用的反萃方法。Katsuta等[136]在无额外萃取剂存在的季铵盐离子液体体系中,直接用硝酸可将已萃入其中的Pt和Pd反萃出来,而且通过控制酸度可将Pt选择性反萃出来。Shimojo等[137]使用DODGAA做萃取剂对镧系元素高效萃取,并通过调节酸度对14种Ln3+成功反萃。Rout等[138]研究两种不互溶的离子液体对稀土元素进行分离,并使用2mol/L HNO3对萃取相进行反萃。随后他们[139]又合成了以DEHP为阴离子的三种离子液体C6mimDEHP、C6mpyrDEHP和N4,4,4,4DEHP,并分别在离子液体C6mimNTf2、C6mpyrNTf2和N1,4,4,4NTf2做稀释剂条件下对Nd3+进行萃取,使用1mol/L硝酸经过四次反萃可实现Nd3+近100%的反萃。除了使用HNO3外,还可以使用氨水调节酸度。Cieszynska等[140]使用氯化三己基(十四烷基)季磷盐离子液体(Cyphos®IL101)为萃取剂、甲苯为稀释剂的条件下对Pa(Ⅱ)可以高效快速萃取,并使用0.5mol/L氨水溶液可使反萃率达到97.1%。
有些萃取体系,不能简单地通过调节溶液酸度来实现反萃。根据离子液体萃取的阳离子交换机理和阴离子交换机理,可以通过加入与离子液体相同的离子抑制萃取而达到反萃的目的。本课题组研究在水相中加入离子液体的阴阳离子对离子液体萃取Sr2+和Cs+的影响,发现在水相中加入C2mimCl会导致DCH18C6-C2mimNTf2对Sr2+的萃取率和BPC6-C2mimNTf2对Cs+的萃取率有明显的下降[27]。而在N6,4,4,4NTf2萃 取体系中加入LiNTf2会明显降低的萃取效率(图12)。利用这一结果,以LiNTf2水溶液对离子液体中的进行反萃,反萃6次后总反萃率可达到99.5%[27]。
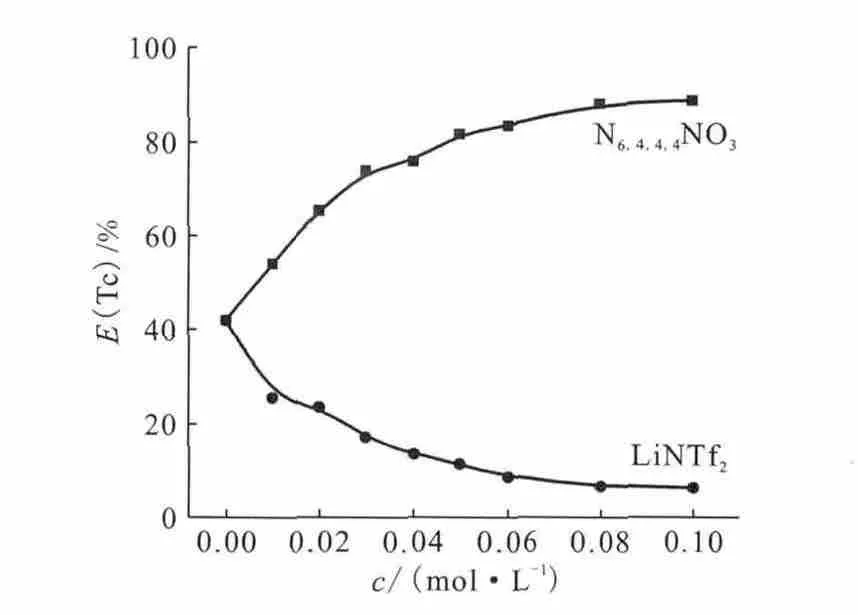
图12 水相中N6,4,4,4NO3和LiNTf2的浓度对N6,4,4,4NTf2萃取的影响[27]Fig.12 Influence of N6,4,4,4NO3and LiNTf2in aqueous phase on the extraction ofby N6,4,4,4NTf2[27]
此外,Hu等[141]使用纯离子液体C8mimPF6萃取而不萃取,离子液体相在碱性条件下,通过加入KPF6溶液可以将定量反萃出来。
一些离子液体萃取体系可以通过加入络合剂达到反萃目的。Nakashima等[35]在CMPOC4mimPF6体系中,单独用硝酸溶液不能将金属离子反萃出来,而采用具有络合剂的缓冲溶液可以将接近100%的Ce3+、Eu3+和Y3+反萃出来(图13)。
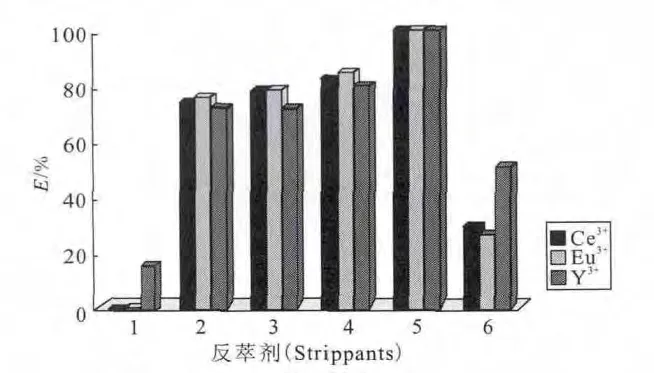
图13 使用各种反萃体系对C4mimPF6中Ce3+、Eu3+和Y3+进行反萃[35]Fig.13 Stripping of Ce3+,Eu3+and Y3+from C4mimPF6phase using various strippants[35]
褚泰伟等[142]使用碳酸胍做反萃剂,可以从C8mimPF6-TBP、C4mimPF6-TBP和N8881Cl-TBP三种萃取体系中定量反萃U(Ⅵ)。Zhang等[143]用TODGA在CnmimPF6体系中萃取和Th4+,反萃用0.5mol/L HNO3时和Th4+反萃率仅为32%和30%,而使用EDTA的钠盐时,和Th4+的反萃效率可达到86%和89%。
Panja等[50]在离子液体中使用TODGA作为萃取剂对Am3+、Pu4+和等锕系离子进行萃取,使用0.05mol/L EDTA、0.05mol/L DTPA和缓冲液(0.1mol/L柠檬酸+0.4mol/L甲酸+0.4mol/L水合肼)作为反萃剂,可达到较好反萃效果。Sengupta等[53]使用T-DGA在三种室温离子液体中对Am3+萃取,与TODGA相比有更高的分离系数,并使用EDTA和DTPA在1mol/L碳酸胍溶液中进行三次反萃后可以达到99%的反萃率。
此外,除了以上常见的三种反萃方法,还有一些特 殊的反萃体系。Zhang等[144]在H2SO4/H3PO4体系中,使用三种双功能团离子液体萃取剂[A336][P507]、[A336][P204]和[A336][C272]对Ce(Ⅳ)萃取进行研究,在H2SO4/H3PO4体系中使用H2O2可以实现有效反萃,并得到CePO4纳米颗粒。Zuo等[95]在C8mimPF6中使用二(2-乙基己基)磷酸酯(DEHEHP)对氟碳铈镧矿浸出液中的Ce(Ⅳ)进行萃取,并使用混合溶 液1%H2O2/NH2OH·HCl/1%H3BO3/0.1mol/L H2SO4将Ce(Ⅳ)从离子液体中定量反萃出来。
由于液-液反萃通常需要反复多次才能达到较高的反萃效率,而离子液体和萃取剂在水中具有一定的溶解度,为避免离子液体的流失,使用液-液反萃要在水相中加入相关离子。Zuo等[145]在纯离子液体C8mimPF6中加去离子水就可将Ce(Ⅳ)定量地反萃出来,同时需要通过在水相中加入C8mim+或抑制离子液体在反萃过程中的流失。目前,液-液反萃有多种体系,关于反萃机理还没有系统研究,在实际使用过程中要结合具体萃取体系的特点选择合适的反萃体系。
2)超临界CO2反萃
从20世纪80年代开始,超临界流体萃取技术(SFE)受到了越来越多的关注,并有很多研究进展。超临界二氧化碳(sc-CO2)作为另一种绿色溶剂,与离子液体之间有着特殊溶解度关系,即sc-CO2在离子液体中有很好的溶解度,而离子液体却几乎不溶于sc-CO2中[146],因此可以利用sc-CO2将离子液体中的金属离子反萃,实现分离回收的目的[4,146-147]。超临界CO2流体萃取金属离子的仪器装置示于图14,主要包括:温度控制系统、压力控制系统、冷却和换热系统、气体压缩机、夹带剂泵、萃取釜、收集釜等。
Blanchard等[146]首次提出了sc-CO2与ILs之间的溶解度关系,sc-CO2在RTILs中有很好的溶解度且溶解过程可逆。Sun等[3]认为离子液体萃取与sc-CO2反萃联合使用的优势是将放射性物质从大体积的水相转移到小体积的离子液体相,再进一步转移到sc-CO2中,可以有效减少放射性物质的体积。
ILs萃取与sc-CO2反萃联用萃取金属离子已有报道。Mekki等[85,148]研究了sc-CO2从离子液体中萃取过渡金属Cu2+以及镧系金属Eu3+,萃取效率均大于90%。该作者设计出H2OC4mimNTf2-sc-CO2体系三步萃取La3+和Eu3+,从离子液体相到sc-CO2相不需要夹带剂和改性剂就可以得到较高的萃取效率[85]。更多情况下,非极性的sc-CO2很难直接萃取极性的金属离子,需要在萃取体系中加入夹带剂或改性剂提高萃取效率。Wang等[40]研究发现硝酸溶液中的可被有效萃取到TBP-C4mimNTf2中,UV-vis光谱表征离子液体相中的以配合物[UO2(NO3)2(TBP)2]形式存在,这种配合物可以有效地转移到sc-CO2中。

图14 超临界CO2流体从IL相反萃金属离子仪器装置图[18]Fig.14 Apparatus for the stripping of metal ions from IL phase to sc-CO2[18]
本课题组[18]使用HTTA-CnmimNTf2体系从水相中萃取Th4+,并结合超临界CO2从离子液体中反萃出Th4+。选择乙醇做夹带剂从离子液体中反萃Th4+,反萃率可达到90%以上。分别考察了温度、压力、改性剂的体积和极性以及动态萃取时间四个因素对反萃率的影响,实验流程示于图15。

图15 Th4+的萃取-反萃过程示意图[18]Fig.15 Diagram showing the extraction-stripping procedure for Th4+[18]
本课题组还用TOPO做改性剂,使用sc-CO2从CMPO-C2mimNTf2体系中将反萃出来[24]。在一定条件下反萃效率可达99%,反萃过程中离子液体有约5%的损失,通过使用ESI-MS分别对反萃产物和回收后的离子液体相进行表征,发现反萃产物中含有[UO2(TOPO)2NO3NTf2·H3O]+、[UO2(TOPO)3NO3NTf2·2H3O]+、[UO2(CMPO)2NO3·2H2O]+和[UO2(CMPO)2(TOPO)NO3·2H2O]+四种阳离子配合物,说明在sc-CO2反萃过程中TOPO与CMPO对萃取的竞争作用与协同作用同时存在。
由于超临界流体萃取过程涉及到多因素、多水平的实验条件选择,需要有效优化实验条件。Pourmortazavi等[149]利用正交实验设计方法优化从固体基质中使用sc-CO2萃取金属离子,并利用方差分析法对实验结果进行分析,得到最优的实验条件。Yamini等[150]利用正交实验设计法优化sc-CO2萃取Re(Ⅶ)和Pt(Ⅳ),使用正交表分别对压力、温度、夹带剂体积、静态和动态萃取时间5个因素进行实验设计,用方差分析法对实验结果进行分析,得到最优化的实验条件。
将超临界流体萃取与离子液体萃取体系联用,利用sc-CO2的特异性,解决反萃问题,实现离子液体的回收再利用的目的,在乏燃料后处理过程中具有潜在的应用价值。目前相关研究还处于实验室探索阶段,对其中存在的一些关键性基础问题进行深入研究,可为今后实际应用奠定坚实的基础。
3)电化学反萃
电化学沉积是从水相反萃液中获得纯金属的最终步骤,离子液体因其较宽的电化学窗口、高导电性、对金属离子高溶解性,可以作为电化学沉积金属离子的有效介质[3,151-152]。此外,电化学反萃可以有效减少废液的产生,而且可以直接得到所需产物,显著简化萃取过程[153]。因此,可以用电化学沉积的方法来解决反萃问题。本课题组研究了CMPO-IL从硝酸铀酰水溶液中萃取的电化学行为,首次利用电化学沉积的方法,对CMPO-C4mimNTf2体系中的进行反萃[22]。Chen等[154]使用液态汞电极对离子液体中的Cs+进行有效的回收,回收率可达97%。随后该作者[113]系统研究了将离子液体萃取与电沉积相结合从水相中分离出Sr2+和Cs+。该过程分为两步:首先将Sr2+和Cs+萃取到离子液体相,进一步两种阳离子在阴极被还原成单质Sr和Cs,分别与汞形成汞齐。
电化学沉积受外界环境因素的影响也有一些研究。Tsuda等[155]研究了电化学沉积过程中残留在离子液体里的水和氧气对Cs+回收的影响,结果发现汞电极上Cs+的还原受水的影响较小而受氧气的影响很大。Giridhar等[37]使用TBPC4mimNTf2体系对硝酸介质中的进行萃取,进一步使用电化学沉积将TBP-C4mimNTf2中的以UO2的形式从离子液体中沉积出来。
Bridges等[156]研究高剂量的γ辐照对离子液体电化学特性的影响,发现离子液体经过1.2MGy的γ辐照后,其导电性和电化学窗口均有明显降低,这将对使用电化学沉积方法对离子液体体系反萃有很大影响。此外,电化学反萃的关键问题是如何选择离子液体使其电化学窗口与金属离子的还原电位相匹配,同时还需考虑电极的选择、干扰离子的还原电位与目标离子的差别以及离子液体中其他成分对电化学还原的影响。总之,影响电化学沉积的因素较多,将电化学沉积法应用于离子液体反萃中的局限性较大。
3 总结与展望
CnmimNTf2、CnmimPF6、Na,b,c,dNTf2、Pa,b,c,dNTf2以及一些功能化离子液体,在乏燃料后处理中的应用研究已经有了较多尝试。萃取过程中的萃取效率、萃取选择性、萃取机理、反萃以及萃取体系的辐照稳定性等方面已经取得了一定的进展,但是仍有很多问题有待解决。
萃取效率对于评估该萃取体系至关重要。目前文献中已经报道了很多有关在多种离子液体中的萃取行为。TBP、CMPO、TBPO以及部分酰胺类萃取剂对均有着较高的萃取效率。冠醚类萃取剂是Cs+和Sr2+等碱金属和碱土金属离子的特征萃取剂,合适条件下,离子液体-冠醚萃取体系对Cs+和Sr2+的萃取分配比能达到1 000以上。对于其他一些锕系元素,如Th、Pu、Am和Cm等,在离子液体中的萃取行为研究则相对较少。因此未来可以逐渐增加这一方面的研究,不断完善研究各种参数对于萃取效率的影响,筛选出高效萃取体系。
有关离子液体体系中萃取选择性的报导目前主要集中在锕系元素(U、Am和Pu)与部分裂片元素(Cs和Sr)之间的选择性。而锕系元素相对于其他裂片元素如Ln、Tc和Zr等元素的选择性则相对较少。因此后续工作可以扩展锕系元素对其他更多裂片元素的选择性研究,进一步为离子液体体系在乏燃料后处理中的实际应用做理论铺垫。
萃取过程的机理研究能够更好地帮助我们理解离子液体萃取体系和常规溶剂萃取体系的不同,为设计相应萃取体系提供依据。萃取过程主要分为三种机理:阳离子交换机理、阴离子交换机理以及中性复合物机理。但是关于萃取过程中萃合物组成结构的确定则相对较难,主要是由于离子液体萃取体系的萃取机理会随着离子液体极性变化而变化,从而导致萃合物的变化。另外,乏燃料后处理通常在硝酸介质中进行,离子液体萃取体系中硝酸根可能会参与萃合物的形成,高浓度硝酸也可能会影响疏水性离子液体的聚集结构。离子液体萃取体系出现三相的原因可能与萃合物在离子液体中的溶解度以及离子液体本身的负载量有关,可以通过调节离子液体极性(如改变离子液体碳链长度)来消除。但离子液体中三相形成的规律仍需要进一步研究。离子液体体系中不同萃取剂之间的协同效应已经有了部分报导,但离子液体本身与萃取剂的协同作用目前还没有定论,有待深入研究。
离子液体反萃可以通过液-液反萃、sc-CO2反萃和电化学反萃三种方法来解决。液-液反萃可以根据不同萃取体系特点和萃取机理选择相应的反萃溶液,包括一定量的硝酸使萃取剂带正电荷排斥金属离子而达到反萃效果;根据阳离子或阴离子交换机理,加入与离子液体相同的离子来抑制萃取过程,而达到反萃目的;某些体系通过加入复杂的络合剂和碳酸胍混合溶液通过竞争萃取将金属离子反萃出来。sc-CO2反萃因其绿色环保且可使离子液体回收再利用,而具有潜在的应用价值。离子液体萃取与sc-CO2反萃联合使用已成功对U、Th、Sr等元素进行分离。因sc-CO2反萃涉及多因素变量,可选用正交实验设计法对反萃最优条件进行系统的研究。目前sc-CO2反萃机理研究还不够深入,有待加强,如何将其工业化是未来的努力方向。电化学反萃是一个可以直接从离子液体相中获得纯金属的方法,但在实际操作中需考虑电化学窗口与金属离子还原电位的匹配性、电极的选择、干扰离子的还原电位与目标离子的差别以及离子液体中其他成分对电化学还原的影响等因素,实验要求比较苛刻,在实际使用过程中受到很大限制。
辐照稳定性研究目前主要集中于乏燃料后处理中使用较多的咪唑类离子液体体系,研究广度还有待拓展。对乏燃料所含金属元素萃取效率高的离子液体体系的辐照稳定性工作还不多,也不够系统,深入开展将对实际应用更具有指导意义。目前辐照稳定性研究主要集中在γ辐照,在乏燃料后处理过程中α和β辐照效应将更为严重,但相关研究较少,有必要进一步深入。
综上所述,需要筛选互相匹配的萃取剂-离子液体体系,对乏燃料中所含锕系元素及放射性裂片元素进行更系统深入的研究,在此基础上有望提出乏燃料后处理先进流程。与此同时,离子液体萃取体系由于对相关放射性元素的高萃取效率和高选择性,还可广泛应用于放化分析及中低放废液相关元素的分离富集。
[1]Walden P.Molecular weights and electrical conductivity of several fused salts[J].Bull Acad Imper Sci St Petersbourg,1914,8:405-422.
[2]Hurley F H.Electrodeposition of aluminum:US,2446331[P].1948.
[3]Sun X Q,Luo H M,Dai S.Ionic liquids-based extraction:apromising strategy for the advanced nuclear fuel cycle[J].Chem Rev,2012,112(4):2100-2128.
[4]Zhao H,Xia S Q,Ma P S.Use of ionic liquids as“green”solvents for extractions[J].J Chem Technol Biotechnol,2005,80(10):1089-1096.
[5]Kubota F,Goto M.Application of ionic liquids to solvent extraction[J].Solvent Extr Res Dev-Jap,2006,13:23-36.
[6]Li Z J,Chang J,Shan H X,et al.Advance of room temperature ionic liquid as solvent for extraction and separation[J].Rev Anal Chem,2007,26(2):109-153.
[7]Mudring A V,Tang S F.Ionic liquids for lanthanide and actinide chemistry[J].Eur J Inorg Chem,2010,18:2569-2581.
[8]Baba Y,Kubota F,Kamiya N,et al.Recent advances in extraction and separation of rare-earth metals using ionic liquids[J].J Chem Eng Jpn,2011,44(10):679-685.
[9]Billard I,Ouadi A,Gaillard C.Liquid-liquid extraction of actinides,lanthanides,and fission products by use of ionic liquids:from discovery to understanding[J].Anal Bioanal Chem,2011,400(6):1555-1566.
[10]Kubota F,Baba Y,Goto M.Application of ionic liquids for the separation of rare earth metals[J].Solvent Extr Res Dev-Jpn,2012,19:17-28.
[11]Liu Y H,Chen J,Li D Q.Application and perspective of ionic liquids on rare earths green separation[J].Sep Sci Technol,2012,47(2):223-232.
[12]Rao P R V,Venkatesan K A,Rout A,et al.Potential applications of room temperature ionic liquids for fission products and actinide separation[J].Sep Sci Technol,2012,47(2):204-222.
[13]沈兴海,徐超,刘新起,等.离子液体在金属离子萃取分离中的应用[J].核化学与放射化学,2006,28(3):129-138.
[14]徐超,沈兴海,陈庆德,等.冠醚-离子液体体系对水相中锶离子的萃取研究[J].中国科学B辑:化学,2009,52(11):1402-1408.
[15]Xu C,Yuan L Y,Shen X H,et al.Efficient removal of caesium ions from aqueous solution using a calix crown ether in ionic liquids:mechanism and radiation effect[J].Dalton Trans,2010,39(16):3897-3902.
[16]沈兴海,张京晶,高嵩,等.典型超分子体系在放射化学领域的应用[J].化学进展,2011,23(7):1386-1399.
[17]Sun T X,Wang Z M,Shen X H.Crystallization of cesium complex containing bis(2-propyloxy)calix[4]crown-6and bis[(trifluoromethyl)sulfonyl]imide[J].Inorg Chim Acta,2012,390:8-11.
[18]Fu J,Chen Q D,Sun T X,et al.Extraction of Th(Ⅳ)from aqueous solution by room-temperature ionic liquids and coupled with supercritical carbon dioxide stripping[J].Sep Purif Technol,2013,119:66-71.
[19]Gao S,Sun T X,Chen Q D,et al.Improvement of the cloud point extraction of uranyl ions by the addition of ionic liquids[J].J Hazard Mater,2013,263:562-568.
[20]Sun T X,Shen X H,Chen Q D.A further understanding of the cation exchange mechanism for the extraction of Sr2+and Cs+by ionic liquid[J].Sci China-Chem,2013,56(6):782-788.
[21]Sun T X,Shen X H,Chen Q D,et al.Identification of F-andas the radiolytic products of the ionic liquid C4mimNTf2and their effect on the extraction of[J].Radiat Phys Chem,2013,83:74-78.
[22]吴京珂,沈兴海,陈庆德.CMPO-离子液体萃取分离铀(Ⅵ)体系的电化学性质[J].物理化学学报,2013,29(8):1705-1711.
[23]孙涛祥,沈兴海,陈庆德.CMPO和TBP在离子液体中选择性萃取水溶液中铀酰离子的研究[J].物理化学学报,2015,31(Suppl):32-38.
[24]Fu J,Chen Q,Shen X.Stripping of uranium from an ionic liquid medium by TOPO-modified supercritical carbon dioxide[J].Sci China-Chem,2015,58(3):545-550.
[25]刘海望,沈兴海,陈庆德.三丁基氧化膦-离子液体体系萃取UO2(NO3)2的机理和选择性[J].物理化学学报,2015,31(5):843-851.
[26]Yuan L Y,Xu C,Peng J,et al.Identification of the radiolytic product of hydrophonic ionic liquid[C4mim][NTf2]during removal of Sr2+from aqueous solution[J].Dalton Trans,2009,38:7873-7875.
[27]孙涛祥.离子液体体系萃取Sr、Cs、U、Tc等元素的研究[D].北京:北京大学,2013.
[28]刘海望.离子液体体系对U和Eu的萃取及其机理研究[D].北京:北京大学,2015.
[29]王硕珏,敖银勇,周翰洋,等.离子液体的辐射效应研究进 展[J].物 理 化 学 学 报,2014,30(9):1597-1604.
[30]袁立永,彭静,翟茂林.咪唑离子液体及其萃取体系的辐射 效 应 研 究[J].化 学 进 展,2011(7):1469-1477.
[31]Visser A E,Jensen M P,Laszak I,et al.Uranyl coordination environment in hydrophobic ionic liquids:an in situ investigation[J].Inorg Chem,2003,42(7):2197-2199.
[32]Visser A E,Rogers R D.Room-temperature ionic liquids:new solvents for f-element separations and associated solution chemistry[J].J Solid State Chem,2003,171(1):109-113.
[33]Giridhar P,Venkatesan K A,Srinivasan T G,et al.Extraction of uranium(Ⅵ)from nitric acid medium by 1.1Mtri-n-butylphosphate in ionic liquid diluent[J].J Radioanal Nucl Chem,2005,265(1):31-38.
[34]Nakashima K,Kubota F,Maruyama T,et al.Ionic liquids as a novel solvent for lanthanide extraction[J].Anal Sci,2003,19(8):1097-1098.
[35]Nakashima K,Kubota F,Maruyama T,et al.Feasibility of ionic liquids as alternative separation media for industrial solvent extraction processes[J].Ind Eng Chem Res,2005,44(12):4368-4372.
[36]Dietz M L,Stepinski D C.Anion concentrationdependent partitioning mechanism in the extraction of uranium into room-temperature ionic liquids[J].Talanta,2008,75(2):598-603.
[37]Giridhar P,Venkatesan K A,Subramaniam S,et al.Extraction of uranium(Ⅵ)by 1.1Mtri-nbutylphosphate/ionic liquid and the feasibility of recovery by direct electrodeposition from organic phase[J].J Alloys Compd,2008,448(1):104-108.
[38]Lohithakshan K V,Aggarwal S K.Solvent extraction studies of Pu(Ⅳ)with CMPO in 1-octyl 3-methyl imidazolium hexa fluorophosphate(C8mimPF6)room temperature ionic liquid(RTIL)[J].Radiochim Acta,2008,96(2):93-97.
[39]Rout A,Venkatesan K A,Srinivasan T G,et al.Extraction of americium(Ⅲ)from nitric acid medium by CMPO-TBP extractants in ionic liquid diluent[J].Radiochim Acta,2009,97(12):719-725.
[40]Wang J S,Sheaff C N,Yoon B,et al.Extraction of uranium from aqueous solutions by using ionic liquid and supercritical carbon dioxide in conjunction[J].Chem Eur J,2009,15(17):4458-4463.
[41]Billard I,Ouadi A,Jobin E,et al.Understanding the extraction mechanism in ionic liquids:/HNO3/TBP/C4mimTf2N as a case study[J].Solvent Extr Ion Exch,2011,29(4):577-601.
[42]Rout A,Venkatesan K A,Srinivasan T G,et al.Room temperature ionic liquid diluent for the extraction of Eu(Ⅲ)using TRUEX extractants[J].J Radioanal Nucl Chem,2011,290(1):215-219.
[43]Rout A,Venkatesan K A,Srinivasan T G,et al.Extraction and third phase formation behavior of Eu(Ⅲ)in CMPO-TBP extractants present in room temperature ionic liquid[J].Sep Purif Technol,2011,76(3):238-243.
[44]黄磊,黄卫,付海英,等.CMPO-离子液体体系对Ce3+的萃取[J].无机化学学报,2012,28(4):669-673.
[45]Shimojo K,Kurahashi K,Naganawa H.Extraction behavior of lanthanides using a diglycolamide derivative TODGA in ionic liquids[J].Dalton Trans,2008,37:5083-5088.
[46]Kubota F,Shimobori Y,Baba Y,et al.Application of ionic liquids to extraction separation of rare earth metals with an effective diglycol amic acid extractant[J].J Chem Eng Jpn,2011,44(5):307-312.
[47]Shen Y L,Tan X W,Wang L,et al.Extraction of the uranyl ion from the aqueous phase into an ionic liquid by diglycolamide[J].Sep Purif Technol,2011,78(3):298-302.
[48]Shen Y L,Wang S F,Zhu L,et al.Extraction of Th(Ⅳ)from an HNO3solution by diglycolamide in ionic liquids[J].Ind Eng Chem Res,2011,50(24):13990-13996.
[49]Bonnaffe-Moity M,Ouadi A,Mazan V,et al.Comparison of uranyl extraction mechanisms in an ionic liquid by use of malonamide or malonamidefunctionalized ionic liquid[J].Dalton Trans,2012,41(25):7526-7536.
[50]Panja S,Mohapatra P K,Tripathi S C,et al.A highly efficient solvent system containing TODGA in room temperature ionic liquids for actinide extraction[J].Sep Purif Technol,2012,96:289-295.
[51]Prathibha T,Venkatesan K A,Selvan B R,et al.Anomalous extraction behavior of americium(Ⅲ)in some diglycolamide isomers present in ionic liquid medium[J].Radiochim Acta,2012,100(12):907-913.
[52]Rout A,Venkatesan K A,Srinivasan T G,et al.Liquid-liquid extraction of Pu(Ⅳ),U(Ⅵ)and Am(Ⅲ)using malonamide in room temperature ionic liquid as diluent[J].J Hazard Mater,2012,221:62-67.
[53]Sengupta A,Mohapatra P K,Iqbal M,et al.Extraction of Am(Ⅲ)using novel solvent systems containing a tripodal diglycolamide ligand in room temperature ionic liquids:a“green”approach for radioactive waste processing[J].RSC Adv,2012,2(19):7492-7500.
[54]Patil A B,Pathak P,Shinde V S,et al.Efficient solvent system containing malonamides in room temperature ionic liquids:actinide extraction,fluorescence and radiolytic degradation studies[J].Dalton Trans,2013,42(5):1519-1529.
[55]Yang F,Kubota F,Baba Y,et al.Selective extraction and recovery of rare earth metals from phosphor powders in waste fluorescent lamps using an ionic liquid system[J].J Hazard Mater,2013,254:79-88.
[56]Sengupta A,Mohapatra P K,Iqbal M,et al.Solvent systems containing diglycolamide-functionalised calix[4]arenes in room temperature ionic liquid for metal ion extraction:studies with simulated highlevel wastes[J].Supramol Chem,2014,26(7):612-619.
[57]Sun M,Yuan L Y,Tan N,et al.Solvent extraction of uranium(Ⅵ)by a dipicolinamide using a room-temperature ionic liquid[J].Radiochim Acta,2014,102(1):87-92.
[58]Rout A,Karmakar S,Venkatesan K A,et al.Room temperature ionic liquid diluent for the mutual separation of europium(Ⅲ)from americium(Ⅲ)[J].Sep Purif Technol,2011,81(2):109-115.
[59]Pathak P N,Prabhu D R,Kumari N,et al.Studies on the extraction of actinides using a solvent containing D2EHiBA in room temperature ionic liquids:unusual extraction of the tetravalent ions[J].Sep Sci Technol,2015,50(3):373-379.
[60]Dai S,Ju Y H,Barnes C E.Solvent extraction of strontium nitrate by a crown ether using room-temperature ionic liquids[J].J Chem Soc-Dalton Trans,1999,8:1201-1202.
[61]Visser A E,Swatloski R P,Reichert W M,et al.Traditional extractants in nontraditional solvents:groups 1and 2extraction by crown ethers in roomtemperature ionic liquids[J].Ind Eng Chem Res,2000,39(10):3596-3604.
[62]Chun S,Dzyuba S V,Bartsch R A.Influence of structural variation in room-temperature ionic liquids on the selectivity and efficiency of competitive alkali metal salt extraction by a crown ether[J].Anal Chem,2001,73(15):3737-3741.
[63]Dietz M L,Dzielawa J A.Ion-exchange as a mode of cation transfer into room-temperature ionic liquids containing crown ethers:implications for the“greenness”of ionic liquids as diluents in liquidliquid extraction[J].Chem Commun,2001,20:2124-2125.
[64]Jensen M P,Dzielawa J A,Rickert P,et al.EXAFS investigations of the mechanism of facilitated ion transfer into a room-temperature ionic liquid[J].J Am Chem Soc,2002,124(36):10664-10665.
[65]Dietz M L,Dzielawa J A,Laszak I,et al.Influence of solvent structural variations on the mechanism of facilitated ion transfer into room-temperature ionic liquids[J].Green Chem,2003,5(6):682-685.
[66]Luo H M,Dai S,Bonnesen P V.Solvent extraction of Sr2+and Cs+based on room-temperature ionic liquids containing monoaza-substituted crown ethers[J].Anal Chem,2004,76(10):2773-2779.
[67]Luo H M,Dai S,Bonnesen P V,et al.Extraction of cesium ions from aqueous solutions using calix[4]arene-bis(tert-octylbenzo-crown-6)in ionic liquids[J].Anal Chem,2004,76(11):3078-3083.
[68]Dietz M L,Stepinski D C.A ternary mechanism for the facilitated transfer of metal ions into room-temperature ionic liquids(RTILs):implications for the“greenness”of RTILs as extraction solvents[J].Green Chem,2005,7(10):747-750.
[69]Stepinski D C,Jensen M P,Dzielawa J A,et al.Synergistic effects in the facilitated transfer of metal ions into room-temperature ionic liquids[J].Green Chem,2005,7(3):151-158.
[70]Vayssiere P,Chaumont A,Wipff G.Cation extraction by 18-crown-6to a room-temperature ionic liquid:the effect of solvent humidity investigated by molecular dynamics simulations[J].Phys Chem Chem Phys,2005,7(1):124-135.
[71]Heitzman H,Young B A,Rausch D J,et al.Fluorous ionic liquids as solvents for the liquid-liquid extraction of metal ions by macrocyclic polyethers[J].Talanta,2006,69(2):527-531.
[72]Luo H,Dai S,Bonnesen P V,et al.A striking effect of ionic-liquid anions in the extraction of Sr2+and Cs+by dicyclohexano-18-crown-6[J].Solvent Extr Ion Exch,2006,24(1):19-31.
[73]Nishi N,Murakami H,Imakura S,et al.Facilitated transfer of alkali-metal cations by dibenzo-18-crown-6across the electrochemically polarized interface between an aqueous solution and a hydrophobic room-temperature ionic liquid[J].Anal Chem,2006,78(16):5805-5812.
[74]Park S H,Demberelnyamba D,Jang S H,et al.Ionic liquid-type crown ether as a novel medium for a liquid/liquid extraction of radioactive metal ion Sr(85)2+[J].Chem Lett,2006,35(9):1024-1025.
[75]Dietz M L,Jakab S,Yamato K,et al.Stereochemical effects on the mode of facilitated ion transfer into room-temperature ionic liquids[J].Green Chem,2008,10(2):174-176.
[76]Hirayama N,Okamura H,Kidani K,et al.Ionic liquid synergistic cation-exchange system for the selective extraction of lanthanum(Ⅲ)using 2-thenoyltrifluoroacetone and 18-crown-6[J].Anal Sci,2008,24(6):697-699.
[77]Shimojo K,Okamura H,Hirayama N,et al.Cooperative intramolecular interaction of diazacrown ether bearing beta-diketone fragments on an ionic liquid extraction system[J].Dalton Trans,2009,25:4850-4852.
[78]Vendilo A G,Djigailo D I,Smirnova S V,et al.18-crown-6and dibenzo-18-crown-6assisted extraction of cesium from water into room temperature ionic liquids and its correlation with stability constants for cesium complexes[J].Molecules,2009,14(12):5001-5016.
[79]Stepinski D C,Vandegrift G F,Shkrob I A,et al.Extraction of tetra-oxo anions into a hydrophobic,ionic liquid-based solvent without concomitant ion exchange[J].Ind Eng Chem Res,2010,49(12):5863-5868.
[80]Ansari S A,Mohapatra P K,Raut D R,et al.Extraction of caesium(Ⅰ)from HNO3medium using room temperature ionic liquid containing calix[4]crown ligands as the selective extractants[J].Radiochim Acta,2011,99(11):713-717.
[81]Turanov A N,Karandashev V K,Baulin V E.Extraction of lanthanides(Ⅲ)with N,N′-bis(diphenylphosphinyl-methylcarbonyl)diaza-18-crown-6in the presence of ionic liquids[J].Solvent Extr Ion Exch,2012,30(3):244-261.
[82]Turanov A N,Karandashev V K,Baulin V E.Extraction of rare earth elements with phosphoryl-containing lariat crown ether in the presence of ionic liquids[J].Russ J Inorg Chem,2012,57(2):292-296.
[83]Jensen M P,Neuefeind J,Beitz J V,et al.Mechanisms of metal ion transfer into room-temperature ionic liquids:the role of anion exchange[J].J Am Chem Soc,2003,125(50):15466-15473.
[84]Cocalia V A,Jensen M P,Holbrey J D,et al.Identical extraction behavior and coordination of trivalent or hexavalent f-element cations using ionic liquid and molecular solvents[J].Dalton Trans,2005,11:1966-1971.
[85]Mekki S,Wai C M,Billard I,et al.Extraction of lanthanides from aqueous solution by using roomtemperature ionic liquid and supercritical carbon dioxide in conjunction[J].Chem Eur J,2006,12(6):1760-1766.
[86]Shimojo K,Naganawa H,Kubota F,et al.Solvent extraction of lanthanides into an ionic liquid containing N,N,N′,N′-tetrakis(2-pyridylmethyl)ethylenediamine[J].Chem Lett,2006,35(5):484-485.
[87]Sieffert N,Wipff G.Comparing an ionic liquid to a molecular solvent in the cesium cation extraction by a calixarene:a molecular dynamics study of the aqueous interfaces[J].J Phys Chem B,2006,110(39):19497-19506.
[88]Kozonoi N,Ikeda Y.Extraction mechanism of metal ion from aqueous solution to the hydrophobic ionic liquid,1-butyl-3-methylimidazolium nonafluorobutanesulfonate[J].Monatsh Chem,2007,138(11):1145-1151.
[89]Sun X Q,Wu D B,Chen J,et al.Separation of scandium(Ⅲ)from lanthanides(Ⅲ)with room temperature ionic liquid based extraction containing Cyanex 925[J].J Chem Technol Biotechnol,2007,82(3):267-272.
[90]Kubota F,Koyanagi Y,Nakashima K,et al.Extraction of lanthanide ions with an organophosphorous extractant into ionic liquids[J].Solvent Extr Res Dev-Jpn,2008,15:81-87.
[91]Sun X Q,Peng B,Chen J,et al.An effective method for enhancing metal-ions′selectivity of ionic liquid-based extraction system:adding water-soluble complexing agent[J].Talanta,2008,74(4):1071-1074.
[92]Turanov A N,Karandashev V K,Baulin V E.Effect of ionic liquids on the extraction of rare-earth elements by bidentate neutral organophosphorus compounds from chloride solutions[J].Russ J Inorg Chem,2008,53(6):970-975.
[93]Zuo Y,Chen J,Li D Q.Reversed micellar solubilization extraction and separation of thorium(Ⅳ)from rare earth(Ⅲ)by primary amine N1923in ionic liquid[J].Sep Purif Technol,2008,63(3):684-690.
[94]Srncik M,Kogelnig D,Stojanovic A,et al.Uranium extraction from aqueous solutions by ionic liquids[J].Appl Radiat Isot,2009,67(12):2146-2149.
[95]Zuo Y,Liu Y,Chen J,et al.Extraction and recovery of cerium(Ⅳ)along with fluorine(Ⅰ)from bastnasite leaching liquor by DEHEHP in C8mimPF6[J].J Chem Technol Biotechnol,2009,84(7):949-956.
[96]Okamura H,Hirayama N,Morita K,et al.Synergistic effect of 18-crown-6derivatives on chelate extraction of lanthanoids(Ⅲ)into an ionic liquid with 2-thenoyltrifluoroacetone[J].Anal Sci,2010,26(5):607-611.
[97]Yoon S J,Lee J G,Tajima H,et al.Extraction of lanthanide ions from aqueous solution by bis(2-ethylhexyl)phosphoric acid with room-temperature ionic liquids[J].J Ind Eng Chem,2010,16(3):350-354.
[98]Pribylova G A.Influence of ionic liquids on actinides extraction by diphenyl(dibutyl)carbamoylmethylphosphine oxide in different solvents from nitric acid solution[J].J Radioanal Nucl Chem,2011,288(3):693-697.
[99]Sun X Q,Bell J R,Luo H M,et al.Extraction separation of rare-earth ions via competitive ligand complexations between aqueous and ionic-liquid phases[J].Dalton Trans,2011,40(31):8019-8023.
[100]Jensen M P,Borkowski M,Laszak I,et al.Anion effects in the extraction of lanthanide 2-thenoyltrifluoroacetone complexes into an ionic liquid[J].Sep Sci Technol,2012,47(2):233-243.
[101]Matveeva E V,Sharova E V,Turanov A N,et al.Extraction properties of beta-aminophosphine oxides towards lanthanides and alkaline earth metals[J].Cent Eur J Chem,2012,10(6):1933-1941.
[102]Shiri-Yekta Z,Yaftian M R,Nilchi A.Extractionseparation of Eu(Ⅲ)and Th(Ⅳ)ions from nitrate media into a room-temperature ionic liquid[J].J Iran Chem Soc,2013,10(2):221-227.
[103]Yang F,Kubota F,Kamiya N,et al.Extraction of rare-earth ions with an 8-hydroxyquinoline derivative in an ionic liquid[J].Solvent Extr Res Dev-Jap,2013,20:123-129.
[104]Atanassova M,Kurteva V,Lubenov L,et al.Comparing extraction,synergism and separation of lanthanoids using acidic and neutral compounds in chloroform and one ionic liquid:is the latter always“better”?[J].RSC Adv,2014,4(73):38820-38829.
[105]Lohithakshan K V,Patil P,Aggarwal S K.Solvent extraction studies of plutonium(Ⅳ)and americium(Ⅲ)in room temperature ionic liquid(RTIL)by di-2-ethyl hexyl phosphoric acid(HDEHP)as extractant[J].J Radioanal Nucl Chem,2014,301(1):153-157.
[106]Mohapatra P K,Raut D R,Sengupta A.Extraction of uranyl ion from nitric acid medium using solvent containing TOPO and its mixture with D2EHPA in room temperature ionic liquids[J].Sep Purif Technol,2014,133:69-75.
[107]Okamura H,Takagi H,Isomura T,et al.Highly selective synergism for the extraction of lanthanoid(Ⅲ)ions with beta-diketones and trioctylphosphine oxide in an ionic liquid[J].Anal Sci,2014,30(3):323-325.
[108]Shen Y L,Li W K,Wu J R,et al.Solvent extraction of lanthanides and yttrium from aqueous solution with methylimidazole in an ionic liquid[J].Dalton Trans,2014,43(26):10023-10032.
[109]Yuan L Y,Sun M,Liao X H,et al.Solvent extraction of U(Ⅵ)by trioctylphosphine oxide using a room-temperature ionic liquid[J].Sci China Chem,2014,57(11):1432-1438.
[110]Zhao Z G,Baba Y,Kubota F,et al.Synergistic extraction of rare-earth metals and separation of scandium using 2-thenoyltriuoroacetone and tri-noctylphosphine oxide in an ionic liquid system[J].J Chem Eng Jpn,2014,47(8):656-662.
[111]Raut D R,Mohapatra P K.Extraction of uranyl ion using 2-thenoyltrifluoro acetone(HTTA)in room temperature ionic liquids[J].Sep Sci Technol,2015,50(3):380-386.
[112]Rout A,Binnemans K.Influence of the ionic liquid cation on the solvent extraction of trivalent rareearth ions by mixtures of Cyanex 923and ionic liquids[J].Dalton Trans,2015,44(3):1379-1387.
[113]Chen P Y.The assessment of removing strontium and cesium cations from aqueous solutions based on the combined methods of ionic liquid extraction and electrodeposition[J].Electrochim Acta,2007,52(17):5484-5492.
[114]Bell T J,Ikeda Y.The application of novel hydrophobic ionic liquids to the extraction of uranium(Ⅵ)from nitric acid medium and a determination of the uranyl complexes formed[J].Dalton Trans,2011,40(39):10125-10130.
[115]Sun X Q,Ji Y,Guo L,et al.A novel ammonium ionic liquid based extraction strategy for separating scandium from yttrium and lanthanides[J].Sep Purif Technol,2011,81(1):25-30.
[116]Rout A,Venkatesan K A,Srinivasan T G,et al.Ionic liquid extractants in molecular diluents:extraction behavior of europium(Ⅲ)in quarternary ammonium-based ionic liquids[J].Sep Purif Technol,2012,95:26-31.
[117]Biswas S,Rupawate V H,Roy S B,et al.Taskspecific ionic liquid tetraalkylammonium hydrogen phthalate as an extractant for U(Ⅵ)extraction from aqueous media[J].J Radioanal Nucl Chem,2014,300(2):853-858.
[118]Stockmann T J,Zhang J,Montgomery A M,et al.Electrochemical assessment of water ionic liquid biphasic systems towards cesium extraction from nuclear waste[J].Anal Chim Acta,2014,821:41-47.
[119]Liu Y H,Zhu L L,Sun X Q,et al.Toward greener separations of rare earths:bifunctional ionic liquid extractants in biodiesel[J].Aiche J,2010,56(9):2338-2346.
[120]Ouadi A,Klimchuk O,Gaillard C,et al.Solvent extraction of U(Ⅵ)by task specific ionic liquids bearing phosphoryl groups[J].Green Chem,2007,9(11):1160-1162.
[121]Odinets I L,Sharova E V,Artyshin O I,et al.Novel class of functionalized ionic liquids with grafted CMPO-moieties for actinides and rare-earth elements recovery[J].Dalton Trans,2010,39(17):4170-4178.
[122]Rout A,Venkatesan K A,Srinivasan T G,et al.Unusual extraction of plutonium(Ⅳ)from uranium(Ⅵ)and americium(Ⅲ)using phosphonate based task specific ionic liquid[J].Radiochim Acta,2010,98(8):459-466.
[123]Rout A,Venkatesan K A,Srinivasan T G,et al.Separation of plutonium(Ⅳ)from uranium(Ⅵ)using phosphonate-based task-specific ionic liquid[J].Desalin Water Treat,2012,38(1-3):179-183.
[124]Vicente J A,Mlonka A,Gunaratne H Q N,et al.Phosphine oxide functionalised imidazolium ionic liquids as tuneable ligands for lanthanide complexation[J].Chem Commun,2012,48(49):6115-6117.
[125]Mohapatra P K,Kandwal P,Iqbal M,et al.A novel CMPO-functionalized task specific ionic liquid:synthesis,extraction and spectroscopic investigations of actinide and lanthanide complexes[J].Dalton Trans,2013,42(13):4343-4347.
[126]Sengupta A,Mohapatra P K,Iqbal M,et al.A highly efficient solvent system containing functionalized diglycolamides and an ionic liquid for americium recovery from radioactive wastes[J].Dalton Trans,2012,41(23):6970-6979.
[127]Sengupta A,Mohapatra P K,Iqbal M,et al.A diglycolamide-functionalized task specific ionic liquid(TSIL)for actinide extraction:solvent extraction,thermodynamics and radiolytic stability studies[J].Sep Purif Technol,2013,118:264-270.
[128]Rout A,Binnemans K.Solvent Extraction of neodymium(Ⅲ)by functionalized ionic liquid trioctylmethylammonium dioctyl diglycolamate in fluorinefree ionic liquid diluent[J].Ind Eng Chem Res,2014,53(15):6500-6508.
[129]Ouadi A,Gadenne B,Hesemann P,et al.Task-specific ionic liquids bearing 2-hydroxybenzylamine units:synthesis and americium-extraction studies[J].Chem Eur J,2006,12(11):3074-3081.
[130]Sun X Q,Ji Y,Chen J,et al.Solvent impregnated resin prepared using task-specific ionic liquids for rare earth separation[J].J Rare Earths,2009,27(6):932-936.
[131]Wang W,Yang H L,Cui H M,et al.Application of bifunctional ionic liquid extractants A336CA-12and A336CA-100to the lanthanum extraction and separation from rare earths in the chloride medium[J].Ind Eng Chem Res,2011,50(12):7534-7541.
[132]Yang H L,Wang W,Cui H M,et al.Recovery of rare earth elements from simulated fluorescent powder using bifunctional ionic liquid extractants(Bif-ILEs)[J].J Chem Technol Biotechnol,2012,87(2):198-205.
[133]Rout A,Venkatesan K A,Srinivasan T G,et al.Tuning the extractive properties of purex solvent using room temperature ionic liquid[J].Sep Sci Technol,2013,48(17):2576-2581.
[134]Sasaki K,Suzuki T,Mori T,et al.Selective liquid-liquid extraction of uranyl species using taskspecific ionic liquid,betainium bis(trifluoromethylsulfonyl)imide[J].Chem Lett,2014,43(6):775-777.
[135]Visser A E,Swatloski R P,Reichert W M,et al.Task-specific ionic liquids for the extraction of metal ions from aqueous solutions[J].Chem Commun,2001,01:135-136.
[136]Katsuta S,Yoshimoto Y,Okai M,et al.Selective extraction of palladium and platinum from hydrochloric acid solutions by trioctylammonium-based mixed ionic liquids[J].Ind Eng Chem Res,2011,50(22):12735-12740.
[137]Shimojo K,Aoyagi N,Saito T,et al.Highly efficient extraction separation of lanthanides using a diglycolamic acid extractant[J].Anal Sci,2014,30(2):263-269.
[138]Rout A,Wellens S,Binnemans K.Separation of rare earths and nickel by solvent extraction with two mutually immiscible ionic liquids[J].Rsc Adv,2014,4(11):5753-5758.
[139]Rout A,Kotlarska J,Dehaen W,et al.Liquidliquid extraction of neodymium(Ⅲ)by dialkylphosphate ionic liquids from acidic medium:the importance of the ionic liquid cation[J].Phys Chem Chem Phys,2013,15(39):16533-16541.
[140]Cieszynska A,Wisniewski M.Extraction of palladium(Ⅱ)from chloride solutions with Cyphos(R)IL 101/toluene mixtures as novel extractant[J].Sep Purif Technol,2010,73(2):202-207.
[141]Hu Q Y,Zhao J M,Wang F C,et al.Selective extraction of vanadium from chromium by pure[C8mim][PF6]:an anion exchange process[J].Sep Purif Technol,2014,131:94-101.
[142]褚泰伟,秦丽,刘新起,等.离子液体用于溶剂萃取铀酰离子的初步研究[J].核化学与放射化学,2007,29(3):146-150.
[143]Zhang Y W,Liu Z Y,Fan F Y,et al.Extraction of uranium and thorium from nitric acid solution by TODGA in ionic liquids[J].Sep Sci Technol,2014,49(12):1895-1902.
[144]Zhang L,Chen J,Jin W Q,et al.Extraction mechanism of cerium(Ⅳ)in H2SO4/H3PO4system using bifunctional ionic liquid extractants[J].J Rare Earth,2013,31(12):1195-1201.
[145]Zuo Y,Liu Y,Chen J,et al.The separation of cerium(Ⅳ)from nitric acid solutions containing thorium(Ⅳ)and lanthanides(Ⅲ)using pure C8mimPF6as extracting phase[J].Ind Eng Chem Res,2008,47(7):2349-2355.
[146]Blanchard L A,Hancu D,Beckman E J,et al.Green processing using ionic liquids and CO2[J].Nature,1999,399(6731):28-29.
[147]Wang J S,Chiu K.Metal extraction from solid matrices using a two-surfactant microemulsion in neat supercritical carbon dioxide[J].Microchim Acta,2009,167(1):61-65.
[148]Mekki S,Wai C M,Billard I,et al.Cu(Ⅱ)extraction by supercritical fluid carbon dioxide from a room temperature ionic liquid using fluorinated betadiketones[J].Green Chem,2005,7(6):421-423.
[149]Pourmortazavi S M,Hajimirsadeghi S S,Kohsari I,et al.Orthogonal array design for the optimization of supercritical carbon dioxide extraction of different metals from a solid matrix with cyanex 301as a ligand[J].J Chem Eng Data,2004,49(6):1530-1534.
[150]Yamini Y,Saleh A,Khajeh M.Orthogonal array design for the optimization of supercritical carbon dioxide extraction of platinum(Ⅳ)and rhenium(Ⅶ)from a solid matrix using cyanex 301[J].Sep Purif Technol,2008,61(1):109-114.
[151]Abbott A P,McKenzie K J.Application of ionic liquids to the electrodeposition of metals[J].Phys Chem Chem Phys,2006,8(37):4265-4279.
[152]邱凌云,袁立永,谭绪凤,等.铀在离子液体中的物种及电化学行为研究进展[J].核化学与放射化学,2014,36(2):65-74.
[153]Rao P R V,Venkatesan K A,Srinivasan T G.Studies on applications of room temperature ionic liquids[J].Prog Nucl Energ,2008,50(2):449-455.
[154]Chen P Y,Hussey C L.Electrodeposition of cesium at mercury electrodes in the tri-1-butylmethylammonium bis((trifluoromethyl)sulfonyl)imide room-temperature ionic liquid[J].Electrochim Acta,2004,49(28):5125-5138.
[155]Tsuda T,Hussey C L,Luo H M,et al.Recovery of cesium extracted from simulated tank waste with an ionic liquid:water and oxygen effects[J].J Electrochem Soc,2006,153(11):171-176.
[156]Bridges N J,Visser A E,Williamson M J,et al.Effects of gamma radiation on electrochemical properties of ionic liquids[J].Radiochim Acta,2010,98(4):243-247.
