乳清蛋白肽的酶法制备、分离纯化及活性评价*
2015-12-25任娇艳赖婷江燕清卢韵君刘鹏廖文镇
任娇艳 赖婷 江燕清 卢韵君 刘鹏 廖文镇
(华南理工大学 轻工与食品学院, 广东 广州 510640)
乳清蛋白肽的酶法制备、分离纯化及活性评价*
任娇艳赖婷江燕清卢韵君刘鹏廖文镇
(华南理工大学 轻工与食品学院, 广东 广州 510640)
摘要:以抗氧化活性及蛋白质回收率为筛选指标对乳清蛋白肽酶解工艺进行优化,用层析柱对酶解液进行逐级分离纯化,并对其分子质量进行检测.研究结果表明:利用胰酶、复合风味蛋白酶、木瓜蛋白酶和碱性蛋白酶酶解制备乳清蛋白肽,最佳用酶为碱性蛋白酶、最适底物含量为4.0%、最适加酶量为8000U/g、最佳酶解时间为4h;酶解液经DEAE-52纤维素层析后得到的A组分抗氧化活性最好,其还原力为0.3200±0.0041,DPPH自由基清除率为6.58%±0.36%;A组分再经Sephadex G-15葡聚糖凝胶层析柱分离纯化后得到组分G,其DPPH自由基清除率为6.73%±0.083%;组分G的主要成分为分子质量378u的肽段,其一级氨基酸组成为赖氨酸(Lys)、亮氨酸(Leu)及丝氨酸(Ser).
关键词:乳清蛋白;酶解;分离;纯化;活性评价;DEAE-52离子交换柱层析;Sephadex G-15葡聚糖凝胶柱层析
乳清蛋白是将牛乳的pH值降低至4.6,沉淀去除酪蛋白后保留在上清液中的多种蛋白质组分的总称,占牛乳总蛋白的20%(质量分数)左右,包括β-乳球蛋白、α-乳白蛋白、牛乳血清白蛋白、免疫球蛋白、乳铁蛋白及乳过氧化物酶等[1-2],且富含必需氨基酸,是一类营养价值较高的优质蛋白.乳清蛋白具有蛋白含量高,脂肪、胆固醇和乳糖含量低的特点,且易消化吸收,具有较高的营养价值[3-4].
生物活性肽源于蛋白质,是对生物体的生命活动有重要调节作用的肽类化合物,具有吸收快、效率高等特点.酶解法是目前制备生物活性肽最常见、有效的方法,该方法具有生产条件温和、水解条件易控制且水解产物安全性较高等特点.随着目前乳源活性肽的研究与相关产品的开发,大量研究证明乳清蛋白中含具有免疫调节、降血压、降血糖、降胆固醇、抗菌、抗氧化及抗病毒等生物活性的肽段[5-9].Castro等[10]研究了不同浓度的乳清分离蛋白对B16F10黑色素瘤细胞增殖的影响,发现较低浓度的乳清分离蛋白有利于抑制癌细胞增殖;Pea-Ramos等[11]将乳清分离蛋白的水解物加到熟猪肉饼中,由Protamex酶解的乳清蛋白的抗氧化性显著提高,抑制了共轭二烯和TBARS等脂类氧化中间产物的形成;Ferreira等[12]用胰蛋白酶酶解乳清蛋白制备了ACE抑制肽,并利用PR-HPLC分离得到了肽段ALPMHIR,具有较好的降血压活性.目前关于乳清蛋白的研究多集中在乳清蛋白成分分析[13]、乳清多肽的制备[14-15]、酶解工艺及抗氧化活性[15-16]等方面,对其分离纯化及分子质量测定的研究相对较少.
本研究以WPC80浓缩乳清蛋白粉为原料,酶解制备乳清蛋白肽,并利用控制变量法对乳清蛋白酶解工艺进行优化,以提高乳清蛋白的蛋白质回收率及利用率;之后,将乳清蛋白酶解物过DEAE-52纤维素离子交换柱和Sephadex G-15葡聚糖凝胶层析柱,对乳清蛋白酶解物进行逐级分离纯化,并对分离纯化后组分进行分子质量分析,初步确定乳清蛋白肽一级氨基酸序列组成.
1材料和方法
1.1材料与试剂
WPC80浓缩乳清蛋白粉,产地为美国哥伦比亚,购自广州市比灵天然配料有限公司;复合风味蛋白酶、木瓜蛋白酶、胰酶和碱性蛋白酶,购自南宁庞博生物工程有限公司;DEAE-52纤维素层析柱填料、Sephadex G-15葡聚糖凝胶柱填料,购自广州市齐云生物技术有限公司;α-氰基-4-羟基肉桂酸(CHCA)基质,购自上海迈瑞尔化学技术有限公司;乙腈,购自瑞典Pharmacia公司;标准混合多肽,购自德国Bruker公司;2,2-Diphenyl-1-picrylhdrazyl(DPPH),购自美国Sigma公司;牛血清白蛋白,购自上海伯奥生物科技有限公司;其他化学试剂均为分析纯;去离子水为实验室自制.
1.2仪器与设备
KDN-1型自动凯氏定氮仪,上海科晓科学仪器有限公司生产;HYP-1020 消化炉,上海书培实验设备有限公司生产;PHS-3C 型pH计,上海仪电科学仪器股份有限公司生产;HL-2B 数显恒流泵、BS-100A自动部分收集器,上海泸西分析仪器厂有限公司生产;752N 紫外-可见分光光度计,上海精密科学仪器有限公司生产;SHZ-D(III)循环水式真空泵,巩义市予华仪器有限责任公司生产;RE-52A旋转蒸发器,上海亚荣生化仪器厂生产;4800 Plus MALDI TOF/TOF Mass质谱仪,(ABI)美国应用生物系统公司生产.
1.3实验方法
1.3.1酶解工艺条件筛选
称取适量乳清蛋白,按一定比例加入去离子水,混合均匀后置于50℃水浴锅中预热30min,按不同加酶量(U/g,以每克乳清蛋白为基准计)分别加入各种蛋白酶,酶解温度为50℃,在各酶最适pH值条件下(胰酶:2×105U/g,pH=8.0;复合风味蛋白酶:2×105U/g ,pH=7.0;木瓜蛋白酶:2×105U/g ,pH= 7.0;碱性蛋白酶:2×105U/g ,pH =9.0)进行酶解,酶解结束后于100℃煮沸10min灭酶,然后于4℃、8000r/min下离心20min,过滤,收集上清液,于4℃冰箱中保存.
1.3.1.1最适水解酶的筛选
按上述酶解工艺,在乳清蛋白质量分数为6.0%、加酶量为8000U/g的条件下,分别加入胰酶、复合风味蛋白酶、木瓜蛋白酶和碱性蛋白酶,在其最适pH值条件下,酶解4h,离心后收集上清液待测,选择最适水解酶.
1.3.1.2最适乳清蛋白质量分数的筛选
按上述酶解工艺,以碱性蛋白酶进行酶解,设计乳清蛋白质量分数分别为2.0%、4.0%、6.0%、8.0%和10.0%,加酶量为8000U/g,酶解4h,离心后收集上清液待测,选择最适乳清蛋白质量分数.
1.3.1.3最适加酶量的筛选
按上述酶解工艺,设计加酶量分别为4000、6000、8000、10000和12000U/g,以碱性蛋白酶进行酶解,乳清蛋白质量分数为4.0%,酶解4h,离心后收集上清液待测,选择最优加酶量.
1.3.1.4最适酶解时间的筛选
按上述酶解工艺,以碱性蛋白酶进行酶解,乳清蛋白质量分数为4.0%,加酶量为8000U/g,设计酶解时间分别为4、8、12h,离心后收集上清液待测,探究最优酶解时间.
1.3.2蛋白质回收率测定
采用凯氏定氮法,参照GB 5009.5—85,分别测定原料蛋白质质量、酶解液的蛋白质质量分数及酶解后上清液质量,按下式计算蛋白质回收率(H):
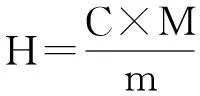
式中:C为酶解液蛋白质质量分数,%;M为酶解离心过滤后上清液的质量,g;m为原料蛋白质的质量,g.
1.3.3DPPH自由基清除率
DPPH自由基清除率的测定参照文献[17]的方法.用2mL去离子水与2mL 95%乙醇溶液混合后进行调零;取2mL DPPH溶液(0.2mmol/L)置于试管中,加入2mL样品液,混匀后在室温下避光反应30min,在波长517nm处测定吸光值,记为Ai;将2mL样品液与2mL 95%乙醇的混合液作为对照样,在波长517nm处测定吸光值,记为Aj;用2mL DPPH溶液与2mL 95%乙醇的混合液作为空白样,在波长517nm处测定吸光值,记为Ac.DPPH自由基清除率按下式计算:
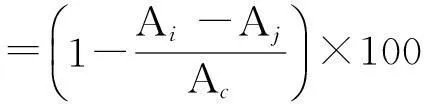
1.3.4还原力测定
还原力测定参照文献[18]的方法并有所改良.取溶解在磷酸盐缓冲液(0.2mmol/L,pH=6.6)中的多肽样品2mL,与2mL磷酸盐缓冲液(0.2mmol/L,pH=6.6)混合振匀,加入2mL铁氰化钾溶液(1%,质量分数),混匀后于50℃保温20 min;之后加入2mL 三氯乙酸(10%,质量分数),于3000r/min离心10min;离心后取上清液2mL,加入2mL去离子水和0.4mL 氯化铁溶液(0.1%,质量分数)并混匀,10min后测定其在700nm处的吸光值,记为A1.空白对照为以缓冲液代替样品溶液,700nm处的吸光值记为A0.还原力按下式进行计算:
还原力=A1-A0.
1.3.5DEAE-52纤维素层析柱分离纯化
DEAE-52纤维素填料经0.5mol/L的盐酸浸泡、去离子水冲洗、0.5mol/L的氢氧化钠溶液浸泡、去离子水冲洗等步骤进行预处理后装柱.称取4~5g乳清蛋白酶解液(约合160~200mg多肽)上样,依次用3种流动相进行梯度洗脱:去离子水、0.1mol/L的 NaCl溶液及0.3mol/L的 NaCl溶液,设定分离流速为0.5mL/min,自动部分收集器收集洗脱液.将收集的分离液经旋转蒸发仪浓缩后,用双缩脲法[19]测定各组分的蛋白质含量.
1.3.6Sephadex G-15葡聚糖凝胶层析柱分离纯化
将经DEAE-52分离后的组分进一步用Sephadex G-15分离纯化.称取6~8mL样品沿柱内壁缓慢加入后,以0.5mL/min的流速加入去离子水进行洗脱;使用自动部分收集器进行收集,收集液经旋转蒸发器浓缩后,测定分离组分的抗氧化活性.
1.3.7MALDI-TOF-MS分析[20]
配制乙腈-超纯水混合液(其中乙腈与超纯水的体积比为1:1,TFA的体积分数为0.1%)作为溶剂备用,将CHCA溶于上述溶剂中,制成饱和溶液,离心,取上清液得到基质溶液.将标准混合多肽和样品分别与基质溶液按体积比1:1混合均匀,取1μL滴在MALDI靶板上,于室温自然干燥后,将样品板放进离子源中进行测定,累计10次单次扫描信号为最终质谱图.
1.3.8统计分析
文中数据均为3次平行测定值的平均值.利用软件Excel 2007及Origin 8.5对数据进行方差分析(ANOVA)及绘图,在显著性水平P=0.05下,进行数据统计与分析,结果表示为“均值±标准差”的形式.
2结果与分析
2.1最佳酶解工艺条件的筛选结果
2.1.1最佳水解酶的筛选结果
经不同酶酶解得到的酶解液的还原力、DPPH自由基清除率和蛋白质回收率如表1所示.
表 1不同酶解液的还原力、DPPH自由基清除率和蛋白质回收率1)
Table 1Reducing power,DPPH radical scavenging activity and protein recovery of different protein hydrolysates

水解用酶酶解液质量浓度为10g/L时的还原力酶解液质量浓度为5g/L时的DPPH自由基清除率/%蛋白质回收率/%胰酶0.27±0.01b13.46±0.18c71.32±1.62c复合风味蛋白酶0.35±0.01a15.64±0.36bc74.55±0.39c木瓜蛋白酶0.27±0.01b18.46±1.09b84.25±0.66a碱性蛋白酶0.35±0.02a24.64±1.18a79.89±0.09b
1)各列中不同上标字母(a-c)表示差异显著(P<0.05).
由表1 可知:以不同的酶酶解得到的乳清蛋白酶解液在质量浓度为10g/L时,复合风味蛋白酶和碱性蛋白酶酶解液的还原力(还原力活性以吸光值进行表征)最高,吸光值均达到0.35,显著高于其他酶解液(P< 0.05);当各酶解液质量浓度为5g/L时,碱性蛋白酶酶解液的DPPH自由基清除率最高,亦显著高于其他酶解液(P< 0.05);就蛋白质回收率而言,木瓜蛋白酶及碱性蛋白酶酶解液相对较高.综合还原力和DPPH自由基清除率来看,经碱性蛋白酶酶解后的乳清蛋白酶解液具有最高的活性,再以蛋白质回收率作为辅助筛选指标,最终选择碱性蛋白酶为乳清蛋白的最适水解用酶.
2.1.2最适乳清蛋白质量分数、加酶量及酶解时间的筛选结果
不同酶解条件对酶解液蛋白质回收率的影响如图1所示.
由图1(a)可知:当乳清蛋白质量分数为2.0%及4.0%时,乳清蛋白酶酶解液的蛋白质回收率较高,为84%左右,两者无显著性差异(P> 0.05);当乳清蛋白质量分数大于4.0 %时,乳清蛋白酶酶解液的蛋白质回收率随着乳清蛋白质量分数的增加而不断降低,当乳清蛋白质量分数为12.0%时,酶解液的蛋白质回收率降到40%左右.由于随着乳清蛋白质量分数增加,酶反应速率不断增加,当乳清蛋白质量分数为2.0%和4.0%时,蛋白质回收率无显著性差异,故选择乳清蛋白质量分数为4.0%,以获得更高的酶反应速率.
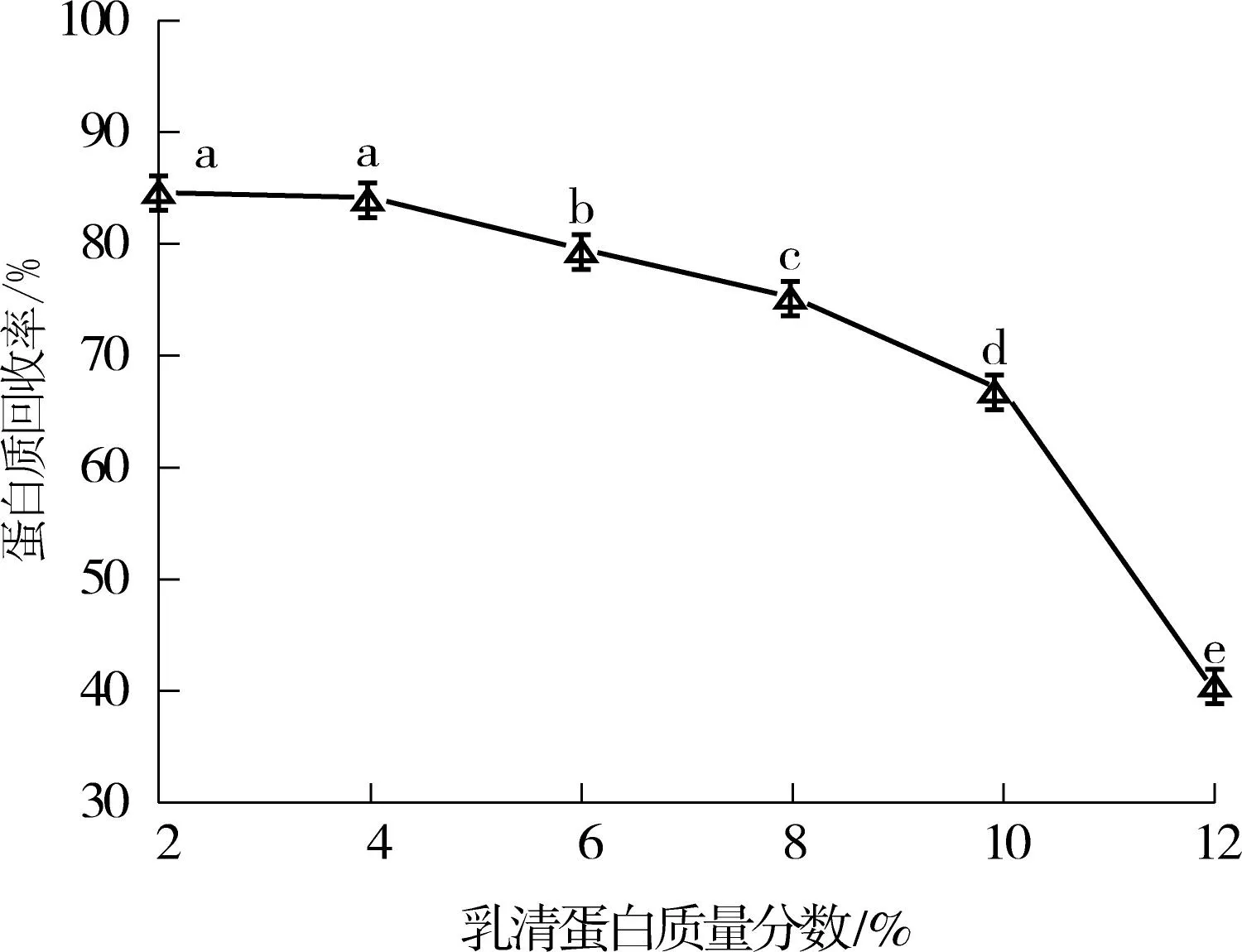
(a)乳清蛋白质量分数对蛋白质回收率的影响
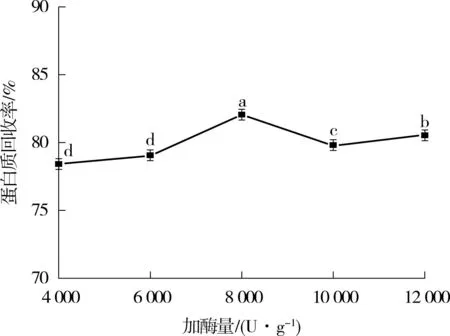
(b)加酶量对蛋白质回收率的影响
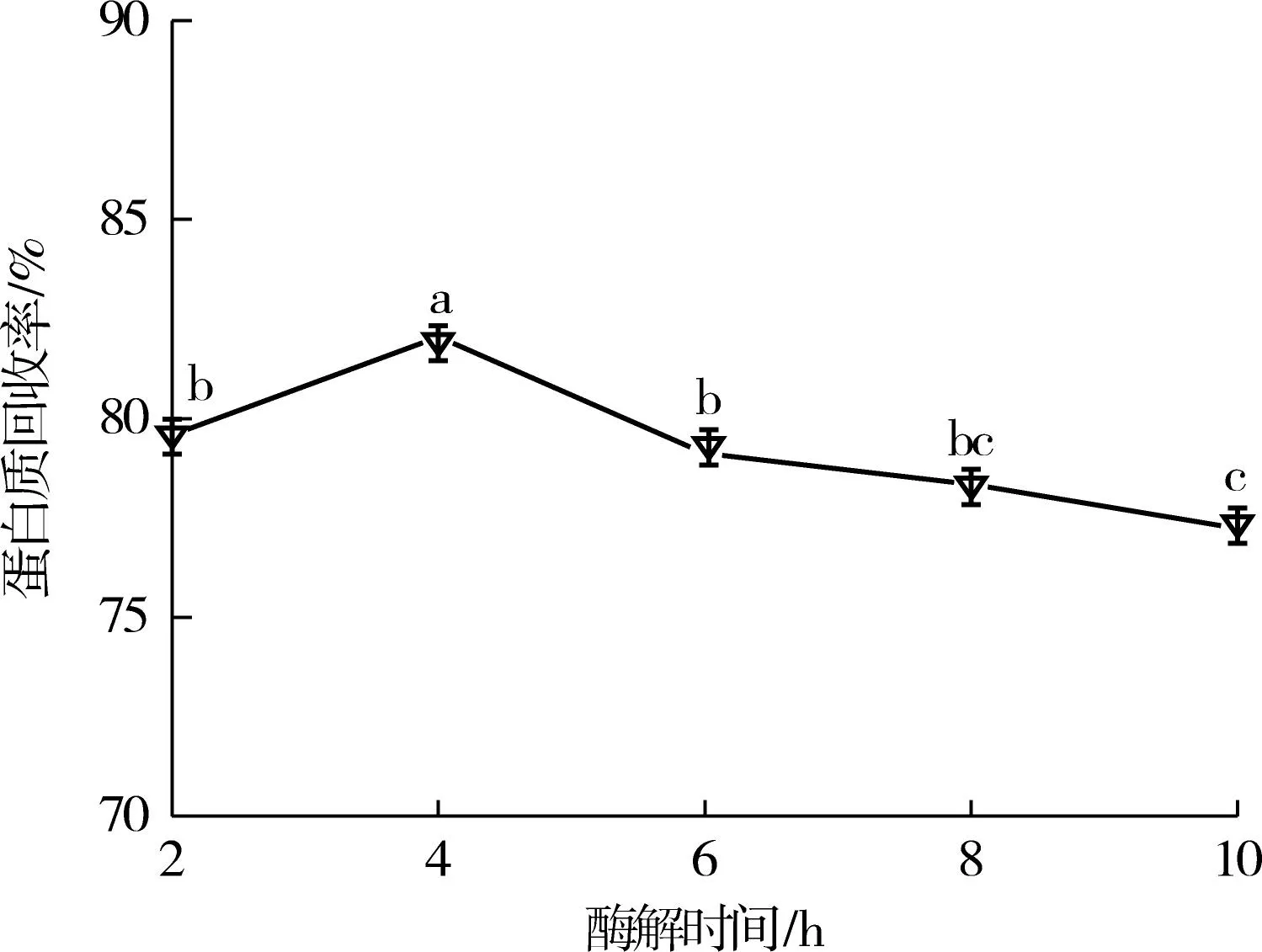
(c)酶解时间对蛋白质回收率的影响图1 不同酶解条件对酶解液蛋白质回收率的影响Fig.1 Effect of different hydrolysis conditions on protein recovery
由图1(b)可知:当加酶量为4000和6000U/g时,酶解液的蛋白质回收率无显著性差异(P> 0.05),随加酶量的增加,酶解液的蛋白质回收率持续增加,当加酶量为8000U/g时,蛋白质回收率达到最大,为82%左右,显著高于其他样品(P< 0.05).加酶量继续增加时,酶解液的蛋白质回收率呈下降再上升趋势,但均未超过加酶量为8000U/g时的蛋白质回收率.因此,选择8000U/g为最适加酶量.
由图1(c)可知,随酶解时间的延长,乳清蛋白酶酶解液的蛋白质回收率呈先增加再降低的趋势,当酶解时间为4h时,酶解液的蛋白质回收率达到最大,为82%左右,显著高于其他酶解液(P< 0.05),这是因为当酶解时间小于4h时,底物未酶解完全,而超过4h后,底物彻底酶解,故继续增加酶解时间对蛋白质回收率无显著影响.故选择4h为最适酶解时间.
综上所述,筛选出碱性蛋白酶为最佳水解酶,最适乳清蛋白质量分数为4.0%,最适加酶量为8000U/g,最佳酶解时间为4h.
2.2乳清蛋白肽的分离纯化及活性鉴定
2.2.1DEAE-52纤维素层析柱分离纯化乳清蛋白肽及其活性鉴定
利用DEAE-52层析柱对乳清蛋白进行初步分离,分离的洗脱图如图2所示,管号1-100的洗脱液为去离子水,管号101-200的洗脱液为0.1mol/L的NaCl溶液,管号201-300的洗脱液为0.3mol/L的NaCl溶液,洗脱速度均为0.5mL/min.
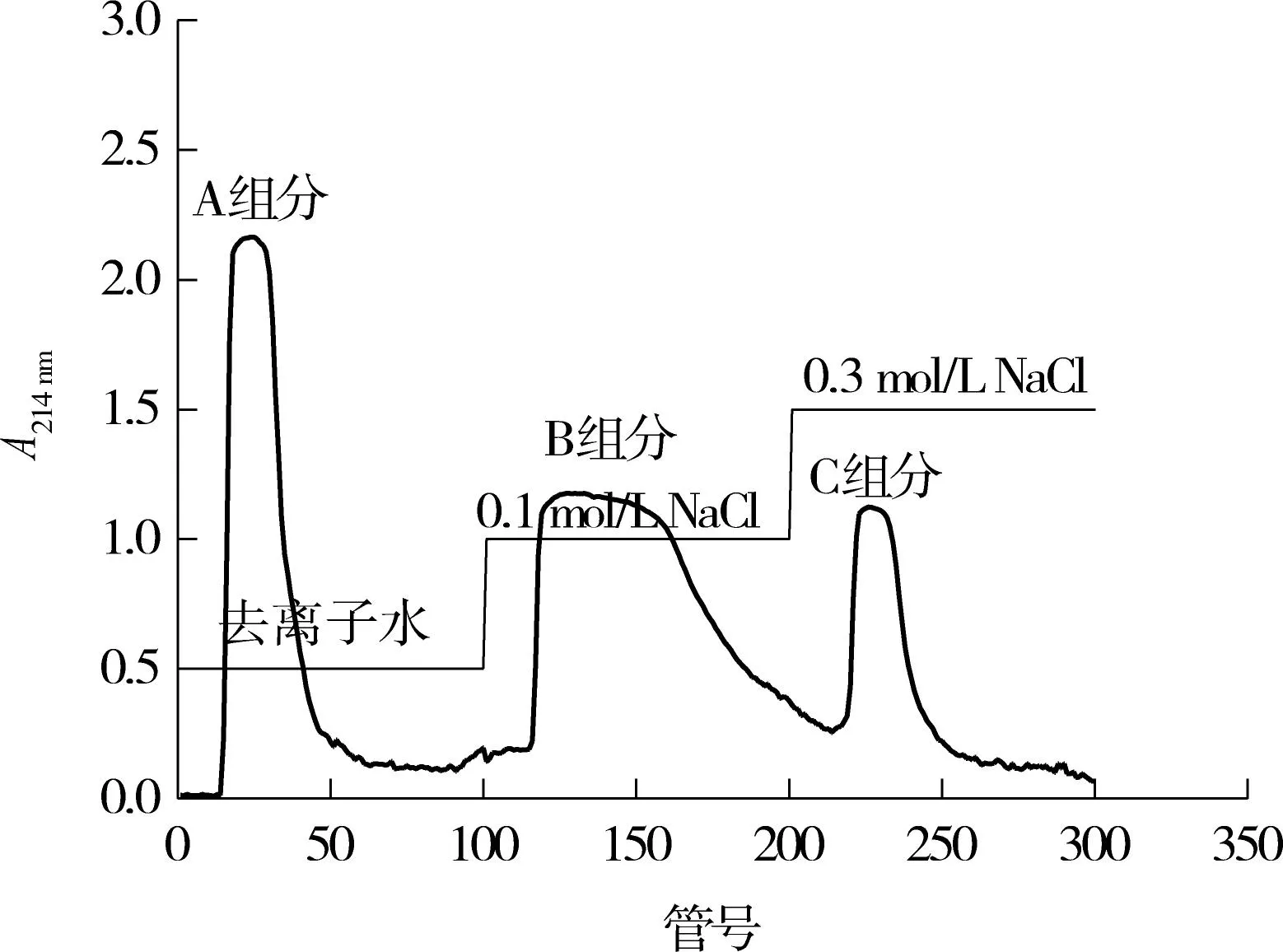
图 2 乳清蛋白酶解物的DEAE-52洗脱图Fig.2 Separation profile of whey protein hydrolysates on DEAE-52 column
由图2可知,经去离子水、0.1mol/L的 NaCl溶液及0.3mol/L的NaCl溶液洗脱后得到3个峰,收集管号15-55的洗脱液合并,浓缩后得到乳清蛋白肽A组分;收集管号119-215的洗脱液合并,浓缩后得到乳清蛋白肽B组分;收集管号220-255的洗脱液合并,浓缩后得到乳清蛋白肽C组分.分离后的A、B、C组分的蛋白质量浓度分别为2.49、6.75和1.33g/L.当3个组分的蛋白质量浓度均为1g/L时,其抗氧化活性(还原力及DPPH自由基清除率)检测结果如图3所示.
由图3可知,当3个组分的蛋白质量浓度均为1g/L时,A组分的还原力最高,即抗氧化活性最强,吸光值为0.3200±0.0041,与其他两个组分的吸光值有显著性差异(P< 0.05);当3个组分的蛋白质量浓度均为1g/L时,组分A和组分B的DPPH自由基清除率无显著性差异(P>0.05),均高于组分C.综上,组分A较组分B、C具有更好的抗氧化活性,故选择组分A进一步用Sephadex G-15葡聚糖凝胶层析柱进行分离纯化.
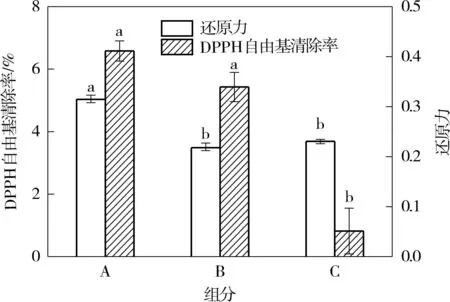
图3 不同组分的还原力活性和DPPH自由基清除率Fig.3 Reducing power assay and DPPH radical scavenging activity of different fractions
2.2.2Sephadex G-15 葡聚糖凝胶层析柱分离纯化乳清蛋白肽及其活性鉴定
以去离子水为洗脱液对乳清蛋白肽组分A溶液进行洗脱,洗脱速度为0.5mL/min,经Sephadex G-15葡聚糖凝胶层析柱分离后,洗脱图如图4所示.

图4 乳清蛋白肽组分A的Sephadex G-15洗脱图Fig.4 Separation profile of whey peptides fraction A on Sephadex G-15 column
由图4可知,用去离子水洗脱得到一个目标峰,即经Sephadex G-15葡聚糖凝胶层析柱分离后,得到相对较纯的乳清蛋白肽.收集管号18-80的洗脱液合并,浓缩后得到乳清蛋白肽组分G,测得其蛋白质质量浓度为1.79g/L.由于乳清蛋白肽组分A对DPPH自由基清除能力较为敏感,且DPPH自由基较稳定,故实验中测定物质的DPPH自由基清除率具有较好的稳定性和重现性,因此用DPPH自由基清除率评价经Sephadex G-15葡聚糖凝胶层析柱分离后的乳清蛋白肽组分G,并将其与乳清蛋白肽A组分做比较.DPPH自由基清除率如图5所示.

图5 乳清蛋白肽组分A和G的DPPH自由基清除率Fig.5 DPPH radical scavenging activity of whey protein peptides A and G
由图5可知,经Sephadex G-15葡聚糖凝胶层析柱分离后的组分G的DPPH自由基清除率为6.730% ± 0.083%,与乳清蛋白肽组分A的DPPH自由基清除率无显著性差异(P> 0.05),即乳清蛋白肽组分A和G均具有最好的抗氧化活性,进一步分离纯化并未降低乳清蛋白肽的抗氧化活性.
2.3乳清蛋白肽的结构鉴定
乳清蛋白肽组分G及基质溶液的MALDI-TOF-MS一级质谱图如图6所示.
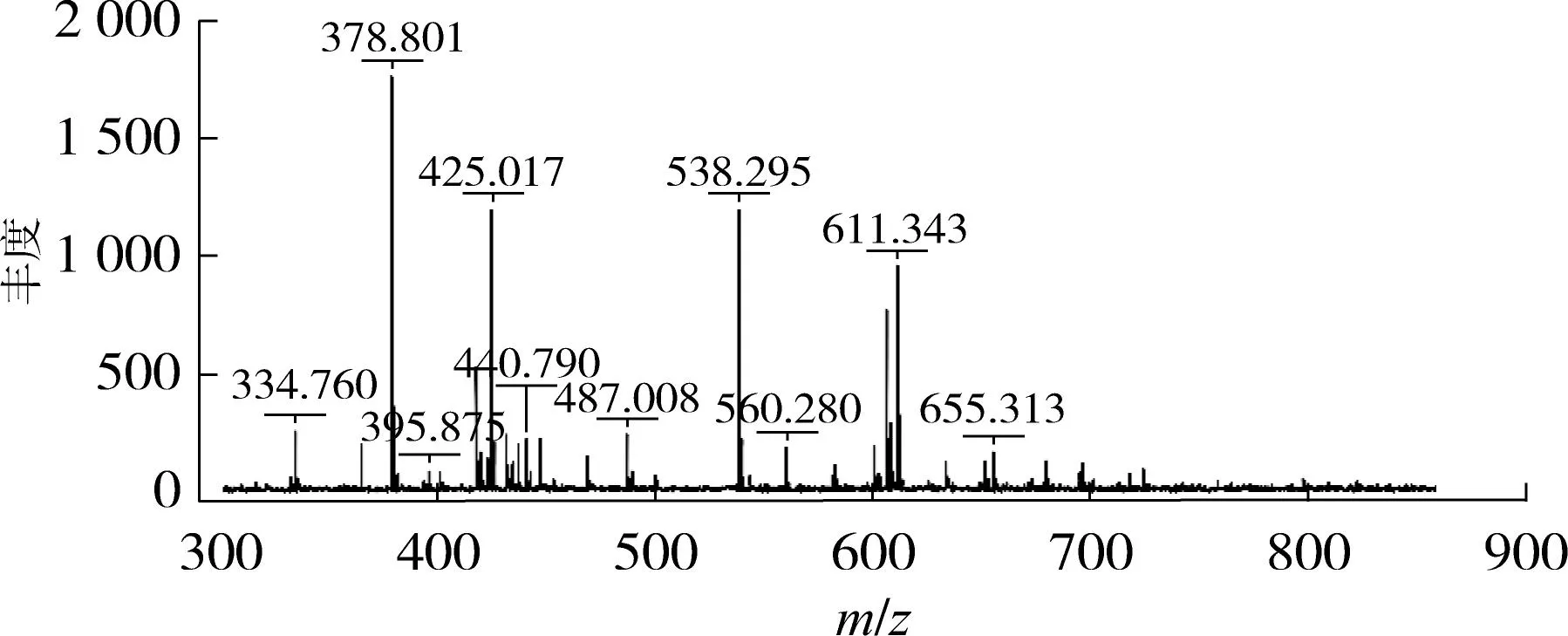
(a)组分G
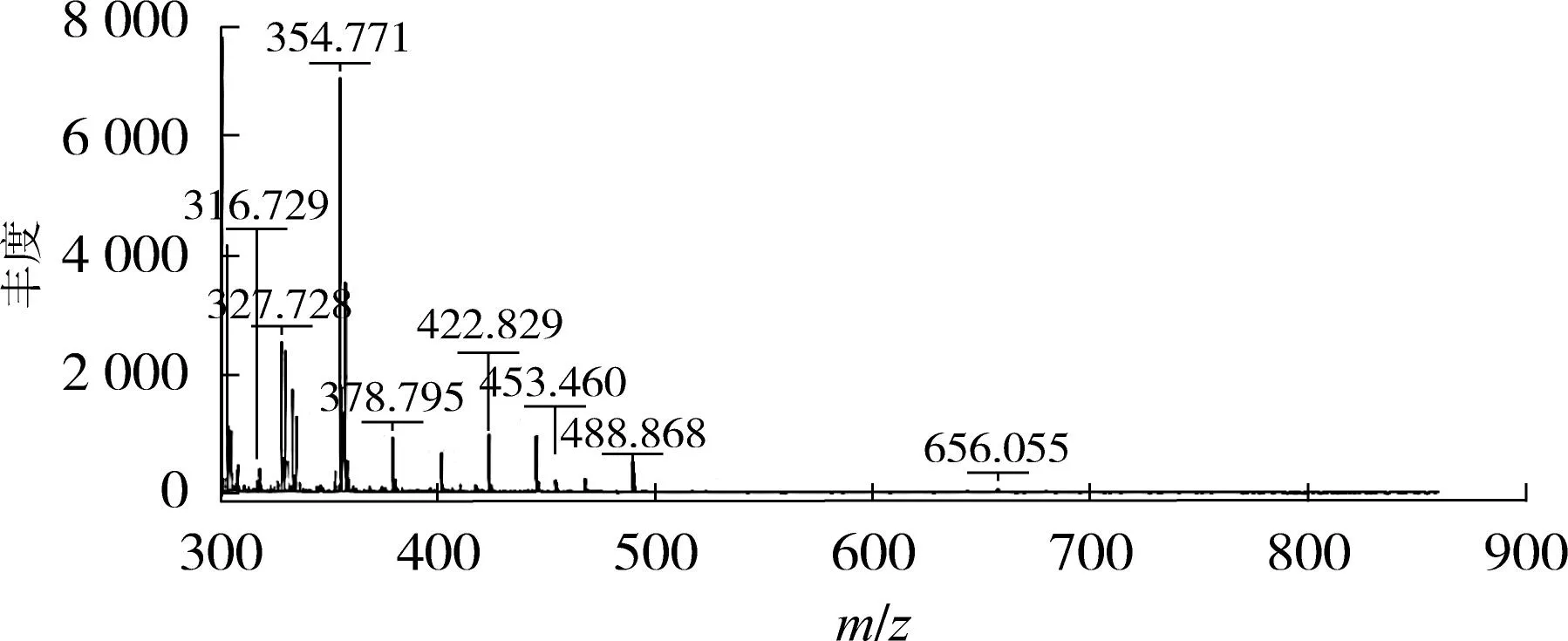
(b)基质溶液图6 组分G及基质溶液的MALDI-TOF-MS一级质谱图Fig.6 MALDI-TOF/MS spectrum of fraction G and the matrix solution
由图6可知,图谱中有10个主要的质子峰,信号最强的质子峰对应的m/z为378.801,其他3个较强信号的质子峰对应的m/z分别为425.017、538.295和611.343,说明组分G中的多肽分子质量均小于700u,且组分G中的主要成分为分子质量 378u的肽段,结合氨基酸分析推测其一级氨基酸组成为赖氨酸(Lys)、亮氨酸(Leu)及丝氨酸(Ser).
3结论
文中对乳清蛋白肽酶解工艺进行了优化,用层析柱对酶解液进行逐级分离纯化,并对其分子质量进行检测,得出以下主要结论:
(1)制备乳清蛋白肽最佳用酶为碱性蛋白酶,最适乳清蛋白质量分数为4.0%,最适加酶量为8000U/g,最佳酶解时间为4h.
(2)用DEAE-52纤维素离子交换柱对乳清蛋白酶解物进行分离纯化后,得到A、B、C3个组分,其中组分A抗氧化活性最高.
(3)选取组分A进行Sephadex G-15葡聚糖凝胶柱分离纯化,分离所得组分G进行MALDI-TOF-MS质谱检测,得出乳清蛋白肽中抗氧化活性较高的肽段分子质量集中在300~700u,结合氨基酸分析推测其一级氨基酸组成为Lys、Leu及Ser.
参考文献:
[1] 魏华,杨史良,徐锋,等.乳清蛋白质的生物学特性和保健功能 [J].天然产物研究与开发,2007,19(1):161-168.
Wei Hua,Yang Shi-liang,Xu Feng,et al.Biological characteristics and health-maintaining functions of whey protein [J].Natural Production Researches Development,2007,19(1):161-168.
[2] 李莹,林晓明.乳清蛋白营养特点与功能作用 [J].中国食物与营养,2008(6):62-64.
Li Yin,Lin Xiao-ming.Characteristics and functions of whey protein nutrition [J].Food and Nutrition in China,2008(6):62-64.
[3] 刘晶,韩清波.乳清蛋白的特性及应用 [J].食品科学,2007,28(7):535-537.
Liu Jing,Han Qing-bo.Characteristics and application of whey protein [J].Food Science,2007,28(7):535-537.
[4] 蒋与刚,庞伟.乳清蛋白的生物学作用研究进展 [J].中国食物与营养,2008(10):49-51.
Jiang Yu-gang,Pang Wei.Research progress of whey protein biological functions [J].Food and Nutrition in China,2008(10):49-51.
[5] Saint-Sauveur D,Gauthier S F,Boutin Y,et al.Immunomodulating properties of a whey protein isolate,its enzymatic digest and peptide fractions [J].International Dairy Journal,2008,18(3):260-270.
[6] Hernández-Ledesma B,Dávalos A,Bartolomé B,et al.Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin andβ-lactoglobulin.Identification of active peptides by HPLC-MS/MS [J].Journal of Agricultural and Food Chemistry,2005,53(3):588-593.
[7] Ferreira I,Pinho O,Mota M V,et al.Preparation of ingredients containing an ACE-inhibitory peptide by tryptic hydrolysis of whey protein concentrates [J].International Dairy Journal,2007,17(5):481-487.
[8] Petersen B L,Ward L S,Bastian E D,et al.A whey protein supplement decreases post-prandial glycemia [J].Nutr J,2009,8(47):1475-2891.
[9] Nagaoka S,Kanamaru Y,Kuzuya Y.Effects of whey protein and casein on the plasma and liver lipids in rats (food & nutrition) [J].Agricultural and Biological Chemistry,1991,55(3):813-818.
[10] Castro G A,Maria D A,Bouhallab S,et al.Invitroimpact of a whey protein isolate (WPI)and collagen hydrolysates (CHs)on B16F10 melanoma cells proliferation [J].Journal of Dermatological Science,2009,56(1):51-57.
[12] Ferreira I,Pinho O,Mota M V,et al.Preparation of ingredients containing an ACE-inhibitory peptide by tryptic hydrolysis of whey protein concentrates [J].International Dairy Journal,2007,17(5):481-487.
[13] Nagar S,Nagal S.Whey:composition,role in human health and its utilization in preparation of value added products [J].International Journal of Food and Fermentation Technology,2013,3(2):93-100.
[14] XiaoDong Li,Chen Jiang,HuiMin Song.Research progress on preparing functional polypeptide from whey protein hydrolysis [J].Journal of Food Safety and Quality,2014,5(5):1405-1412.
[15] Zhidong L,Benheng G,Xuezhong C,et al.Optimisation of hydrolysis conditions for antioxidant hydrolysate production from whey protein isolates using response surface methodology [J].Irish Journal of Agricultural and Food Research,2013,52:53-65.
[16] Power O,Jakeman P,FitzGerald R J.Antioxidative peptides:enzymatic production,in vitro and in vivo antioxidant activity and potential applications of milk-derived antioxidative peptides [J].Amino Acids,2013,44(3):797-820.
[17] Milella L,Bader A,De Tommasi N,et al.Antioxidant and free radical-scavenging activity of constituents from two Scorzonera species [J].Food Chemistry,2014,160:298-304.
[18] Wu H C,Chen H M,Shiau C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus) [J].Food Research International,2003,36(9):949-957.
[19] 刘邻渭,陶健,毕磊.双缩脲法测定荞麦蛋白质 [J].食品科学,2005,25(10):258-261.
Liu Lin-wei,Tao Jian,Bi Lei.Quantitative analysis of buckwheat protein with biuret method [J].Food Science,2005,25(10):258-261.
[20] Caprioli R M,Farmer T B,Gile J.Molecular imaging of biological samples:localization of peptides and proteins using MALDI-TOF MS [J].Analytical Chemistry,1997,69(23):4751-4760.
文章编号:1000-565X(2015)02-0001-07
收稿日期:2014-08-05
*基金项目:广东省自然科学杰出青年基金资助项目 (S2013050013954);教育部新世纪优秀人才支持计划项目(NCET-13-0213);广东省科技计划项目(2013B010404001);农业部重点实验室开放基金资助项目(NYJG201402)
Foundation items: Supported by the Natural Science Foundation of Guangdong Province for Distinguished Young Scholars(S2013050013954),Program for New Century Excellent Talents in University of Ministry of Education of China(NCET-13-0213)and the Science and Technology Project Item of Guangdong Province(2013B010404001)
作者简介:任娇艳(1980-),女,博士,教授,主要从事食品生物化学、食品营养与健康等研究.E-mail: jyren@scut.edu.cn
中图分类号:TS252.9
doi:10.3969/j.issn.1000-565X.2015.02.001
Enzymatic Preparation, Separation, Purification and Antioxidant
Activity Evaluation of Whey Protein Peptides
RenJiao-yanLaiTingJiangYan-qingLuYun-junLiuPengLiaoWen-zhen
(School of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, Guangdong,China)
Abstract:Whey protein peptides were prepared via enzymolysis, and the corresponding conditions were optimized by taking antioxidant activity and protein recovery as two indicators. Then, the enzymatic hydrolysate was separated and purified by means of column chromatography, and the molecular mass of the product was measured. The results indicate that (1) alkaline protease is more suitable for the enzymolysis than trypsogen, flavorzyme and papain, with an optimal substrate dosage of 4.0%, an optimal enzyme dosage of 8000U/g and an optimal enzymolysis time of 4h; (2) fraction A obtained by DEAE-52 cellulose column chromatography exhibits the highest antioxidant activity, with a reducing power value of 0.3200±0.0041 and a DPPH radical scavenging activity of 6.58%±0.36%; (3) further separation of fraction A via Sephadex G-15 gel column chromatography helps to obtain fraction G with a DPPH radical scavenging activity of 6.73%±0.083%; and (4) the main component identified from fraction G, which contains three amino acids (namely Lys, Leu and Ser), is of a molecular mass of 378u.
Key words:whey protein; enzymolysis; separation; purification; activity evaluation; DEAE-52 ion exchange column chromatography; Sephadex G-15 gel filtration chromatography
