三阴乳腺癌应用表阿霉素联合多西紫杉醇新辅助化疗疗效分析
2015-12-25郭康453000河南省新乡医学院第三附属医院肿瘤内二科
郭康453000河南省新乡医学院第三附属医院肿瘤内二科
三阴乳腺癌应用表阿霉素联合多西紫杉醇新辅助化疗疗效分析
郭康
453000河南省新乡医学院第三附属医院肿瘤内二科
目的:探讨三阴乳腺癌(人表皮生长因子受体、孕激素受体、雌激素受体均阴性)应用表阿霉素联合多西紫杉醇新辅助化疗临床疗效。方法:2010年1月-2013年12月收治应用表阿霉素联合多西紫杉醇新辅助化疗的三阴乳腺癌患者48例,回顾性分析临床资料。结果:48例三阴乳腺癌患者中,临床总有效率84.5%,临床完全缓解率18.5%,临床部分缓解率67.5%,病理完全缓解率16.5%。结论:表阿霉素联合多西紫杉醇新辅助化疗方案治疗三阴乳腺癌患者,临床总有效率以及病理完全缓解率较高,获得较好的临床效果。
三阴乳腺癌;表阿霉素;多西紫杉醇;联合化疗
临床上三阴乳腺癌是指雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体(HER2)均为阴性的乳腺癌。其占全部乳腺癌的17%~21%[1-2]。三阴乳腺癌患者不能从抗HER2的靶向治疗和内分泌治疗中获益,研究表明三阴乳腺癌易局部复发及向远处转移,死亡率更高[3-4],所以化疗在三阴乳腺癌的全身治疗中起着重要作用。2010年1月-2013年12月收治三阴乳腺癌患者48例,应用表阿霉素联合多西紫杉醇新辅助化疗,取得满意的临床疗效,现总结报告如下。
资料与方法
2010年1月-2013年12月收治三阴乳腺癌患者48例,均符合以下条件:①患者的肿瘤临床表现、肿瘤病理大小、淋巴结状态、HER2、PR、ER受体状态等临床资料完整;②均为临床Ⅱ~Ⅲ期乳腺癌女性患者,化疗前通过肝脏彩超、胸片和骨扫描排除远处转移;③患者接受3个疗程以上的新辅助化疗,同时排除其他恶性肿瘤病史;④术前经细针穿刺活检病理确诊,所有患者有临床可测量的病灶。
方法:所有患者采用葸环类联合多西紫杉酵(ET方案)。表柔比星90mg/m2,静滴,d1;多西紫杉醇75mg/m2,持续3h静滴,dl,2ld为1个疗程。化疗结束2~3周后行手术治疗,评估新辅助化疗疗效。
临床疗效评价:疗效评价严格按照WHO实体瘤标准RECIST,病理完全缓解(pCR)是指经规范化疗后,肿瘤原发区域及区域淋巴结未发现癌残留,残留原位癌也被认定为病理上的完全缓解。肿瘤病灶>4cm,以B超标出肿瘤边界,在患者体表标出肿块具体位置,应用游标卡尺测出肿瘤双径;肿瘤病灶<4cm(B超探头),则是以B超为准。
兔疫组化检查:免疫组化方法确定ER、PR及HER2状态,免疫组化染色阳性细胞>10%则认定为ER、PR受体阳性,按照乳腺癌HER2检测指南判读HER2免疫组化及FISH[5]:①HER2-、1+为阴性;②HER2 3+为阳性;③HER2 2+同时FISH检测存在基因拷贝数扩增,亦认定为阳性。ER、PR、HER2三个中有任何一个阳性则定义为非三阴乳腺癌。ER、PR、HER2均为阴性,则被认定为三阴乳腺癌。
结果
48例三阴乳腺癌患者中,临床总有效率84.5%,其中临床完全缓解率18.5%,临床部分缓解率67.5%,病理完全缓解率16.5%。
讨论
乳腺癌是一类分子水平上具有高度异质性的恶性肿瘤,肿瘤化疗治疗的敏感性不一致,分子遗传学改变不完全相同,预后也不尽相同。化疗是治疗三阴乳腺癌的唯一全身性治疗方法,三阴乳腺癌性激素受体及表皮生长因子受体缺乏,导致肿瘤更易向远处转移,患者预后更差,死亡率也相对较高。三阴乳腺癌对环磷酰胺及蒽环类化疗药物敏感。携带BRCA1突变基因的乳腺癌对环磷酰胺及蒽环类化疗药敏感[6-7]。同时越来越多的临床结论证实紫杉类药物治疗三阴乳腺癌有效,因此在治疗三阴乳腺癌时需要加入紫杉类化疗药。
三阴乳腺癌新辅助化疗的目的是尽可能使三阴乳腺癌患者达到病理完全缓解,传统化疗药物乳腺癌患者的临床总有效率一般≤30%[8],而临床试验表明赫赛汀可以显著提高HER2+乳腺癌患者的生存时间[9-11]。在新辅助化疗中加入分子靶向治疗显得尤为必要,三阴乳腺癌表达c-kit及EGRF等[12],这些均可能成为其潜在治疗靶点。
综上所述,三阴乳腺癌患者接受ET方案化疗具有更高的病理完全缓解率,对ET化疗的新辅助化疗方案更敏感。乳腺癌原发肿瘤的大小以及腋窝淋巴结状态等均为影响疗效的因素[13-14],因此,对于ET方案能否减少三阴乳腺癌的转移、复发以及提高远期生存率,仍需进一步研究。
[1]Iwase H,Yamamoto Y.Biologicalcharacteristics of trip Ie negative breast cancer[J].Jpn J BreastCancer,2008,23(2):75-80.
[2]Kobayashi S.Basal-like subtype of breast cancer:a review of its unigue characteristics and their clinicalsignificance[J].BreastCancer,2008,15(2):153-158.
[3]Sorlie T,Tibshirani R,Parker J,et al.Repeated observation of breast tumor subtypes in independent gene expression data sets[J].PNASUSA,2003,100(14):8418-8423.
[4]Bauer KR,Brown M,Cress RD,etal.Descriptive anaIysisofestrogen receptor(ER-negative,progesterone receptor(PR)-negative,and Her2 negative invasive breast cancer,the so-called triplenegative phenotype:a population-based study from the California cancer Registry[J].Cancer,2007,109(9):1721-1728.
[5]乳腺癌HER2检测指南编写组.乳腺癌HER2检测指南[J].中华病理学杂志,2006,35(10):631-633.
[6]Chappuis PO,Goffin J,Wong N,etal.A significant response to neoadjuvant chemotherapy in BRCA1/2 related breast cancer[J].JMed Genet,2008,39(8):608-810.
[7]Dent R,Trudeau M,Pritchard KI,etal.Triplenegative breast cancer:clinical features and patterns of recurrence[J].CIin Cancer Res,2007,13(4):4429-4434.
[8]Chen XS,Wu JY,Huang O,et al.Molecular subtype can predict the response and outcome of Chinese locally advanced breast cancer patients treated with preoperative therapy[J].OncolRep,2010,23:1213-1220.
[9]IRomond E,Perez EA,Bryant J,etal.Trastuzumab plus adjuvantchemotherapy for operable HER2-positive breast cancer[J].N Engl JMed,2005,35(16):1673-1684.
[10]I Piccart-Gebhart MJ,Proctor M,LeyI-and-Jones B,et al.Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer[J].N Engl J Med,2005,353(16):1659-1672.
[11]I SorIie T,Tibshirani R,Parker J,et al.Repeated observation of breast tumor subtypes in independent gene expression data sets[J].PNASUSA,2003,100(14):8418-8423.
[12]I CIeator S,HeIIer W,Coombes RC,et al.Trip Ienegative breast cancer:therapeutic options[J].LancetOncoI,2007,8(3):235-244.
[13]张斌.乳腺癌新辅助化疗疗效的评价及影响因素分析[J].中华肿瘤杂志,2006,28(11):867-870.
[14]徐兵河.乳腺癌辅助化疗的新概念[J].中国实用外科杂志,2006,26(4):251-253.
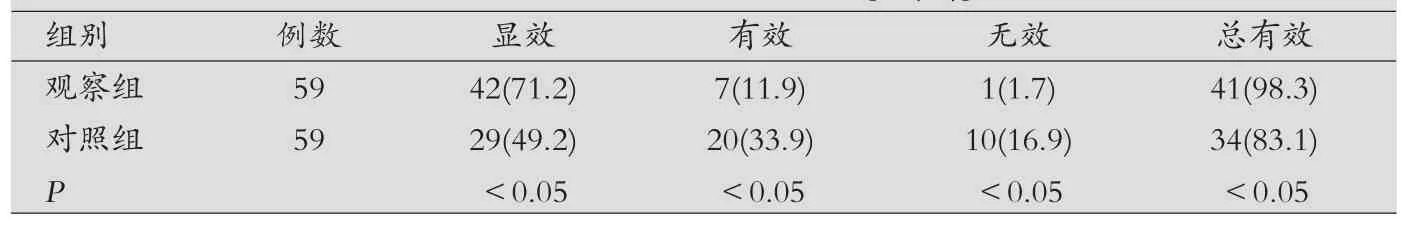
表1 两组患者治疗效果比较[例(%)]
本组资料结果显示,经过治疗后观察组显效42例,显效率71.2%,有效7例,有效率11.9%,无效1例,总有效率98.3%;对照组显效29例,显效率49.2%,有效20例,有效率33.9%,无效10例,总有效率83.1%,两组比较差异有统计学意义(P<0.05)。对照组在治疗过程中出现轻度恶心1例,不良反应率1.7%,观察组出现皮疹1例,轻度恶心1例,不良反应率3.4%,两组比较差异无统计学意义(P>0.05)。由此可见,奥硝唑联合法莫替丁治疗慢性胃炎疗效显著,值得推广。
参考文献
[1]巨光淑.奥硝唑联合法莫替丁治疗慢性胃炎50例疗效观察[J].医学信息(中旬刊),2011,24(7):3293-3294.
[2]杜世章.兰索拉唑与法莫替丁治疗胃溃疡50例临床疗效分析[J].中国社区医师:医学专业,2012,14(28):67.
[3]傅明健.探讨奥美拉唑联合法莫替丁治疗慢性胃炎的临床分析[J].健康大视野,2013,21(2):27.
[4]李耀兴,刘丽梅.奥硝唑、替硝唑和甲硝唑在口腔治疗的应用和药效比较[J].北方医学,2012,9(9):23.
[5]余芬.奥美拉唑联合法莫替丁治疗慢性胃炎的临床疗效及安全性分析[J].心理医生(下半月版),2012,(12):258-259.
[6]黄小华,郑俊,黄黎明.奥硝唑联合法莫替丁治疗急慢性胃炎74例疗效观察[J].航空航天医药,2010,21(8):1478.
[7]陈荣皇.奥美拉唑联合法莫替丁治疗慢性胃炎的临床疗效及安全性[J].中国医药指南,2013,(12):93-94.
Therapeutic effect analysis of the neoad juvant chemotherapy of epirubicin combined with docetaxel in the treatment of three negative breast cancer
Guo Kang
The Second Department of Oncology,the Third Hospital Affiliated to Xinxiang Medical College,Henan Province 453000
Objective:To investigate the therapeutic effect of the neoadjuvant chemotherapy of epirubicin combined with docetaxel in the treatment of three negative breast cancer(human epidermal growth factor receptor,progesterone receptor and estrogen receptor were negative).Methods:The clinical data of 48 cases of patientswith three negative breast cancer treated with neoadjuvant chemotherapy of epirubicin combined with docetaxel from January 2010 to December 2013 were analyzed retrospectively.Results:Among 48 cases with three negative breast cancer,the clinical total effective rate was 84.5%;the clinical complete remission rate was 18.5%;the clinical partial remission rate was 67.5%;the rate of pathologic complete response was 16.5%.Conclusion:The neoadjuvant chemotherapy of epirubicin combined with docetaxel in the treatmentof three negative breast cancer has high clinical total effective rate and the rate of pathologic complete response,which obtain better clinical effect.
Three negative breastcancer;Epirubicin;Docetaxel;Combined chemotherapy
10.3969/j.issn.1007-614x.2015.1.30
