抗菌肽在饲用枯草芽孢杆菌中表达的研究进展
2015-12-25李连彬陈秀丽
李连彬,陈秀丽
(1.西北农林科技大学动物科技学院,陕西杨凌 712100;2.陕西省汉中市动物疾病预防控制中心,陕西汉中 723100)
由于抗生素药物的滥用,出现了越来越多的抗生素耐药菌株,传统抗生素替代药物的开发已成为目前研究热点。在生物机体中分离出的抗菌肽被认为是一种最有潜力的抗菌类药物。抗菌肽一般含有10~50个氨基酸,整体带有2~9个的正电荷,较大部分(≥30%)的疏水性氨基酸(Hancock和Sahl,2006)。抗菌肽具有抗菌谱广、抗菌活性高、不易产生耐药性、无毒副作用 (仅少数种类具有溶血活性)、无残留与无污染等优点,符合畜产品安全生产的需要,适合在饲料生产中使用,具有作为新一代饲料添加剂的潜质(单安山等,2012)。
枯草芽孢杆菌(Bacillus subtilis)是广泛存在于土壤和动物胃肠道的一类革兰氏阳性菌,目前已作为重要的工业菌种被越来越多地应用于畜牧业生产中。枯草芽孢杆菌具有易于分离培养、较清晰的遗传背景、良好的分泌性及无致病性等优点。近几年来利用重组枯草芽孢杆菌生产饲用酶、饲用活性代谢产物以及作为肠道益生菌成为热点研究领域。本文对枯草芽孢杆菌表达系统及抗菌肽在其中的表达进行了简要的综述,以期为开发饲用型抗菌制剂提供参考。
1 枯草芽孢杆菌表达系统
枯草芽孢杆菌属于芽孢杆菌属,是一类好氧型、内生抗逆性孢子的革兰氏阳性菌。其细胞呈直杆状,大小为(0.8 ~ 1.2)μm×(1.5 ~ 4.0)μm,广泛分布于土壤及腐败的有机物中。因其培养简单快速,具有较强的分泌蛋白质的能力、非致病性及良好的发酵基础和生产技术,故枯草芽孢杆菌是目前生产各种工业用酶,如淀粉酶、蛋白酶和脂肪酶等的理想表达宿主,是微生物研究领域中的一种重要模式菌株。
枯草芽孢杆菌具有自己独特的生长规律:生长延滞期、对数期、稳定期、衰亡期及芽孢发育期。其在不同的生长阶段基因表达不同,有多种不同时序性的 σ因子来调节 (Staroń等,2009)。 杨明明(2013)利用电转化介导枯草芽孢杆菌早期生孢基因的敲除,获得了枯草芽孢杆菌生孢基因缺失株B.subtilis GJ09。枯草芽孢杆菌表达系统的另一个特点是其能将蛋白大量分泌至培养基中,通过生物信息学预测,枯草芽孢杆菌共有294种外分泌型蛋白。但是由于其胞外蛋白酶表达量大反而容易引起目标蛋白的降解,目前通常的解决方法是采用蛋白酶缺陷株作为宿主(Nijland 和 Kuipers,2008)。
虽然与大肠杆菌表达系统相比枯草芽孢杆菌表达系统更适合应用到制备饲用酶及抗菌制剂中,但是其嵌合载体拷贝数低、启动子活性低,导致目标基因表达量低等问题。近几年的研究主要围绕着如何构建高拷贝的载体、筛选高活性的启动子等内容。
1.1 枯草芽孢杆菌载体系统 在微生物的遗传操作中,质粒载体是基因重组技术中的重要工具。然而大部分枯草芽孢杆菌不含内源性质粒。目前常用的质粒一般来源于葡萄球菌和链球菌,其中应用效果较好的是采用滚环型复制的小型质粒。但是质粒仍然存在分离不稳定,结构不稳定等问题(Tanaka等,2010)。这严重影响了其在枯草芽孢杆菌的研究应用,此外在枯草芽孢杆菌的遗传操作中,体外连接的双链质粒DNA分子直接转化宿主效率极低。许多基因不能直接构建枯草芽孢杆菌质粒载体,转入宿主菌进行表达。然而,大肠杆菌分子遗传操作成熟,不会产生质粒不稳定性现象,因此可以将外源基因在大肠杆菌中构建完成后再转化到枯草芽孢杆菌中表达。故构建大肠杆菌-枯草芽孢杆菌的穿梭质粒载体是十分必要,目前常用的穿梭质粒载体有 pEB10、pEB20、pEB60、pUB18、pUB19 和 pWB980,还有能够实现在枯草芽孢杆菌中高效表达的pHT01和pHT43(余小霞等,2015;Nguyen 等,2007)。 李瑞芳等(2006)用大肠杆菌质粒pSP72和枯草杆菌质粒Pub18共整合得到双功能克隆载体pSB。杨明明(2013)从质粒的大小、多克隆位点的合理布局、抗性标记的便利性、质粒提取的便利性以及复制子特性等角度出发,构建了新的结构紧凑的大肠杆菌-枯草芽孢杆菌穿梭载体pGJ03及pGJ148。
1.2 枯草芽孢杆菌表达系统的启动子 启动子是位于结构基因 5'端上游的 DNA序列,能够活化RNA聚合酶,使之与模板DNA准确的结合并具有转录起始的特异性。获得高活性的启动子是实现外源基因高效表达的关键。在枯草芽孢杆菌表达系统中常用的启动子主要分为2个类型:组成型启动子和诱导型启动子。组成型启动子即持续性表达蛋白的启动子,如P43启动子(Chiang等,2010)。这类启动子启动强度通常要求较强,且成本低,一些组成型启动子常通过构建胞内或分泌表达载体表达目的蛋白,但存在对宿主生长有害的蛋白难以表达和可控性差的缺陷 (Ying等,2011)。诱导型启动子可以根据需要调控基因的表达。常用的诱导型启动子主要有4类:Pspac、Pxyl、PsacB和Pglv。Pspac由SPO1的启动子和大肠杆菌乳糖操纵元的阻遏蛋白结合位点嵌合而成,由IPTG诱导表达(Knobloch等,2011)。但是IPTG价格高且有毒性,Pspac启动强度还是不够。Pxyl启动子是由木糖诱导表达的一类启动子,该系统调控严谨,诱导效率高但是却受葡萄糖抑制。PsacB启动子则是利用自身的可控元件来实现外源基因的诱导表达。其表达量偏低。Pglv是目前有很好的应用潜力的启动子系统,其诱导物麦芽糖相对于IPTG和木糖来说价格便宜、成本低且对细菌本身无毒性,因此在工业生产上很有实用性价值,但是葡萄糖对其有抑制作用(杨明明和陈玉林,2013)。Yang等(2010)改善了Pglv启动子系统,大大降低了葡萄糖的抑制作用。
2 抗菌肽在枯草芽孢杆菌表达系统中的表达
如上所述枯草芽孢杆菌表达系统目前还不是很完善。但是其对于饲用抗菌制剂的开发具有独特的优点,加上近几年这个系统的逐渐成熟,人们逐渐将抗菌肽的表达转移到枯草芽孢杆菌上来。目前,大约有2300多种抗菌肽被发现,不同的抗菌肽具有不同的抑菌谱。对于枯草芽孢杆菌表达系统来讲,那些对革兰氏阴性菌有高杀伤力而对革兰氏阳性菌没有杀伤力的抗菌肽可以采用直接表达的方法;而对于大部分既能杀灭革兰氏阴性菌又对革兰氏阳性菌有杀伤力的抗菌肽必须采用融合表达的策略。
2.1 直接表达 在畜牧业生产中,很多致病菌是革兰氏阴性菌,如常见的鸡白痢沙门氏菌、鸡伤寒沙门氏菌和引发仔猪白痢的大肠杆菌等。因此部分对革兰氏阴性菌有高杀伤力而对革兰氏阳性菌没有杀伤力的抗菌肽在畜牧业生产中具有重要意义。李丽等(2009)利用抗菌肽Abaecin对革兰氏阴性菌有很强的杀伤力,而对革兰氏阳性菌没有杀伤力这一特点选择了枯草芽孢杆菌作为表达宿主菌。利用重叠PCR获得了Abaecin的基因序列AP,将 AP、质粒 pHCMC05的启动子 Pspac及阻遏蛋白基因LacI和质粒pAX01的终止子t0t1插入大肠杆菌-枯草芽孢杆菌穿梭质粒pGJ103中构建了新型表达质粒pGplat,并利用麦芽糖诱导表达抗菌肽Abaecin。在枯草芽孢杆菌的发酵液中检测到了抗菌肽Abaecin,其生物活性得到也验证。岳敏杰(2013)利用枯草芽孢杆菌表达质粒pWB980为骨架构建了大肠杆菌-枯草芽孢杆菌穿梭质粒pWBAO,在枯草芽孢杆菌中表达了鸡干扰素ChlFN-a,利用蔗糖进行诱导表达,但是产量较低。虽然通过直接表达可以获得一些抗菌肽,但是大部分抗菌肽具有广谱的抗菌性,想要得到必须通过融合表达的方法获得。
2.2 融合表达 广谱的抗菌肽在枯草芽孢杆菌系统中表达面临2个难题:抗菌肽的抗菌特性使其对宿主菌具有潜在的致命毒性;抗菌肽小分子量和高阳离子性使其易被蛋白水解酶降解。而采用融合表达可以克服这两个难题。Chen等(2009)利用SUMO融合技术首先在枯草芽孢杆菌中表达出了广谱性的抗菌肽Cecropin AD,将SUMO融合蛋白和SUMO切割酶构建到同一个质粒载体中,从而实现将广谱性抗菌肽Cecropin AD直接表达到发酵液中。陈香等 (2011)和王阿荣等(2011)将利用此种方法表达的抗菌肽直接添加到了仔猪的日粮中,结果表明这种抗菌肽制剂可显著改善饲料转化率,降低饲料成本,提高断奶仔猪的生产性能和机体免疫性能。但是用这种方法获得抗菌肽的产量偏低,不能达到工业化生产的水平。 栾超(2014)比较了 3 种融合技术(Trx、Gst和SUMO)对抗菌肽CBF表达量的影响,证实SUMO融合技术效果最好。为了提高产量,其在枯草芽孢杆菌系统中分别表达SUMO融合蛋白和SUMO切割酶,但是其过程因多了一步体外切割,故较繁琐。为了简化表达纯化抗菌肽的过程,He等(2015)利用内含肽自切割技术首次在枯草芽孢杆菌中表达出了抗菌肽CBF,并且纯化过程只需一步,较为简单,但是产量很低,离工业化生产的目标相距较远。谢海伟等(2011)和尚田田(2014)均在枯草芽孢杆菌中表达获得抗菌肽。近年来,利用枯草芽孢杆菌表达的抗菌肽所采用的方法、融合系统和产量等指标见表1。
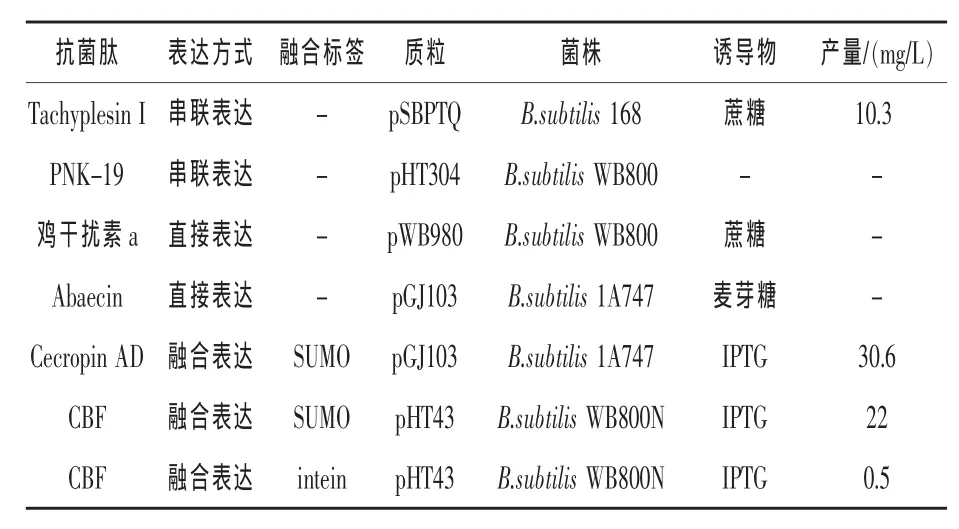
表1 抗菌肽在枯草芽孢杆菌中的表达
3 小结
目前,随着枯草芽孢杆菌基因工程不断的发展完善,越来越多的与工业发酵相关的基因获得成功表达。但是相对于大肠杆菌表达系统其还有很多需要改进的地方,如构建更小、拷贝数高的新型质粒载体;进一步提高质粒的稳定性与安全性;遗传操作方法需要进一步优化,尤其要解决枯草芽孢杆菌转化效率偏低的问题;筛选更强的启动子。可以预见,随着这些问题的解决,枯草芽孢杆菌将具有更为广阔的应用前景。
[1]陈香,谯仕彦,李波,等.添加天蚕素抗菌肽对断奶仔猪生长性能的影响[J].中国饲料,2011,12:30.
[2]单安山,马得莹,冯兴军,等.抗菌肽的功能,研发与应用[J].中国农业科学,2012,45(11):2249 ~ 2259.
[3]李丽,谯仕彦,祝发明,等.蜜蜂抗菌肽 Abaecin在枯草杆菌中的分泌表达[J].畜牧兽医学报,2009,40(11):1681 ~ 1685.
[4]李瑞芳,张添元,罗进贤.双功能枯草杆菌诱导型高效表达分泌载体的构建与鉴定[J].微生物学报,2006,46(5):714 ~ 719.
[5]栾超.利用SUMO融合技术在枯萆芽孢杆菌中重组表达抗菌肽cathelicidin-BF及其生物学活性研究:[博士学位论文][D].杭州:浙江大学,2014.
[6]尚田田.枯草芽孢杆菌表达体系高效表达抗菌肽PNK-19方法的建立:[硕士学位论文][D].新乡:河南科技学院,2014
[7]王阿荣,敖长金,宋青龙,等.日粮中添加天蚕素抗菌肽对断奶仔猪生产性能和血液生化指标的影响[J].饲料工业,2011,32(10):21 ~ 24.
[8]谢海伟,文冰,王娣,等.海洋生物抗菌肽在枯草杆菌 BS168中的高效表达[J].海洋科学,2011,3:55 ~ 63.
[9]杨明明.枯草芽孢杆菌关键遗传调控元件及表达系统的研究:[博士学位论文][D].杨凌:西北农林科技大学,2013.
[10]杨明明,陈玉林.饲用枯草芽孢杆菌表达系统研究进展[J].家畜生态学报,2013,34(12):1 ~ 7.
[11]余小霞,田健,刘晓青,等.枯草芽孢杆菌表达系统及其启动子研究进展[J].生物技术通报,2015,31(2):35 ~ 44.
[12]岳敏杰.鸡干扰素a在枯草芽孢杆菌中的表达及活性检测:[硕士学位论文][D].郑州:河南农业大学,2013
[13]Chiang C J,Chen P T,Chao Y P.Secreted production of Renilla luciferase in Bacillus subtilis[J].Biotechnology progress,2010,26(2):589 ~ 594.
[14]Chen X,Zhu F,Cao Y,et al.Novel expression vector for secretion of cecropin AD in Bacillus subtilis with enhanced antimicrobial activity[J].Antimicrobial agents and chemotherapy,2009,53(9):3683 ~ 3689.
[15]Hancock R E W,Sahl H G.Antimicrobial and host-defense peptides as new anti-infective therapeutic strategies[J].Nature biotechnology,2006,24(12):1551 ~ 1557.
[16]He Q,Fu A,Li T.Expression and one-step purification of the antimicrobial peptide cathelicidin-BF using the intein system in Bacillus subtilis[J].Journal of industrial microbiology&biotechnology,2015,42:1 ~ 7.
[17]Knobloch D,Clemens A,Ostermann K,et al.The xylA promoter of Bacillus megaterium mediates constitutive gene expression in Escherichia coli[J].Engineering in Life Sciences,2011,11(5):458 ~ 462.
[18]Luan C,Zhang H W,Song D G,et al.Expressing antimicrobial peptide cathelicidin-BF in Bacillus subtilis using SUMO technology[J].Applied microbiology and biotechnology,2014,98(8):3651 ~ 3658.
[19]Nguyen H D,Phan T T P,Schumann W.Expression vectors for the rapid purification of recombinant proteins in Bacillus subtilis[J].Current microbiology,2007,55(2):89 ~ 93.
[20]Nijland R,Kuipers O P.Optimization of protein secretion by Bacillus subtilis[J].Recent patents on biotechnology,2008,2(2):79 ~ 87.
[21]Staroń A,Sofia H J,Dietrich S,et al.The third pillar of bacterial signal transduction:classification of the extracytoplasmic function(ECF)σ factor protein family[J].Molecular microbiology,2009,74(3):557 ~ 581.
[22]Tanaka T.Functional analysis of the stability determinant AlfB of pBET131,a miniplasmid derivative of Bacillus subtilis(natto)plasmid pLS32[J].Journal of bacteriology,2010,192(5):1221 ~ 1230.
[23]Yang M M,Zhang W W,Chen Y L,et al.Development of a Bacillus subtilis expression system using the improved Pglv promoter[J].Microbial cell factories,2010,9(1):55.
[24]Ying Q,Zhang C,Guo F,et al.Secreted expression of a hyperthermophilic α-amylase gene from Thermococcus sp.HJ21 in Bacillus subtilis[J].Journal of molecular microbiology and biotechnology,2011,22(6):392 ~ 398.
