不同黄体支持方法对冻融囊胚移植周期结局的影响
2015-08-10徐芳林佳赵军招沈晓露
徐芳,林佳,赵军招,沈晓露
(温州医科大学温州市第三临床学院,温州 325000)
激素替代周期行冻融囊胚移植(FET)在临床应用广泛。但是其缺乏自身黄体功能,需要完全依赖外来激素支持,因此如何应用黄体支持将对妊娠结局产生重大影响。但是黄体酮药物种类、用药剂量、用药途径、应用时间等均未统一。现今我国很多生殖中心进行黄体支持时采用不同给药途径、不同种类的黄体酮制剂联合应用。国内外关于采用黄体酮单药进行黄体支持的对比研究资料丰富,而在联合不同种类黄体酮用药方面资料相对偏少。本研究旨在探讨行激素替代周期FET 的患者接受不同的黄体酮制剂联合用药进行黄体支持对其妊娠结局的影响及药物费用。
资料与方法
一、研究对象
采用前瞻性随机研究,将2012年10月~2013年4月在温州医科大学附属第一医院生殖医学中心接受激素替代周期行冻融囊胚移植治疗的160例患者的160个周期,运用随机列表法,随机分为3 组:A组64 例,采用黄体酮针剂肌肉注射(60 mg 每日1次)联 合 地 屈 孕 酮 口 服(10 mg 每 日2 次);B 组50例,采用黄体酮阴道缓释凝胶阴道给药(90 mg每日1次)联合地屈孕酮口服(10 mg 每日2 次);C组46例,采用黄体酮针剂肌肉注射(60 mg每日1次)联合微粒化黄体酮软胶囊阴道给药(200 mg每日2次)。三组患者的周期数不同,是因为部分患者因舒适度和经济等因素退出,因此导致三组间不平衡。所有患者均签署知情同意书。
纳入标准:(1)接受FET 周期助孕;(2)年龄<40岁;(3)有1~2个第5天囊胚可移植。
排除标准:(1)存在其他影响胚胎着床的因素,如子宫明显畸形、子宫内膜息肉、输卵管积水及宫腔粘连等;(2)严重内外科疾病;(3)性激素应用禁忌;(4)夫妻染色体异常;(5)反复移植失败。
二、药物
1.黄体酮注射液:仙居制药有限公司,浙江;20mg/支,单价0.91元/支;
2.地屈孕酮:商品名:达芙通,雅培制药有限公司,荷兰;10mg/片,单价6.32元/片;
3.黄体酮阴道缓释凝胶:商品名:雪诺同®8%,默克雪兰诺公司,德国;90mg/支,单价77.86元/支;
4.微粒化黄体酮软胶囊:商品名:安琪坦,法杏大药厂,法国;100mg/粒,单价3.31元/粒;
5.雌二醇片/雌二醇地屈孕酮片:商品名:芬吗通,雅培制药有限公司,荷兰;白片雌二醇1mg/片,灰片雌二醇1 mg 与地屈孕酮10 mg/片,单价121.2/盒。
三、研究方法及步骤
1.囊胚的获取方法、囊胚的冻存和囊胚的解冻:按本中心常规[1]进行。确定囊胚存活的标准为大于50%的卵裂球应该完整透亮。囊胚评分根据Gardner评分标准[2]。
2.子宫内膜准备方法:月经周期的第3天到第5天开始口服雌二醇片即芬吗通白片1 mg,每日2次,共3~5d后改为1 mg阴道给药,每日1次,5~7d后来医院,监测血E2及孕酮(P)水平,如果E2≥600pmol/L,内膜厚度≥7mm,开始补充孕激素诱导内膜向分泌期转化。专人行超声监测,记录子宫内膜内膜类型及厚度平均值。
A 组采用黄体酮针剂60 mg每日1 次肌肉注射,联合地屈孕酮片10mg口服每日2次;B组采用黄体酮阴道缓释凝胶90mg阴道给药每日1次,联合地屈孕酮片10mg口服每日2次;C 组采用黄体酮针剂60mg肌肉注射,每日1次,联合黄体酮软胶囊200mg 阴道给药每日2 次。开始使用孕激素5d,复苏及移植D5 囊胚,每个移植周期均有1~2个可移植D5囊胚。
3.囊胚的移植:由两名医师严格按操作常规进行。术后患者静卧半小时。移植当日继续原有黄体酮方案行黄体支持治疗。
6.妊娠确定:囊胚移植后11d晨测尿HCG,若尿HCG 阳性则再测血HCG,血HCG>10U/L 确定为妊娠,若妊娠则连续用药直至移植后8周。监测血HCG 水平呈下降趋势或者移植后28d行阴道B超检查未发现孕囊,则确定为生化妊娠。移植后28d,B超确认子宫内有孕囊存在,且可见胎心搏动则确认为宫内妊娠;宫内未见孕囊而宫外可见则为异位妊娠。
7.主要观察指标:观察3 组患者的实验室及临床指标包括(1)种植率:计算方法为孕囊数/移植胚胎数×100%;(2)生化妊娠率:计算方法为:生化妊娠周期数/移植周期数×100%;(3)临床妊娠率:计算方法为:临床妊娠周期数/移植周期数×100%;(4)双胎妊娠率:计算方法为双胎妊娠周期数/移植周期数×100%;(5)异位妊娠率:计算方法为异位妊娠周期数/移植周期数×100%;(6)成本效果比(CER):每获得1 例临床妊娠所消耗费用。
三、统计学处理
采用SPSS 13.0软件进行统计学处理,率的比较采用卡方检验;平均数的比较方差齐性的两组计量资料数据比较采用两独立样本t检验,方差不齐则采用Satterthwaite近似t检验法。
结 果
一、三组患者一般情况比较
B、C两组分别与A 组比较:患者平均年龄、开始使用孕激素日子宫内膜厚度、开始使用孕激素日P、E2值。A、B 型子宫内膜所占比例,差异无统计学意义(P>0.05)。开始使用孕激素日子宫内膜类型比较:A 组子宫内膜A 型53.1%(34/64),B 型46.9%(30/64);B 组 子 宫 内 膜A 型54.0%(27/50),B 型46.0% (23/50);C 组 子 宫 内 膜A 型47.8%(22/46),B型52.2%(24/46)(表1)。
二、三组患者临床结果比较
A 组64个周期中共移植115个胚胎,每周期平均移植胚胎数(1.80±0.41)个;B组50个周期中共移植86个胚胎,平均移植胚胎数(1.72±0.45)个;C组46个周期中共移植75 个胚胎,平均移植胚胎数(1.63±0.49)个。B、C两组分别与A 组比较,平均移植胚胎数差异无统计学意义(P>0.05),且种植率、生化妊娠率、临床妊娠率、早期流产率、多胎妊娠率及异位妊娠率,差异均无统计学意义(P >0.05)(表2)。

表1 三组患者的一般情况及开始使用孕激素日生殖激素比较(x±s)
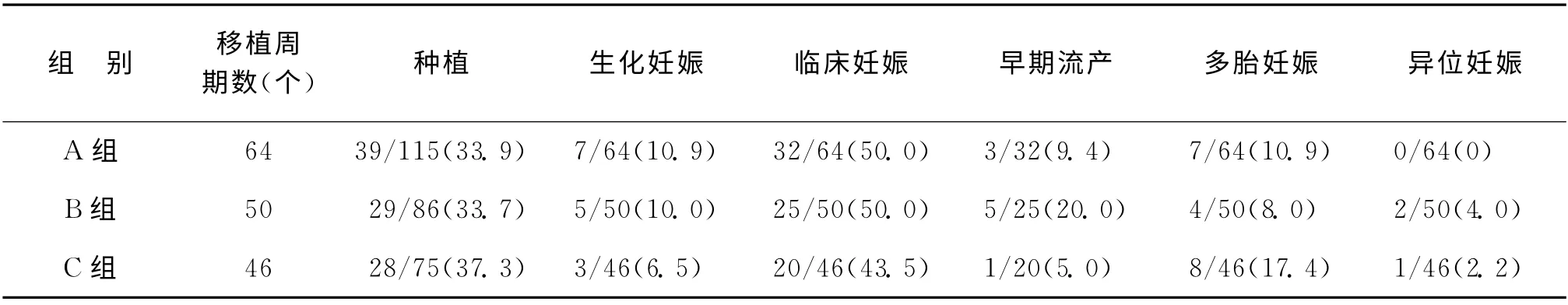
表2 三组患者临床结果比较[n,(%)]
三、三组患者黄体酮药物成本效果分析
三组除外芬吗通的费用,按开始使用孕激素日起至测定HCG 日共17d,B 组每周期黄体酮治疗平均费用最高,C组稍高于A 组。B 组成本效果比(每获得1例临床妊娠所消耗费用)最高,C 组较A组稍高(表3)。

表3 三组患者黄体酮成本效果比较
四、患者的不适反应
接受黄体酮针剂肌肉注射患者的局部红肿发生率2.7%(3/110),未出现人工性脂膜炎,经过局部热敷、按摩、药物涂抹后均明显好转。接受黄体酮阴道缓释凝胶阴道给药的患者中出现阴道分泌物增多伴瘙痒占2.0%(1/50),而接受微粒化黄体酮软胶囊经阴道给药者中发生率为10.9%(5/46),后者高于前者但差异无统计学意义(P>0.05),均经过局部清洁给药明显好转。接受地屈孕酮口服的患者,发生轻度胃肠道不适占1.76%(2/114)。
讨 论
激素替代周期是FET 中应用非常广泛的子宫内膜准备方法。目前临床上采用比较多的雌激素制剂为戊酸雌二醇片,较常见的使用方法为月经周期的第1~5天开始,2~6 mg每日二次口服,予以B超监测调整用量直到子宫内膜达到转化标准。此方法雌激素使用剂量较大,可达到14mg/d[3-4]。但是对于部分子宫内膜受过严重创伤的患者,给予大剂量雌激素也无法获得理想的子宫内膜准备。陈芳等[5]提出高雌激素环境能升高血清转化生长因子-β1、碱性成纤维细胞生长因子水平,促进子宫内膜纤维化的发生,加剧宫腔粘连形成。所以寻找一种稳定有效、低剂量的性激素是目前临床关注的焦点。
自报道E2经阴道用药比口服有更好的效果后[6],有多项研究[7-10]均表明E2经阴道用药安全有效,口服E2的患者子宫内膜生长不良改阴道给药后达到理想形态子宫内膜并成功妊娠。同时研究中发现E2经阴道用药者血清中E2水平高于口服者约10倍,但性激素结合蛋白及脂蛋白水平却无明显差异[7,9]。试探性使用芬吗通白片即E2片进行子宫内膜准备,可获得良好的效果,给药途径有口服,阴道给药等。耿嘉瑄等[11]报道单纯使用补佳乐不能获得满意子宫内膜厚度的患者,使用芬吗通口服用药可取得较好疗效。本研究的160个激素替代周期平均在月经周期的第(14.31±2.13)天,内膜达到≥7mm 及血E2≥600pmol/L,且均为A 或B型子宫内膜,A 型83例,占51.9%,B型77例,占48.1%。160例均未出现阴道不规则流血、阴道瘙痒及分泌物异常情况,均得到满意的子宫内膜准备。提示使用芬吗通白片即E2片经阴道给药可以进一步减少雌激素的用量而同样能得到满意的子宫内膜准备。
辅助生殖技术黄体支持的药物有HCG、孕酮、促性腺激素释放激素激动剂(GnRH-a)等。但因为HCG 有增加卵巢过度刺激综合征(OHSS)危险的可能,GnRH-a有诱发LH 峰等不利因素,所以孕酮的应用较为广泛。传统应用广泛的是黄体酮针剂,其效果稳定,价格便宜。长期进行肌肉注射,局部疼痛明显,可引起变态反应,影响药物吸收。孙青等[12]研究发现局部不良反应可能与黄体酮溶媒量或溶媒质量相关。本研究中有2.7%(3/110)接受黄体酮针剂注射的患者出现局部红肿反应,未出现人工性脂膜炎。天然孕酮制剂给药方式除了肌肉注射,还有口服、阴道给药、直肠给药等。地屈孕酮是一种逆转孕酮制剂,对孕激素受体高度选择,无雌雄激素或抗雌雄激素活性,一般口服给药;黄体酮阴道缓释凝胶,用药方便,持续恒量释放,局部药物浓度高,全身反应小;黄体酮微粒化软胶囊,可口服或阴道给药。
在单药应用效果方面,担忧地屈孕酮效果是否和黄体酮针剂一样良好,是因其血中药物浓度无法进行常规有效测定。国内研究[13]显示40 mg地屈孕酮与40mg黄体酮针剂诱导子宫内膜向分泌期转化的效应相当。口服地屈孕酮片进行黄体支持可达到与黄体酮针剂相同的临床结局[14],在黄体支持及保胎方面都被证实安全有效[15-17]。对430位行IVF/ICSI需黄体支持的妇女进行研究,随机分组地屈孕酮口服(10mg每日2 次)或黄体酮微粒化软胶囊阴道给药(200mg每日3次)对比发现二者效果同样无差别[18]。本研究中接受口服地屈孕酮患者中仅1.76%(2/114)发生轻度胃肠道不适,依从性良好。故地屈孕酮在黄体支持中有良好应用前景。
黄体酮阴道缓释凝胶价格高昂,但用药方便、效果持续稳定。关于其给药剂量,存有争议。有证据表明90mg每日2 次比每日1 次增加活产率[19]。另一研究结果显示,90 mg 每日1 次剂量已经足够[20]。国内大多数生殖中心多采用90 mg每日1次阴道给药。本研究黄体酮针剂联合地屈孕酮片组与阴道凝胶联合地屈孕酮片组比较妊娠结局无明显差异,但是在黄体酮费用方面后者显著高于前者。在不适反应上,接受凝胶患者中仅2.0%(1/50)出现轻度的阴道分泌物增多伴瘙痒,经过局部清洁3d内明显好转。而2.7%(3/110)接受黄体酮针剂注射的患者出现局部红肿反应,平均经过30余天的局部物理治疗好转。近期的研究结果[21]也提示采用凝胶与针剂的临床妊娠率、活产率及流产率无差异,而患者对凝胶满意度高。故阴道凝胶联合地屈孕酮片进行黄体支持可以避免油性针剂注射痛苦及不良反应,但存在价格高昂、加重患者经济负担的不利因素。在患者经济条件许可、能接受用药方式的前提下应用,无疑可以提高其满意度。
微粒化黄体酮软胶囊价格较凝胶低廉,除经阴道给药外还可以口服。经阴道使用直接作用于子宫孕激素受体,避免肝脏首过效应。对于药物不适反应,本研究中接受凝胶阴道给药的患者出现阴道分泌物增多伴瘙痒的发生率2.0%(1/50)明显低于接受软胶囊者的10.9%(5/46)。有资料[22]表明两者的黄体支持效应相近,但凝胶的患者满意度更高;而龚斐等[23]提出凝胶比软胶囊获得更好的临床效果,提高着床率和临床妊娠率,减少早期流产。
黄体支持中选用黄体酮单药还是联合不同黄体酮制剂用药没有统一标准,很多情况下取决于临床医师的用药习惯及经验。本研究结果显示,黄体酮针剂注射联合地屈孕酮片口服比较凝胶阴道给药联合地屈孕酮片口服在激素替代方案FET 周期中所获得的种植率、生化妊娠率、临床妊娠率、多胎妊娠率、早期流产率及异位妊娠率无明显差异。同样黄体酮针剂注射联合地屈孕酮片口服,比较黄体酮针剂注射联合安琪坦阴道给药两者无明显差异。但是从药物费用成本效果分析,凝胶阴道给药联合地屈孕酮片口服获得1例临床妊娠所需成本远远高于其他两种联合方案,而黄体酮针剂注射联合软胶囊阴道给药稍高于黄体酮针剂注射联合地屈孕酮片口服。
从给药方便性、安全性和舒适性分析,阴道给药因直接作用在子宫、阴道,局部药物浓度高,无全身效应,全身不适反应较少。黄体酮针剂肌肉注射及口服微粒化孕酮血中浓度高,需要经过肝脏代谢,代谢产物种类多,影响全身,相对易出现头晕、潮热、恶心、催眠、镇静等不良反应。口服或阴道给药制剂可以使患者免受长期肌肉注射的痛苦,而且给药方便,不受地域限制,是黄体支持方案中较佳给药途径。
Tomic等[24]研究表明联合口服微粒化黄体酮软胶囊和雪诺酮阴道缓释凝胶比单一使用雪诺酮凝胶阴道给药在患者接受度及妊娠率方面无明显差异,但在妊娠期阴道流血率及早期流产方面前者发生率明显较后者低。该结果或许因为单用阴道缓释凝胶的部分患者中血清孕酮水平低,有时甚至低于自然周期黄体期水平[25-26]。同样单用黄体酮针剂注射则可能出现药物吸收不良,局部药物蓄积,影响其治疗效果。故联合口服黄体酮制剂和阴道给药途径制剂能够让血清及局部子宫内膜孕酮水平均保持稳定,有利胚胎种植。分析本文结果,我们认为同时保持两个途径用药,比单药应用更加安全。对生殖辅助技术中黄体酮联合用药是否比单药更有效、联合用药中的药物剂量及如何配伍需要进一步研究。
综上所述,对于FET 周期,联合多途径不同黄体支持方法均可获得比较满意的临床结果。相比较于给药更简便,患者舒适度高但价格较贵的黄体酮缓释凝胶联合地屈孕酮片组,黄体酮针剂联合地屈孕酮片或微粒化黄体酮软胶囊组更经济。在选用黄体支持方案时,应该根据患者具体的经济情况、给药方式的接受度、对不适反应的认识程度来制定不同的黄体支持方案。
[1] 陈雅文,肖仕全,林金菊.冻融囊胚移植后临床结局分析[J].生殖医学杂志,2011,20:352-355.
[2] 庄广伦.现代辅助生殖技术[M].第1版.北京:人民卫生出版社,2005:402.
[3] 田甜,李艳萍,刘冬娥.激素替代周期冻融胚胎移植术的安全性评价[J].生殖医学杂志,2012,21:30-33.
[4] 王晓兰,刘能辉,李艳萍,等.3种子宫内膜准备方案对冻融胚胎移植的临床结局比较[J].中国现代医学杂志,2011,21:431-434.
[5] 陈芳,段华,张颖,等.不同水平雌激素在宫腔粘连形成中的作用及相关机制[J].中华妇产科杂志,2010,45:917-920.
[6] Nahoul K,Dehennin L,Jondet M,et al.Profiles of plasma estrogens,progesterone and their metabolites after oral or vaginal administration of estradiol or progesterone[J].Maturitas,1993,16:185-202.
[7] Tourgeman DE,Slater CC,Stanczyk FZ,et al.Endocrine and clinical effects of micronized estradiol administered vaginally or orally[J].Fertil Steril,2001,75:200-202.
[8] Tourgeman DE,Gentzchein E,Stanczyk FZ,et al.Serum and tissue hormone levels of vaginally and orally administered estradiol[J].Am J Obstet Gynecol,1999,180:1480-1483.
[9] Fanchin R,Righini C,Schönauer LM,et al.Vaginal versus oral E(2)administration:effects on endometrial thickness,uterine perfusion,and contractility[J].Fertil Steril,2001,76:994-998.
[10] Simon J,Nachtigall L,Ulrich LG,et al.Endometrial safety of ultra-low-dose estradiol vaginal tablets[J].Obstet Gynecol,2010,116:876-883.
[11] 耿嘉瑄,张翠莲,张少娣,等.不同内膜准备方案在冻融胚胎移植中的作用[J].现代妇产科进展,2012,9:706-708.
[12] 孙青,苗金彦,陈捷,等.肌肉注射黄体酮致局部不良反应相关因素分析[J].中国药物应用与监测,2009,6:300-302.
[13] 陈霞,赵军招,陈茜茜,等.黄体酮针和地屈孕酮片对子宫内膜影响的比较研究[J].医学研究杂志,2012,41:109-112.
[14] 郭薇,陈薪,叶德盛,等.口服地屈孕酮对冻融胚胎移植周期临床妊娠结局的影响[J].南方医科大学学报,2013,6:861-865.
[15] 李雪梅,赵坤,刘庆芝,等.地屈孕酮治疗先兆流产的临床观察[J].实用医学杂志,2007,23:1245-1246.
[16] Hill MJ,Whitcomb BW,Lewis TD,et al.Progesterone luteal support after ovulation induction and intrauterine insemination:a systematic review and meta-analysis[J].Fertil Steril,2013,100:1373-1380.
[17] 连蔚,欧阳贺月.地屈孕酮预防多囊卵巢综合征患者卵泡黄素化的意义[J].亚太传统医学,2009,5:86-87.
[18] Chakravarty BN,Shirazee HH,Dam P,et al.Oral dydrogesterone versus intravaginal micronised progesterone as luteal phase support in assisted reproductive technology(ART)cycles:results of a randomized study[J].J Steroid Biochem Mol Biol,2005,97:416-420.
[19] Alsbjerg B,Polyzos NP,Elbaek HO,et al.Increasing vaginal progesterone gel supplementation after frozen-thawed embryo transfer significantly increases the delivery rate[J/OL].Reprod Biomed Online,2013,26:133-137.
[20] Dal Prato L,Bianchi L,Cattoli M,et al.Vaginal gel versus intramuscular progesterone for luteal phase supplementation:aprospective randomized trial[J/OL].Reprod Biomed Online,2008,16:361-367.
[21] Yanushpolsky E,Hurwitz S,Greenberg L,et al.Crinone vaginal gel is equally effective and better tolerated than intramuscular progesterone for luteal phase support in in vitro fertilization-embryo transfer cycles:aprospective randomized study[J].Fertil Steril,2010,94:2596-2599.
[22] Simunic V,Tomic V,Tomic J,et al.Comparative study of the efficacy and tolerability of two vaginal progesterone formulations,Crinone 8% gel and Utrogestan capsules used for luteal support[J].Fertil Steril,2007,87:83-87.
[23] 龚斐,蔡素芬,卢光璃,等.两种阴道给药黄体支持药物在IVF—ET/ICSI后用药的比较研究[J].实用妇产科杂志,2012,28:199-201.
[24] Tomic V,Tomic J,Klaic DZ.Oral micronized progesterone combined with vaginal progesterone gel for luteal support[J].Gynecol Endocrinol,2011,27:1010-1013.
[25] Fanchin R,De Ziegler D,Bergeron C,et al.Transvaginal administration of progesterone[J].Obstet Gynecol,1997,90:396-401.
[26] Waren M,Biller B,Shangold M.A new clinical option for hormone replacement therapy in women with secondary amenorrhea:effect of cyclic administration of progesterone from the sustained-release vaginal gel Crinone(4%and 8%)on endometrial morphologic features and withdrawal bleeding[J].Am J Obstet Gynecol,1999,180:42-48.
