内吗啡肽-2 的合成
2015-12-24赵红玲高杨李云红尹志峰王良友
赵红玲,高杨,李云红,尹志峰,王良友
(1.河北省中药研究与开发重点实验室 承德医学院,河北 承德 067000;2.承德天创生物制品有限公司,河北 承德 067000)
内吗啡肽-2(EM-2)是一种具有镇痛作用的四肽,其氨基酸序列为Tyr-Pro-Phe-Phe-NH2,相对分子量(Mr)571.7。1997 年由美国新奥尔良市都蓝大学神经生物学家Zadina 等[1]在牛脑中发现,它存在于动物和人的中枢神经系统内,是内源性L 阿片受体的激动剂,具有高亲和性和选择性[2]。
文献[3-4]采用液相二肽片段缩合的方法制备EM-2,步骤繁琐,收率低。还有采用基因工程的方法将人源生长因子信号肽与EM-2 融合表达[5],成本高,不易放大。
本研究采用多肽固相合成法,按照内吗啡肽-2的肽序列,依次从C 端向N 端偶联氨基酸,肽树脂经TFA 裂解得到粗肽,再经反相高效制备液相纯化转盐制备醋酸内吗啡肽-2。此合成工艺操作简单,产品纯度高,重复性好、收率高,适合于工业化放大生产。
1 实验部分
1.1 试剂与仪器
Rink Amid 树脂(替代度0.80 mmol/g);Fmoc-Phe-OH、Fmoc-Pro-OH、Fmoc-Tyr(OtBu)-OH、1-羟基苯并三唑(HOBT)、N,N’-二异丙基碳二亚胺(DIC)、N,N-二甲基甲酰胺(DMF)、冰乙醚、二氯甲烷、三氟乙酸(TFA)均为分析纯;乙腈,色谱纯;氨基酸,标准品。
AR224CN 分析天平;HDFD-3 PSA 制氮机;TDL-40B 高速大容量离心机;SHZ-Ⅳ循环水多用真空泵;Heal Force Easy20 纯水机;Agilent 1200 反相高效液相-ESI 质谱联用仪;Newstyle NP7000 反相高效半制备液相色谱仪;LC98-I AAA 氨基酸分析系统;CHRIST ALPHA 1-4 LD 型冻干机。
1.2 EM-2 肽树脂的合成[6]
1.2.1 Rink 树脂脱Fmoc 保护 把Rink Amide 树脂1.259 g(1 mmol)投入到多肽反应柱中,10 mL DMF 溶涨30 min,抽干液体;10 mL DMF 洗涤1 次。分别加入10 mL DBLK(20%哌啶的DMF 溶液),脱除Fmoc 保护2 次,时间分别是10 min 和5 min,茚三酮检测(Kaiser 法)阳性。分别加入DMF、DCM、DMF 各5 mL,洗涤树脂3 次。
1.2.2 氨基酸偶联 称取Fmoc-Phe-OH 1.165 g(3 mmol)、DIC 0. 557 mL (3. 6 mmol)和HOBt 0.486 g(3.6 mmol)10 mL DMF 溶解,加入到树脂中,N2吹拂搅拌反应2 h,茚三酮检测阴性,抽滤去除反应液。10 mL DMF 洗涤1 次,抽干。分别加入10 mL DBLK(20%哌啶的DMF 溶液),脱除Fmoc 保护2 次,时间分别是10 min 和5 min,茚三酮检测阳性,分别加入DMF、DCM 和DMF 各5 mL,洗涤树脂3 次。按照上述氨基酸脱保护与偶联方法,依次偶联Fmoc-Phe-OH、Fmoc-Pro-OH 和Fmoc-Tyr(OtBu)-OH。肽树脂分别用DMF 洗涤3 次、二氯甲烷洗涤3次,每次洗涤1 min,再用甲醇收缩2 次,每次收缩10 min,抽干甲醇。得到流沙状肽树脂1.873 g。
1.3 肽链切割
向1 g 肽树脂中缓缓加入10 mL-20 ℃预冻的三氟乙酸,室温裂解1.5 h,滤除树脂,将滤液缓慢滴加到60 mL 乙醚中,边加边搅拌,4 000 r/min 离心4 min,倒出上清液,下方沉淀经乙醚洗4 次,真空减压干燥,得到EM-2 粗肽0.644 g。
1.4 EM-2 纯化与转盐
1.4.1 高效液相分析条件 色谱柱为Agela C18柱(4.6 mm×250 mm,10 μm),检测波长215 nm,流动相:缓冲液A 为0. 1% TFA/H2O,B 为乙腈,流速0.8 mL/min,进样量10 μL,洗脱条件B 项5% ~95%,为单一峰,出峰时间为11.891 min,粗肽纯度为98.5%。
1.4.2 制备液相纯化转盐 色谱柱为Hedera ODS-2 反相硅胶柱(20 mm ×250 mm,10 μm),检测波长215 nm,流动相A 为0.3%醋酸/H2O,流动相B 为乙腈,流速15 mL/min,进样量100 mL,洗脱梯度B:25% ~38%,分布收集,精肽出峰时间为11.837 min,纯度为99.6%(见图1),冷冻干燥得到干粉0.516 g,得率为80.1%。
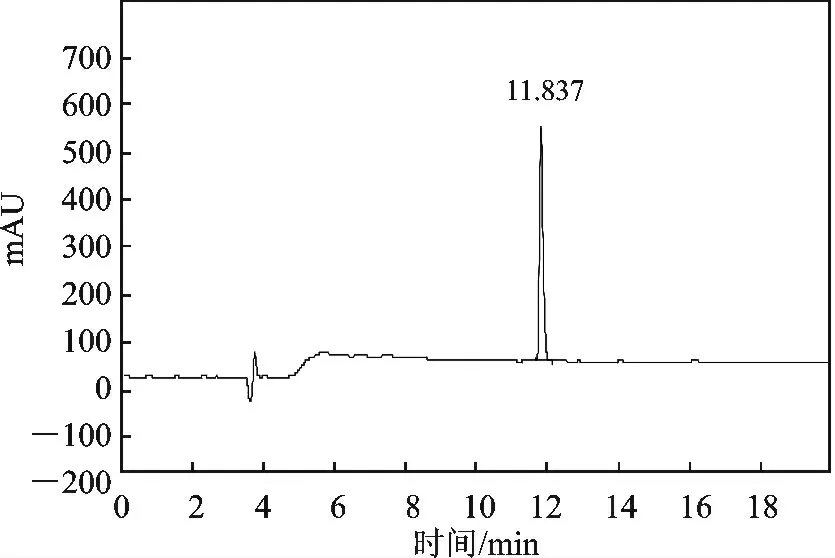
图1 EM-2HPLC 精肽分析谱图Fig.1 EM-2 HPLC peptide the fine spectra analysis
2 结果与讨论
2.1 质谱分析
精肽的ESI-MS 谱图见图2,[M + H]+=572.3,与理论值571.7 相符。
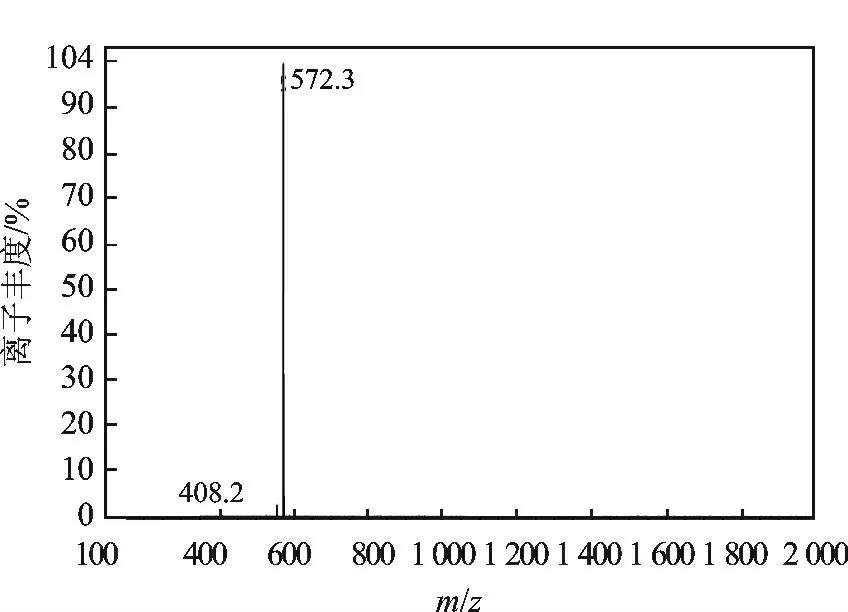
图2 EM-2 的ESI-MS 测定谱图Fig.2 EM-2 ESI-MS spectra
2.2 氨基酸组成分析[7]
2. 2. 1 EM-2 酸解衍生 称取5 mg EM-2,放入10 mL安培瓶中,加入6 mol/L 盐酸5 mL 混匀。氮气保护下封口,110 ℃水解24 h。水解液45 ℃减压旋蒸浓缩至干,用0.1 mol/L 盐酸5 mL 溶解。充分溶解后,取0.2 mL 水解液,加入0.1 mL 衍生剂Y(1.2%异硫氰酸苯酯的乙腈溶液)和0.1 mL 衍生剂S(13.9%三乙胺的乙腈溶液),室温静置1 h。再加入0.4 mL 正己烷振荡,静置10 min,取下层清液稀释5 倍进样检测。
2.2.2 色谱分析条件 色谱柱为氨基酸分析专用ODS 柱,柱温40 ℃,流速1 mL/min,波长254 nm,梯度见表1。氨基酸组成分析结果(图3、图4)为:固相合成EM-2 的氨基酸种类、个数与Tyr-Pro-Phe-Phe-NH2一致。
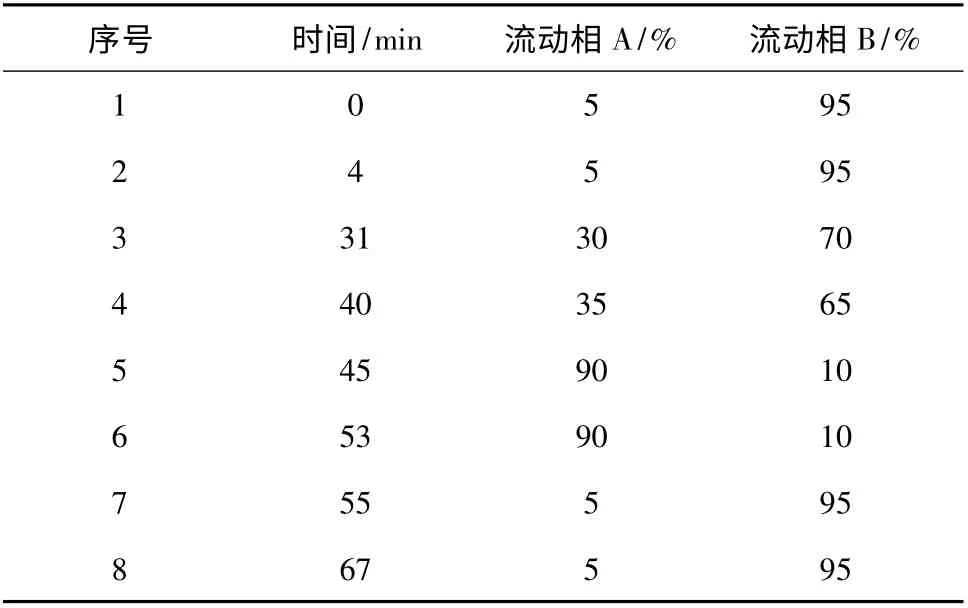
表1 梯度洗脱曲线Table 1 Gradient elution curves
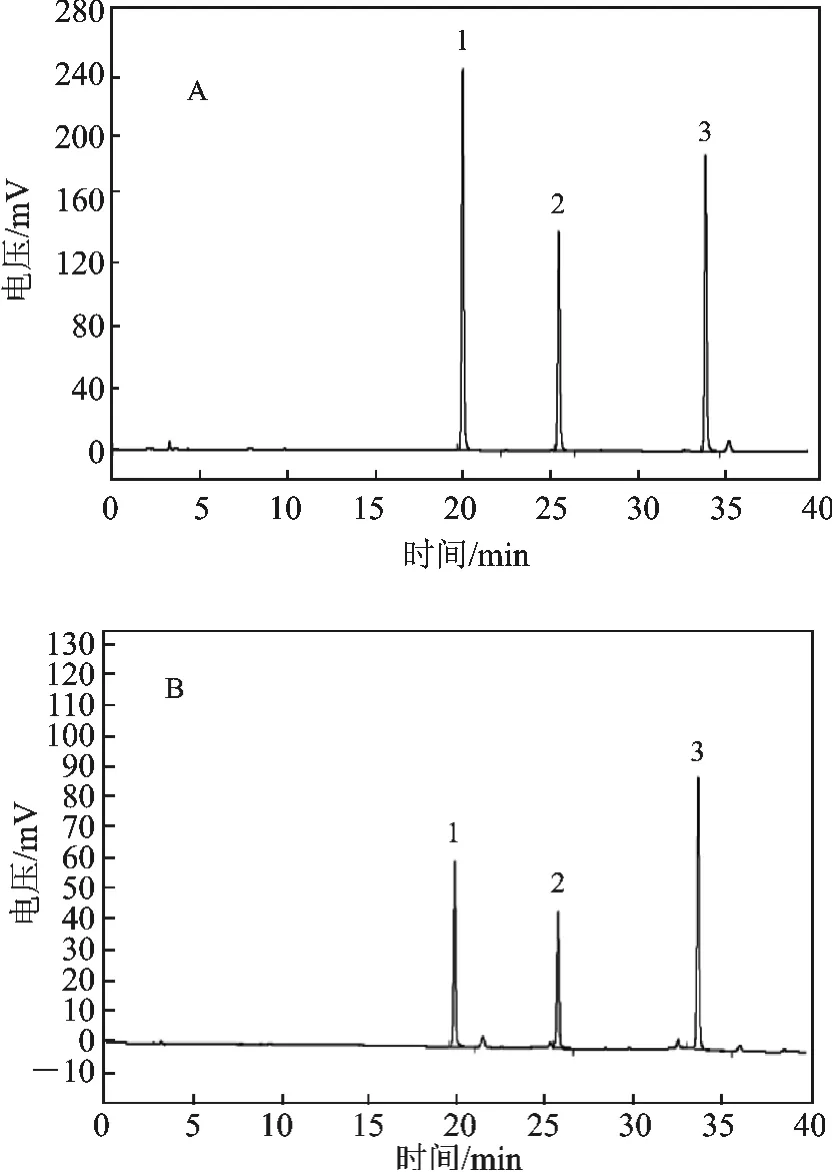
图3 氨基酸标准品(A)与EM-2(B)的氨基酸组成分析谱图Fig.3 Amino acid standard and EM-2 (A)(B)the amino acid composition analysis of spectra
2.3 放大实验
不同规模合成实验结果见表2。
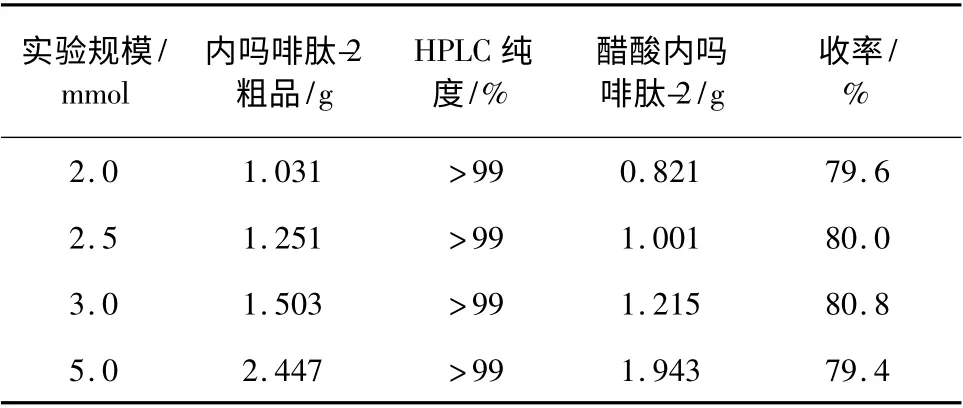
表2 放大重复实验数据Table 2 Repeat the experimental data
由表2 可知,实验易于放大,重复性好,收率高而且稳定。
3 结论
内吗啡肽-2 可从动物的组织中分离提取,获得的量有限而且成本高;采用液相合成法制备,产品纯度不高,收率低,满足不了市场的需求。本研究采用多肽固相合成法,操作简便,易于放大,重复性好,收率高。本实验研究的固相合成工艺,对于内吗啡肽-2 的工业化生产具有重要的参考价值。
[1] Zadina J E,Hackler L,Ge L J,et al.A potent and selective endogenous agonist for the L-opiate receptor[J].Nature,1997,386:499-501.
[2] Schild S M,Zadina J E,Gerall A A,et al.Localization of endomorphin-2 like immunoreactivity in the ratmedulla and spinal cord[J].Peptides,1997,18(10):1641-1649.
[3] 梁月洁,孟庆国,李明慧,等. 内吗啡肽-2 的合成研究[J].烟台大学学报,2007,20(1):19-21.
[4] 李俊,陈钧辉,聂永军,等. 内吗啡肽-2 的人工合成及其酶促降解[J]. 中国生物化学与分子生物学报,2004,20(2):270-274.
[5] 吴飞翔,俞卫峰,孙玉明.一种高效表达生产内吗啡肽-2 的方法及其应用:CN,103320472A[P].2013-06-19.
[6] 高杨,赵红玲,王小青,等.阿基瑞林的固相合成[J].承德医学院学报,2014,31(5):420-421.
[7] 王丽莉.多肽类药物的氨基酸检测方法[J].科技创新与应用,2014(16):272.
