β-内酰胺酶E166C突变型的原核表达、纯化及鉴定
2015-12-23肖美芳,王昌富,周义正等
【军事医学与卫生装备】
β-内酰胺酶E166C突变型的原核表达、纯化及鉴定
肖美芳,王昌富,周义正,邱晓燕
(华中科技大学附属荆州医院, 湖北 荆州434020)
摘要:目的本研究旨在构建β-内酰胺酶E166C突变体并于大肠杆菌中原核表达,纯化及鉴定该蛋白。方法利用体外PCR扩增获得β-内酰胺酶penP突变质粒并通过DNA测序鉴定,将重组质粒转化至BL21(DE3) 中,以IPTG 诱导蛋白表达。菌液超声裂解后首先以镍柱纯化融合蛋白,蛋白水解酶 HRV3C 除去融合标签,然后用凝胶过滤层析色谱进一步纯化得到目标蛋白,最后应用SDS-PAGE和电喷雾质谱法鉴定纯化的目标蛋白。结果成功构建了β-内酰胺酶penP-E166C突变质粒,并且先后通过亲和镍柱和凝胶过滤层析柱纯化获得了纯度非常高的单一蛋白,SDS-PAGE和电喷雾质谱法确定蛋白的分子量与理论值一致。结论本课题获得的penP的活性位点突变体E166C蛋白将用于以后进一步的研究,可以有助于我们从分子水平上去研究抗生素和β-内酰胺酶的相互作用。
关键词:β-内酰胺酶E166C突变体;PCR-介导的定点突变;蛋白纯化及鉴定
收稿日期:2015-01-12
作者简介:肖美芳(1982—),女,硕士研究生。主要从事细菌耐药性研究。
doi:10.11809/scbgxb2015.06.039
中图分类号:R961
文章编号:1006-0707(2015)06-0153-05
本文引用格式:肖美芳,王昌富,周义正,等.β-内酰胺酶E166C突变型的原核表达、纯化及鉴定[J].四川兵工学报,2015(6):153-156.
Citationformat:XIAOMei-fang,WANGChang-fu,ZHOUYi-zheng,etal.ProteinExpression,PurificationandIdentificationofβ-LactamasePenP-E166CWildtypeandMutants[J].JournalofSichuanOrdnance,2015(6):153-156.
ProteinExpression,PurificationandIdentificationof
β-LactamasePenP-E166CWildtypeandMutants
XIAOMei-fang,WANGChang-fu,ZHOUYi-zheng,QIUXiao-yan
(JingzhouCentralHospitalAffiliatedtoHuazhongUniversityofScienceandTechnology,Jingzhou434020,China)
Abstract:Objective This study was aimed to construct β-lactamase penP-E166C mutant and over-express it in E.coli, followed by purification and characterization. Method The plasmid of mutated β-lactamase penP was successfully amplified by PCR-mediated mutagenesis, which was then confirmed by DNA sequencing. The confirmed plasmids were firstly transformed into competent BL21(DE3) cells and the positive colonies were selected by antibiotics kanamycin, which were then induced by the addition of IPTG. The bacterial cells were firstly liaised by sonication, followed by Ni2+-affinity column purification, protease 3C digestion and gel filtration column purification to obtain target protein. The proteins were characterized by SDS-PAGE and ESI-mass spectrometry. Results We successively constructed penP-E166C mutant and purified this protein by Ni2+-affinity column and gel filtration column. SDS-PAGE and ESI-mass spectrometry further identified the protein molecular weight was consistent with theoretical value. Conclusion The obtained penP-E166C protein with mutation at the active site will be used in later study, which will help us to understand the interaction between antibiotics and β-lactamase better.
Keywords:β-lactamase-penPmutant;PCR-mediatedpointmutagenesis;proteinpurificationandcharacterization
β-内酰胺类抗生素 (β-lactamantibiotics)由于抗菌作用强,毒性低是目前临床抗感染治疗最普遍的一类抗生素。β-内酰胺类抗生素可以不可逆地结合到青霉素结合蛋白(PBPs的活性部位,而使其失活。由于PBPs是一组细菌细胞壁合成的关键酶,抑制其活性就会然阻断细菌细胞壁的合成,导致细菌渗透裂解然后死亡[1,2]。β-内酰胺类抗生素的优势是它可以选择性的作用于快速分裂的细菌,而作为宿主的人类细胞因为没有细胞壁就会不受影响。随着抗生素的广泛使用(尤其是吴用和滥用)以及致病菌的进化,使得耐药性传染病菌不断涌现和全球蔓延,如耐甲氧西林金黄色葡萄球菌(MRSA)[3]。最近,数株肺炎克雷伯菌更被确定为具有超广谱抗性,几乎可以抵抗所有的β-内酰胺类抗生素,甚至包括“最后的”防线碳青霉烯类抗生素[4]。这些所谓“超级病菌”的耐药菌株,由于治疗难度很高,导致住院时间延长并增加感染的广泛传播的机会,从而给医疗保健系统带来巨大的风险。
细菌可以通过多种方式获得对β-内酰胺抗生素抗药性,包括突变青霉素结合蛋白(PBP)的活性位点,使β-内酰胺不能结合到它的作用靶点;或者是增加外排,泵出侵入细菌的抗生素;又或是表达β-内酰胺酶来使抗生素失活[5,6]。其中,β-内酰胺酶的产生是最重要的,也是最多被研究细菌耐药性的机制。β-内酰胺酶可以通过细菌染色体嵌入基因或者是通过水平基因转移而获得,这些酶可以水解抗生素独特的β-内酰胺环,使他们不能有效结合到PBPs而失去活性。研究表明,虽然β-内酰胺酶的总数高得惊人并在不断增长,但是这些酶的许多成员之间可能只有很小的差别,只有一个或几个热点氨基酸残基发生了突变,从而导致β-内酰胺酶活性中心的构象发生改变,继而其作用底物谱也发生改变[7]。
penP,TEM-1和SHV-1系列是A类β-内酰胺酶的典型代表,其与90%革兰阴性菌对青霉素耐药性相关[8]。penP,其与TEM-1和SHV-1的序列相似性高,热稳定性高(Tm~ 65 ℃) ,使得它可以广泛用于突变与酶结构,酶活性关系方面的研究[6-7]。氨基酸残基E166是β-内酰胺酶penP的关键活性位点,其作为一般碱,与酶的水解活性密切相关[8]。本研究拟构建penP-E166C的突变质粒并纯化突变体蛋白,为今后的结构生物学实验提供蛋白来源。结构生物学实验将会进一步弄清影响β-内酰胺酶活性的关键氨基酸残基提供实验基础,为将来设计β-内酰胺酶抑制剂,逆转抗生素广谱耐药性提供重要的理论依据[9]。
1材料与方法
1.1菌株与质粒
感受态大肠杆菌DH5α和BL21DE3 购买自Invitrogen,包含Penp全长序列的质粒pRset-K_6xHis_TEV_PenP由本科室保存。
1.2主要仪器与试剂
梯度PCR仪( 美国Bio-Rad公司), 琼脂糖水平电泳仪( 北京市六一仪器厂),凝胶扫描成像系统( 美国Bio-Rad公司),蛋白质垂直电泳槽( 美国Bio-Rad公司) ,台式高速冷冻离心机( 德国Eppendorf公司),His-trapHP型镍离子亲和层析柱(美国GE公司),HiLoad16/60,superdex75 凝胶过滤色谱柱 (美国GE公司),AKTA快速蛋白纯化色谱仪(美国GE公司)。
PhuDNA聚合酶,BamHI,EcoRI限制性内切酶、T4DNA连接酶均为Fermentas产品、、琼脂糖凝胶DNA回收,质粒提取试剂盒购自上海桑尼生物科技有限公司产品。引物合成、质粒测序均委托北京六合华大基因科技有限公司完成。
1.3PCR介导的Penp基因体外定点突变
以pRset-K_6xHis_TEV_PenP为模板和table1中所列的引物,QuickChangeSite-DirectedMutagenesis试剂盒(Strategene)进行PCR介导的体外定点突变。PCR组分和反应程序见table2 和table3.PCR结束后加入1μLDpnⅠ酶消化原始模板。将消化后产物直接转化大肠杆菌感受态细胞E.coliDH5α,以含50μg/mL卡那霉素的LB平板筛选阳性克隆,突变子最终通过测序确定。
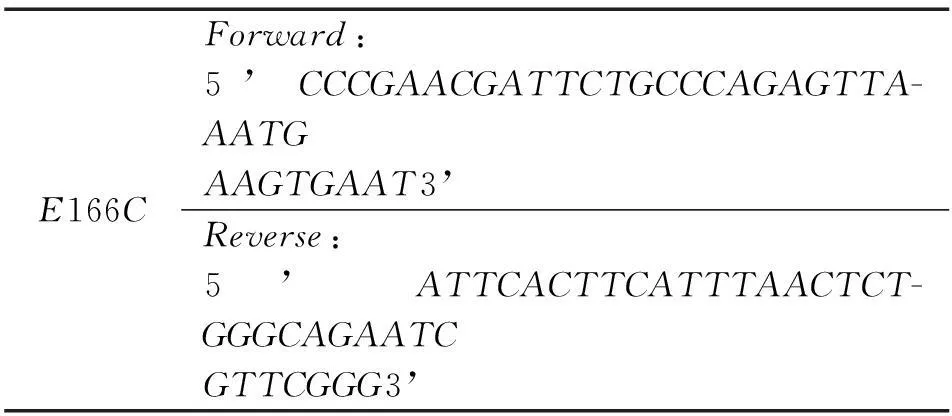
表1 引物列表

表2 PCR反应各组分配比

表3 PCR(聚合酶链式反应)反应程序
1.4重组蛋白质的诱导表达
将测序鉴定正确的突变型pRset-K_6xHis_TEV_PenP_E166C质粒转化大肠杆菌感受态细胞BL21DE3,37℃过夜培养后挑取单菌落到5mL含50μg/mL卡那霉素的LB液体培养基,37 ℃,250rpm孵育过夜。次日,按1∶100的比例接种至新鲜的含50μg/mL卡那霉素的LB液体培养基中培养至A600nm=0.5~0.7时,加入终浓度为0.5mmol/L的异丙基-β-D硫代吡喃半乳糖苷(IPTG),30 ℃诱导培养4h,离心收集菌体,置-80℃备用。
1.5Penp蛋白的纯化
1.5.1His-Trap亲和柱纯化融合蛋白6xHis_TEV_PenP_E166C
离心收集完成诱导的菌体,以50mL的冰预冷缓冲液(50mMTris,150mMNaCl,pH8.0,1mMPMSFand10mMbeta-mecaptoethanol,) 重悬菌体。冰浴超声裂菌20min,使融合蛋白完全释放。将超声破碎后的菌体悬液以20 000rpm/min4℃离心1h,收集上清,利用AKTA-FPLC系统纯化。首先将裂解上清液上到5mLHis-trapHP亲和柱上,然后用20倍柱体积平衡液(20mMsodiumphosphate,500mMNaCl,40mMimidazole,pH7.4)清洗纯化柱,再用洗脱液(20mMsodiumphosphate,500mMNaCl,500mMimidazole,pH7.4)洗脱6xHis_TEV_PenP_E166C融合蛋白。
洗脱液用超滤离心管浓缩至4mL,然后加入100μL蛋白水解酶TEV4℃酶切。酶切反应溶液再次上样到亲和色谱柱,6XHis标签将结合到镍柱,而目标蛋白将随washbuffer流出,收集含有目标蛋白的流出液,并浓缩样品至2mL。
1.5.2凝胶过滤层析色谱纯化目标蛋白PenP_E166C
首先,HiLoad16/60,superdex75层析柱连接到AKTA蛋白纯化系统,先后用120mL去离子水和缓冲液(50mMTris-Hcl,150mMNaCl,PH8.0)平衡;然后将2mL酶切后的样品上样,用上述缓冲液洗脱,洗脱速度为1mL/min,根据洗脱液的紫外吸收信号自动收集洗脱组分。目标组分浓缩,封装,液氮速冻后保存于-80℃冰箱。
2实验结果
2.1Penp—E166C突变体的构建和鉴定
以pRset-K_6xHis_TEV_PenP质粒为模板,分别利用携带突变碱基的引物对(table1),经PCR-介导的体外定点突变方法,获得目的片段约6kb大小的PCR产物。DpnI降解模板后转化感受态大肠杆菌DH5α,阳性单克隆抽提的质粒测序结果用Expasytranslate工具翻译成氨基酸序列(图1)显示突变体成功构建。

图1 6 xHis_TEV_PenP_E166 C的蛋白质序列
2.26 xHis_TEV_PenP_E166 C 融合蛋白的表达和纯化
利用pRset-K载体表达外源蛋白时,融合蛋白N端含有6XHis标签,可以利用Ni-NTA层析柱进行纯化。表达菌破碎后上清经亲和层析得到唯一的洗脱峰(图2)即为 6xHis_TEV_PenP融合蛋白。蛋白样品经12%SDS-PAGE电泳分析(图3),蛋白分子量经质谱检测为31.225kDa,与理论值一致(图4)。
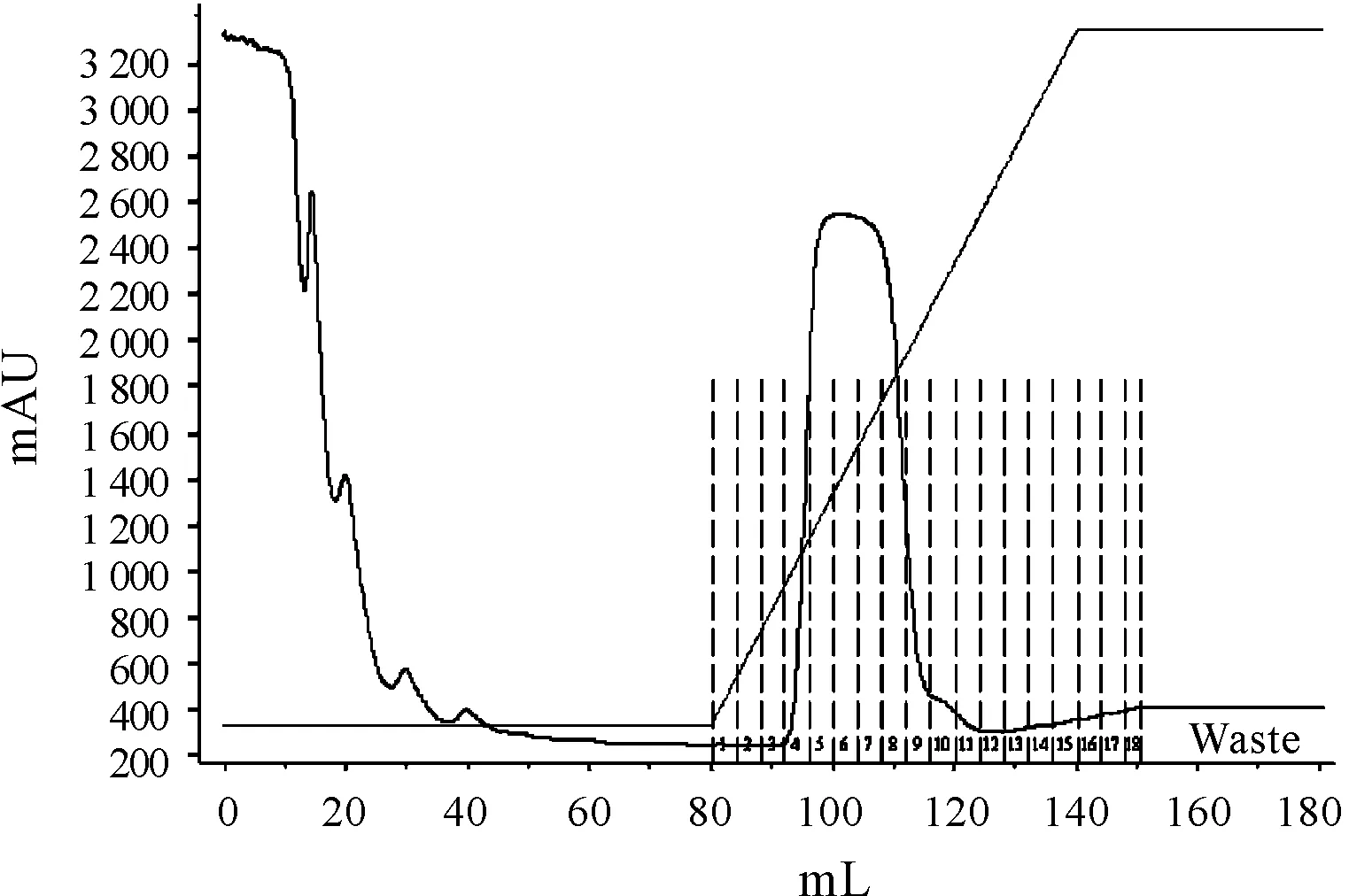
亲和色谱柱为 GE公司的 HiTrap镍柱,检测波长为280 nm。

泳道1是低范围分子量标记;泳道2是上样到柱上之前的样品;泳道3经由色谱柱流出的样品;泳道4是从柱上洗出未结合的蛋白;泳道5至10分别从柱上洗脱下来的不同组分
图312%聚丙烯酰胺凝胶电泳分析亲和层析
过程中的每个样品

图4 融合蛋白6 xHis_TEV_PenP_E166 C的质谱图
2.3目标蛋白 Penp_E166 C的纯化
由于在6XHis标签和目标蛋白PenP之间存在着proteaseTEV的酶切位点,可以利用TEV蛋白水解酶切下6XHis标签,酶切反应时间通过SDS-PAGE检测,发现6小时后反应完全基本水解 (图5)。酶水解反应物再一次通过Ni-NTA层析柱进行纯化,从而6XHis标签结合到亲和柱,而目标蛋白被洗脱(图6)。洗脱液浓缩后进一步通过凝胶过滤层析色谱柱,目标蛋白以单一峰从凝胶色谱柱上洗脱出来(图7),质谱结果显示蛋白的分子量为29.607Kda(图8),与理论分子量一致。
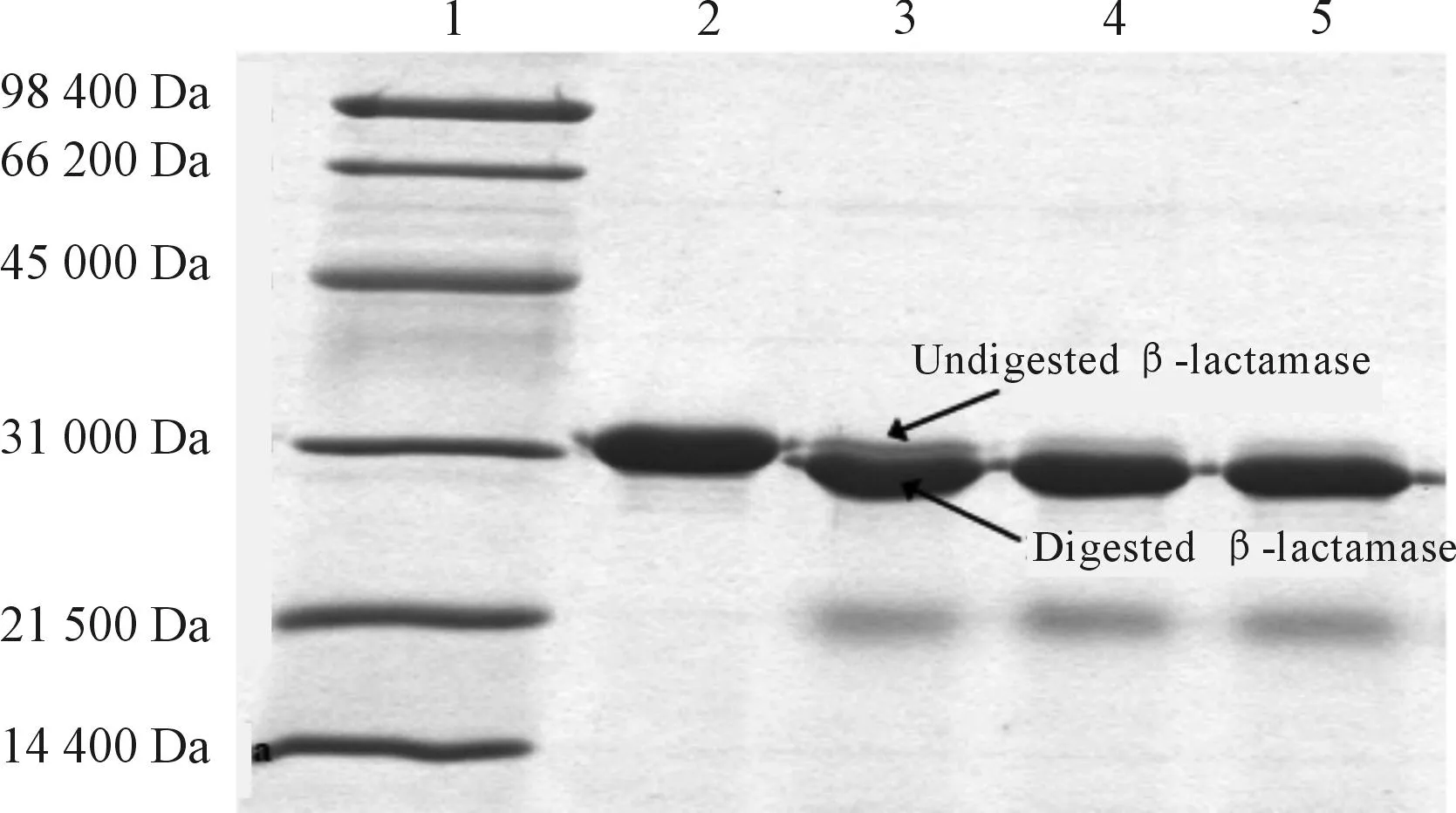
泳道1是低范围分子量标记;泳道2是未裂解的融合蛋白;泳道3至5分别是2、4、6小时酶切的样品
图512%聚丙烯酰胺凝胶电泳监测TVE不同时间点
酶切6xHis-TEV-penP的过程
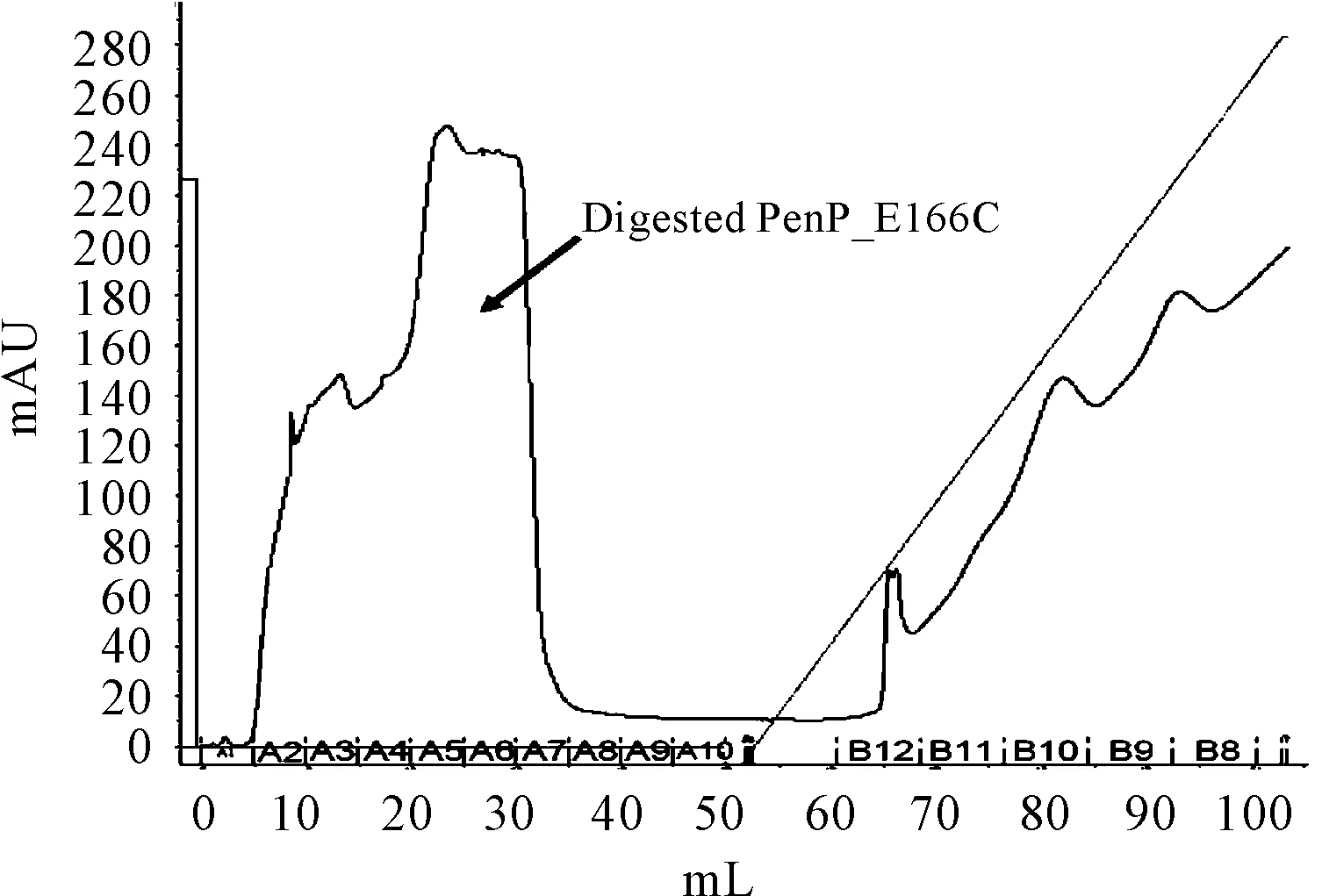
图6 目标蛋白 TEV_PenP_E166 C的洗脱曲线
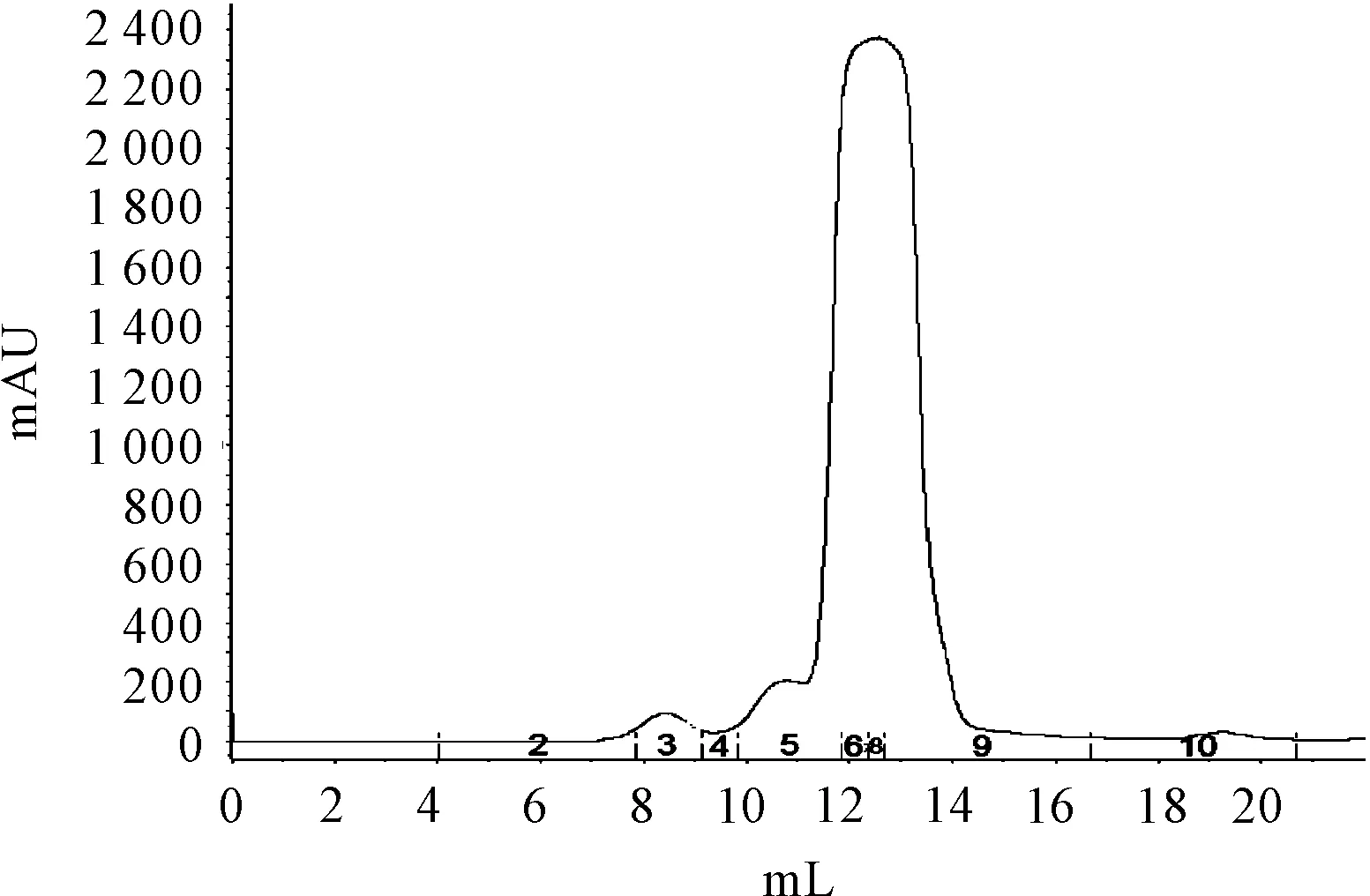
图7 目标蛋白 TEV_PenP_E166 C凝胶过滤层析曲线

图8 目标蛋白 PenP_E166 C的质谱图
3结论
本研究主要涉及β-内酰胺酶PenP的突变体PenP_E166C的质粒构建、原核表达、纯化和鉴定。利用PCR-介导的体外定点突变获得pRset-K_6xHis_TEV_PenP_E166C质粒,将其转化入大肠杆菌BL21(DE3)中,经IPTG诱导,超声裂解细菌后经Ni-NTA亲和柱层析柱获得融合蛋白6xHis_TEV_PenP_E166C,经TEV水解去除融合标签6xHis,经gelfiltration凝胶过滤层析色谱柱获得目标蛋白PenP_E166C。证实了在大肠杆菌表达系统中表达并获得高纯度PenP_E166C蛋白的可行性。
随着抗生素的使用日益增多,新的广谱β-内酰胺酶在世界各地不断被发现,其衍变规律还有待于进一步揭示。从分子水平上对β-内酰胺酶与抗生素相互作用的机制、产酶基因的结构和功能进行更深入研究。本课题获得的penP的活性位点突变体E166C,将用于培养酶-抗生素复合物的蛋白晶体,用X-射线晶体衍射仪分析复合物的三维结构[10]。此研究将从分子水平解释了靶标和药物之间的相互作用模式,对基于该靶标设计新型β-内酰胺类抗生素的研究起着重大作用。同时这些研究方法和结果对今后进一步研究其他型β-内酰胺酶家族以及其与β-内酰胺类抗生素尤其是第3代、第4代头孢菌素和单酰胺环类抗生素的相互作用机理提供了新的思路,也为解决临床新型抗生素的设计问题提供了参考[11]。
参考文献:
[1]张致平.β-内酰胺类抗生素研究的进展(Ⅰ)[J].中国抗生素杂志,2000(2).
[2]陈代杰.抗菌药物与细菌耐药性[M].上海:华东理工大学出版社,2000:70-89.
[3]GuignardB,EntenzaJM,MoreillonP.Beta-lactamsagainstmethicillin-resistantStaphylococcusaureus[J].CurrOpinPharmacol,2005,5(5):479-89.
[4]ChristianWoods,GeneColice.Methicillin-resistantStaphylococcusaureuspneumoniainadults[J].ExpertReviewofRespiratoryMedicine,2014,8(5):641-651.
[5]HakenbeckR,BrücknerR,DenapaiteD,etal.Molecularmechanismsofβ-lactamresistanceinStreptococcuspneumoniae[J].FutureMicrobiol.2012,7(3):395-410.
[6]Pérez-LlarenaFJ1,BouG.Beta-lactamaseinhibitors:thestorysofar[J].CurrMedChem.2009;16(28):3740-65.
[7]DrawzSM,BonomoRA.Threedecadesofbeta-lactamaseinhibitors[J].ClinMicrobiolRev.2010,23:160-201.
[8]DenizMeneksedag,AsligulDogan,PinarKanlikilicer,ElifOzkirimli.CommunicationbetweentheactivesiteandtheallostericsiteinclassAbeta-lactamases.ComputationalBiologyandChemistry.Volume43,April2013,Pages1-10.
[9]WorthingtonRJ,MelanderC,Overcomingresistancetoβ-lactamantibiotics[J].JOrgChem,78(9):4207-4213.
[10]ShaikhS,FatimaJ,ShakilS,etal.Antibioticresistanceandextendedspectrumbeta-lactamases:Types,epidemiologyandtreatment[J].SaudiJBiolSci,2015,22(1):90-101.
[11]LewandowskiEM1,SkibaJ,TorelliNJ,etal.AntibacterialpropertiesandatomicresolutionX-raycomplexcrystalstructureofaruthenoceneconjugatedβ-lactamaseantibiotic[J].ChemCommun(Camb),2015,24(28):6186.
(责任编辑何杰玲)
