一例猪伪狂犬病病毒的分离鉴定及综合防治措施
2015-12-22徐志文方和俊周远成
杨 凡,徐志文,李 萍,方和俊,郭 博,周远成
(四川农业大学动物医学院 动物生物技术中心,四川 成都 611134)
一例猪伪狂犬病病毒的分离鉴定及综合防治措施
杨 凡,徐志文*,李 萍,方和俊,郭 博,周远成
(四川农业大学动物医学院 动物生物技术中心,四川 成都 611134)
无菌采集疑似猪伪狂犬病病猪脑组织,进行病毒的分离鉴定。经PCR检测为阳性的病料接种PK-15细胞进行病毒分离,将所分病毒暂命名为SC株。蚀斑实验测定病毒滴度,并采用PCR和琼扩实验对其进行进一步鉴定。结果:PRV阳性病料接种PK-15细胞,传至第5代后产生稳定细胞病变,主要表现为细胞变圆、变亮、聚堆且可见典型的空斑,而对照组细胞贴壁生长良好;基于PRV gE基因的PCR检测,扩增产物为378 bp,与预期目的条带一致;用病毒蚀斑技术测定该分离株的滴度为2.65×104PFU/mL;琼扩实验显示病毒原液至32倍稀释后均能与PRV阳性血清形成可见沉淀线。以上结果均表明所送检病猪为PRV阳性,据此为猪场提出综合防治措施。
猪伪狂犬病病毒;分离鉴定;蚀斑实验;琼扩实验;综合防治
猪伪狂犬病是由伪狂犬病病毒(PRV)引起的多种家畜和野生动物共患的一种急性传染病。病猪以新生仔猪的急性死亡,4周龄以上的仔猪出现呕吐、神经症状和妊娠母猪流产、产死胎及呼吸道症状为主要特征,可能引起人的轻微感染[1-3]。伪狂犬病的首次发现追溯到1813年的美国牛群中,随后蔓延分布至全世界。1947年,我国首次报道PRV,目前该病已在国内广泛流行。本病尚无有效治疗的药物,只能靠接种疫苗预防,给养猪业带来了巨大的经济损失[4]。2015年3月,四川崇州某规模化猪场出现疑似伪狂犬病症状病猪,剖检发现患病猪扁桃体、肝和脾均有散在的白色坏死点,肾脏有针尖大小出血点,且出现神经症状的病猪脑脊液增多。本研究拟采集发病猪脑组织,进行基于PRV gE基因的PCR检测,经PCR检测为阳性的病料接种PK-15细胞开展病毒分离,并将分离所得病毒株再次进行PCR检测,用蚀斑实验测定该病毒株的滴度,采用琼扩实验对该病毒进一步鉴定[5-9]。最后,根据相应诊断结果提出综合防治措施。
1 材料和方法
1.1 实验材料
1.1.1 病料采集
无菌采集崇州某猪场疑似PRV发病仔猪脑组织,经研钵研磨后,加PBS配制1:5组织悬液,-20 ℃冻存。
1.1.2 实验试剂
1 000单位双抗;猪肾传代细胞(PK-15)由实验室保存;新生犊牛血清、DMEM细胞培养液购自Gibco公司;营养液(含10% 犊牛血清)、维持液(含2% 犊牛血清)、无钙镁水;饱和酚、氯仿、异丙醇、25% 冰乙醇;PRV阳性血清、PCR试剂盒等。
1.2 实验方法
1.2.1 总DNA提取
取出冻存的组织悬液,-20 ℃和37 ℃,反复冻融3次,12 000 r/min 离心5 min;取400 µL上清液于无菌EP管中,加入500µL饱和酚,混匀,静置5 min,4 ℃,12 000 r/min离心5 min;取上清,加入酚、氯仿各200 µL,混匀,静置5 min,4 ℃,12 000 r/min离心5 min;取上清,加入酚、氯仿各200µL,混匀,静置5 min,4 ℃,12 000 r/min离心5 min;取上清,加入400µL氯仿,混匀,静置5 min,4 ℃,12 000 r/min离 心5 min;取上清,加入2倍体积异丙醇,轻摇约2 min,室温静置15 min,4℃,12000r/min离心15 min;弃上清液,加入1 mL 25% 冰乙醇洗涤沉淀及管壁,4 ℃,12 000 r/min离心5 min;弃上清液,室温干燥沉淀后加入35µL ddH2O溶解,-20 ℃保存备用。同时,提取正常细胞的DNA做阴性对照。
1.2.2 病料PCR检测
根 据GenBank上 发 表 的PRV gE基因保守序列设计合成1对引物,上游引物:5’-TGCTCG TGATGACCCACAAA-3’;下游引物:5’-TGTACACCGGCGAGAGCAT -3’,预期目的片段大小为378 bp。引物序列送至宝生物工程(大连)有限公司合成。
以提取的病毒DNA和正常细胞DNA为模板,按照下列PCR体系(10µL体系)进行扩增(见表1)。
反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火35 s,72 ℃延伸35 s,总共35个循环;72 ℃总延伸7 min;4 ℃保存。PCR产物经1% 琼脂糖凝胶电泳,凝胶成像系统观察记录实验结果。

表1 PCR扩增体系
1.2.3 病毒分离
取出冻存的组织悬液,反复冻融3次,离心取上清, 每1 mL上清液加1 000单位双抗,置4 ℃处理过夜。
观察培养的PK-15细胞生长状况,当贴壁铺满单层,弃去培养液,无钙镁水洗2~3次,每瓶接种600µL处理好的组织悬液,对照组加入等量培养液。37 ℃吸附作用1 h,在此期间每隔15 min轻轻摇晃细胞瓶,使细胞和病毒液充分接触。每瓶加入4 mL维持液,37 ℃恒温培养箱培养。当细胞病变达70%以上时收毒,即-20 ℃和37 ℃反复冻融3次,3 000 r/min离心15 min,取上清。将收取的病毒液继续接种PK-15单层细胞传代培养,先盲传3代,直至产生稳定的细胞病变,收毒,-70 ℃冻存。
1.2.4 病毒PCR检测
按1.2.1步骤,用酚、氯仿法抽提第5代、第7代病毒液总DNA,进行猪伪狂犬病病毒的PCR检测。同时,应用本实验室建立的猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪乙型脑炎病毒(JEV)RT-PCR检测方法和猪细小病毒(PPV)、猪圆环病毒2型(PCV2)PCR检测方法,对第7代病毒液进行外源性病毒检测。
1.2.5 蚀斑实验
将六孔培养板中各孔已长满单层细胞的的营养液吸弃,并将第7代病毒液连续进行10倍稀释,选取10-2稀释度,接种于六孔板各孔,每孔0.2 mL,轻轻摇动使病毒液均匀分布于细胞表面;置37 ℃的恒温培养箱培养,吸附1 h后,加入1% 甲基纤维素培养基,使其均匀覆盖于细胞表面;置37℃恒温培养箱中,培养2~7 d;将覆盖的甲基纤维素吸出弃之,用5%福尔马林-1%结晶紫固定染色液固定和染色感染细胞,每孔加入1 mL;20 min后,用水冲洗,观察细胞生长状况,记录蚀斑个数。
1.2.6 琼扩实验
用PBS配制1%琼脂液,倒于平板内制成凝胶。取打孔器在琼脂凝胶上打梅花孔,孔径为2 mm,中央孔与周围孔间距约3 mm。将病毒液作2倍倍比稀释,即1∶1、1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256。中央孔滴加PRV阳性血清,周围孔分别滴加稀释后的病毒液。试验设立对照组,中央孔滴加PRV阳性血清,周围各孔均滴加等量的稀释液。保持一定湿度,37 ℃恒温培养箱扩散24 h,观察记录沉淀线情况。
2 实验结果
2.1 病料PCR检测
用组织悬液抽提得到的DNA为模板,进行PCR引物扩增,设立PRV阴性和阳性对照,产物经1% 琼脂糖凝胶电泳检测,以DNA Marker DL 2 000为标准,病料模板PCR扩增产物大小近似378 bp,扩增出的特异性片段与预期的大小一致(图1)。
2.2 病毒分离

图1 病料PCR产物电泳结果

图2 PRV分离株在PK-15细胞上的变化
经处理的PCR检测为阳性的送检病猪病料,接种PK-15细胞,盲传3代未见明显细胞病变。传至第4代,接毒后46 h可见部分细胞变圆、变亮、脱落形成典型的空斑,对照组无细胞变圆、脱落;病毒传至第5代以后,感染后38 h均可见80%左右细胞产生病变,主要表现为细胞变圆、变亮、聚堆且细胞病变初可见典型的空斑,即在PK-15细胞上产生稳定细胞病变,对照组细胞贴壁良好,无明显细胞病变(图2)。
2.3 病毒PCR检测
用第5、第7代病毒液抽提得到的DNA为模板,进行PCR引物扩增,设立PRV阴性和阳性对照,产物经1% 琼脂糖凝胶电泳检测,以DNA Marker DL2 000为标准,病毒液模板PCR扩增产物大小近似378 bp,扩增出的特异性片段与预期的大小一致,而外源性病 毒:CSFV、PRRSV、JEV、PPV、PCV2检测均为阴性(图3)。
2.4 蚀斑实验
将收获的第7代病毒液稀释后,选择10-2稀释度接种PK-15细胞,接种后于37 ℃培养箱避光培养5 d,观察并记录蚀斑个数,测得六孔板中平均每孔形成53个蚀斑,则病毒悬液的蚀斑形成单位为2.65 ×104PFU/mL,即每1 mL病毒液滴度为2.65×104PFU(图4)。
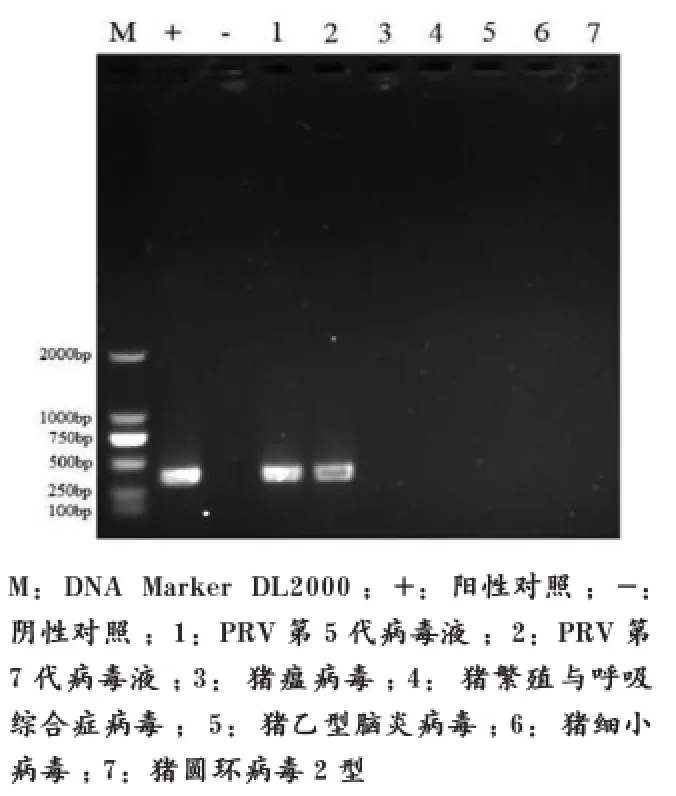
图3 病毒PCR产物电泳结果

图4 蚀斑实验结果
2.5 琼扩实验
将病毒液作2倍倍比稀释,实验组中央孔滴加PRV阳性血清,周围孔分别滴加稀释后的病毒液。对照组中央孔滴加PRV阳性血清,周围孔滴加等量的病毒稀释液。结果发现:病毒原液至32倍稀释均可见抗原抗体沉淀带,从64倍稀释度开始未见沉淀带。对照组中均未见抗原抗体沉淀带(见图5)。

图5 琼扩实验结果图
3 结果讨论
目前,我们已掌握许多对猪伪狂犬病病毒进行分离鉴定的方法,比如聚合酶链式反应(polymerase chain reaction,PCR)、蚀斑实验(plaque formation test)、琼脂凝胶免疫扩散实验(agar gel immunodiffusion test,AGID)等。PCR技术又称为体外基因扩增技术,诞生于1985年。Belak等应用gB基因引物率先建立了检测PRV的PCR方法,检测PRV与其他猪病毒病的多重PCR方法在近年也相继建立。PCR具有敏感、快速、特异性强等优点,还能活体检测大批量样品,目前在病毒鉴定上已经得到广泛运用[5,6];AGID最早的应用是在1905年为研究利泽甘氏现象,1932年应用于细菌菌株的鉴定。Oudin于1946年在试管中进行了琼扩实验,对抗原混合物进行分析。Elek和 Ouchterlony于1948年分别建立了琼脂双向双扩散法,可以同时鉴定、比较2种以上抗原或抗体,并对免疫扩散的理论依据相继进行了研究。琼扩试验操作简单、快捷,较适用于现场定性诊断和猪群阴性无感染者的普查,但结果易受pH、温度等影响[7]。
PRV广泛分布于机体各组织脏器中,比如扁桃体、肝脏、脾脏、肺和肾脏,但感染量以脑部三叉神经节居多,因此实验中主要采集病猪脑组织进行病毒的分离培养[10-11]。PRV具有泛嗜性,能在许多细胞中增殖,其中以ST细胞和PK-15细胞最敏感,在接种后24~72 h可出现典型的细胞病变,其次是BHK-21、MDBK、CEF等细胞。试验中常用PK-15、BHK-21、MDBK等传代细胞系分离培养该病毒[12]。
本实验从病猪脑组织分离得到1株PRV,对该株病毒进行PCR 检测、蚀斑实验、琼扩实验后,证实该分离是成功的。针对以上实验结果,对猪场建议主要包括以下几个方面。第一,立即淘汰出现相应临床特征的猪群,尤其是仔猪和种猪,同时采用2%~3%氢氧化钠或熟石灰对相应圈舍地面、墙壁及周围场地进行严格消毒处理。第二,抽取猪场中所有猪只血样,并标记清楚。用PRV gE抗体检测试剂盒进行抗体检测,淘汰检测结果呈阳性的全部猪只,阴性猪只进行严格隔离饲养。对测定结果为可疑的猪只先实行隔离饲养,然后重新采血检测,根据检测结果作出相应处理。第三,采集隔离饲养的所有健康猪群血样,进行PRV gB抗体检测,对所有阴性猪只紧急接种弱毒疫苗。第四,完善饲养管理制度。严禁从PRV阳性猪场引种,对待引进猪只采血检测,确定为阴性后方可引进,最好自繁自养。猪群尽量做到全进全出。猪场实行封闭式管理,外来人员必须经过相应消毒措施处理,隔离3 d后才可进入生产区。圈舍和周围场地平时严格消毒,做好清洁卫生。针对不同生长阶段的猪群,合理搭配日粮。第五,制定合理免疫程序。仔猪出生3日龄后进行伪狂犬病疫苗滴鼻免疫,5~6周龄时肌肉注射1头份,种公猪每半年普免1次,母猪产前3个月普免1次[13]。
[1] 谭诗文,冉懋韬,余波,等.伪狂犬病的研究进展[J].上海畜牧兽医通讯,2012 (3): 14-17.
[2] 李春华,王英,蒋凤英,等.猪伪狂犬病研究进展[J]. 动物医学进展, 2008,29(3): 68-72.
[3] 周泰冲.猪伪狂犬病毒对人的感染性问题(综述)[J].中国兽医杂志,1987,13(1): 44-47.
[4] 杨毅, 李文刚, 饶宝, 等. 猪伪狂犬病疫苗的研究进展[J]. 江西农业学报,2010, 22(3): 154-157.
[5] 赵丽, 崔保安, 方忠意, 等. PCR 检测猪伪狂犬病病毒方法的研究[J]. 中国预防兽医学报, 2007, 29(2): 142-146.
[6] 王勤,郭万柱.猪伪狂犬病 gE 基因的研究进展[J].畜牧兽医杂志,2002,21(5): 18-20.
[7] 代明娟.应用琼脂免疫扩散试验检测猪伪狂犬病[J].黑龙江畜牧兽医,2002 (7): 40.
[8] 杨庆芳, 宁官保, 李俊达. 猪伪狂犬病病毒的分离鉴定[J]. 山西农业科学,2011, 39(8): 886-889.
[9] 王小玉, 李小欢, 郭万柱, 等. 猪伪狂犬病病毒四川株的分离鉴定及UL43基因序列分析[J]. 畜牧与兽医, 2010,42(10): 1-10.
[10] Cheung A K. Investigation of pseudorabies virus DNA and RNA in trigeminal ganglia and tonsil tissues of latently infected swine[J]. AM J VET RES, 1995, 56(1): 45-50.
[11] Brown J R T, Shin K, Fuller F.Detection of pseudorabies viral DNA in tonsillar epithelial cells of latently infected pigs[J]. AM J VET RES,1995, 56(5): 587-594.
[12] 彭丽英, 倪建平, 张婉华, 等. 猪伪狂犬病病毒在不同细胞中增殖的研究[J].上海农业学报,2012,27(4):67-69.
[13] 宋胜敏,孙秀月,郑晓君,等.猪伪狂犬病的防治[J].山东畜牧兽医,2005(5): 26-27.
2015-09-02)
四川省科技成果转化项目(2013NC0014);四川省科技支撑计划(2013NZ0016)
杨凡(1992-),男,四川南充人,在读硕士研究生,主要研究方向为动物传染病病原分子生物学。E-mail:abtcyf@126.com
徐志文,教授,博士,预防兽医学。E-mail:abtcxzw@126.com
