固相萃取柱净化-高效液相色谱法测定小麦中脱氧雪腐镰刀菌烯醇
2015-12-21罗颖鹏陈正行罗小虎李永富李亚男邵慧丽
罗颖鹏,陈正行,王 韧,罗小虎,李永富,李亚男,邵慧丽,王 莉*
(江南大学食品学院,粮食发酵工艺与技术国家工程实验室,食品科学与技术国家重点实验室,江苏 无锡 214122)
固相萃取柱净化-高效液相色谱法测定小麦中脱氧雪腐镰刀菌烯醇
罗颖鹏,陈正行,王 韧,罗小虎,李永富,李亚男,邵慧丽,王 莉*
(江南大学食品学院,粮食发酵工艺与技术国家工程实验室,食品科学与技术国家重点实验室,江苏 无锡 214122)
建立固相萃取-高效液相色谱对小麦中脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)进行测定的方法。从提取溶剂、净化方式、流动相组成以及流动相流速等条件优化DON检测方法。结果表明,当样品提取溶剂为乙腈-水(84∶16,V/V),Bond Elut Mycotoxin固相萃取柱净化,流动相组成为乙腈-水(6∶94,V/V),流速为0.9 mL/min时,DON检测结果最好,该检测方法的DON回收率达到90.12%~106.25%,日内和日间相对标准偏差分别为4.51%和6.12%。该方法快速、准确,重复性好,稳定性高,适合DON污染小麦样品的大批量检测。
脱氧雪腐镰刀菌烯醇;小麦;高效液相色谱;固相萃取;检测
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)又称呕吐毒素,是镰刀菌属的禾谷镰刀菌和黄色镰刀菌等的次级代谢产物,是真菌毒素常见的一种,其广泛存在于小麦、大麦、玉米等粮食作物中,每年全世界谷物类粮食都受到DON的困扰,造成了极大的经济损失[1-2]。人和动物长期大量摄入DON可抑制蛋白质的合成,造成呕吐、腹泻、厌食、恶心、神经紊乱等毒性效应[3-5]。DON的性质十分稳定,烘焙、高温、高压等食品加工方法对它的影响很小,120 ℃的高温仍然不能使其降解,当温度升高到210 ℃处理30~40 min才能被破坏[6-7]。为减少DON对人类的危害,目前很多地区和国家都制订了相应的标准来限制粮食中DON的含量,我国和联合国粮农组织规定食用粮中DON的限量为1 mg/kg[8]。
小麦是我国主要粮食作物,但由于收获、储藏和气候等原因,容易被DON等真菌毒素污染[9-10]。熊凯华等[11]调查表明,安徽省和河南省小麦中的DON检出率分别为76.7%和75.3%,其他省份的DON检出率也有60%。针对粮食或饲料中的DON污染严重,迄今有一系列的检测方法,常用的有气相色谱法[12]、高效液相色谱(high performance liquid chromatography,HPLC)法[13-15]以及酶联免疫吸附测定法[16],另外还有薄层色谱法[17]和荧光法[18]等。
目前DON的检测方法研究较多,但实际应用较少,主要原因是分析方法灵敏度相对较低、分析速度较慢、溶剂消耗量大、很难定量测定[19-20]。因此,建立一个快速、简便、有效的DON检测方法是很有必要的。本实验在优化小麦中DON的提取和净化条件的基础上,进一步优化了HPLC检测过程中不同流动相组成与配比、流速等条件,研究出适宜快速提取检测小麦中DON方法。
1 材料与方法
1.1 材料与试剂
DON污染与未污染小麦 合肥市购;乙腈(色谱纯) 美国Fisher公司;超纯水(电阻≥18.2 MΩ);DON标准品(纯度≥99.8%) 百灵威科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
1260系列HPLC仪带紫外检测器、ZORBAX SB C18色谱柱、Bond Elut Mycotoxin(BEM)固相萃取柱 美国Agilent科技有限公司;MycoSep 227#固相萃取柱 美国Romer Labs公司;DCY-12G型氮吹仪 青岛海科仪器股份有限公司;Simplicity UV型超纯水仪 美国Millipore公司;BSA124S-CW分析天平 赛多利斯科学仪器(北京)有限公司;SHZ-B型水浴恒温振荡器 上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 呕吐毒素标准溶液的配制
准确称取5.00 mg的DON标准品(精确至0.01 mg),将其用色谱纯甲醇溶解,得到质量浓度为100 μg/mL的DON标准储备液,-20 ℃保藏;取1 mL的DON标准储备液,50 ℃氮气吹干,流动相配成0.10、0.20、0.40、0.80、1.00、5.00、10.00 μg/mL的系列标准工作液。
1.3.2 样品前处理
样品提取:取25.00 g过30 目筛的小麦样品到250 mL锥形瓶中,加入100 mL乙腈-水(84∶16,V/V)溶液,40 ℃水浴恒温200 r/min振荡30 min,样品过滤。
样品净化:将DON样品提取液滤液加入到固相萃取柱中,待提取液滤过固相萃取柱后,取5 mL净化液50 ℃条件下N2吹干,残余物用1 mL乙腈-水(6∶94,V/V)复溶,涡旋30 s。再用0.22 μm有机滤膜过滤,2 mL进样瓶收集滤液,样品待测。
1.3.3 HPLC条件
色谱柱:Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm);柱温:30 ℃;紫外检测器检测波长:218 nm;流动相:乙腈-水(6∶94,V/V);流速:0.9 mL/min;进样量:20 μL。
1.4 数据统计分析
2 结果与分析
2.1 样品的提取
研究[13,21]表明,食品中DON易溶于水、甲醇、乙醇、乙腈、丙酮和乙酸乙酯等极性溶剂。由于乙酸乙酯、丙酮等毒性较大,而乙醇等容易将样品中杂质溶解出[15]。本研究以小麦为基质,分别采用水、乙腈、甲醇和不同比例的乙腈-水、甲醇-水作为提取溶剂,同时在样品中添加DON标准品,通过计算各提取溶剂的加标回收率比较不同溶液的提取效率。结果表明,纯水提取时DON回收率较高,但纯水提取的样品检测时,杂质对目标物干扰较大,且样品经固相萃取柱净化后,回收率大大降低;而乙腈-水(84∶16,V/V)提取时,回收率与纯水相比,没有显著差别,但乙腈-水体系沉淀样品中蛋白质等干扰物的效果优于纯水,且样品经MycoSep 227#和BEM固相萃取柱净化后,回收率依然良好。因此,本实验确定乙腈-水(84∶16,V/V)为样品提取液。
2.2 样品的净化
目前,样品溶液中DON净化方式主要有固相萃取柱和免疫亲和柱(immuno affinity column,IAC)净化[22-23]。由于固相萃取柱操作简便、成本较低、能有效分离杂质和目标物损失较小,目前最为常用[24]。本研究比较MycoSep 227#和BEM这两种固相萃取柱对样品的净化效果,结果如图1所示。从图1可以看出,未净化样品的色谱图杂峰多,严重干扰了DON的定量。而样品经MycoSep 227#和BEM净化,目标峰两边的杂峰都明显减少,干扰减少,测定结果更准确。Moazami等[22]研究了4 种净化方式,其中使用MycoSep 227#净化柱的DON回收率只有53%;而Stecher等[25]用MycoSep 227#净化样品,回收率达到了93.84%,造成上述结果差异显著的原因可能是所用提取溶剂不同而造成的。本研究中的MycoSep 227#与BEM柱净化效果相比,回收率分别为87.96%和92.30%,BEM净化效果较好,回收率较高,且成本较低。因此选用BEM净化柱。
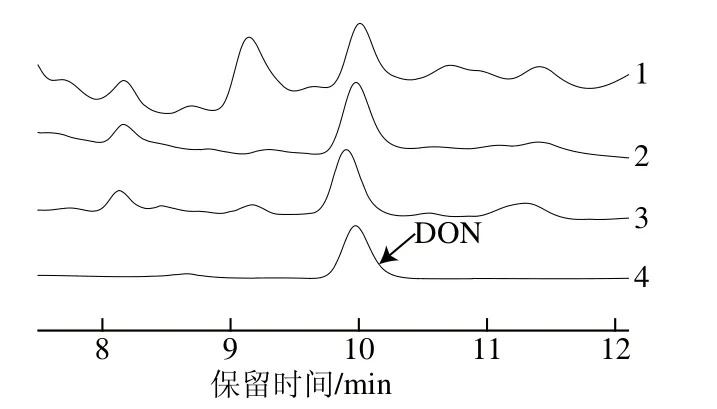
1.未净化;2. MycoSep 227#柱净化;3. BEM柱净化;4. DON标准品。
2.3 流动相的选择优化
流动相是影响目标物分离效果的重要因素,根据DON易溶于极性溶剂,本实验选用反相色谱常用的流动相水、乙腈、甲醇,研究不同比例的水-乙腈-甲醇体系下的分离效果[24,26-27]。根据目标物峰面积、保留时间、峰形等因素确定最佳的流动相比例。如图2所示,流动相中水的比例越大,目标物的保留时间越长,与杂质的分离程度越高,当流动相为乙腈-水(6∶94,V/V),灵敏度和分离度良好。且从图3可看出,当流动相为乙腈-水(6∶94,V/V)时,DON峰面积显著高于其他流动相,表明该流动相条件下能更灵敏的测定目标物。因此,本研究选用乙腈-水(6∶94,V/V)为检测小麦中的DON含量流动相。
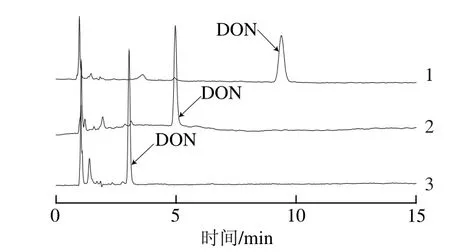
图2 不同流动相组成的DON样品色谱图Fig.2 DON chromatograms with different mobile phases
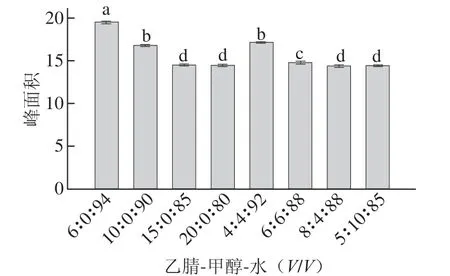
图3 不同流动相DON检测结果Fig.3 Recovery of DON with different mobile phases
2.4 流动相流速的选择
流动相流速也显著影响样品中DON的分离检测[26,28-29]。本实验结合前人研究结果,选择流速为0.8~1.1 mL/min进行研究,结果图4所示,当流速为0.9 mL/min时,目标物受杂质影响小,分离效果最好,峰面积显著高于其他流动相流速。因此本研究选择流动相流速为0.9 mL/min。
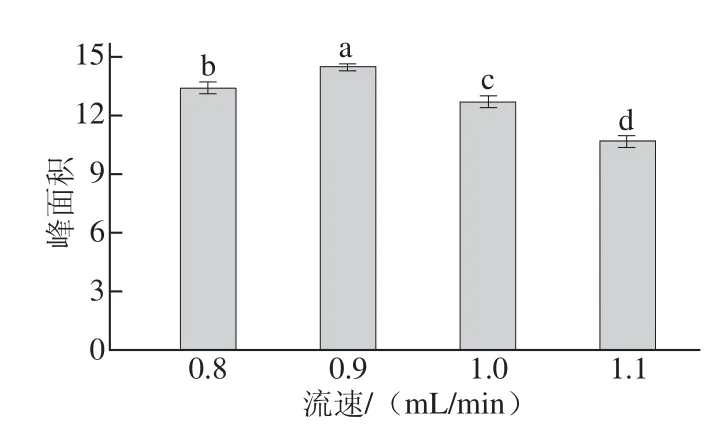
图4 流动相流速对DON检测结果的影响Fig.4 Effect of different fl ow rates of mobile phase on DON recovery
2.5 标准曲线的绘制
移取适量标准工作溶液(0.10、0.20、0.40、0.80、1.00、5.00、10.00 μg/mL),每一质量浓度测定5 次,根据DON的保留时间定性,以测得的峰面积为纵坐标(Y),进样质量(ng)为横坐标(X),制作标准曲线,得回归方程为Y=1 497.990X+0.494,R2=0.999,线性范围为2~200 ng。
2.6 检测限与定量限
根据峰高法以3 倍信噪比的峰响应值作为最低检测线,10 倍的信噪比的峰响应值作为最低定量限进行计算,得出此方法的最低检测限为60 μg/kg,最低定量限200 μg/kg,符合实际分析的要求。
2.7 回收率与精密度
取未污染DON的小麦样品,分别配成500、1 000、2 000 μg/kg的DON加标样品,按前述样品前处理方法处理后,在上述液相色谱检测条件下进行测定,每个加标样做3 个重复,得到方法的回收率。将加标量为1 000 μg/kg的样品每天提取3 次,重复3 d,测定方法的日内和日间精密度。其结果见表1,样品的加标回收率在90.12%~106.25%之间,日内和日间相对标准偏差(relative standard deviation,RSD)分别为4.51%和6.12%。本方法与现有文献[6,13,26-28,30-31]相比,也有着较高回收率,较低检测限等优点(表2)。按前述方法制备DON加标样品,采用GB/T 23503—2009《食品中脱氧雪腐镰刀菌烯醇的测定:免疫亲和层析净化高效液相色谱法方法》测定加标样品回收率、日内和日间精密度结果表明,与GB/T 23503—2009相比,本研究方法在测定小麦中DON时,也具有较高的回收率和较低的RSD,且本研究方法操作较简便,成本较低。
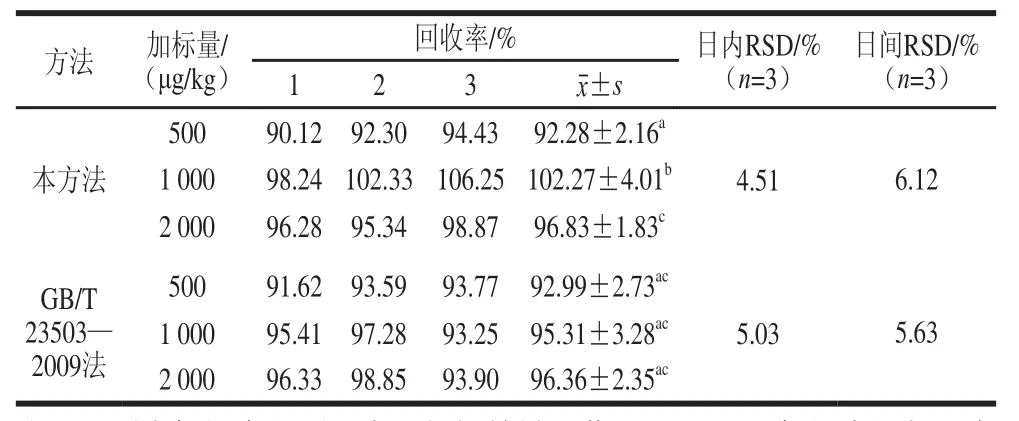
表1 本方法与GB/T 23503—2009方法样品加标回收率与精密度实验结果Table1 Recoveries and precision of this method and GB/T 23503—2009
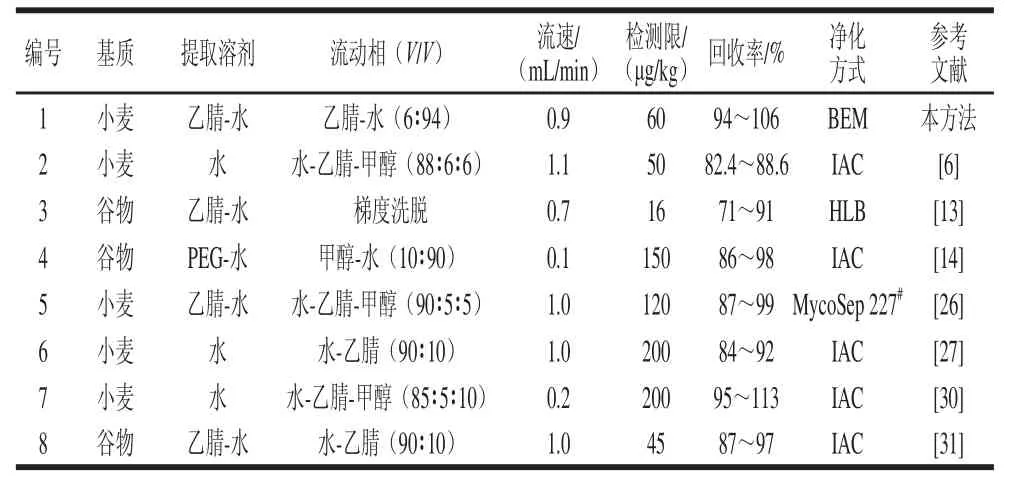
表2 本方法与其他液相色谱方法对比Table2 Comparison of this method with other HPLC methods in the literature
3 结 论
本研究考察了小麦样品中DON的提取溶剂、净化方式、流动相组成以及流动相流速对DON检测结果的影响,结果当提取溶剂为乙腈-水(84∶16,V/V),BEM固相萃取柱净化,流动相为乙腈-水(6∶94,V/V),流速为0.9 mL/min时,HPLC-紫外检测器对DON的分离检测效果最好。该方法在测定小麦样品中的DON时,具有良好的线性范围及检测限,且方法经回收率、日内和日间精密度考察,重复性和稳定性良好。该方法操作简便、快速准确,适合大批量污染DON的小麦样品检测。
[1] 孙长坡, 代岩石, 王松雪, 等. 利用生物技术防控、消减粮食及其制品中的真菌毒素[J]. 中国粮油学报, 2009, 24(11): 97-101.
[2] JAJIĆ I, KRSTOVIĆ S, KOS J, et al. Incidence of deoxynivalenol in serbian wheat and barley[J]. Journal of Food Protection, 2014, 77(5): 853-858.
[3] YANG Wei, YU Miao, FU Juan, et al. Deoxynivalenol induced oxidative stress and genotoxicity in human peripheral blood lymphocytes[J]. Food and Chemical Toxicology, 2014, 64: 383-396.
[4] SHAR Z H, SUMBAL G A, SHERAZI S T H, et al. Natural cooccurrence of aflatoxins and deoxynivalenol in poultry feed in Pakistan[J]. Food Additives and Contaminants Part B: Surveillance, 2014, 7(3): 162-167.
[5] PIETSCH C, SCHULZ C, ROVIRA P, et al. Organ damage and hepatic lipid accumulation in carp (Cyprinus carpio L.) after feedborne exposure to the mycotoxin, deoxynivalenol (DON)[J]. Toxins, 2014, 6(2): 756-778.
[6] KARAMI-OSBOO R, MAHAM M, MIRI R, et al. Evaluation of dispersive liquid-liquid microextraction-HPLC-UV for determination of deoxynivalenol (DON) in wheat fl our[J]. Food Analytical Methods, 2013, 6(1): 176-180.
[7] 付杨, 李洪军, 贺稚非, 等. 脱氧雪腐镰刀菌烯醇研究进展[J]. 食品科学, 2011, 32(21): 289-292.
[8] 罗雪云, 李凤琴, 刘秀梅, 等. GB 2761—2011 食品中真菌毒素限量[S]. 北京: 中国标准出版社, 2011.
[9] 孙秀兰, 邵景东, 王俊双. 粮油食品中呕吐毒素危害及风险分析[J].粮食与油脂, 2007(3): 41-43.
[10] 杨史良, 程波财, 郭亮, 等. 粮食饲料中的真菌毒素污染及微生物清除毒素的研究进展[J]. 中国粮油学报, 2008, 23(3): 214-218.
[11] 熊凯华, 胡威, 汪孟娟, 等. 安徽河南粮食中脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮的污染调查[J]. 食品科学, 2009, 30(20): 265-268.
[12] SHAR Z H, SUMBAL G A, SHERAZI S T H, et al. Determination of deoxynivalenol in poultry feed by three gas chromatographic detection techniques[J]. Chromatographia, 2014, 77(3/4): 337-346.
[13] YANG D, GENG Z M, YAO J B, et al. Simultaneous determination of deoxynivalenol, and 15-and 3-acetyldeoxynivalenol in cereals by HPLCUV detection[J]. World Mycotoxin Journal, 2013, 6(2): 117-125.
[14] 谢刚, 王松雪, 张艳. 粮食中呕吐毒素含量的免疫亲和柱净化超高效液相色谱法快速测定[J]. 分析测试学报, 2011, 30(12): 1362-1366.
[15] 黄娟, 陈国松, 张晓燕, 等. 固相萃取-高效液相色谱-串联质谱法检测粮食及其制品中的呕吐毒素[J]. 色谱, 2012, 30(11): 1203-1207.
[16] LI YanShen, SHI Weimin, SHEN Jianzhong, et al. Development of a rapid competitive indirect ELISA procedure for the determination of deoxynivalenol in cereals[J]. Food and Agricultural Immunology, 2012, 23(1): 41-49.
[17] ANAYA I, VENTURA M, AGUT M, et al. Rapid screening method for deoxynivalenol, T-2 toxin and diacetoxyscirpenol in maize-based foods by thin layer chromatography[J]. Afi nidad, 2004, 61: 124-128.
[18] FUJITA K, TSUTA M, KOKAWA M, et al. Detection of deoxynivalenol using fl uorescence excitation-emission matrix[J]. Food and Bioprocess Technology, 2010, 3(6): 922-927.
[19] 张宇昊, 杨琳, 马良. 真菌毒素同时检测方法研究进展[J]. 中国粮油学报, 2011, 26(6): 123-128.
[20] 褚庆华, 郭德华, 王敏, 等. 油料和食用油中真菌毒素快速测定方法的研究[J]. 中国粮油学报, 2006, 21(2): 114-120.
[21] ROMAGNOLI B, FERRARI M, BERGAMINI C. Simultaneous determination of deoxynivalenol, zearalenone, T-2 and HT-2 toxins in breakfast cereals and baby food by high-performance liquid chromatography and tandem mass spectrometry[J]. Journal of Mass Spectrometry, 2010, 45(9): 1075-1080.
[22] MOAZAMI E F, JINAP S. Optimisation of the determination of deoxynivalenol in wheat flour by HPLC and a comparison of four clean-up procedures[J]. Food Additives and Contaminants Part A: Chemistry Analysis Control Exposure and Risk Assessment, 2009, 26(9): 1290-1297.
[23] SUGITA-KONSIHI Y, TANAKA T, TABATA S, et al. Validation of an HPLC analytical method coupled to a multifunctional clean-up column for the determination of deoxynivalenol[J]. Mycopathologia, 2006, 161(4): 239-243.
[24] LATTANZIO V M T, GATTA S D, SUMAN M, et al. Development and in-house validation of a robust and sensitive solid-phase extraction liquid chromatography/tandem mass spectrometry method for the quantitative determination of aflatoxins B-1, B-2, G(1), G(2), ochratoxin A, deoxynivalenol, zearalenone, T-2 and HT-2 toxins in cereal-based foods[J]. Rapid Communications in Mass Spectrometry, 2011, 25(13): 1869-1880.
[25] STECHER G, JARUKAMJORN K, ZABORSKI P, et al. Evaluation of extraction methods for the simultaneous analysis of simple and macrocyclic trichothecenes[J]. Talanta, 2007, 73(2): 251-257.
[26] 隋凯, 李军, 卫锋. 多功能柱净化-高效液相色谱法同时检测小麦中雪腐镰刀菌烯醇和脱氧雪腐镰刀菌烯醇[J]. 分析测试学报, 2006, 25(3): 56-59.
[27] 王伟, 刘安法, 李明奇, 等. 免疫亲和柱净化-高效液相色谱法检测小麦中的脱氧雪腐镰刀菌烯醇[J]. 粮食与饲料工业, 2013(1): 60-61.
[28] ANTONIOS D, GUITTON V, DARROZES S, et al. Monitoring the levels of deoxynivalenol (DON) in cereals in Lebanon and validation of an HPLC/UV detection for the determination of DON in crushed wheat (bulgur)[J]. Food Additives and Contaminants Part B-Surveillance, 2010, 3(1): 45-51.
[29] SOLEIMANY F, JINAP S, FARIDAH A, et al. A UPLC-MS/MS for simultaneous determination of afl atoxins, ochratoxin A, zearalenone, DON, fumonisins, T-2 toxin and HT-2 toxin, in cereals[J]. Food Control, 2012, 25(2): 647-653.
[30] KLINGLMAYR C, NOBAUER K, RAZZAZI-FAZELI E, et al. Determination of deoxynivalenol in organic and conventional food and feed by sol-gel immunoaffinity chromatography and HPLC-UV detection[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2010, 878(2): 187-193.
[31] BELAJOVA E, RAUOVA D. Single laboratory-validated HPLC methods for determination of ochratoxin A, fumonisin B1and B2, zearalenone and deoxynivalenol in cereals and cereal-based foods[J]. Journal of Food and Nutrition Research, 2010, 49(2): 57-68.
Determination of Deoxynivalenol in Wheat Grains by HPLC Using Solid-Phase Extraction Cleanup Column
LUO Yingpeng, CHEN Zhengxing, WANG Ren, LUO Xiaohu, LI Yongfu, LI Yanan, SHAO Huili, WANG Li*
(National Engineering Laboratory for Cereal Fermentation Technology, State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Deoxynivalenol (DON) is a ubiquitous mycotoxin present in cereal grains such as wheat and corn. This mycotoxin causes huge damage to human and animal health. This study optimized the experimental conditions including extraction solvent, cleanup column, composition and flow rate of mobile phase for DON detection by high-performance liquid chromatography (HPLC) after solid-phase extraction (SPE) cleanup. The optimized HPLC method was established when the extraction was performed using a mixture of acetonitrile (ACN) and water (84:16, V/V) followed by SPE cleanup on a Bond Elut Mycotoxin column using a mobile phase consisting of ACN and water (6:94, V/V) at a fl ow rate of 0.9 mL/min. Under these conditions, the recoveries of DON with this method ranged from 90.12% to 106.25%, with intra- and inter-day relative standard deviations between 4.51% and 6.12%, respectively. The proposed method is applicable to determine DON in grains because of its rapidity as well as good accuracy, repeatability and stability.
deoxynivalenol; wheat; high performance liquid chromatography (HPLC); solid-phase extraction; detection
TS207
A
1002-6630(2015)20-0222-04
10.7506/spkx1002-6630-201520043
2014-12-02
公益性行业(粮食)科研专项(201313005);公益性行业(农业)科研专项(201203037);
“十二五”国家科技支撑计划项目(2012BAD34B02);国家自然科学基金面上项目(31371874;311717835);
国家自然科学基金青年科学基金项目(31101383;31201381;31501579);中央高校基本科研业务费专项(JUSRP11510)
罗颖鹏(1990—),男,硕士研究生,研究方向为粮食质量与安全。E-mail:lyp_jiangnan@163.com
*通信作者:王莉(1981—),女,副教授,博士,研究方向为粮食精深加工与粮食质量与安全。E-mail:legend0318@hotmail.com
