液相色谱法测定 猕猴桃果实中抗坏血酸含量的前处理技术优化
2015-12-21王柏松章秋平张素敏
杨 巍,王柏松,刘 晶,王 杰,章秋平,张素敏
(辽宁省果树科学研究所,辽宁 熊岳 115009)
液相色谱法测定 猕猴桃果实中抗坏血酸含量的前处理技术优化
杨 巍,王柏松,刘 晶,王 杰,章秋平,张素敏
(辽宁省果树科学研究所,辽宁 熊岳 115009)
以猕猴桃果实为试材,去除果皮,切取月牙形果块,按样液比1∶4(g/mL)进行研磨和匀浆破碎处理,通过浸提剂种类与质量分数、浸提温度与时间以及贮存条件等实验优化,分析各处理样品中抗坏血酸含量差异显著性。结果表明:人工研磨与机械匀浆都是破碎处理的有效手段,其中机械匀浆是更为理想的破碎方法。浸提温度、时间以及振荡处理是影响样品提取效果的主要因素,要把握适度,以在0 ℃条件下超声波振荡提取15 min为宜。样品经前处理后立即检测与贮藏后检测结果差异很大,最好立即分析。浸提液种类与质量分数、浆液是否分离、贮存温度、光照是影响贮存效果的主要因素,利用较高质量分数的酸性溶液作为浸提剂,破碎后进行离心分离处理,然后置于冷、冻且避光条件下保存是比较理想的样品贮存办法。猕猴桃不同果实间抗坏血酸含量不存在显著性差异,但仍应十分注意材料的选取。
液相色谱;猕猴桃;抗坏血酸;前处理技术
抗坏血酸,即VC,是人体必需的具有保健功效的营养物质[1-6],主要存在于植物中,合成于线粒体,由载体运输[7-8],尤其在水果、蔬菜中分布广泛。因此,测定果蔬抗坏血酸含量对评定其营养价值具有重要意义。关于抗坏血酸相关研究由来已久,前人在抗坏血酸定性定量分析技术研究过程中陆续开发了分光光度法[9-12]、原子吸收光谱法、荧光分光光度法[13]、滴定分析法[14-15]和高效液相色谱法[16-18]等多种检测方法,这些方法均具有各自的优越性,同时也存在相应的局限性。其中,高效液相色谱法具有灵敏度高、选择性好、测定准确等 优点[19-21],是近年来发展较快的最为先进的一种分析方法,有很好的应用前景。随着色谱技术的完善与普及,液相色谱在水果营养品质指标分析中得到了广泛的应用,成为抗坏血酸定性、定量分析的有效手段,但科学、系统的前处理技术仍鲜见报道。本研究采用猕猴桃果实为试材,对样品破碎方法、浸提剂种类、浸提条件与方式以及样品贮存方法进行了全面比对、筛查与优化,旨在寻找科学、简捷、高效的前处理技术,为利用液相色谱对抗坏血酸进行精准定性、定量分析提供理论依据。
1 材料与方法
1.1 材料与试剂
成熟的猕猴桃果实于2012年10月购于辽宁省熊岳正大超市。
抗坏血酸标准品 美国Sigma公司。
1.2 仪器与设备
TOLEDO十 万分之一电子天平 瑞士梅特勒托利多仪器公司;超纯水系统 美国密理博公司;制冰机日本三洋公司; KQ5200型超声波提取器 江苏昆山舒美超声仪器有限公司;离心机 上海安亭科学仪器厂;U-3000型液相色谱仪(配有紫外检测器) 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 样品前处理
取大小相似、成熟度相近的猕猴桃果实,去除果皮,纵向切成月牙形果块,以偏磷酸为浸提液,样液比为1∶4(g/mL),于同一果实中取材进行人工研磨和机械匀浆、超声波处理温度与时间以及样品贮存条件的研究,材料破碎后转移至离心管中在转速为10 000 r/min条件下离心10 min,取上清液经0.45 μm滤头过滤保存,待上机检测。以上每处理重复3 次。
1.3.2 实验设计
样品破碎采用室温(25 ℃)条件下人工研磨与机械匀浆两种处理方式;浸提剂选择0.0%、0.2%、2.0%、6.0% 4 种质量分数的偏磷酸溶液;超声波振荡于0 ℃和25 ℃条件下分别处理0、15、30 min;样品贮存时,分别选择浸提剂为水与0.2%偏磷酸溶液,浆液分离与共存,贮藏温度为-50、4 ℃与25 ℃,贮藏环境为避光和照光;不同果实是于同一果箱中随机抽取的样品。
1.3.3 色谱条件
利用紫外检测器进行有机酸定量测定,采用Agilent ZOBAX C18柱(250 mm×4.6 mm),柱温20 ℃,检测波长260 nm,流速为1.0 mL/min,利用戴安变色龙软件进行仪器操作程序控制与数据处理。
2 结果与分析
2.1 液相色谱图
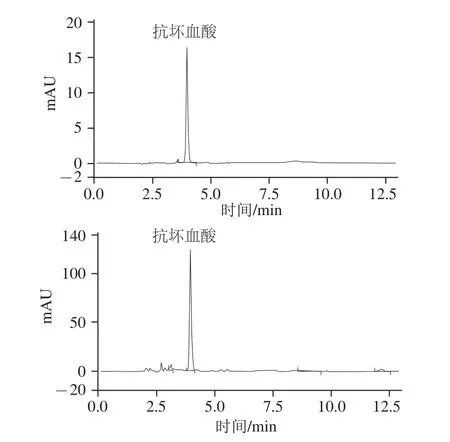
图1 标准品(A)与样品中(B)抗坏血酸色谱图Fig.1 Chromatograms of ascorbic acid standard and sample
由图1可知,标准溶液中抗坏血酸与样品中抗坏血酸的保留时间均为3.973 min。
2.2 破碎处理方式对提取效果的影响
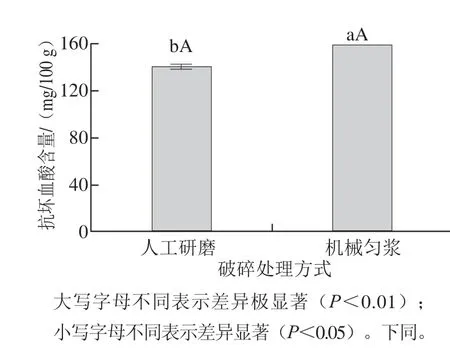
图2 破碎处理方式对抗坏血酸含量的影响Fig.2 Ascorbe acid contents in kiwi pulp samples after manual grinding and mechanical homogenization
由图2可知,猕猴桃果实经人工研磨处理后抗坏血酸获得量为138.877 2 mg/100 g,经机械匀浆处理后抗坏血酸获得量为157.783 4 mg/100 g,两者相差18.906 2 mg/100 g,存在极显著性差异。二者相较,以机械匀浆破碎效果更好。
2.3 偏磷酸质量分数对提取效果的影响
以4种不同质量分数偏磷酸为提取剂对样品进行浸提处理,图3结果表明,0.0%、0.2%、2.0%、6.0%偏磷酸浸提处理抗坏血酸获得量不存在显著性差异,但从数据量值观察,有随着偏磷酸质量分数升高而抗坏血酸获得量随之增加的趋势,说明浸提剂的酸性有利于抗坏血酸的溶出和保持。在抗坏血酸定量分析实验当中,在一定范围内,应尽量选择酸性较强的浸提剂,以使检测数值更接近样品中指标的真实含量。
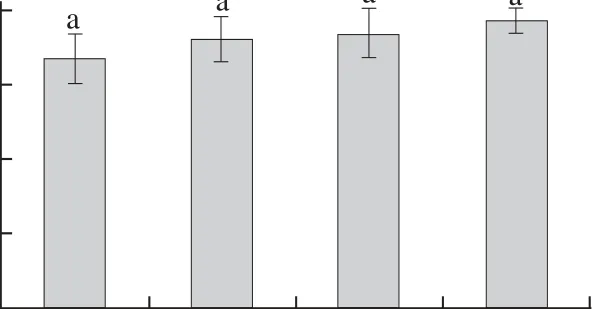
图3 偏磷酸质量分数对抗坏血酸含量的影响Fig.3 Ascorbe acid contents in kiwi pulp samples extracted with different concentrations of metaphosphoric acid aqueous solution
2.4 超声波振荡时间和温度对提取效果的影响
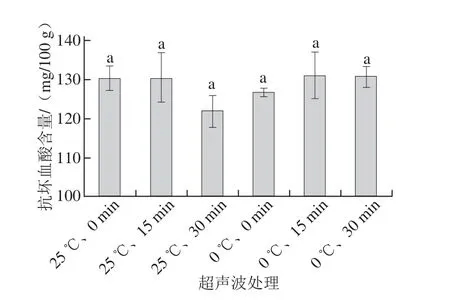
图4 超声波振荡温度和时间对抗坏血酸含量的影响Fig.4 Ascorbe acid contents in kiwi pulp samples extracted at different temperatures for different times
不同提取条件处理样品抗坏血酸分析结果表明(图4),6 种条件下抗坏血酸获得量数值间不尽相同,但不存在显著性差异。其中,25 ℃条件下未经超声波振荡处理、25 ℃条件下超声波振荡浸提15 min、0 ℃条件下超声波振荡浸提15 min、0 ℃条件下超声波振荡浸提30 min抗坏血酸获得量极其相近,说明使用这4种浸提剂处理样品的方法具有几近相同的效果。另外,0 ℃条件下未经超声波振荡处理与25 ℃条件下超声波振荡浸提30 min抗坏血酸获得量虽与以上4 种提取方式没有显著性差异,但数值明显较低,分别为126.536 7 mg/100 g和121.710 8 mg/100 g。同时可以看出,在25 ℃条件下,浸提时间越长,抗坏血酸的获得量反而越低,而在0 ℃条件下,浸提时间越长,抗坏血酸的获得量随之增加。从以上结果可看出,样品浸提过程中温度、时间以及是否采用振荡辅助措施都会影响抗坏血酸的提取效果,在一定范围内,提高提取温度、延长提取时间、采用振荡提取方式都会提高抗坏血酸的获得量,但如超出一定范围,反而会导致抗坏血酸的转化损失。综合以上,0 ℃条件下超声 波振荡15 min是比较理想的抗坏血酸提取条件。
2.5 贮存条件对样品抗坏血酸含量的影响
2.5.1 浸提剂种类对贮存效果的影响采用0.2%偏磷酸溶液与超纯水作为样品提取溶剂,机械匀浆破碎,经离心分离后,放置于4 ℃冰箱中避光冷藏贮存,7 d后检测抗坏血酸含量分别为153.970 1 mg/100 g和82.049 4 mg/100 g,二者差异极显著,0.2%偏磷酸溶液匀浆样品经冷藏后抗坏血酸含量显著高于利用水溶液匀浆所得经冷藏贮存的样品(图5)。样品如需贮存,应注意浸提剂的选择,其酸性作用对抗坏血酸含量的保持十分重要。
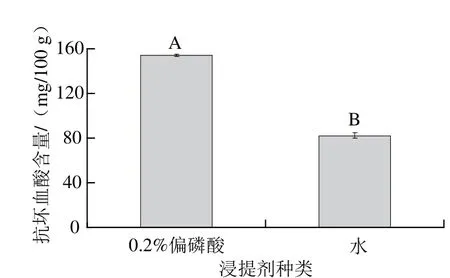
图5 浸提剂种类对抗坏血酸含量的影响Fig.5 Ascorbe acid contents in kiwi pulp samples extracted with different extractants
2.5.2 浆液共存与分离对贮存效果的影响
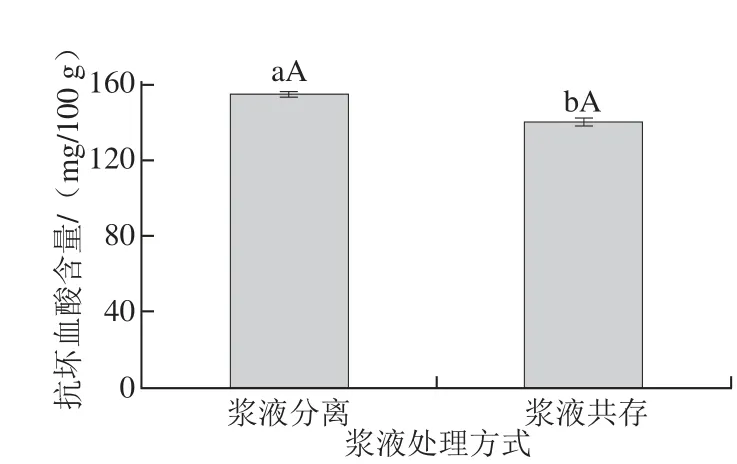
图6 浆液共存与分离对抗坏血酸含量的影响Fig.6 Ascorbe acid contents in kiwi pulp samples with and without centrifugation
样品匀浆破碎处理后,部分直接转移至10 mL离心管中,另一部分经离心分离也转移至离心管中,于-4 ℃冷藏避光条件下贮存7 d后,抗坏血酸定量检测结果(图6)表明,经离心分离样品贮存7 d后抗坏血酸含量为153.970 1 mg/100 g,未经分离处理样品抗坏血酸含量为139.658 1 mg/100 g,二者差异显著。样品破碎后离心除去其中的果肉碎屑再进行贮存更有利于抗坏血酸指标含量的保持。
2.5.3 贮存温度对贮存效果的影响
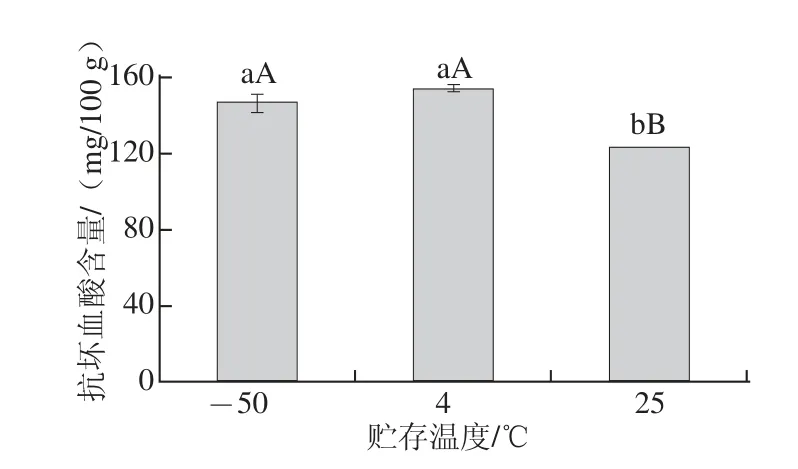
图7 贮存温度对抗坏血酸含量的影响Fig.7 Ascorbe acid contents in kiwi pulp samples after storage at different temperatures
设置了-50 ℃避光贮藏7 d、4℃避光贮藏7 d、25 ℃避光贮藏7 d 3 个处理,结果表明(图7),3 类样品抗坏血酸含量较立即检测样品抗坏血酸含量均有不同程度的降低,立即检测样品抗坏血酸含量虽明显高于4 ℃避光贮藏7 d的样品,但不存在显著性差异,而立即检测样品与其他两种方式贮存样品抗坏血酸含量却存在着极显著性差异,冷、冻环境较常温条件明显有利于样品的保存,而冷藏与冷冻间温度的变化却没有对指标含量带来显著性影响。综上,样品经前处理后最好立即检测,如不能按时完成,以4 ℃避光冷藏贮存效果最好。
2.5.4 光照对贮存效果的影响
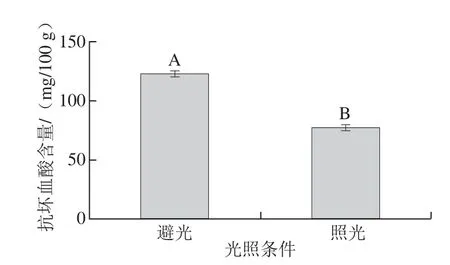
图8 光照对抗坏血酸含量的影响Fig.8 Ascorbe acid contents in kiwi pulp samples after storage under dark and light conditions
样品利用匀浆破碎,经离心分离后置于培养箱中,在25 ℃条件下,一组进行照光保存,光照强度为5 lx,一组利用双层黑色塑料袋包装再密封于纸箱中进行避光保存,定量检测结果表明(图8),照光处理抗坏血酸含量为77.024 0 mg/100 g,避光处理含量为122.823 1 mg/100 g,二者存在极显著性差异。贮藏过程中,遮光使样品抗坏血酸含量得到了较好的保持。
2.6 猕猴桃不同果实抗坏血酸含量分析
3 个不同果实当中,果A抗坏血酸含量为130.828 3 mg/100 g,果B为143.640 7 mg/100 g,果C为157.783 4 mg/100 g,果B较果A高12.8134 mg/100 g,果C较果B高14.1427 mg/100 g,依次相差10%左右,而果A与果C更是相差26.9551 mg/100 g,超过20%。猕猴桃不同果实间抗坏血酸含量虽不存在显著性差异,但数值相差明显(图9)。
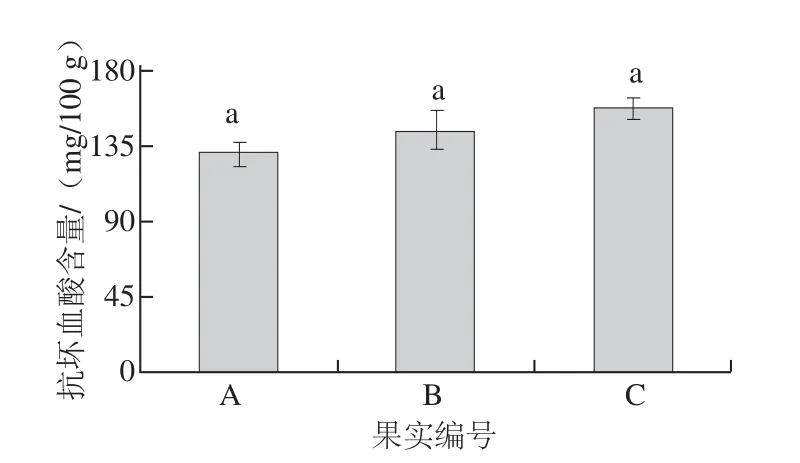
图9 猕猴桃不同单果抗坏血酸含量Fig.9 Ascorbe acid contents in different kiwi fruits
3 讨 论
3.1 样品的前处理技术
本研究样品前处理虽不是十分复杂,但也包含破碎、浸提与分离等多个环节,每一步骤都会影响实验结果的质量,应全面考虑、注意细节。浸提过程当中温度、时间、振荡等提取条件与手段均会促进抗坏血酸的获得,这与刘剑利[22]、叶新红[23]等在香菇多糖与葡萄多酚提取研究中的结论相似,但采用振荡提取方式、提取温度过高、提取时间过长都会使抗坏血酸的获得量下降,在一般实验中建议采用0.2%偏磷酸溶液作为浸提剂在冰浴条件下振荡提取15 min为宜。这与宁德生等[17]在对罗汉果抗坏血酸定量分析研究中对前处理时间的考察结论相同。
3.2 处理后样品的保存
科学贮存的样品,检测结果能够真实反映样品中目标物质的实际存在,而不良的贮藏条件,所检结果与样品指标真值含量相距甚远,不能作为科学分析的理论依据,样品采集后应尽量立即处理、检测,直接获得结果,再科学的贮藏技术也与新鲜样品的分析结果存在一定的距离。抗坏血酸是一种极易被氧化的物质,因此,贮藏过程中样品的状态、温度、光照等因素都会对检测结果有较大的影响,浆液分离样品贮藏后检测结果明显高于浆液共存的样品,这可能是因为,未经离心分离的样品中含有很多果肉碎块,其中一些有机物质可能能够促进抗坏血酸的氧化转化,而使其含量明显下降。贮藏过程中的温度与光照也十分关键,高温、照光均能够使样品中的抗坏血酸发生变化,使其含量显著下降。由此我们可以得出,经前处理后的样品最好立即进行检测分析[24],如不能立即检测,也要对样品进行离心分离去除部分杂质后,在低温、避光的环境下短期贮藏。王乐乐等[25]在刺梨果实VC含量分析中也有相似的结论。
3.3 材料的选取
不同单果指标含量差异明显,实验当中应注意试材的选取,以尽量减少选材所造成的误差,确保实验的科学性。这与程志强等[26]在西瓜果实VC含量研究结果相同。植物生长与农业生产过程中,由于种植品种、植株个体、生长气候环境以及栽培管理技术水平的不同,而使不同材料本身相互间存在差异甚至相去甚远。由不同果实中抗坏血酸含量差异可以看出,材料间的差异确实能够影响甚至改变处理间的结果,足以误导对客观规律的应有认识,甚至背道而驰。因此在同一实验不同处理过程中应尽量在品种相同、个体长势相近、同一地域和相同栽培管理方式的果园选取试材,有时甚至需要选取同一树上、位置相近、外观相似的果实,必要时可以选择同一果实进行实验,以进一步减小误差,提高实验的准确性。郜海燕[27]、田世平[28]等在桃品质分析研究中对实验材料的选取均有相似严格的要求。
[1] 宋圃菊, 徐勇. 中华猕猴桃的防癌作用[J]. 营养学报, 1988, 10(1): 50-54.
[2] HOLICK C N, de VIVO I, FESKANICH D, et al. Intake of fruits and vegetables, carotenoids, folate, and vitamins A, C, E and risk of bladder cancer among women (United States)[J]. Cancer Causes and Control, 2005, 16: 1135-1145.
[3] KIM D S, LEE M S, KIM Y S, et al. Effect modifi cation by vitamin C on the relation between gastric cancer and Helicobacter pylori[J]. European Journal of Epidemiology, 2005, 20: 67-71.
[4] JIAN L, DU C J, LEE A H, et al. Do dietary lycopene and other carotenoids protect against prostate cancer[J]. International Journal of Cancer, 2005, 113: 1010-1014.
[5] WRIGHT M E, MAYNE S T, SWANSON C A, et al. Dietary carotenoids, vegetables, and lung cancer risk in women: the Missouri women’s health study (United States)[J]. Cancer Causes and Control, 2003, 14: 85-96.
[6] KUCUK O. Chemoprevention of prostate cancer[J]. Cancer and Metastasis Reviews, 2002, 21: 111-124.
[7] HOREMANS N, FOYER C H, POERTTRS G. Ascorbate function and assiciated transport systems in plants[J]. Plant Physiology Biochemistry, 2000, 38: 531-560.
[8] HOREMANS N, ASARD H, CAUBERGS R J. The ascorbate carrier of higher plant plasma membranes preferentially translocates the fully oxidized (dehydroascorbate) molecule[J]. Plantphysiol, 1997, 114: 1247-1253.
[9] 安华明, 陈力耕, 樊卫国, 等. 刺梨果实中维生素C积累与相关酶活性的关系[J]. 植物生理与分子生物学学报, 2005, 31(4): 431-436.
[10] 赵树堂, 关军锋, 孟庆瑞, 等. 李果实发育过程中、酸、维生素C含量的变化[J]. 果树学报, 2004, 21(6): 612-614.
[11] 周德庆, 韩雅珊. 紫外分光光度法快速测定果蔬及饮料中维生素C含量的研究[J]. 中国农业大学学报, 1997, 2(5): 7-13.
[12] 王桂荣. 蔬菜维生素C含量测定试验[J]. 现代农业科技, 2009(24): 325-326.
[13] 杨青珍, 饶景萍, 王玉萍. ‘徐香’猕猴桃采收后逐步降温处理对果实冷害、品质和活性氧代谢的影响[J]. 园艺学报, 2013, 40(4): 651-662.
[14] 甘霖, 谢永红, 吴正琴, 等. ‘嘉平大枣’果实发育过程中糖、酸及维生素C含量的变化[J]. 园艺学报, 2000, 27(5): 317-320.
[15] 中国标准出版社第一编辑室. 中国农业标准汇编: 果蔬卷: 上[M].北京: 中国标准出版社, 2002: 90-93.
[16] 胡志群, 王惠聪, 胡桂兵. 高效液相色谱测定荔枝果肉中的糖、酸和维生素C[J]. 果树学报, 2005, 22(5): 582-585.
[17] 宁德生, 梁小燕, 方宏. 高效液相色谱法对罗汉果中VC含量的检测[J].食品科学, 2010, 31(20): 311-313.
[18] 张雪, 杨曼, 安华明, 等. 外源 Ca2+、Mg2+、Cu2+和吖啶黄素对刺梨果实维生素C合成的影响[J]. 中国农业科学, 2012, 45(6): 1144-1149.
[19] 刘嘉祺, 孙仁国, 李磊. 高效液相色谱法测定芒果中的VC含量[J].中国食物与营养, 2013, 19(12): 66-68.
[20] 刘文海, 范洁, 刘丽莉. HPLC法测定5 种果汁中抗坏血酸的含量[J].安徽农业科学, 2009, 37(4): 1412-1413.
[21] 李玉明, 张少华. 猕猴桃中维生素C的HPLC分析[J]. 计算机与应用化学2011, 28(4): 458-460.
[22] 刘剑利, 曹向宇, 芦秀丽, 等. 香菇菌丝体多糖的分离纯化和抗氧化作用[J]. 食品科学, 2011, 32(12): 19-23.
[23] 叶新红, 李永春, 胡彩香, 等. 不同处理对葡萄皮中多酚类化合物溶出效果的研究[J]. 新疆农业科学, 2009, 46(4): 877-880.
[24] 朱立伟, 钱炳俊, 肖晨龙, 等. 纯氧贮藏梨果肉褐变及相关生理的研究[J]. 上海农业学报. 2010, 26(2): 25-33.
[25] 王乐乐, 安华明. HPLC测定刺梨果实中维生素C含量方法的优化[J].现代食品科技, 2013, 29(2): 397-400.
[26] 程志强, 刘文革, 刘志敏, 等. 不同倍性西瓜果实维生素C含量比较研究[J]. 果树学报, 2008, 25(5): 760-763.
[27] 郜海燕, 陈杭君, 陈文烜, 等. 采收成熟度对冷藏水蜜桃果实品质和冷害的影响[J]. 中国农业科学, 2009, 42(2): 612-618.
[28] 田世平, 徐勇, 姜爱丽, 等. 冬雪蜜桃在气调冷藏期间品质及相关酶活性的变化[J]. 中国农业科学, 2001, 34(6): 656-661.
Optimization of Pretreatment Conditions for Determination of Ascorbic Acid Content in Kiwi Fruit Pulp by Liquid Chromatography
YANG Wei, WANG Baisong, LIU Jing, WANG Jie, ZHANG Qiuping, ZHANG Sumin (Liaoning Institute of Pomology, Xiongyue 115009, China)
Ripe kiwi fruits were peeled, cut into crescent pieces and ground with aqueous metaphosphoric acid at a solid to water ratio of 1:4 manually or by mechanical homogenization, and then the mash was ultrasonically extracted, centrifuged and stored until being analyzed for the ascorbic acid content by liquid chromatography. The pretreatment conditions including manual or mechanical grinding, extractant type and concentration, extraction temperature and time, and storage conditions were optimized. Signifi cant difference analyses were carried out among various processed samples. The results showed that both manual grinding and mechanical homogenization were effective means of mashing the fruit, and the latter method was superior to the former. Extraction temperature and time were identifi ed as main factors infl uencing extraction effi ciency. An extraction temperature of 0 ℃ and 10 min extraction proved optimal. Accurate results were obtained when the analysis was carried out immediately after sample preparation, signifi cantly different from those reported for the stored samples. Extractant type and concentration, separation of the mash, storage temperature, and light condition were main factors affecting the accuracy of the determination of ascorbic acid using the stored samples. The samples prepared by extraction using higher concentrations of acid and centrifugation should be stored at low temperatures in darkness if analysis cannot be performed immediately. Though no signifi cant difference in ascorbic acid content existed among three kiwifruits, much attention should be paid to selection of the test material.
liquid chromatography; kiwi fruit; ascorbic acid; pretreatment technologies
S661.1
A
1002-6630(2015)20-0163-05
10.7506/spkx1002-6630-201520031
2015-02-09
辽宁省百千万人才工程项目;辽宁省自然科学基金项目(20102223)
杨巍(1972—),男,副研究员,硕士,研究方向为果树资源品质生理。E-mail:ywsys@yeah.net
