植物乳杆菌发酵草鱼肉挥发性成分的变化规律
2015-12-21裘迪红欧昌荣苏秀榕明庭红
裘迪红,欧昌荣,苏秀榕,明庭红
(1.浙江医学高等专科学校,浙江 杭州 310053;2.宁波大学海洋学院,浙江 宁波 315211)
植物乳杆菌发酵草鱼肉挥发性成分的变化规律
裘迪红1,欧昌荣2,苏秀榕2,明庭红2
(1.浙江医学高等专科学校,浙江 杭州 310053;2.宁波大学海洋学院,浙江 宁波 315211)
研究植物乳杆菌发酵草鱼的过程中挥发性成分变化规律。利用电子鼻、顶空固相微萃取和气相色谱-质谱联用技术对草鱼发酵不同时间段的挥发性成分进行分析。结果表明,电子鼻能够较好地区分发酵不同阶段的鱼肉样品的风味,各阶段的成分有显著差异,进一步采用气相色谱-质谱法对不同时间的草鱼发酵样品中的挥发性成分进行分析,鉴定出54 种挥发性物质,在发酵过程中,土腥味的己醛、庚醛等醛类物质逐渐减少;蘑菇香味的1-辛烯-3-醇含量逐渐增多,发酵后期产生了有薄荷香味的丙酮,以及有奶油香味的乙偶姻等增香成分,这和感官评定的结果一致。
植物乳杆菌;草鱼肉;电子鼻;气相色谱-质谱;挥发性成分
草鱼是典型的草食性鱼类,鱼肉中含有丰富的蛋白质,含水量较高,自身带有较多的微生物和酶,容易腐败变质,且鱼肉的腥味较重[1]。研究[2]显示将乳酸菌用于肉类发酵,不仅可以抑制病原菌和腐败菌的生长,同时乳酸菌生长代谢产生的酶类还能促进蛋白质等大分子物质的分解,提高人体所需的氨基酸、维生素等含量,并且促进产品形成特殊的风味。草鱼肉在发酵过程中产生的挥发性风味成分决定其感官品质,分析研究草鱼肉的挥发性风味成分对评价其感官品质以及改善草鱼发酵工艺具有非常重要的意义。电子鼻是一种新颖的识别、检测和分析复杂气味和大多数挥发性成分的仪器[3],电子鼻具有测定速度快、范围广等多项优点,目前在肉制品的风味检测中有较多应用,研究[4]表明,通过电子鼻顶空固相微萃取-气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用的手段对鱼肉的挥发性风味成分进行分析有显著的优势。风味分析的第1步就是从样品中提取出挥发性的目标物质,将蒸馏提取法与动态顶空法结合起来,在蒸馏法充分收集高沸点化合物的同时用动态顶空法来弥补其难以掌握低沸点化合物的缺点,这样就可以更全面地反映鱼肉中的风味成分,使检测数据更真实准确[5]。风味提取之后利用GC-MS联用技术对提取物中的各种风味成分进行分离、鉴别。目前,这种方法在食品风味研究中起了重要的作用,用在发酵鱼肉的过程控制中也将会起到积极的作用。
本实验利用电子鼻和GC-MS对发酵不同阶段草鱼肉的风味物质进行检测,同时结合感官评定进一步探索植物乳杆菌发酵草鱼肉的风味变化规律。为研究鱼肉发酵过程中风味的形成机理打下基础,为发酵工艺的改进以及过程控制提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活草鱼(尾质量约1 kg) 市购;植物乳杆菌实验室分离鉴定获得;MRS肉汤培养基、种子培养基[6]、发酵培养基[6]。
1.2 仪器与设备
HWS恒温恒湿培养箱 宁波江南仪器厂;PL4002电子天平 梅特勒-托利多仪器有限公司;DK-8D电热恒温水浴锅 上海恒温科技有限公司;65 μm PDMS萃取头 美国Supelco公司;6890 N/5973 GC-MS联用仪美国Agilent公司;RCT2basic加热磁力搅拌器 日本岛津公司;PEN3便携式电子鼻 德国Airsense公司;电子鼻包含10 个金属氧化物传感器阵列,每个传感器名称及特点见表1。
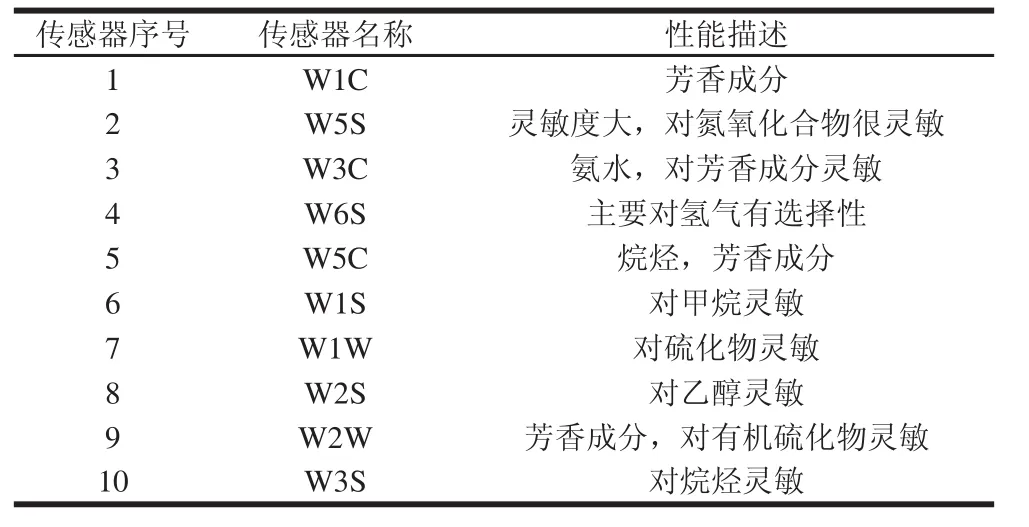
表1 PEN3所用传感器及其性能描述Table1 Sensors used and their main applications in PEN3
1.3 方法
1.3.1 发酵剂的制备
将筛选出的植物乳杆菌接种至MRS肉汤培养基中,35 ℃摇床培养16 h,活化后以合适接种量接种至种子培养基中,然后转接发酵培养基中培养至菌体浓度约为107~108CFU/mL。
1.3.2 样品的制备
草鱼经洗涤、去鳞、除内脏、剔骨后,切成小块(3 cm×3 cm)放入无菌玻璃瓶中,添加质量分数5%食盐、3%蔗糖在4 ℃条件下腌制4 h后,无菌条件下取植物乳杆菌培养液按鱼肉质量的8%进行接种,密封后在30 ℃恒温培养箱中进行发酵。
1.3.3 电子鼻分析
发酵过程中每隔4 h用电子鼻检测样品鱼挥发性物质的变化,称取2 g样品鱼,放入顶空瓶中密封备用,每个样品重复测量6 次。
测定条件:由预实验确定电子鼻的参数,样品气体进样速率为300 mL/min,载气速率为300mL/min,测量时间为100 s,因样品气味不同,清洗时间为400~1 000 s。
数据处理方法:对电子鼻的数据主要采用主成分分析(principal component analysis,PCA)、线性判别式分析(linear discriminant analysis,LDA)。
1.3.4 样品的GC-MS分析
1.3.4.1 顶空固相微萃取
称取磨碎的4 g样品,置于15 mL顶空瓶中,60 ℃水浴10 min,将经过老化处理过的50/30 μm DVB/CAR/ PDMS萃取头插入顶空瓶中,60 ℃萃取35 min,20 ℃条件下静置平衡20 min,迅速将萃取头置于进样口解吸5 min,进行GC-MS分析。
1.3.4.2 GC-MS分析条件
GC条件:色谱柱(30 m×0.25 mm,0.25 μm);程序升温:40 ℃保持2 min,以5/min升至60 ℃,保持2 min,然后以6 ℃/min升至140 ℃,保持2 min,最后以8 ℃/min上升至230 ℃,并保持15 min;采用不分流进样模式,载气为He;流速为1 mL/min。
MS条件:离子源温度200 ℃;电子电离源;电子能量70 eV;接口温度250 ℃;质量扫描范围33~450 u;扫描时间35 min。
1.3.5 感官评定
采用定量描述性感官评价法,以鱼肉气味的6 个主要风味指标鱼腥味、青草味、油脂味、金属味、泥土味和肉香味为依据[7],采用数字评估法对发酵不同阶段的鱼肉中每一种风味指标的气味强度进行打分。取不同发酵阶段的鱼肉2 g,蒸煮20 min后,置于样品瓶中,样品温度保持在60 ℃左右,然后进行感官分析。成立10 人感官小组(5 男5 女),事先对其进行简单的培训。对不同发酵阶段每一种风味指标的气味强度进行打分,取平均值,最后绘制出风味剖面图。
2 结果与分析
2.1 电子鼻对发酵过程中草鱼肉风味物质的分析
2.1.1 PCA发酵不同阶段的草鱼肉风味成分变化
PCA是将多个指标转化为较少的几个综合指标的一种统计分析方法。其将所提取的10 个传感器的信息进行数据转换和降维,并对降维后的特征向量进行线性分类,最后在PCA分析的散点图上显示主要的两维散点图[8]。它对原来具有信息重叠的多个指标进行线形组合,从而使得这些综合指标间既互不相关,同时还能反映原来多指标的信息[9-10]。图1是采用PCA方法分析不同发酵阶段草鱼肉的电子鼻响应值结果。
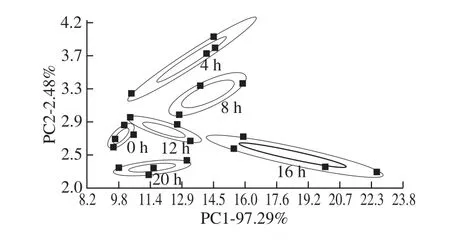
图1 草鱼发酵不同阶段的PCA分析Fig.1 PCA analysis for different fermentation stages of grass carp
从图1可以看出,PC1和PC2贡献率分别为97.29%和2.48%,总贡献率为99.77%。草鱼肉的挥发性气味随着发酵时间的变化而变化,且不同发酵时间的草鱼气味响应值没有重叠区域,区分度较好。沿PC2轴可以看出,随着发酵时间的延长,草鱼气味响应值的分布呈现一定的趋势。究其原因,可能是草鱼在发酵过程中,微生物生长代谢蛋白质、糖类、脂肪等营养物质,产生了一些挥发性成分,如蛋白质降解所产生的游离氨基酸是主要呈味物质和挥发性成分的前体物质;脂类的水解为脂质的氧化提供底物,可以产生对发酵鱼风味具有决定作用的醛、酮、醇类化合物[11]。
2.1.2 LDA发酵不同阶段的草鱼肉风味成分变化
LDA是判别样品所属类型的一种分析方法,其通过计算未知样品与各类已知样品的马氏距离,且考虑到样品归属的先验概率,针对每一组样品计算出一个以原有变量为基础的线性判别函数,再将需要进行分类的样本的相应指标代入判别函数,然后对未知类型的样品进行判别分类[12]。LDA更加注重样品在空间中的分布状态及彼此之间的距离分析,将样品信号数据通过运算法则投影到某一方向,使得组与组之间的投影尽可能分开[13-14]。
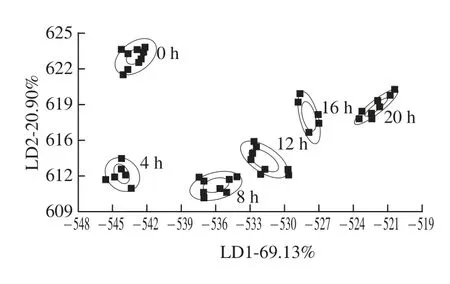
图2 草鱼发酵不同阶段的LDAFig.2 LDA analysis for different fermentation stages of grass carp
从图2可以看出,判别式LD1和判别式LD2的贡献率分别为69.13%和20.90%,两判别式的总贡献率为90.03%。随着发酵时间的延长,LD1呈现递增的趋势,LD2呈先下降后上升的变化趋势。LDA方法能够明显区分不同发酵阶段的草鱼,发酵前草鱼的腥味较重,随着微生物发酵产生了醇、醛、酮、挥发性有机酸等物质,形成了独特的呈味物质,从而改善了发酵鱼制品的风味。
2.2 GC-MS进一步对发酵过程中草鱼肉风味成分的分析
利用GC-MS从不同发酵阶段草鱼肉中共分离检测出54 种挥发性化合物,其中烃类19 种、醇类10 种、醛类7 种、酮类10 种、酯类4 种、酸类2 种以及含氮化合物2 种。表2列出了发酵不同阶段草鱼肉中各类挥发性成分的相对含量。
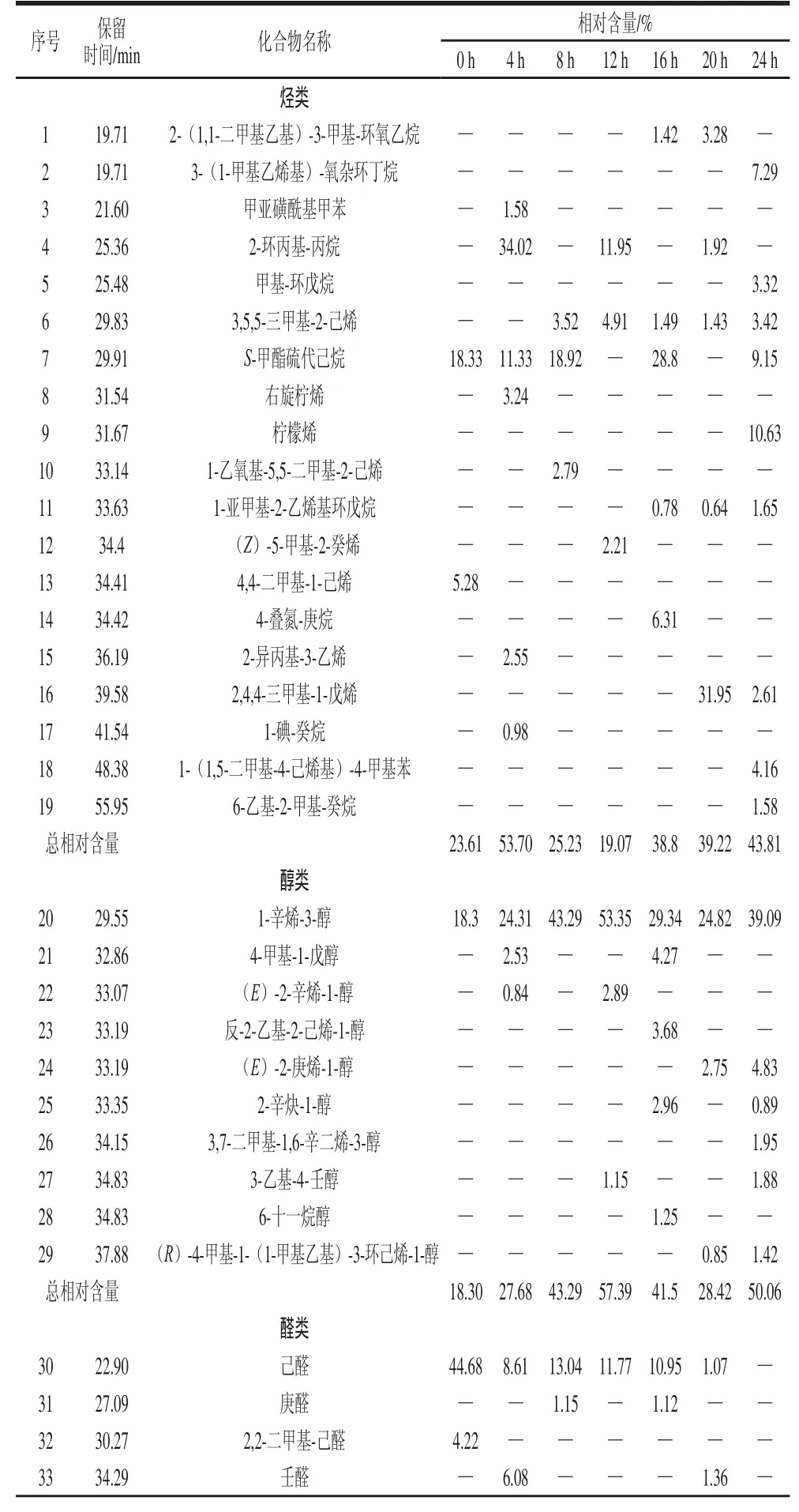
表2 发酵不同阶段草鱼肉中挥发性成分的相对含量Table2 Relative contents of volatile compounds identifi ed in grass carp during different stages of fermentation
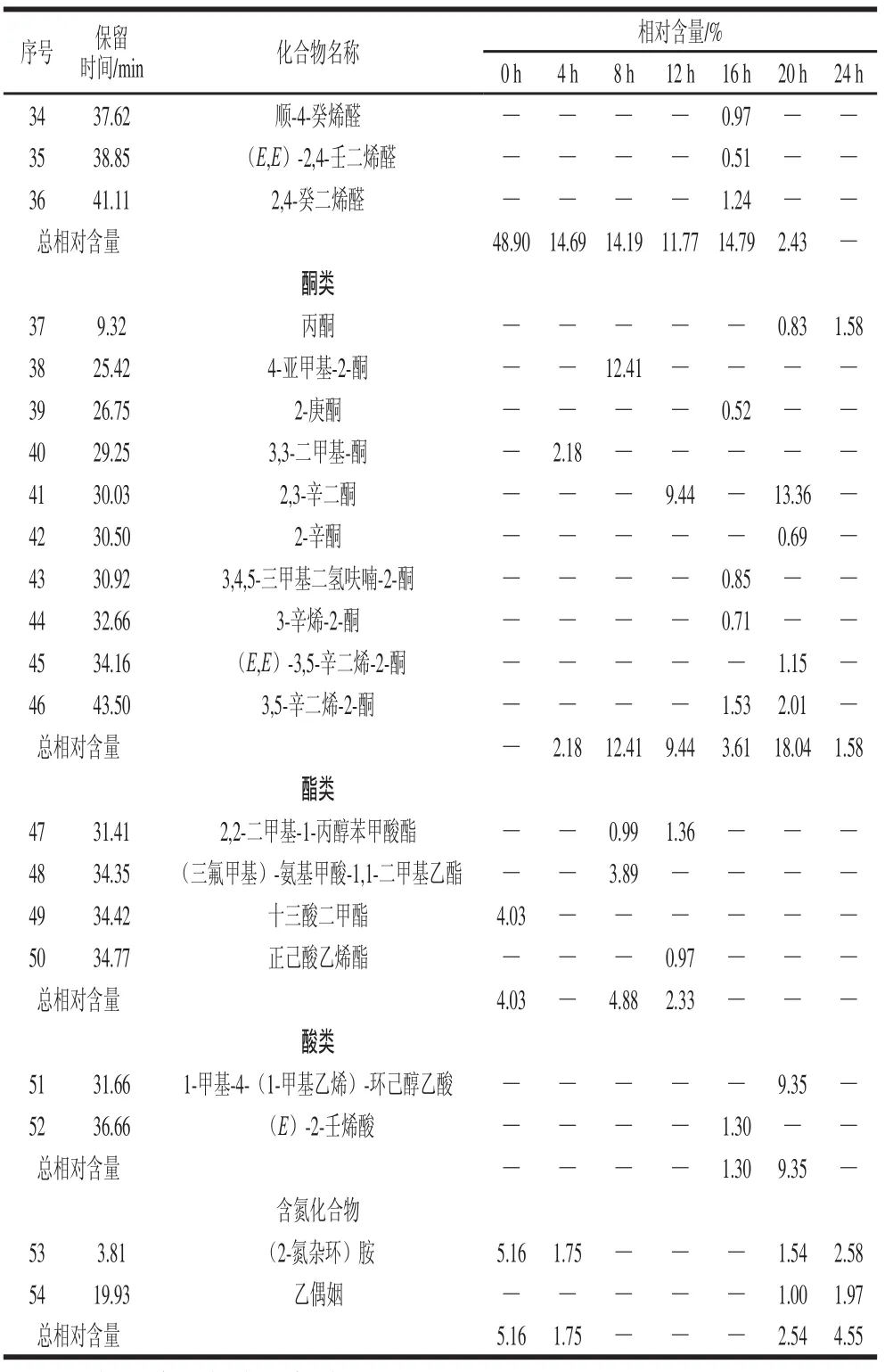
续表2
2.2.1 挥发性化合物的变化规律
2.2.1.1 烷烃类化合物的变化
在草鱼肉中检出的烃类化合物中包括烷烃9 种、烯烃8 种及2 种芳香烃。不同发酵阶段样品中烃类化合物的相对含量差异较大,种类和相对含量总体上增多。其中S-甲酯硫代己烷的相对含量由0 h的18.33%最终降低到9.15%,2-环丙基-丙烷的相对含量也由开始的34.02%下降至1.92%。甲亚磺酰基甲苯、右旋柠烯、4,4-二甲基-1-己烯、1-碘-癸烷、2-异丙基-3-乙烯5 种烃类基本出现的发酵的前期阶段,而3-(1-甲基乙烯基)-氧杂环丁烷、甲基-环戊烷、柠檬烯、4-叠氮-庚烷、2,4,4-三甲基-1-戊烯、1-(1,5-二甲基-4-己烯基)-4-甲基苯、6-乙基-2-甲基-癸烷7 种化合物主要出现在发酵的后期阶段。其中,3,5,5-三甲基-2-己烯和S-甲酯硫代己烷是发酵草鱼烃类挥发性化合物的主要成分。柠檬烯存在于各种鱼类、虾类和头足类的组织中,具有令人愉快的、新鲜的甜味[15]。
2.2.1.2 醇类化合物的变化
在不同的发酵草鱼样品中检测出10 种醇类化合物,其中1-辛烯-3-醇的相对含量最丰富(18.3%~53.35%)且在整个发酵过程中均能检出。Iglesias等[16]认为1-辛烯-3-醇是亚油酸在氧化过程中产生氢过氧化物的降解产物,表现出类似蘑菇的香气,普遍存在于鱼类的挥发性香味物质中[17]。反-2-乙基-2-己烯-1-醇、3,7-二甲基-1,6-辛二烯-3-醇、6-十一烷醇等仅在个别样品中检出,相对含量也较低。此外除了4-甲基-1-戊醇和(E)-2-辛烯-1-醇这2 种醇类化合物,其他醇类化合物主要在发酵中后期的样品中检出。发酵草鱼中醇类化合物的相对总含量由发酵初期的18.30%上升到最终的50.06%。
2.2.1.3 醛类化合物变化
在检出的醛类化合物中包括4 种饱和醛和3 种烯醛。己醛几乎在整个发酵阶段都可检出,其相对含量是其他醛类化合物的几十倍。在发酵16 h的样品中检出的醛类物质最多,而在发酵末期未检出醛类化合物。己醛、庚醛、壬醛等直链的饱和醛在各种火腿、香肠等发酵制品中也可检出[18-19],己醛、庚醛等醛类物质被认为是淡水鱼肉土腥味的主要成分,壬醛具有强烈的甜橙气息,它作为低阈值醛类,可能会对鱼肉气味产生重要影响[20]。2,4-癸二烯醛也是鱼肉腥味的主要成分之一[17],经发酵后其全部脱除。(E,E)-2,4-壬二烯醛为低阈值醛类,呈现出果香、青草和明显的脂肪香气[21],有鸡汤香味。鱼类中的甜香和类植物香主要来自于挥发性羰基化合物,其中醛类物质阈值低且相对含量高,所以对风味贡献较大。
2.2.1.4 酮类化合物的变化
酮类是水产品风味物质重要的组成部分,一般呈现果香味或奶油味。不同发酵时间的草鱼中检测出的饱和酮仅有丙酮、2-庚酮和2-辛酮,其余均为不饱和酮。不饱和酮对发酵鱼的特征风味具有重要作用。在检测出的酮类化合物中4-亚甲基-2-酮和3,3-二甲基-酮出现在发酵前期,发酵后期未有检出。其中,2,3-辛二酮的相对含量较高,约9.44%~13.36%。发酵后期产生了少量丙酮,其具有薄荷香味。酮类化合物主要出现在发酵16~20 h的时段,对鱼肉中甜的花香及果香风味有贡献,并随着碳链的增加产生更强的花香特征[22]。
2.2.1.5 酯类化合物变化
酯类物质一般是由发酵或者脂质代谢生成的羧酸和醇酯化后的产物[23],酯类化合物主要在发酵前中期的样品中被检出,分别为2,2-二甲基-1-丙醇苯甲酸酯、(三氟甲基)-氨基甲酸-1,1-二甲基乙酯、十三酸二甲酯和正己酸乙烯酯4 种化合物。其中十三酸二甲酯和(三氟甲基)-氨基甲酸-1,1-二甲基乙酯的相对含量较高,分别为4.03%和3.89%。酯类化合物是一种良好的风味物质,乳酸菌活动过程中可形成酯类,且少量的酯类物质即可产生明显的香气。
2.2.1.6 其他化合物的变化
其他化合物包括酸类化合物和含氮化合物均有2 种,其中酸类化合物出现在发酵后期,而含氮化合物出现的发酵初期和末期,两者相对含量均不高。含氮化合物中的乙偶姻是一种令人愉快的香味物质,具有奶油、脂肪、白脱样香气,高度稀释后有令人愉快的奶香气。
2.2.2 各种挥发性化合物的相对含量分析
草鱼发酵过程中产生的主要挥发性成分有烃、醇、醛、酮、酯、酸及含氮化合物7 类,但不同发酵阶段样品中各类物质的相对含量和数量有明显的差异,结果见图3。
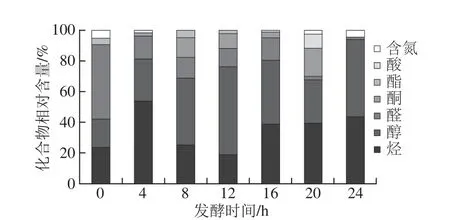
图3 发酵不同阶段草鱼肉中各类挥发性成分的相对含量Fig.3 Relative contents of chemical classes of volatile compounds in grass carp during different stages of fermentation
由图3可以看出,烃类和醇类化合物是发酵草鱼中相对含量最丰富的挥发性成分,相对含量分别为19.07%~53.70%和18.30%~57.39%。同时,发酵不同阶段草鱼中烃类和醇类的相对含量差异明显,发酵12 h样品中烃类物质的相对含量最少,发酵4 h时最多;醇类物质是在未发酵样品中最少,在发酵12 h样品中最多。醛类化合物的相对含量为2.43%~48.90%,酮类物质的相对含量为1.58%~18.04%。酮是醛进一步氧化的结果,所以发酵草鱼中酮类化合物的相对含量与醛类物质的相反,发酵20 h样品中的醛类物质相对含量最少,而酮类物质的相对含量最多;未发酵样品中醛类物质相对含量最多,而酮类物质相对含量最少。此外,酯类化合物、酸类化合物及含氮类化合物的相对含量都较少。
2.2.3 挥发性风味物质相对含量、种类与组织蛋白酶及胞外酶活力的相关性分析
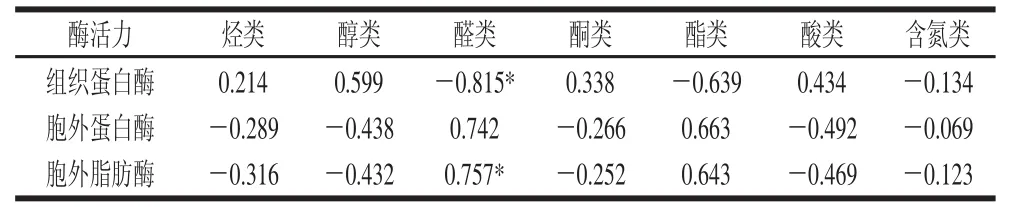
表3 挥发性风味物质相对含量与酶活力的相关性分析Table3 Correlation analysis of the contents of volatile fl avor substances and enzyme activities
从表3可以看出,组织蛋白酶活力与烃类、醇类、酮类、酸类物质相对含量呈正相关,与醛类、酯类以及含氮类物质相对含量呈负相关,且与醛类物质显著性负相关(P<0.05);胞外蛋白酶活力与醛类和酯类物质相对含量呈正相关,与其他物质呈负相关,其相关性均不显著;胞外脂肪酶活力与醛类和酯类物质相对含量呈正相关,且与醛类物质的相关性显著(P<0.05),与其他物质相对含量呈负相关,相关性不显著。由表4可知,组织蛋白酶活力与烃类、醇类、酮类、酸类和含氮类物质种类呈正相关,与醛类和酯类物质种类呈负相关,其中与醇类物质种类相关性极显著(P<0.01),与酮类物质种类相关性显著(P<0.05);胞外蛋白酶活力与醛类、酯类种类呈正相关,与其他物质种类呈负相关,相关性不显著;胞外脂肪酶活力与醛类、酯类种类呈正相关,而与其他物质种类呈负相关,其中与烃类物质种类呈显著负相关(P<0.05)。
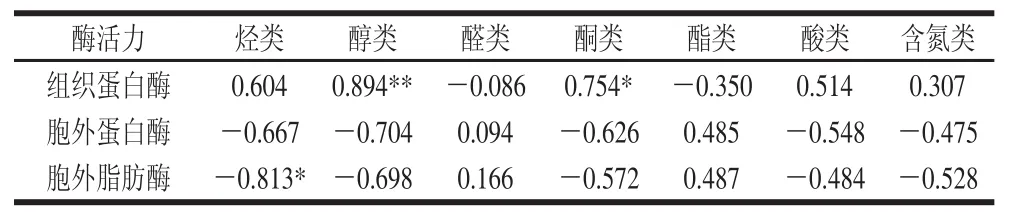
表4 挥发性风味物质种类与酶活力的相关性分析Table4 Correlation analysis of the species of volatile fl avor substances and enzyme activities
2.3 感官评定
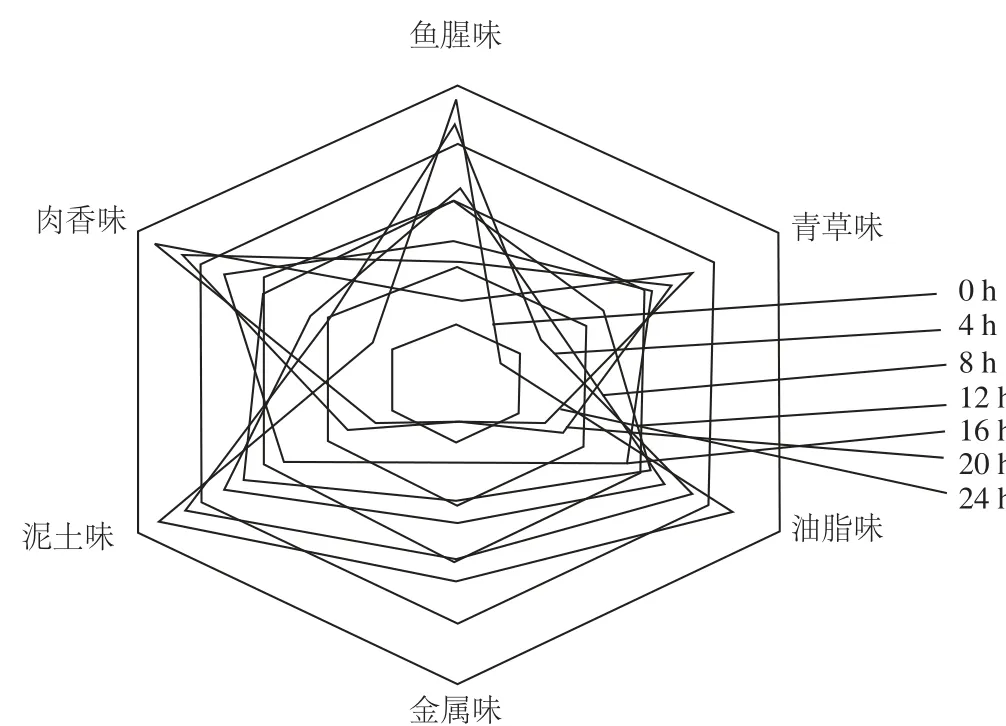
图4 不同发酵阶段草鱼肉风味剖面图Fig.4 Flavor profi les of fermented grass carp at different stages of fermentation
通过风味刨面感官分析法对发酵不同阶段草鱼肉的挥发性风味进行整体评价。图4结果表明,随着发酵时间的延长,草鱼肉气味的主要特征及强度都在发生变化。发酵初期草鱼肉具有非常强烈的鱼腥味,当发酵时间延长到8 h时,鱼腥味的气味强度降到中等强度,20 h时鱼腥味已经很弱。发酵前鱼肉中几乎识别不出青草味,因为它被强烈的鱼腥味、泥土味和油脂味所掩盖;发酵时间不断延长,鱼肉中的青草味也越来越容易被识别,当发酵16 h时,鱼肉的青草味已经达到中等强度。随着发酵时间的变化,鱼肉中泥土味和油脂味的气味强度的变化很相似,起初的气味都很强烈,慢慢随着发酵变得越来越弱,发酵终点时泥土味和油脂味都已经很弱。鱼肉中金属味随着发酵的进行慢慢变弱,由最初的中等强度变为很弱。相反,发酵草鱼的肉香味不断增强,当发酵12 h,肉香味由一开始很弱变为中等强度,发酵终点时鱼肉的肉香味很强。
鱼肉的香味是在受热过程中产生的,生肉除了鱼腥味、金属味和淡淡的咸味外无任何熟肉的诱人香味[24]。受热时,鱼肉中的香味前体物质发生分解、氧化、还原等化学反应,所产生的各种挥发性香味物质共同作用形成肉的特殊香味[25]。发酵前的草鱼由于脂肪含量高,含有较多的腥味物质,这主要与脂肪分解后产生的短链的醛、酮等腥味物质有关,代表物质有3-己烯醛、三甲胺、2,4-庚二烯醛、六氢吡啶、2,4-壬二烯醛等[26]。体现青草味的主要物质有己醛,来自于α-6不饱和脂肪酸。对于油脂味贡献较大的物质有顺-4-庚烯醛、辛醛、2-壬烯醛和2,4-壬二烯醛,它们来自于多不饱和脂肪酸氧化,是肉制品中构成各种氧化风味的重要来源[27]。另外,1,5-辛二烯-3-酮、辛醛、3-甲基-1-丁醛等多次被报道与水产品中的金属味有关。熟鱼肉的肉香味的重要成分是含硫化合物,主要来自含硫氨基酸或不饱和脂肪酸,主要物质有4-甲基-4-巯基-2-戊酮、二甲基三硫、二甲基二硫、2-甲基-3-巯基呋喃等[28]。
3 讨 论
鱼类的风味主要由它们的嗅感香气和鲜味共同组成,其中嗅感香气由挥发性含香化合物构成,鲜味由非挥发性滋味活性物质构成[29]。新鲜的鱼类非常容易腐败,其肉香味可能会因自溶作用或被微生物破坏,或者生成新的化合物掩蔽了鱼体原有的香气。很多人认为所有鱼类都有鱼腥味,其实不然,非常新鲜的活鱼具有优美的芳香,而通过商业渠道得到的鱼类芳香和新鲜的风味已基本丧失。所以,在实验和生产中应尽量选择新鲜的鱼类,以保证产品的最终质量。
发酵前的草鱼由于生长在池塘或湖泊中,含有较重的土腥味[30],这也是制约淡水鱼加工利用的重要原因之一。添加发酵菌种后,鱼肉的风味发生很大变化,青草味和肉香味增强,而鱼腥味、泥土味等减弱。在整个发酵过程中,烃类化合物的相对含量差异较大,种类和相对含量总体上升。醇类化合物的总相对含量由发酵初期的18.30%上升到最终的50.06%。由于草鱼肉中醇类物质相对含量高会掩盖其他风味物质的挥发检测,故在检测之前最好采用真空旋转蒸发仪蒸发掉过多的水分和醇,使得能够检测出更多的风味成分。鱼类中的甜香和类植物香主要来自于挥发性羰基化合物,其中醛类物质阈值低且含量高,所以对风味贡献较大。发酵后期的鱼肉样品中检测出一定量的酸类物质,这是由于乳酸杆菌和酵母菌的代谢分解产生的。随着发酵时间的延长,微生物代谢产生的酸类会与醇类物质进一步反应生成酯类等芳香物质。酮类化合物主要出现在发酵16~20 h的时段,对鱼肉中甜的花香及果香风味有贡献,并随着碳链的增加产生更强的花香特征。酮是醛进一步氧化的结果,所以发酵草鱼中酮类化合物的相对含量与醛类物质相反。酯类化合物是一种良好的风味物质,乳酸菌活动过程中可形成酯类,且少量的酯类物质即可产生明显的香气。
在发酵草鱼风味的形成中,组织蛋白酶和胞外脂肪酶起主要作用,胞外蛋白酶作用较弱。组织蛋白酶活力与醛类物质相对含量呈显著性负相关,与醇类物质种类正相关极显著,与酮类物质种类正相关显著;胞外脂肪酶活力与醛类物质相对含量呈显著正相关,而与烃类物质种类呈显著负相关。
鱼肉中的脂类经胞外脂肪酶的水解形成游离脂肪酸,其中不饱和脂肪酸因含有双键而易于发生氧化生成过氧化物,进一步分解生成醛类等挥发性化合物。己醛具有青草味,与具有风味活性的低分子碳链醛类物质共同构成鱼体的整体腥味。
LDA法能够明显区分不同发酵阶段的草鱼肉风味变化情况,这和韩娇娇等[31]的分析结果一致,但是,电子鼻只能区分各阶段的变化情况,要具体了解各阶段的物质成分,结合GC-MS可以从不同发酵阶段草鱼肉中分离检测出各种挥发性化合物。
[1] 王磊, 刘学军. 草鱼肉发酵香肠的发酵工艺研究[J]. 食品工业科技, 2011, 32(2): 172-173.
[2] CAPLICE E, FITZGERALD G F. Food fermentation: role of microorganisms in food production and preservation[J]. International Fournal of Food Microbiology, 1999, 50(1/2): 131-149.
[3] 潘磊庆, 唐琳, 詹歌, 等. 电子鼻对芝麻油掺假的检测[J]. 食品科学, 2010, 31(20): 318-319.
[4] 王霞, 黄健, 苏秀榕, 等. 电子鼻结合气相色谱-质谱联用技术分析黄鳍金枪鱼肉的挥发性成分[J]. 食品科学, 2012, 33(12): 268-272.
[5] 姜琳琳. 鱼肉中挥发性风味物质的研究进展[J]. 渔业现代化, 2007, 34(5): 54-56.
[6] 张娟. 产弹性蛋白酶芽孢杆菌的选育及发酵条件的优化[D]. 成都:四川农业大学, 2007: 11.
[7] 吴薇, 顾赛麒, 陶宁萍. 熟制刀鱼肉挥发性风味轮廓研究[J]. 食品工业科技, 2013, 34(6): 163-166.
[8] 王镜岩, 朱圣庚. 生物化学: 上[M]. 北京: 高等教育出版社, 2002: 355-363.
[9] DUTTA R, KASHWANK R, BHUYAN M, et al. Electronic nose based tea quality standardization[J]. Neural Networks, 2003, 16(5/6): 847-853.
[10] LABRECHE S, BAZZO S, CADE S, et al. Shelf life determination by electronic nose: application to milk[J]. Sensors and Actuators B: Chemical, 2005, 106(1): 199-206.
[11] 李应华, 苏巧艳. 发酵香肠中乳酸菌的应用研究[J]. 肉类加工, 2009(5): 21-22.
[12] 黄燕, 吴平. SAS统计分析及应用[M]. 北京: 机械工业出版社, 2006: 315.
[13] 唐晓伟, 张万清, 耿利华, 等. 电子鼻评价甜瓜成熟度及风味的研究[J].中国农学通报, 2010, 26(21): 75-80.
[14] 胡桂仙, 王俊, 海铮, 等. 不同储藏时间柑橘电子鼻检测研究[J]. 浙江农业学报, 2006, 18(6): 458-461.
[15] 朱清顺, 柏如发. 养殖中华绒鳌蟹风味品质比较研究[J]. 中国农学通报, 2008, 24(3): 463-468.
[16] IGLESIAS J, MEEDINA I, BIANCHI F, et al. Study of the volatile compounds useful for the characterisation of fresh and frozen-thawed cultured gilthead sea bream fish by solid-phase microextraction gas chromatography mass spectrometry[J]. Food Chemistry, 2009, 115(4): 1473-1478.
[17] 王磊, 刘学军. 草鱼肉发酵香肠的发酵工艺研究[J]. 食品工业科技, 2011, 32(2): 172-173.
[18] 章建浩, 朱健辉, 王莉, 等. 干腌火腿品级风味品质指标分析研究[J].食品科学, 2005, 26(9): 95-100.
[19] 要萍, 乔发东, 闰红, 等. 宣威火腿挥发性成分的分离与鉴定[J]. 食品科学, 2004, 25(2): 146-150.
[20] 蔺佳良, 廖芳芳, 苏秀榕, 等. 中华绒螯蟹不同部位挥发性物质的研究[J]. 核农学报, 2014, 28(2): 259-269.
[21] 张华. 反式-2-烯醛类化合物和反-2,4-二烯醛类化合物在香精中的应用[J]. 香精香料化妆品, 2006(2): 30-34.
[22] CHUNG H. Aroma extract dilution analysis of volatile compounds from crab meat[J]. Journal of Agricultural and Food Chemistry, 1994, 42(12): 2867-2870.
[23] CHEN Dewei, ZHANG Min. Analysis of volatile compounds in Chinese mitten crab[J]. Journal of Food and Drug Analysis, 2010, 14(3): 297-300.
[24] 莫树平, 林嘉慧, 柏建玲, 等. 肉制品中的风味物质及其分析方法[J].中国调味品, 2007(1): 25-30.
[25] 张晓鸣. 食品风味化学[M]. 北京: 中国轻工业出版社, 2009: 155-181.
[26] 黄骆镰, 黄克, 肖如武. 水产品腥味物质形成机理的研究进展[J]. 广东化工, 2009(9): 146-161.
[27] MOTTRAM D S. Flavor formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62(4): 415-424.
[28] 沙希迪, 李洁. 肉制品与水产品的风味[M]. 北京: 中国轻工业出版社, 2001: 6-17.
[29] SHAHIDI E. 肉制品与水产品的风味[M]. 李洁, 朱国斌, 译. 北京:中国轻工业出版社, 2001: 117.
[30] 陈俊卿, 王锡昌. 项空固相微萃取-气相色谱-质谱法分析白鲢鱼中的挥发性成分[J]. 质谱学报, 2005, 26(2): 76-80.
[31] 韩娇娇, 裘迪红, 宋绍华. 电子鼻检测植物乳杆菌发酵草鱼中的风味物质[J]. 食品科学, 2012, 33(10): 208-211.
Changes in Volatile Flavor Components of Grass Carp Meat during Fermentation by Lactobacillus plantarum
QIU Dihong1, OU Changrong2, SU Xiurong2, MING Tinghong2
(1. Zhejiang Medical College, Hangzhou 310053, China; 2. School of Marine Sciences, Ningbo University, Ningbo 315211, China)
To explore the changes in volatile fl avor components during the fermentation of grass carp meat by Lactobacillus plantarum. The volatile compounds of fermented grass carp at different times were analyzed by electronic nose and headspace solid-phase micro-extraction combined with gas chromatography-mass spectrometry (GC-MS). The results revealed that electronic nose could obviously distinguish the flavor differences among fermented grass carp at different stages, and there was obvious difference in the fl avor components among these samples. Moreover, the volatile constituents of the grass carp samples fermented for different times were further analyzed by GC-MS, 54 volatile compounds being identified. During the fermentation process, the soily and fishy odor compounds including hexanal, heptanal and other aldehydes gradually decreased, while the mushroom fl avor compound, 1-octene-3-alcohol, gradually increased. In the later stage of fermentation, acetone responsible for mint aroma and other aroma components such as acetoin contributing to butter fl avor were produced. The GC-MS results were consistent with those of sensory analysis.
Lactobacillus plantarum; grass carp; electronic nose; gas chromatography-mass spectrometry (GC-MS); volatile components
TS254.4
A
1002-6630(2015)20-0174-07
10.7506/spkx1002-6630-201520033
2015-01-13
浙江医学高等专科学校科研基金项目(2015B05);国家自然科学基金面上项目(31271890)
裘迪红(1966—),女,教授,博士,研究方向为食品营养与卫生。E-mail:qiudihong@nbu.edu.cn
