脂肪酶型温度时间指示体系测定羊肉鲜度的应用研究
2015-12-21卢士玲郭素娟石河子大学食品学院新疆石河子832000
田 盼 卢士玲 郭素娟(石河子大学食品学院,新疆 石河子 832000)
新疆羊肉因其蛋白质含量丰富,胆固醇含量较低,具有一定的滋补功效,并且味道鲜美,膻味小,产自天然大草原,无污染,深受区内外消费者喜爱。羊肉品质测量的方法有很多,如挥发性盐基氮(TVB-N)[1]、过氧化值(POV)、剪切力(WBSF)、微生物总数、pH 值、红度(a*)、感官评定肌肉的色泽、气味、弹性、组织形态[2,3]等,而这些指标无法直观地对羊肉的新鲜程度进行判断,而是通过一定的时间和方法,根据测出来的数据对羊肉的新鲜程度进行判断。
脂肪酶型温度时间指示体系是通过pH的变化,引起指示剂颜色的变化的,同时羊肉的新鲜程度受温度时间的影响,因此指示体系的颜色可指示羊肉品质的变化历程,监控羊肉质量安全变化[4],所以体系的颜色变化,可以直观地反应羊肉的质量。国内外已有温度时间指示体系应用到蘑菇[5]、冷冻牛肉[6]、冷冻汉堡[7]等食品领域中的报道,中国对脂肪酶型温度时间指示体系研究较少,吴丹等[8,9]以碱性脂肪酶为基础对指示体系进行了研究。
本试验拟以郭素娟等[10]研究的脂肪酶型温度时间指示体系为基础,将羊肉和温度时间指示体系同时置于同一温度条件下的冷链贮运和销售中,利用温度时间反应体系检测颜色,同时对羊肉的各项理化指标进行测定,通过各项理化指标判定羊肉的新鲜程度,并与温度时间指示体系的颜色进行对比,判断该脂肪酶型温度时间指示体系的颜色与羊肉的新鲜程度的关系。
1 材料与方法
1.1 材料
羊肉:取自新疆石河子中心农贸市场,为宰后1h的绵羊肉;
甘氨酸(Glycine):分析纯,天津市大茂化学试剂厂;
脂肪酶:酶活力2万U/g,上海楷洋生物技术有限公司;
三丁酸甘油酯、无水乙醇:分析纯,上海楷洋生物技术有限公司;
溴代麝香酚兰:分析纯,北京化工厂;
聚乙烯醇(PVA-124):分析纯,天津市西尔斯化工有限公司。
1.2 仪器
申光色差仪:WSC-S型,海精密科学仪器有限公司;pH计:UB型号,德国赛多利斯集团;
电子天平:SL2002N型,上海民桥精密科学仪器有限公司;
磁力搅拌器:SH21-1型,上海梅颖浦仪器仪表制造有限公司;
全自动新型生化培养箱:ZXSD-1160型,上海智诚分析仪器制造有限公司;
数显型匀浆机:T25-DS25UC TRA-TURRAX型,德国IKA公司。
1.3 脂肪酶型温度时间体系试剂配制的方法
1.3.1 0.05mol/L pH 9.0的 Gly—NaOH 缓冲溶液的配制 50mL 0.2mol/L的 Gly溶液和8.8mL 0.2mol/L的NaOH溶液加蒸馏水定容至200mL。
1.3.2 混合pH指示剂的配制 取0.1%的甲酚红、0.05%的溴代麝香酚兰和0.1%的酚酞溶液的体积比为2∶3∶10。
1.3.3 2.0g/L脂肪酶溶液配制 称取0.2g脂肪酶,溶于0.05mol/L pH 9.0 的 Gly—NaOH 缓 冲 溶 液,定 容 至100mL,静置l h,过滤取滤液,即得2.0g/L的酶溶液,将滤液置于4℃以下保存,备用。
1.3.4 25g/L聚乙烯醇溶液配制 称取6.25g的聚乙烯醇粉末,加入0.05mol/L pH为9.0的Gly—NaOH缓冲液200mL,在80℃的超声波清洗机中保持1.5h,至完全溶解,冷却定容至250mL,备用[11]。
1.3.5 乳化液的配制 量取25g/L的聚乙烯醇溶液100mL,加入三丁酸甘油酯5mL,10 000r/min高速分散机[12,13],乳化6min,中间暂停5min(即3—5—3min),乳化液冷藏备用。
1.3.6 1mol/L Ca2+溶液的配制 称取11.1g氯化钙,加去离子水定容至100mL,即得1mol/L Ca2+溶液。
1.4 试验方法
将羊肉和温度时间指示体系同时置于同一温度条件下的冷链中,通过可调节的冷藏箱模拟0,4,10,15,20℃下的冷链过程,随着贮藏时间的变化,测定羊肉的剪切力、挥发性盐基氮、pH值、过氧化值、红度、微生物总数、感官品质,同时监控混合指示剂的颜色,最后以不同指标数据为依据判断的新鲜程度与指示剂颜色进行对比。
1.5 各指标的检测方法
1.5.1 剪切力 (WBSF)的 测定 按 NY/T 1180—2006执行。
1.5.2 挥发性盐基氮(TVB-N)的测定 按 GB/T 5009.44—2003执行。
1.5.3 pH值的测定 按 GB/T 9695.5—2008执行。
1.5.4 过氧化值(POV)的测定 按 GB/T 5538—2005执行。
1.5.5 红度(a*)的测定 采用色彩色差计测定。
1.5.6 微生物总数的测定 每天取样,在无菌条件下称取25g样品(3个平行),加灭菌生理盐水225mL,摇床振摇30min。取1mL上清液依次进行10倍递增稀释,选取适合的稀释度,每个稀释度做3个平行,倾注平板。采用PCA培养基于37℃培养48h[14],计算菌落总数,每个样品菌落总数取平均值后的对数值(N)。
1.5.7 感官评定标准 按GB/T 9961—2008中的羊肉感官要求,分成不同等级进行评定,感官评定标准见表1。

表1 羊肉贮藏期间感官评定标准Table 1 Evaluation standards of sense-organs index during mutton's storage
2 结果与分析
2.1 贮藏期间羊肉剪切力的变化
由图1可知,在0~4℃条件下,前4d的剪切力值呈上升趋势,酮体进入尸僵阶段,第5天完成解僵成熟,剪切力值开始下降;在10℃条件下,从第0天到第2天的剪切力值呈上升趋势,酮体进入尸僵阶段,由于温度较高,2d后酮体完成了成熟阶段,进入到酮体自溶阶段,导致羊肉的剪切力一直下降;在15,20℃条件下,由于高温的环境,提高了酶的活性,加快了蛋白质的降解速度,从而改善了肉的嫩度[15],因此羊肉完成僵直解僵和成熟的速度越快,剪切力值下降的速度也越快。

图1 贮藏期间羊肉剪切力的变化Figure 1 The change of mutton shear force during storage
2.2 贮藏期间羊肉挥发性盐基氮(TVB-N)的变化
根据 GB/T 5009.44—2003的判定标准,TVB-N的含量不高于15mg/100g时,为一级鲜肉;TVB-N的含量介于15~25mg/100g时,为二级 鲜 肉;TVB-N 的 含 量 高 于25mg/100g为腐败肉。由图2可知,羊肉在0~4℃条件下,可以储藏11d,在10℃条件下可以储藏5d,15℃条件下可以储藏4d,20℃条件下可以储藏3d。因此,在运输和销售过程中,偶有短时间的温度波动对其影响不会太大,可以满足运输和市场销售时间。
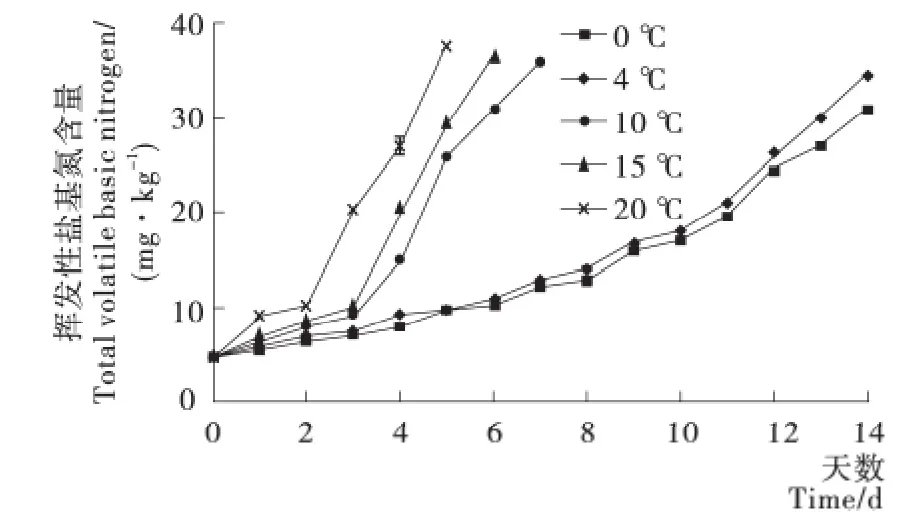
图2 贮藏期间羊肉挥发性盐基氮(TVB-N)的变化Figure 2 The change of mutton TVB-N values during storage
羊肉在0~4℃条件下,TVB-N含量在前4d时呈现较平稳的增高趋势,这个变化仅来自于肉自身内环境中蛋白酶水解蛋白质,产生盐基氮类含氮物,所以不会有明显的增高变化,而10,15,20℃条件下,TVB-N的含量从第3天开始骤然增高,这一方面是由于在高温条件下,酮体内环境中的蛋白酶的活性增高,酶促反应加快了蛋白质的水解,产生了更多的盐基氮类含氮物;另一方面,空气中的各种微生物在高温下开始在肉的表面进行繁殖,一些蛋白质分解菌产生胞外蛋白酶,会促进蛋白质继续分解,导致了TVB-N的急剧增加。而0~4℃条件下,随着贮藏时间的不断延长,空气中降落在肉表面的各种微生物开始增值,一些蛋白质分解菌产生胞外蛋白酶,会促进蛋白质继续分解,在贮藏后期,肉质发生腐败变质,在内外因素的影响下,肉中的蛋白质等物质,分解产生大量的含氮物,因此致使TVB-N含量在贮藏后期呈现增长趋势,与羊肉在贮藏期的新鲜度呈正相关。
2.3 贮藏期间羊肉pH值的变化
刚刚屠宰的酮体pH值在7.1~7.3,呈出中性或弱碱性[16]。由图3可知,刚刚屠宰2~3h,酮体的pH值为7.11左右,此时酮体还保有体温,没有发生糖酵解;0~4℃,羊肉pH值在第2天降到6.10左右,这一阶段为糖酵解阶段,酮体为了维持宰前新陈代谢,糖原在缺氧情况下进行糖酵解,生成了乳酸;接着pH值又继续下降,降低至5.69左右,大量的ATP被消耗,此阶段称为僵直阶段;随后pH值又回升到6.46左右,此时羊肉完成成熟阶段;紧接着进入到自溶阶段,pH值又开始下降,这是因为一些蛋白质分解菌产生的胞外蛋白酶和胞内酶的共同作用,蛋白质被分解成脂肪酸,此外一些产酸微生物生成酸性产物,导致了pH值的下降。贮藏在10,15,20℃条件下的羊肉也相继经历糖酵解阶段、僵直阶段、成熟阶段、自溶阶段,由于温度的影响,它们在各温度条件下进入阶段的时间不同,与羊肉的新鲜度呈负相关。
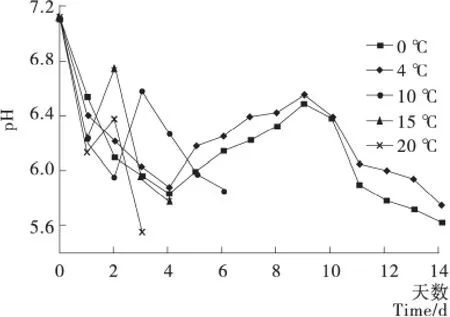
图3 贮藏期间羊肉pH值的变化Figure 3 The change mutton pH values during storage
2.4 贮藏期间羊肉过氧化值(POV)的变化
羊肉主要由肌肉、脂肪和结缔组织等构成,羊肉表面脂肪含量较为丰富,脂肪组织的pH值呈中性,呼吸活性差,脂肪难以在有氧存在的环境下发生自动氧化,但是Fe—O复合物和活性氧对脂肪的氧化具有促进作用[17],所以,减少脂肪的氧化反应,是保证羊肉质量品质的重要因素之一。另外,脂肪在羊肉宰后的冷链运输中能够形成一层隔膜,起到隔离层的作用,减少羊肉的老化。由图4可知,在10~20℃贮藏条件下,从贮藏期第2天开始,脂肪氧化速率加快,POV值大幅度上升,这是由于羊肉在高温条件下,贮藏后期羊肉腐败程度加深,促进了脂肪的氧化,使POV值显著升高。0~4℃时,POV值一直呈现缓慢增长趋势,从第10天开始,羊肉在贮藏后期腐败程度加深,脂肪氧化程度加大,使POV值显著增大。
2.5 贮藏期间羊肉红度(a*)的变化

图4 贮藏期间羊肉过氧化值(POV)的变化Figure 4 The change of mutton POV values during storage
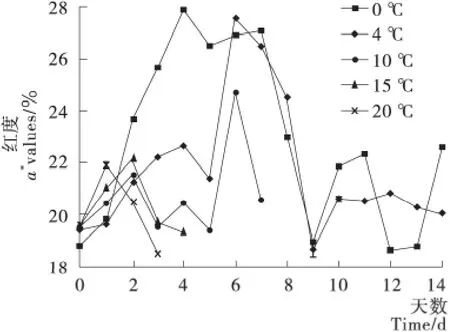
图5 贮藏期间羊肉a*值的变化Figure 5 The change mutton a*values during storage
羊肉的色泽是评估羊肉品质的重要指标之一,在贮藏期间羊肉颜色的变化一方面与羊肉中色素蛋白的含量、化学存在形式、分布情况有关,另一方面,在测量肉的组织结构时,与入射光的吸收和散射能力有关。利用色差计对羊肉的色泽进行分析,由图5可知,不同温度下,a*值相差很大,这主要是在不同的温度下,羊肉中的色素蛋白的含量和化学形式发生了变化,导致了色泽变化,但是总的趋势是相同的,先增加,降低,再增加。在糖酵解阶段之前,各温度下的a*都呈现增长趋势,这是由于刚刚屠宰过的酮体尚未消耗氧气,肉中色素蛋白的含量较高;进入糖酵解阶段,肉中色素蛋白的含量降低,化学存在形式发生变化,所以a*值降低;随着贮藏时间的延长和与空气中接触面积的增大,羊肉的氧化程度增高,而羊肉的颜色与羊肉的氧化程度呈正相关,所以羊肉的a*值增加。
2.6 贮藏期间羊肉微生物总数的变化
贮藏温度不同,相同天数菌落总数差异很大。由图6可知,在贮藏期间,不同贮藏温度的菌落总数从103CFU/g增加到106CFU/g所用的时间分别是:0~4℃为11~12d,10~15℃为4~5d,20℃为2~3d。在15~20℃的高温条件下,在贮藏末期,细菌的生长繁殖速率加快,加速了羊肉的腐败变质,菌落总数接近于108CFU/g。
2.7 贮藏期间羊肉感官品质的变化
由表2可知,羊肉的各项指标随时间的延长评分变化呈现降低趋势,未写明的评分点羊肉的各项感官指标在10~20℃高温条件下,变化较快,严重缩短了羊肉的货架期,在0~4℃条件下贮藏到第14天时羊肉出现了恶臭味,表面有粘稠物,颜色呈现出绿色,结合羊肉 TVB-N值的变化(图2),可知此时的羊肉已经腐败变质。
2.8 羊肉新鲜程度与反应体系颜色对比
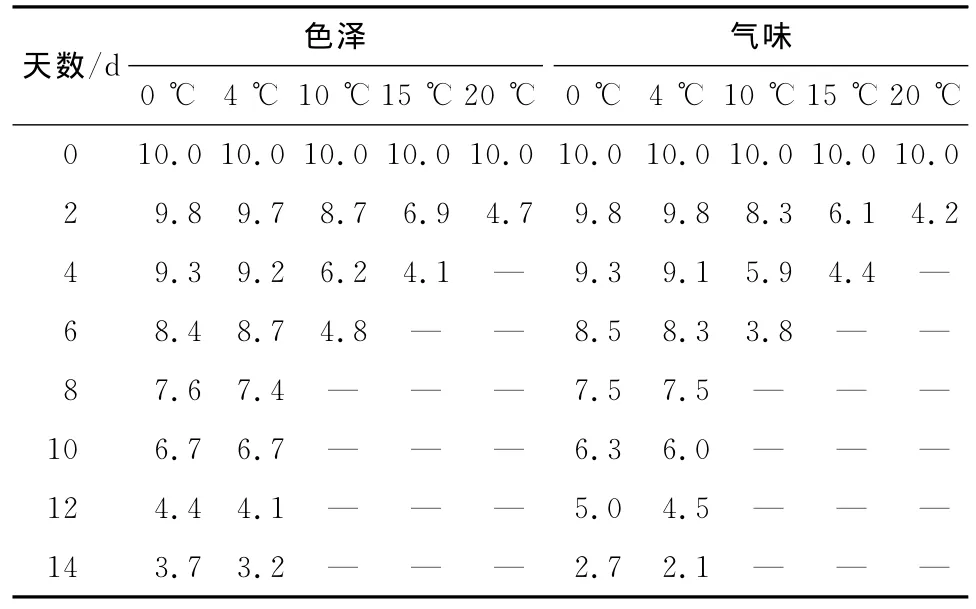
表2 羊肉贮藏期间的感官评分结果Table 2 The result sense-organs index of mutton during storage
从脂肪酶型温度时间指示体系中混合指示剂的颜色变化与羊肉各项理化指标(图1~6)和感官指标的变化(表2)相结合,由各项理化指标和感官指标判断羊肉新鲜程度。由表3可知,通过混合指示剂的颜色可清晰准确地鉴别,当羊肉为一级鲜肉时,混合指示剂的pH大于7.50,颜色为紫色、蓝色、青绿色;羊肉为二级鲜肉时,混合指示剂介于7.50~6.80,颜色为淡绿色、黄绿色;羊肉为腐败肉时,混合指示剂的pH小于6.80,颜色为黄色、浅黄色。

表3 羊肉新鲜程度与反应体系颜色对照表Table 3 Mutton freshness and color reaction
3 结论
通过本试验的研究,了解了羊肉在贮藏期间基于温度时间指示条件下各理化指标和感官指标的变化,并以羊肉的各理化指标和感官评定为依据判定羊肉的新鲜程度,结合脂肪酶型温度时间指示体系的颜色,得出该脂肪酶型温度时间指示体系,通过混合指示剂的颜色可清晰准确地鉴别。羊肉为一级鲜肉时,混合指示剂的pH大于7.50,颜色为紫色、蓝色、青绿色;羊肉为二级鲜肉时,混合指示剂介于7.50~6.80,颜色为淡绿色、黄绿色;羊肉为腐败肉时,混合指示剂的pH小于6.80,颜色为黄色、浅黄色。
1 Kalae P,Krizek M,Pelikanova T,et al.Contents of poly-amines in seleeted foods[J].Food Chemistry,2005,90(4):561~564.
2 石亚中,伍亚华,许晖,等.竹叶黄酮与Vc、VE复配对冷却猪肉品质的影响[J].食品与机械,2013,29(1):180~183.
3 刘骁,谢晶,林永艳,等.复合生物保鲜剂对猪肉保鲜的研究[J].食品与机械,2011,27(6):199~203.
4 Bobelyn E,Hertog M,Nicolaim.Applicability of an enzymatic time temperature integrator as a quality indicator for mushrooms in the distribution chain[J].Postharvest Biology and Technology,2006,42(1):104~114.
5 王晓原,李军.GM(1,1)模型在区域物流规模预测中的应用[J].武汉理工大学学报(交通科学与工程版),2005,29(3):613~615.
6 Rodriguez N,Zaritzky N E.Development of a time-temperature integrator indicator for frozen beef[J].Food Sci.,1983,48(5):1 526~1 531.
7 Wells J H,Singh R P,Noble A C.A graphical interpretation of time-temperature related quality changes in frozen food[J].Food Sic.,1987,52(2):436~439.
8 吴丹.碱性脂肪酶货架寿命指示体系的开发[D].杭州:浙江大学,2005.
9 宁鹏,费英,徐幸莲,等.碱性脂肪酶性时间—温度指示卡反应体系的研究[J].南京农业大学学报,2009,32(1):115~120.
10 郭素娟,卢士玲,李开雄,等.基于TTI的冷鲜羊肉新鲜度研究[J].食品工业科技,2014,35(13):112~116.
11 George Petee Wachtell.Time temperature integrating indicator device and method:US,3965741[P].1976—06—29.
12 Ronald J Veitch,Helmut Jakusch,Peter Heilmann.Temperature indicator for deep frozen products:US,5490476[P].1996—02—13.
13 Sigmund Hoffman.Frozen food thawing indicator:US,2553369[P].1948-11-16.
14 杨华,娄永红.国产碱性脂肪酶的测定方法和特性研究[J].中国食品学报,2006,6(3):138~142.
15 秦瑞升,谷雪莲,刘宝林.不同贮藏温度对速冻羊肉品质影响的实验研究[J].食品科学,2007,28(8):495~497.
16 李利.不同温度处理对羊肉宰后成熟速度和食用品质的影响[D].内蒙古:内蒙古农业大学,2003.
17 罗欣,黄明,朱燕.电刺激技术在牛肉快速成熟中的应用研究[J].农业工程学报,2001,17(6):127~131.
