龙眼核提取物的体外抗氧化及抑菌活性研究
2015-12-21胡卓炎周沫霖华南农业大学食品学院广东广州510642
周 凯 胡卓炎 周沫霖 赵 雷(华南农业大学食品学院,广东 广州 510642)
龙眼(Dimocarpus longan lour.)俗名桂圆,是无患子科龙眼属植物,属于典型的亚热带果树,在中国主要分布于广东、广西、福建及台湾一带,海南、云南、四川和贵州等省也有栽培,产量居世界首位。龙眼核即龙眼的种仁,占果实鲜重约为17%(干品约75%),其性味涩、平,气微,味淡而微苦,具有止血、定痛、理气化湿、治创伤出血、疝气等和治狐臭作用[1]。龙眼核的化学成分和药理活性研究发现,其提取物中含有多糖、生物碱、黄酮和多酚类等活性物质[2-7],具有良好的抗氧化[6,8]、抑菌及降血糖等生物活性[9-12]。目前龙眼加工基本以制成龙眼干、桂圆肉、龙眼果肉罐头为主,龙眼核是加工过程中产生的主要废弃物,每年废弃的龙眼核高达几十万吨[13]。本研究以龙眼核为原料,通过95%乙醇提取,得到的粗提物用不同极性的有机溶剂萃取,经浓缩、干燥后研究各萃取物的抗氧化和抑菌活性,以期为龙眼核药用植物资源的充分利用和合理开发提供依据。
1 材料与方法
1.1 材料与试剂
龙眼核:品种为石硖,购于广州天河区长湴综合市场;
无水乙醇、95%乙醇:分析纯,天津富宇精细化工有限公司;
石油醚(沸程60~90℃)、氯仿、乙酸乙酯、正丁醇、邻苯三酚、抗坏血酸、没食子酸等:分析纯,国药集团化学试剂有限公司;
Folin-Ciocalteu:美国Sigma公司;
1,1-二苯基苦基苯肼(DPPH):梯希爱化成工业有限公司;
ABTS试剂盒:碧云天生物技术有限公司;
供试菌种:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella typhimurium),由华南农业大学食品学院微生物实验室提供。
1.2 仪器与设备
紫外分光光度计:uvmini-1240型,岛津公司;
酶标仪:EnsPire型,珀金埃尔默企业管理(上海)有限公司;
真空冷冻干燥机:FD-1C型,北京博医康实验仪器有限公司;
离心机:TD5-II型,长沙平凡仪器有限公司;
旋转蒸发仪:RE-52A型,上海亚荣生化仪器厂;
人工气候箱:LRH-250-GSB型,广东省医疗器械厂。
1.3 试验方法
1.3.1 龙眼核粗提物及各萃取物的制备 将60℃下烘干至恒重的龙眼核粉碎至粉末状,取粉末200g,加入95%乙醇1L,70℃下利用搅拌机搅拌,提取3次,每次3h;合并提取液,离心15min(3 500r/min),50℃减压浓缩至无醇味的浸膏;浸膏加适量蒸馏水分散,用石油醚脱脂,氯仿、乙酸乙酯、水饱和正丁醇都与分散液体积比3∶1依次萃取,每种溶剂萃取4次,合并萃取液,50℃减压浓缩、回收溶剂;除石油醚浓缩物外,其他不同极性的浓缩物在真空冷冻干燥机中干燥,得到其质量分别为氯仿萃取物0.69g,乙酸乙酯萃取物4.14g,正丁醇萃取物4.19g,剩余水层物5.51g。
1.3.2 菌悬液的制备 试验前从保存菌种斜面上用接种环蘸取微量的菌苔,接种在MH肉汤培养基中,于37℃培养16~18h,取出作为原菌液,再用MH肉汤培养基或1%灭菌胨水把原菌液稀释成菌液浓度为106~107CFU/mL的菌悬液。
1.3.3 总酚含量测定 参照文献[14]的方法并稍作改进,取0.2mL样品溶液于10mL容量瓶,加入5.8mL蒸馏水,摇匀,再加0.5mL福林酚溶液充分混匀30s,室温下反应3~8min加入15%碳酸钠溶液1.5mL,定容至10mL,在室温下避光放置2h后在765nm下测定其吸光值,并以没食子酸标准品制作标准曲线,得线性回归方程y=0.109 3x-0.035 3,线性范围为0~0.1mg,相关系数R2为0.998 6。
1.3.4 体外抗氧化活性的测定
(1)ABTS+自由基清除能力的测定:参照文献[15]。萃取物清除ABTS+自由基的能力与Trolox清除自由基的能力相对比。确定其相对抗氧化活性,单位为mmol/g,即每克萃取物样品清除ABTS+自由基能力相当于Trolox清除同等自由基能力的毫摩尔数。
(2)DPPH 自由基清除能力的测定:参照[16]、[17]。
(3)超氧阴离子自由基清除能力的测定:邻苯三酚自氧化法[18-20]。
(4)羟自由基清除能力的测定:邻二氮菲—Fe2+氧化法[21-23]。
以水溶性维生素E(Trolox)和抗坏血酸为阳性对照,以上试验平行样均为3个,取平均值。
1.3.5 体外抑菌活性的测定 采用牛津杯法[24]。将配好的菌悬液用无菌棉签蘸取菌液在管壁上挤去多余菌液,涂布整个平板表面,涂布均匀,制成含菌平板。用镊子将灭菌后的牛津杯轻轻放入培养皿中,在水平放置的平皿中均匀地放置3只牛津杯(规格10mm×7.8mm×6mm),逐一加入各样液150μL,以无菌水与95%乙醇作为阴性对照,质量浓度为1mg/mL的阿莫西林作为阳性对照。细菌37℃恒温培养24h后,观察抑菌情况,用直尺测量抑菌圈直径,每个平板做3个平行样,取平均值。
2 结果与分析
2.1 龙眼核粗提物不同极性部位的总酚含量
龙眼核粗提物依次用不同有机溶剂萃取得到氯仿萃取物、乙酸乙酯萃取物、正丁醇萃取物及剩余水层物,以龙眼核粉末200g为总质量来计算,经真空冷冻干燥后各部分萃取物得率分别为0.35%,2.07%,2.10%,2.78%。采用Folin-Ciocalteu比色法测定龙眼核粗提物中各萃取物的总酚含量,结果见图1,总酚含量由高到低为:乙酸乙酯层>氯仿层>正丁醇层>剩余水层,其中乙酸乙酯层的总酚含量高达693.51mg/g。
2.2 龙眼核粗提物不同极性部位的抗氧化活性

图1 龙眼核粗提物不同极性部位的总酚含量Figure 1 The total polyphenol contents in crude extract of different polarity parts of Longan seeds
2.2.1 清除ABTS·+的能力 由图2可知,随着浓度上升,各物质对ABTS·+的清除能力逐渐增大,测试样品浓度与清除率呈一定的量效关系。当Trolox的摩尔浓度为0.9mmol/L时对 ABTS·+的清除率达到平衡,清除率为94.00%,随着浓度的增加,清除率缓慢增大,很快达到平衡。利用Origin 8.0进行曲线拟合,得到乙酸乙酯、氯仿、正丁醇、剩余水层萃取物的IC50值分别为0.10,0.14,0.39,1.27mg/mL,Trolox的IC50值为0.35mmol/L,同时可估算出其总抗氧化能力分别为3.5,2.5,0.9,0.3mmol/g。龙眼核各萃取物对ABTS·+的清除能力有显著差异,其总抗氧化能力由高到低依次为:乙酸乙酯层>氯仿层>正丁醇层>剩余水层。
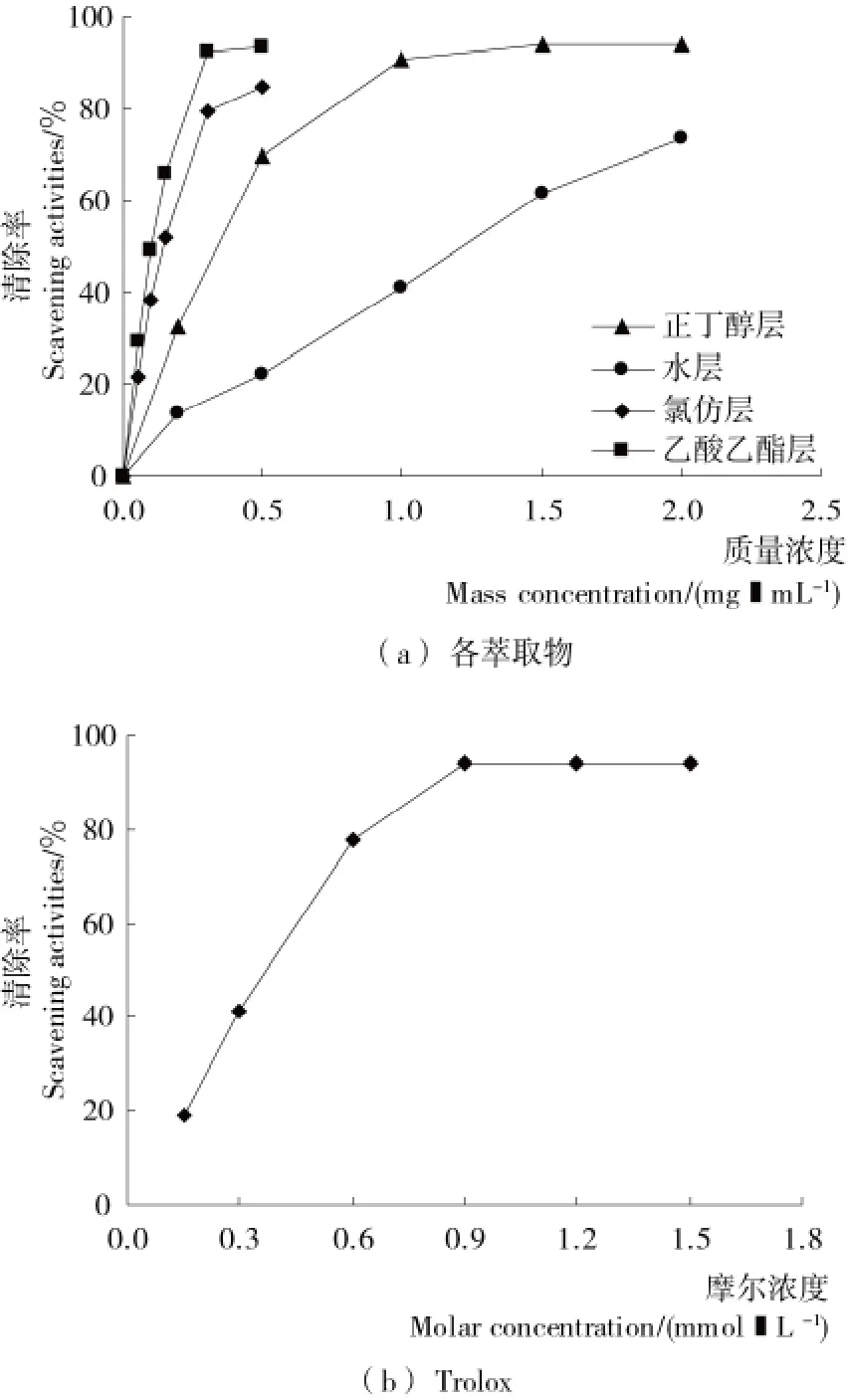
图2 龙眼核各萃取物及Trolox对ABTS·+的清除Figure 2 The ABTS·+radical scavenging activities ofTrolox and four fractions of Longan seeds
2.2.2 清除DPPH·的能力 由图3可知,在一定质量浓度范围内,各物质的抗氧化能力都随浓度的增加而增强。乙酸乙酯层和氯仿层对DPPH·的清除能力都比抗坏血酸强,随着浓度增加,清除率很快达到平衡,其IC50值分别为0.13,0.16mg/mL,抗坏血酸的IC50值为0.35mg/mL。而正丁醇层和剩余水层对DPPH·的清除能力相对较弱,当浓度为2mg/mL时,清除率分别为37.23%和31.77%,由于正丁醇层和剩余水层对DPPH·的清除能力太低,因此未能测出IC50值。

图3 龙眼核各萃取物及抗坏血酸对DPPH·的清除能力Figure 3 The DPPH·radical scavenging activities of ascorbic acid and four fractions of Longan seeds

图4 龙眼核各萃取物和抗坏血酸对·的清除能力Figure 4 The·radical scavenging activities of ascorbic acid and four fractions of Longan seeds
2.2.4 清除·OH的能力 羟基自由基是自由基中最为活跃的,其来源可由H2O2在金属离子如Fe2+、Cu2+的催化下进行Fenton反应(Fe2++H2O2→Fe3++OH-+·OH)所生成。·OH极易与生物体分子反应,引起DNA链断裂、蛋白质变性、酶失活、生物膜结构损伤、细胞解体乃至机体病变和死亡,所以·OH是对生物体危害最大的活性氧物质。
由于龙眼核各萃取物中主要抗氧化物质多酚的含量存在显著差异,多酚浓度过高易与铁离子结合形成一种紫色络合物,从而影响对反应液吸光度的观察,为了更好地观察它们对·OH的清除效果,故选择了不同的浓度范围。由图5可知,各物质清除·OH均有明显的量效关系。在相同浓度范围内,抗坏血酸的·OH清除能力大于正丁醇萃取物,当浓度为1mg/mL时,其清除率基本持平,分别为56.56%和56.36%。乙酸乙酯层对·OH的清除效果最好,其次是氯仿层,当达到其最大浓度时,清除率分别为70.45%和55.19%,而水层的清除能力最弱,最高为49.92%。除水层外,抗坏血酸、正丁醇层、氯仿层和乙酸乙酯层的IC50分别为525.2,712.5,459.8,130.5μg/mL。
2.3 龙眼核粗提物不同极性部位的抑菌活性

图5 龙眼核各萃取物及抗坏血酸对·OH的清除能力Figure 5 The·OH radical scavenging activities of ascorbic acid and Four fractions of Longan seeds
通过牛津杯法对龙眼核粗提物不同极性部位的抑菌效果进行比较,结果(表1)表明,除水层对沙门氏菌和大肠杆菌均无明显抑制作用外,4种萃取物对沙门氏菌、大肠杆菌和金黄色葡萄球菌具有不同强度的抑制作用,且对革兰氏阳性菌的抑制效果明显强于对革兰氏阴性菌的抑制效果。其中乙酸乙酯层对沙门氏菌、大肠杆菌、金黄色葡萄球菌的抑制效果最强,其抑菌圈直径分别为15.0,18.1,18.9mm。另外,试验中阿莫西林对金黄色葡萄球菌的抑制作用很强,说明这一种金黄色葡萄球菌为不产β-内酰胺酶的葡萄球菌。不同浓度的氯仿层和乙酸乙酯层对这3种致病菌均有较好的抑制作用,并呈现出良好的剂量效应关系。
表1 龙眼核各萃取物的抑菌圈直径Table 1 The diameter of antiblatstic circle of different extract from longan seeds(x ±sd,n=3)

表1 龙眼核各萃取物的抑菌圈直径Table 1 The diameter of antiblatstic circle of different extract from longan seeds(x ±sd,n=3)
“-”表示无抑菌圈,阿莫西林为1mg/mL。
供试样品 浓度/(mg·mL-1)沙门氏菌/mm大肠杆菌/mm金黄色葡萄球菌/mm氯仿层乙酸乙酯层正丁醇层水层 阴性对照阳性对照2.5 5.0 10.0 2.5 5.0 10.0 2.5 5.0 10.0 2.5 5.0 10.0无菌水95%乙醇阿莫西林-8.7±0.6 10.5±0.9 10.5±0.8 11.7±1.1 15.0±1.3- -9.1±0.6 -----17.2±2.1 9.3±0.7 9.9±0.9 11.0±0.7 14.3±1.1 14.7±1.4 18.1±1.7- -9.4±0.6-----14.6±1.1 9.8±0.7 11.6±0.9 15.4±1.3 13.9±1.1 15.1±1.0 18.9±1.4 12.1±0.9 16.5±1.1 18.5±1.3 11.6±0.7 13.0±0.8 14.6±1.1 - -40.7±2.3
3 讨论
用不同极性的有机溶剂对龙眼核95%乙醇提取物进行萃取,发现不同萃取物的总酚含量存在显著差异,其中乙酸乙酯层的总酚含量最高,达到69.35%。体外抗氧化试验中,龙眼核4种萃取物在不同的抗氧化体系中对不同的自由基表现出不同的清除能力,总体上表现为对ABTS·+、DPPH·的清除能力强于对·OH的清除能力,而对·的清除能力表现最弱,这可能与龙眼核抗氧化活性成分对不同自由基的敏感性及作用机理差异有关,这与黄晓冬[13]的研究结果基本一致。在试验范围内,4种萃取物对ABTS·+、DPPH·和·OH的清除作用由强到弱依次为:乙酸乙酯萃取物>氯仿萃取物>正丁醇萃取物>水层剩余物。说明龙眼核中的多酚类抗氧化物质主要为小分子化合物,极性较小,易溶于乙酸乙酯等极性较小的有机溶剂,导致乙酸乙酯部分总酚含量最高[25]。而抗氧化活性与总酚含量直接相关,总酚含量越高,则其抗氧化活性越好。因此乙酸乙酯萃取物的抗氧化活性最强,氯仿萃取物的抗氧化活性次之,而剩余水层物的抗氧化活性则最弱。
体外抑菌试验显示,除剩余水层物对沙门氏菌和大肠杆菌均无明显抑制作用外,4种萃取物对沙门氏菌、大肠杆菌和金黄色葡萄球菌具有不同强度的抑制作用,且对革兰氏阳性菌的抑制效果明显强于对革兰氏阴性菌的抑制效果,其原因可能与两种菌在细胞壁结构组成上的差异有关。一般革兰氏阳性菌细胞壁的主要成分是肽聚糖和少量磷壁酸,它对糖类、氨基酸和大部分离子来说容易透过,溶质通透性较强,且一般对青霉素、磺胺类药物敏感;而革兰氏阴性菌的细胞壁结构复杂,由肽聚糖层和外膜构成,不太容易被破坏,且外膜的负电荷较强,能控制某些物质的进出[26]。龙眼核剩余水层物中的成分多为蛋白质、多糖、鞣质等大分子化合物,难以通过革兰氏阴性菌的细胞壁并影响其生长代谢,所以它对沙门氏菌和大肠杆菌均无明显抑制作用,而对革兰氏阳性菌的抑制作用较为明显。同时,龙眼核各萃取物中多酚含量的不同使其对这3种供试菌的抑菌活性产生了差异,说明龙眼核中的多酚类物质可能是主要的抑菌活性成分。龙眼核中所含有的多酚类物质种类繁多,抑菌机制也多样化,虽然龙眼核不同极性萃取物对3种所试菌种表现出一定的抑菌作用,但还有必要进一步扩大供试菌种类,确定其抑菌谱和研究其抑菌机理,且需要进一步分离纯化其多酚类物质,以筛选出更加明确有效的抑菌活性成分。
龙眼核自古以来就被用来作为止血定痛,理气化湿,治创伤出血、疝气等病症的中药材,龙眼核中含有较为丰富的黄酮类和酚酸等多酚类物质,其主要的化学成分和结构逐渐被确定,所具有的抗氧化、抑菌、降血糖和抗癌等药理活性的研究也屡见报道[8-12,27]。因此,龙眼加工过程中废弃的龙眼核可以作为一种药用植物资源被加以综合开发利用,为中国的龙眼产业创造出更多的经济效益,并造福于人类。
1 江苏新医学院.中药大辞典(上册)[M].上海:上海科学技术出版社,1986:636~639.
2 Jiang Guo-xiang,Wen Ling-rong,Chen Feng,et al.Structural characteristics and antioxidant activities of polysaccharides from longan seed [J]. Carbohydrate Polymers,2012,92 (1):758~764.
3 贤景春,陈晨.龙眼核总生物碱提取工艺[J].食品研究与开发,2013,34(3):28~30.
4 黄晓兵,林丽静,周瑶敏,等.响应面法超声提取龙眼核黄酮工艺的优化[J].江西农业学报,2013,24(4):116~119.
5 Soong Y Y,Barlow P J.Quantification of gallic acid and ellagic acid from longan seed and mango kerneland their effects on antioxidant activity[J].Food Chemistry,2006,97(3):524~530.
6 Soong Y Y,Barlow P J.Isolation and structure elucidation of phenolic compounds from longan seed by high-p erformance liquid chromatography-electrospray ionization mass spectrometry[J].Journal of Chromatography A,2005,1 085(2):270~277.
7 Rangkadilok N,Worasuttayangkurn L,Bennett R N,et al.I-dentification and quantification of polyphenolic compounds in Longan(Euphoria longana Lam.)fruit[J].Journal of Agricultural and Food Chemistry,2005,53(5):1 387~1 392.
8 Zheng Gong-ming,Xu Liang-xiong,Wu Ping,et al.Polyphenols from longan seeds and their radical scavenging activity[J].Food Chemistry,2009,116(2):433~436.
9 邹金美,黄冰晴,韦丽香,等.龙眼核提取物的抑菌活性研究[J].漳州师范学院学报(自然科学版),2011(4):87~92.
10 黄晓冬.4种龙眼核提取物的总黄酮含量、体外抗菌活性与抗氧化活性[J].食品科学,2011,32(11):43~47.
11 黄儒强,刘学铭,曾庆孝.龙眼核提取物对α-葡萄糖苷酶抑制作用的研究[J].现代食品科技,2005,21(2):62~63.
12 黄儒强,邹宇晓,刘学铭.龙眼核提取液的降血糖作用[J].天然产物研究与开发,2006(18):991~992.
13 肖更生,黄儒强,陈卫东,等.龙眼核的营养成分[J].食品科技,2004(1):93~94.
14 Ronald E,Wrolstad,Terry E,et al.Handbook of food analytical chemistry:pigments,colorants,flavors,texture,and bioactive food components[M].New York:Wiley,2005:463~465.
15 Miller N J,Sampson J,Candeias L P,et al.Antioxidant activities of carotenes and xanthophylls[J].FEBS Letters,1996,384(3):240~242.
16 Turkoglu A,Duru M E,Mercan N,et al.Antioxidant and antimicrobial activities of Laetiporus sulphureus (Bull.)Murril[J].Food Chemistry,2007,101(1):267~273.
17 何志平,庞林江,茅林春,等.山核桃叶提取物的抗氧化活性比较[J].食品与机械,2011,27(3):45~48.
18 Ruch R J.Prevention of oytotoxicity and inhibition of intercellular communication by antioxidant catech in isolated from Chinese green tea[J].Carcinogenesis,1989(10):1 003.
19 张莲姬,南昌希,张丽霞.桔梗多糖的提取及其抗氧化作用研究[J].食品与机械,2008,24(3):60~63.
20 焦士蓉,郑贵菊.柚皮黄酮类物质的微波辅助提取及其抗氧化活性研究[J].食品与机械,2007,23(1):73~75,86.
21 梁志,左映平.龙眼核中总黄酮含量测定及其抗氧化性研究[J].云南化工,2010,37(5):14~16.
22 刘小玲,林莹,尹秀华,等.罗非鱼皮胶原肽的制备及抗氧化活性研究[J].食品与机械,2007,23(3):92~95.
23 何玲玲,王新,石中亮,等.水提板栗壳色素对羟自由基和超氧阴离子自由基的清除作用[J].食品与机械,2006,22(6):56~57,82.
24 周邦靖.常用中药的抗菌作用及其测定方法[M].重庆:科学技术出版社重庆分社,1987.
25 王淑霞,李爱梅,张俊杰,等.龙眼核多酚物质的液质联用分析及其抗氧化活性[J].食品科学,2011,32(12):196~203.
26 孙军德,杨幼慧,赵春燕.微生物学[M].南京:东南大学出版社,2009:18~21.
27 Chung Yuan-chiang,Lin Chin-cheng,Chou Chih-chung,et al.The effect of Longan seed polyphenols on colorectal carcinoma cells[J].European Journal of Clinal Investgation,2010(40):713~721.
