PTEN调节神经样细胞微管相关蛋白tau的聚集及意义
2015-12-21闫旭阚世廉金晔
闫旭,阚世廉,金晔
PTEN调节神经样细胞微管相关蛋白tau的聚集及意义
闫旭1,2,阚世廉2△,金晔3
目的观察体外诱导成人骨髓基质干细胞(BMSC)向神经细胞分化过程中,在第10号染色体缺失的磷酸酶及张力蛋白同源物基因(PTEN)调节细胞骨架中轴突标志分子微管相关蛋白tau(MAPT)分布及聚集的特征,并探讨其意义。方法从成人骨髓中分离基质干细胞,在体外经细胞因子诱导分化2周后成为神经样细胞,将未分化的BMSC作为对照组;应用半定量逆转录-聚合酶链反应(RT-PCR)和Western blot方法研究MAPT的表达变化;经PTEN抑制剂BPV作用于该细胞后,用结合有荧光剂的鬼笔环肽直接染色细胞微丝肌动蛋白,并联合用免疫荧光细胞化学方法染色MAPT,在激光共聚焦显微镜下观察MAPT和肌动蛋白的定位及关联性。结果成人骨髓来源的基质干细胞经诱导分化后,MAPT的mRNA在分化1周和2周时相对表达水平为0.24±0.04和0.52±0.04,高于对照组BMSC的0.04±0.02(P<0.05)。MAPT蛋白表达水平分别为0.18±0.03和0.44±0.05,高于对照组0.06±0.04(P<0.05)。细胞染色后,经BPV作用后MAPT由弥散状态变为聚集状态,并分布于细胞一侧,神经样细胞开始出现极性。结论BMSC来源的神经细胞分化成熟时,PTEN参与调节细胞骨架中轴突标志分子MAPT的转运和聚集,为神经细胞的轴突进一步生长提供物质支持。
肿瘤抑制蛋白质类;tau蛋白质类;细胞骨架;逆转录聚合酶链反应;免疫荧光测定;第10号染色体缺失的磷酸酶及张力蛋白同源物基因
微管相关蛋白是细胞骨架中微管主干蛋白之外的一些蛋白成分,占微管总蛋白成分的5%~20%,其中微管相关蛋白tau(microtubule-associated protein tau,MAPT)在中枢神经系统的神经元中非常丰富,而少见于其他细胞,并可作为神经轴突的标志分子[1]。最近研究表明,抑癌基因PTEN下调可以促进视神经轴突的再生[2]。但是PTEN如何影响神经细胞骨架,尤其是神经轴突内的MAPT转运和聚集的研究目前尚鲜见报道。本研究在体外成功诱导成人骨髓基质干细胞(bone marrow stem cells,BMSC)向神经细胞分化,旨在模拟神经细胞的发育,并观察PTEN调节的MAPT的分布变化,进一步分析PTEN下调在神经轴突再生方面的临床意义。
1 材料与方法
1.1 实验材料二喹啉甲酸(BCA)蛋白浓度测定试剂盒购于美国HyClone公司。Hoechst 33258购于北京欣经科公司。TRIzol购于美国Invitrogen公司。Ficoll-Paque Plus购于瑞典Amersham Biosciences。BSA购于美国Roche公司,表皮细胞生长因子(EGF)购于英国Pepro Tech公司。Oligo(dT)、MMLV和Taq DNA聚合酶购于美国Promega公司。脑源性神经营养因子(BDNF)、神经生长因子(NGF)和Phalloidin-FITC购于美国Sigma公司。PTEN抑制剂BPV购于美国Calbiochem公司。细胞裂解液及Western blot相关试剂盒购于美国Thermo公司。TRITC和辣根过氧化物酶(HRP)标记的山羊抗兔IgG购于北京中杉金桥。兔抗多物种MAPT多克隆抗体和兔抗多物种β-actin多克隆抗体购于日本Abcam。
1.2 方法
1.2.1 成人骨髓基质干细胞的分离和培养骨髓基质细胞取自成人开胸手术中弃置的肋骨。4℃无菌状态下用生理盐水冲出骨髓,在Ficoll-Paque分离液中2 000 r/min,20 min离心分离出单个核细胞,以细胞计数器计数。将原代细胞以1×105/cm2密度接种于明胶包被的100 mL培养瓶中,未贴壁细胞换液时被去除。不进行分化的BMSC培养于含有10% FBS的DMEM/F12培养基中。在10%FBS的DMEM/F12中再加入10 μg/L NGF、10 μg/L BDNF和10 μg/L EGF诱导细胞分化。原代细胞在培养1周和2周后以Trypsin-乙二胺四乙酸(EDTA)消化,计数后以1×105/cm2密度接种于35 mm培养皿中传代培养,以备研究。所有培养细胞置37℃、5% CO2培养箱中,隔日给予半量更换培养基。
1.2.2 神经细胞骨架中轴突标志分子MAPT mRNA的逆转录-聚合酶链反应(RT-PCR)及半定量分析BMSC和其诱导分化第1周和2周的细胞分别用TRIzol法提取总RNA,经反转录后获得cDNA。反转录反应体系为1 μg RNA及Oigo(dT)10 μL,5×Buffer 5 μL,10 mmol/L dNTP 1.5 μL,40 U/μL RNA酶抑制剂(rRNasin)1 μL,50 U/μL M-MLV 4 μL,加去DEPC水至25 μL,37℃反应60 min。MAPT基因的引物于上海生工生物工程有限公司合成,见表1。PCR体系包括10×Buffer 2.5 μL,10 mmol/L dNTP 0.5 μL,25 μmol/L引物正义链0.5 μL,25 μmol/L反义链0.5 μL,10 U/μLTaq DNA合成酶0.125 μL,cDNA 2.5 μL,加去DEPC水至25 μL。PCR程序为95℃3 min,94℃30 s,根据引物要求在58℃下退火30 s,72℃延伸1 min,共35个循环后,72℃下作用10 min,实验重复3次。取PCR产物5 μL在3%琼脂糖凝胶中90 V电泳30 min,应用TANON Gis-2016型紫外读胶仪(上海)观察,目标基因表达水平取其特异条带与相应β-actin条带灰度比值,经Gis 3.74凝胶图像处理系统分析后获得。

Tab.1Primer sequences of MAPT and β-actin gene表1 MAPT和β-actin基因特异性引物序列表
1.2.3 Western blot检测6孔板中BMSC、诱导分化1周和2周的神经样细胞共3组各取4孔,加人蛋白裂解液充分裂解后,12 000×g、4℃离心8 min,收集上清,提取总蛋白用于后续实验。采用BCA蛋白浓度测定试剂盒测定各样品总蛋白含量。按每孔20 μg上样10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,电转移至聚偏氟乙烯(PVDF)膜,50 g/L BSA封闭,以β-actin为内参。加入1∶1 000稀释的一抗(兔抗多物种MAPT和β-actin多克隆抗体)4℃过夜孵育,次日TBST(Tris-HCl、NaCl和Tween-20混合物)缓冲液洗膜后再加入二抗为HRP标记的山羊抗兔IgG(工作浓度为1∶1 000),室温孵育1 h,增强化学发光(ECL)法检测显影,重复实验3次。TANON Gis-2016型紫外读胶仪(上海)观察,经Gis 3.74凝胶图像处理系统进行灰度值定量,目标蛋白表达水平取其特异条带与相应β-actin条带灰度比值。按照Thermo公司试剂盒说明书进行操作。
1.2.4 用PTEN抑制剂BPV处理神经样细胞BMSC定向诱导分化2周的神经样细胞以Trypsin-EDTA消化,计数后以1×105/cm2密度接种于底部预置直径13 mm玻片的6孔培养板中传代后培养,玻片表面包被Matrigel基质胶作为细胞外基质,有利于细胞发生极化。PTEN抑制剂BPV以终浓度200 nmol/L溶于含有10%FBS的DMEM/F12培养基中,处理传代培养的细胞,作用维持1周。未经BPV处理的细胞传代后用含有10%FBS的DMEM/F12培养基继续培养,作为阴性对照。所有培养细胞置37℃、5%CO2培养箱中,隔日给予半量更换培养液。
1.2.5 细胞骨架肌动蛋白染色结合有绿色荧光剂FITC的鬼笔环肽(Phalloidin-FITC)和细胞骨架中的肌动蛋白特异性结合,使细胞骨架显示绿色。经过和未经过PTEN抑制剂BPV培养的细胞用PBS洗净,4%多聚甲醛在室温下固定5 min,用PBS充分洗净。细胞用0.1%的Triton X-100冰上透化处理30 min或更长。用50 mg/L Phalloidin-FITC 100 μL在室温下作用40 min,用PBS充分洗净。
1.2.6 MAPT免疫荧光细胞化学染色肌动蛋白经染色后,该细胞加入100 μL1∶50稀释的一抗(兔抗多物种MAPT多克隆抗体),4℃过夜孵育,抗体稀释液为3%BSA的PBS溶液。每个检测应包括2组对照,分别为:(1)与一抗同一种属、类型的无关抗体组,以检测染色的特异性。(2)未加一抗的对照组,以检测二抗染色的背景。洗掉未结合的一抗,二抗为1∶200稀释后的TRITC标记的山羊抗兔IgG,用含0.2%Triton X-100的PBS洗3次,Hoechst 33258复染细胞核。吸干后用80%甘油/PBS封片,在Leica TSF ST2激光共聚焦显微镜下观察10个以上视野、采集图像。
1.3 统计学方法采用SPSS 16.0统计软件包分析,各组各时间点目标基因表达灰度值以均数±标准差表示;多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法;并以P<0.05为差异有统计学意义。
2 结果
2.1 MAPT mRNA表达成人BMSC体外定向诱导分化1周和2周2时点神经细胞轴突特异性标志分子MAPT mRNA水平均高于对照组BMSC,灰度值显示在BMSC中MAPT的mRNA几乎没有表达,见图1、表2。
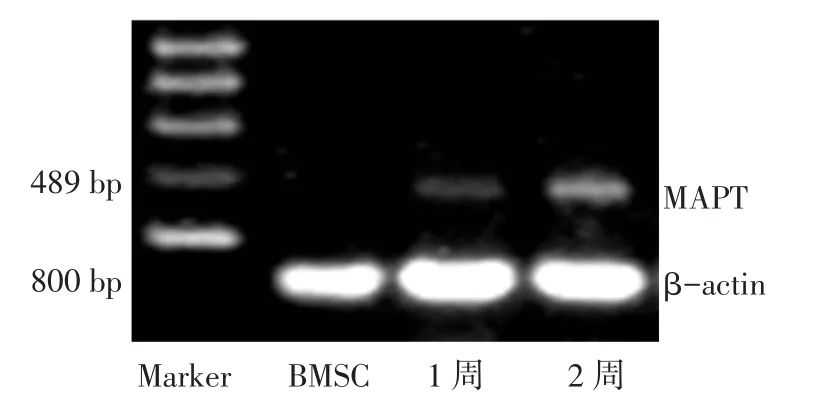
Fig.1MAPT mRNA expressions in different time points by RT-PCR图1 RT-PCR法检测各时间点MAPT mRNA的表达
2.2 MAPT蛋白表达神经样细胞MAPT蛋白表达水平1周和2周均高于对照组BMSC中的表达水平,灰度值显示在BMSC中几乎没有MAPT蛋白的表达,见图2、表2。
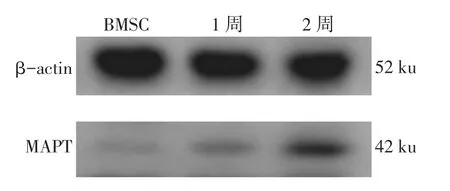
Fig.2MAPT expressions in different time points by Western blot analysis图2 Western blot法检测分化各时间点MAPT蛋白的表达
2.3 MAPT在神经样细胞中的分布特征神经样细胞中的MAPT染色为红色,在未经BPV处理前弥散在整个细胞浆中,与经Phalloidin-FITC染色为绿色的细胞骨架中的微丝肌动蛋白没有关联,见图3 a;经PTEN抑制剂BPV作用后,镜下观察发现红色的MAPT开始聚集,细胞开始出现极化,并和绿色的肌动蛋白存在共定位现象,染色呈黄色,见图3 b。
Tab.2Comparison of MAPT between three groups表2 各组细胞MAPT监测指标结果比较(n=3)

Tab.2Comparison of MAPT between three groups表2 各组细胞MAPT监测指标结果比较(n=3)
**P<0.01;a与(1)组比较,b与(2)组比较,P<0.05
组别BMSC(1)分化1周(2)分化2周(3)F mRNA 0.04±0.02 0.24±0.04a0.52±0.04ab157.622**蛋白0.06±0.04 0.18±0.03a0.44±0.05ab106.588**
3 讨论
3.1 神经细胞内细胞骨架的特征细胞骨架不仅在维持细胞形态、承受外力、保持细胞内部结构的有序性方面起重要作用,而且还参与许多重要的生命活动,如在细胞分裂中细胞骨架牵引染色体分离;在细胞物质运输中,各类小泡和细胞器可沿着细胞骨架定向转运;同样在神经系统发育和神经轴突再生过程中发挥着重要的作用[3]。神经细胞轴突和树突的伸展均与细胞骨架有关。细胞骨架主要由微管、微丝和中间纤维(IF)等蛋白质构架而成。所有微管均由约55 ku的α及β微管蛋白组成。微管是细胞骨架的架构主干,同时也是某些细胞器的主体,可作为膜泡运输的导轨。从各种组织中提纯微管蛋白可以发现还存在一些其他蛋白成分,称之为微管相关蛋白(microtube-associated proteins,MAPs),即微管由微管蛋白及微管相关蛋白组成[4]。国内有研究表明,在多种原因引起的脑或脊髓神经细胞损伤后,神经再生时MAPs的表达和装配发生变化[5-6]。
3.2 MAPT在神经系统中的特征由于MAPs的作用和酶修饰有关,使得微管形成的某些结构比较稳定,并参与多种细胞功能。这些蛋白具有组织特异性,如神经细胞轴突中MAPT蛋白就可作为神经轴突的标志物。MAPT蛋白编集微管系统构成神经细胞骨架成分。MAPT蛋白为含磷酸基蛋白,是含量最高的MAPs。正常成熟脑中MAPT蛋白分子含2~3个磷酸基。MAPT蛋白与微管蛋白结合,促进形成微管,并维持微管稳定性,降低微管蛋白分子的解离,并诱导微管成束。随着分化成熟,细胞骨架中MAPT可作为轴突的标志物,只有在神经细胞轴突内可见,并随神经轴突向远端延伸,其密度逐渐增加[7]。BMSC在体外经多种细胞因子和(或)化学试剂的定向诱导下,可分化成具有功能的神经细胞,该方法已经在前期的研究中证实[8]。本实验发现在神经细胞分化过程中,在mRNA水平,轴突标志性分子MAPT开始表达,为轴突生长提供转录的模板;经Western blot证实在蛋白质水平,MAPT蛋白开始表达,为轴突生长提供物质准备,并为轴突的进一步生长提供物质保障。
阿尔茨海默病患者脑的MAPT蛋白异常过度磷酸化,MAPT蛋白总量多于正常人,且正常MAPT蛋白减少而异常过度磷酸化,MAPT蛋白大量增加,也失去其促进微管装配形成的生物学功能、丧失维持微管稳定的作用,并从微管上夺取这些蛋白,导致微管解聚,破坏正常的微管系统,造成神经冲动传导障碍[9]。有研究表明PTEN的高表达可使MAPT过度磷酸化,进而破坏微管系统[10]。
3.3 PTEN调节MAPT蛋白的聚集特征及意义在周围神经系统(PNS)和中枢神经系统(CNS)中,如何调控神经轴突的生长和再生的分子机制尚不清楚。在对神经发育时轴突生长和神经损伤时轴突再生这两个有共性的生物学过程的分子机制研究中,揭示了PTEN基因独立且重要的分子机制。这一细胞信号转导通路可影响神经细胞体内多种生理现象,例如调节蛋白转运;也可以影响轴突的生长,例如细胞骨架的构建和装配。PTEN含张力蛋白(tensin)的同源序列,tensin作用于肌动蛋白,使整合素介导的细胞黏附分子磷酸化,降低肌动蛋白水平和细胞骨架随机的方向性聚合,抑制细胞的迁移与游走。免疫荧光染色后,通过激光共聚焦显微镜发现,PTEN受抑制后,轴突标志性蛋白由散在状态转为聚集状态,并与细胞骨架的微丝结构肌动蛋白产生关联或以某种方式结合,开始轴突的生长。从而证实了PTEN在神经轴突发生过程中及细胞骨架的构建中起重要的调节作用。
总之,PTEN的下调可影响神经细胞骨架中轴突标志分子MAPT由弥散状态转为聚集状态,使神经样细胞形成极化,为进一步发展成有功能的神经细胞作准备。在今后的实验中将探讨PTEN如何调控细胞骨架中轴突标志蛋白MAPT逐渐向轴突远端转运的机制,并进一步探讨周围神经损伤后PTEN调节轴突的再生机制。
(图3见插页)
[1]Wang JZ,Liu F.Microtubule-associated protein tau in development,degeneration and protection of neurons[J].ProgNeurobiol, 2008,85(2):148-175.doi:10.1016/j.pneurobio.2008.03.002.
[2]Park KK,Liu K,Hu Y,et al.Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway[J].Science, 2008,322(5903):963-966.doi:10.1126/science.1161566.
[3]Weissmann C,Reyher HJ,Gauthier A,et al.Microtubule binding and trapping at the tip of neurites regulate tau motion in living neurons[J].Traffic,2009,10(11):1655-1668.doi:10.1111/j.1600-0854.2009.00977.x.
[4]Cui M,Feng SQ,Fan NJ,et al.Baicalin Promotes the neuronal differentiation of neural stem cells through downregulating the p-STAT3[J]. Tianjin Med J,2013,41(8):786-788.[崔猛,冯世庆,范宁建,等.黄芩苷下调p-STAT3诱导神经干细胞向神经元分化[J].天津医药,2013, 41(8):786-788].doi:10.3969/j.issn.0253-9896.2013.08.014.
[5]Lin X,Zhi DS,Zhang WZ,et al.Theexperimental study of mesenchymal stem cells in co-culture with neural stem cells in vitro[J].Tianjin Med J,2011,39(3):247-249.[林欣,只达石,张文治,等.骨髓基质细胞和神经干细胞体外共培养的实验研究[J].天津医药, 2011,39(3):247-249].doi:10.3969/j.issn.0253-9896.2011.03. 021.
[6]Sun HT,Liu XZ,Wang ZQ,et al.Postponed effect of mild hypothermia on neuron apoptosis following traumatic brain injury[J].Tianjin Med J,2008,36(5):368-370.[孙洪涛,刘晓智,王志强,等.亚低温延缓脑创伤后神经元迟发性凋亡进程的研究[J].天津医药, 2008,36(5):368-370].
[7]Hinrichs MH,Jalal A,Brenner B,et al.Tau protein diffuses along the microtubule lattice[J].J BiolChem,2012,287(46):38559-38568.doi:10.1074/jbc.M112.369785.
[8]Yan X,Kan SL,JinY,et al.Construction of cytoskeleton modulated by phosphatase and tensin homolog deleted on chromosome ten/ mammalian target of rapamycin during the differentiation of bone marrow stem cell-derived nerve cells[J].Chin J ExpSurg,2013,30(7): 1387-1389.[闫旭,阚世廉,金晔,等.第10号染色体缺失的磷酸酶及张力蛋白同源物基因/雷帕霉素靶蛋白调节细胞骨架构建在神经细胞分化过程中的变化及意义[J].中华实验外科杂志,2013,30 (7):1387-1389].doi:10,3760/cma.j.issn.1001-9030.2013.07.018.
[9]Noble W,Hanger DP,Miller CC,et al.The importance of tau phosphorylation for neurodegenerative disease[J].Front Neurol,2013,4: 83.doi:10.3389/fneur.2013.00083.
[10]Zhang X,Li F,Bulloj A,et al.Tumor-suppressor PTEN affects tau phosphorylation,aggregation,andbindingtomicrotubules[J]. FASEB J,2006,20(8):1272-1274.
(2014-06-09收稿2014-08-26修回)
(本文编辑李鹏)
Aggregation of microtubule-associated protein tau modulated by PTEN during the differentiation of bone marrow stem cell-derived nerve cells
YAN Xu1,2,KAN Shilian2△,JIN Ye3
Graduate School,Tianjin Medical University,Tianjin 300070,China;2 Tianjin Hospital;3 Central Laboratory,Peking Union Medical College Hospital△
ObjectiveTo observe the diffusion and aggregation of the microtubule associated protein tau(MAPT)modulated by phosphatase and tensin homolog deleted on chromosome ten(PTEN)during the nerve cell differentiation by human bone marrow stem cells(BMSC)in vitro,and to analyse the signification.MethodsAdult bone marrow stem cells were isolated and induced into nerve-like cells by some cytokines in vitro.The mRNA expression of MAPT was detected by semiquantitative RT-PCR and Western blot assay.The patterns of diffusion and aggregation of the MAPT association of the actin were indicated by Phalloidin-fluoresceineisothioeyanate(FITC)and immunofluorescence(IF)cyto-chemistry,and observed by the laser-confocal microscopy.ResultsThe MAPT mRNA levels were 0.24±0.04 and 0.52±0.04 at 1 week and 2 weeks after the induction,which were significantly higher compared with those of BMSC(0.04±0.02)after the induction (P<0.05).The MAPT protein levels were 0.18±0.03 and 0.44±0.05 at 1 week and 2 weeks after the induction,which were significantly higher compared those of BMSC(0.06±0.04,P<0.05).The distribution patterns of MAPT were changed from the diffusion to the aggregation in cells after treatment by BPV.The nerve-like cells appeared the characteristic of polarization.ConclusionWhen the nerve cells derived from bone marrow stem cells obtain the mature differentiation,PTEN may possess the ability of modulating the diffusion and aggregation of MAPT in vitro,also may provide a kind of material basis for the growth of the nerve axon.
tumor suppressor proteins;tau proteins;cytoskeleton;reverse transcriptase polymerase chain reaction;fluoroimmunoassay;phosphatase and tensin homolog deleted in chronlosome 10
R349.52
A
10.3969/j.issn.0253-9896.2015.01.009
1天津医科大学研究生院(邮编300070);2天津市天津医院骨科;3中国医学科学院北京协和医学院北京协和医院中心实验室
闫旭(1976),男,副主任医师,博士在读,主要从事神经再生研究
△通讯作者E-mail:pumc@sina.com
